皮肤衰老是指皮肤衰老性损伤,使其对机体的防护能力和调节能力减退,导致不能适应内外环境的变化,出现颜色、色泽、形态、质感等外观整体状况的改变[1]。紫外线照射、遗传因素和生活习惯是引起皮肤衰老的主要因素,具体表现为皮肤含水率降低、胶原蛋白流失和弹性蛋白减少,导致皮肤干燥、松弛和皱纹产生。目前,最受认可的衰老假说是自由基衰老学说,该学说认为衰老是由各种活性氧簇(reactive oxygen species,ROS)在体内积累,加速氧化损伤核酸、蛋白质和生物膜系统的结果[2]。正常状态下,机体内促氧化作用与抗氧化防御处于动态平衡,使自由基维持在生理水平[3]。当机体处于氧化应激状态时,体内的抗氧化酶活性降低,还原性物质生成减少,使动态平衡打破,加速皮肤衰老[4]。
荔枝(Litchi chinensis Sonn.)是一种广泛分布亚热带地区的水果,具有口感甘甜、营养丰富、促进皮肤新陈代谢和延缓衰老的功效。研究发现,荔枝果肉含有丰富的多糖和酚类活性物质,具有抗氧化、抗炎、降血脂和增强免疫力等作用[5-8]。玫瑰(Rosa rugosa Thunb.)属蔷薇科植物,花瓣富含维生素、氨基酸和多酚类物质,其中维生素C(vitamin C,VC)含量较高,具有较强的抗氧化、抗炎等生物活性,已被广泛应用于食品、药品等领域[9-14]。本研究综合荔枝和玫瑰这两种不同药食原料的营养保健价值,开发出一款对皮肤具有健康功效的低酒精度果酒,可满足人们对天然抗氧化饮品的消费需求[15-18]。
该研究前期以新鲜荔枝和玫瑰花瓣为主要原料,辅以苹果、枸杞和葡萄原酒,应用现代酿酒技术,开发出了一款具有特殊香气和醇厚口感的荔枝玫瑰酒。测定了其主要营养物质和活性成分,以D-半乳糖诱导的皮肤衰老小鼠模型作为研究对象,探讨了荔枝玫瑰酒对小鼠皮肤组织理化指标、氧化还原稳态和胶原合成的影响,以期为荔枝玫瑰酒的开发和推广提供有价值的理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
荔枝玫瑰酒(酒精度为12%vol):株洲千金药业股份有限公司。
60只无特定病原体(specific pathogen free,SPF)级美国癌症研究所(institute of cancer research,ICR)雄鼠[5周龄,(29.75±1.35)g]:上海斯莱克实验动物有限责任公司,饲喂于江南大学实验动物中心。饲养条件为光照周期12 h(8:00~20:00),恒温(23±2)℃,恒湿(60±5)%。
1.1.2 试剂
无水葡萄糖、没食子酸、亚硝酸钠、硝酸铝、单宁酸、甲醇、乙醚、抗坏血酸、草酸、亚硫酸钠、钼酸胺、对苯二酚、磷酸二氢钾(均为分析纯)、芦丁(纯度>95%):国药集团化学试剂有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)、羟脯氨酸(hydroxyproline,HYP)、蛋白质羰基(protein carbonyl,PC)试剂盒:南京建成生物研究所;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒:碧云天生物技术有限公司;鲁米诺、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPES)、辣根过氧化物酶、邻苯二甲醛、N-乙基顺丁烯二酰亚胺:上海阿拉丁生化科技股份有限公司;Trizol:上海生工生物工程股份有限公司;脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)、RNase Inhibitor、M-MLV逆转录酶:美国ThermoFisher科技公司;SYBR Green Master Mix:南京诺唯赞生物科技有限公司。
1.2 仪器与设备
NexION 350D电感耦合等离子体质谱(inductively coupled plasma massspectrometry,ICP-MS)仪:美国PE公司;BioTek Epoch全波长酶标仪:美国Biotek公司;Agilent 1100液相色谱仪:美国Agilent公司;UV2300紫外分光光度计:中国上海天美仪器有限公司;5804R离心机:德国Eppendorf公司;CFX96 Touch实时荧光定量聚合酶链式反应(real time-fluorescence quantitative,polymerase chain reaction,RTFQ PCR)仪:美国Bio-rad公司;One Drop spectrophotometer OD-1000:南京五义科技有限公司;ETC811PCR扩增仪:东胜兴业科学仪器有限公司。
1.3 试验方法
1.3.1 荔枝玫瑰酒营养成分分析
总糖与还原糖含量测定:采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中斐林试剂滴定法;蛋白质含量测定:采用GB 5009.5—2016《食品中蛋白质的测定》中凯氏定氮法;粗脂肪含量测定:采用GB 5009.6—2016《食品中脂肪的测定》中索氏抽提法;总多酚含量测定:采用福林-酚(Folin-Ciocaleu)法[19];总黄酮含量测定:采用NaNO2-Al(NO3)3比色法(以芦丁为标准品)[20];单宁含量测定:采用Folin-Ciocaleu法(以单宁酸为标准品)[21]。
维生素A、E含量测定:采用GB 5009.82—2016《食品中维生素A、D、E的测定》中反相高效液相色谱法;维生素B1含量测定:采用GB 5009.84—2016《食品中硫胺素(维生素B1)的测定》中高效液相色谱法;维生素B2含量测定:采用GB 5009.85—2016《食品中维生素B2的测定》中高效液相色谱法;维生素B6含量测定:采用GB 5009.154—2016《食品中维生素B6的测定》中高效液相色谱法;维生素C含量测定:采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中二氯靛酚染料滴定法。
1.3.2 荔枝玫瑰酒皮肤抗氧化功效研究
(1)动物分组
所有实验操作均按照江南大学动物使用和福利协会要求进行。60只SPF级ICR雄鼠预饲1周后,小鼠随机分为6组:正常组(10只)、D-半乳糖处理组(衰老模型,10只)、VC对照组(抗衰老对照,10只)、低剂量荔枝玫瑰酒组(10只)、中剂量荔枝玫瑰酒组(10只)、高剂量荔枝玫瑰酒组(10只)。正常组注射等体积生理盐水,其余五组颈背部皮下连续注射D-半乳糖1 200 mg/(kg·d),建立小鼠衰老模型。6周后,荔枝玫瑰酒组分别饲喂含低(11.25 mL/kg体质量)、中(22.50 mL/kg体质量)、高(45.00 mL/kg体质量)剂量荔枝玫瑰酒的饮用水,添加量相当于人体每天摄入75 mL、150 mL和300 mL荔枝玫瑰酒产品。正常组及D-半乳糖处理组饲喂含体积分数12%乙醇的饮用水,对照组的VC添加量为450 mg/kg体质量。同时,除正常组外,其余各组继续给予相同剂量D-半乳糖颈背部皮下注射。所有动物每周一上午10点用天平称其体质量,自由采食、饮水,12周后采样分析。
(2)检测样品的采集
饲养结束后,小鼠禁食不禁水12 h,用5%硫化钠涂于小鼠颈背部,脱去绒毛,随后用清水冲洗,清洁纱布拭干。眼球采血后颈椎脱臼处死小鼠,取小鼠颈背部皮肤称质量。皮肤取同一部位0.1 g,加入0.9 mL生理盐水后用高通量组织研磨器匀浆,4 000 r/min离心10 min后分离上清,按照BCA蛋白浓度测定试剂盒说明书测定蛋白质含量,放置于-80 ℃冰箱。
(3)皮肤组织理化指标测定
皮肤水分含量测定:取小鼠背部皮肤,去毛清洁后,精密称其湿质量,随即将其放入烘箱中,于80 ℃烘干12 h,称其干质量,干湿质量的差值与湿质量之比即皮肤含水百分率。皮肤羟脯胺酸含量测定:按照HYP试剂盒说明书方法进行测定。皮肤胶原蛋白含量:根据HYP试剂盒说明书,羟脯氨酸在胶原蛋白中占13.4%进行换算。
(4)氧化应激指标测定
活性氧自由基:采用化学发光法测定[22]。50 μL组织匀浆液与830 μL Krebs-HEPEs缓冲液混合后加入20 μL 3 mg/mL辣根过氧化物酶,放入化学发光仪避光后立即加入0.1 mL鲁米诺溶液后检测。
总抗氧化能力、丙二醛、超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、谷胱甘肽、蛋白质羰基:按照相应试剂盒说明书所示方法进行测定。
(5)RNA提取及反转录
采用Trizol法[23]提取小鼠颈背部皮肤组织的RNA,并测RNA浓度及RNA的OD260nm/OD280nm值,将OD260nm/OD280nm值在1.8~2.0范围的样品用焦碳酸二乙酯(diethylpyrocarbonate,DEPC)水调节质量浓度至1000μg/mL,之后严格按照说明书使用逆转录试剂盒将RNA逆转录成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),逆转录好的cDNA于-80 ℃保存备用。
(6)实时荧光定量PCR[24]
采用实时荧光定量聚合酶链式反应(RT-FQ PCR)测定胶原蛋白合成分解相关基因(TGF-β1、MMP-1、MMP-8)及皮肤抗氧化相关基因(β-actin、Gsk-3β、Nrf2、HO-1、NQO-1)的相对表达量。PCR扩增总体系20 μL,其中cDNA 2 μL,上、下游引物各0.8 μL,2×SYB Green Mix 10 μL,双蒸水6.4 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性20 s,62 ℃退火30 s,72 ℃延伸20 s,共循环40次;72 ℃终末延伸2 min。以β-肌动蛋白(β-actin)作为内参基因,采用2-ΔΔCt法对数据进行计算处理,RT-FQ PCR所用引物序列见表1。
表1 RT-FQ PCR所用引物序列
Table 1 Primers sequences used in RT-FQ PCR

1.3.3 数据处理
结果均以“平均值±标准差”表示。采用SPSS 25.0软件对数据进行统计分析,运用单因素ANOVA方差分析,Duncan检验进行组间比较,显著水平为P<0.05。采用GraphPad Prism7.0软件处理作图。
2 结果与分析
2.1 荔枝玫瑰酒的营养指标分析
2.1.1 荔枝玫瑰酒的主要营养成分及活性物质分析
表2 荔枝玫瑰酒的主要营养成分及活性物质测定结果
Table 2 Determination results of main nutrient components and active substances in litchi rose wine

由表2可知,荔枝玫瑰酒中含有蛋白质2.30 g/L、粗脂肪7.93 g/L、总糖25.60 g/L、还原糖19.71 g/L(占总糖含量的76.95%)。在荔枝玫瑰酒酿造过程中,由于果汁本身以及发酵过程中微生物及其代谢产物的存在,使荔枝玫瑰酒存在一定量的蛋白质和脂肪,且糖和脂肪含量较低,根据GB 28050—2011《食品安全国家标准 预包装食品营养标签通则》,荔枝玫瑰酒属于低糖低脂食品。此外,荔枝玫瑰酒中还含有生物碱6.62 g/L、多酚0.43 g/L、总黄酮0.25 g/L、单宁0.12 g/L、花色苷0.42×10-3 g/L,这使果酒具有独特的香味和色泽。植物多酚是一类具有多种生物学活性的多元酚结构的次级代谢产物,广泛存在于人们日常食用的蔬果的叶、花和果实中,其含量在表皮中尤为丰富[25]。研究表明,多酚类化合物不仅是天然抗炎症和抗氧化剂的主要来源,而且可作为信号分子调节细胞功能和基因表达,具有潜在的保健功效[26]。黄酮类化合是植物和浆果的重要功能成分,可直接捕捉和清除ROS,通过激活体内抗氧化系统发挥抗氧化的作用[27]。植物单宁是良好的自由基清除剂和脂质过氧化抑制剂,可抑制脂质氧化,阻断自由基链式反应,具有较强的抗氧化能力[28]。这些可能是荔枝玫瑰酒营养价值及抗氧化稳定性的主要因素。
2.1.2 荔枝玫瑰酒维生素含量分析
表3 荔枝玫瑰酒中维生素含量测定结果
Table 3 Determination results of vitamins content in litchi rose wine
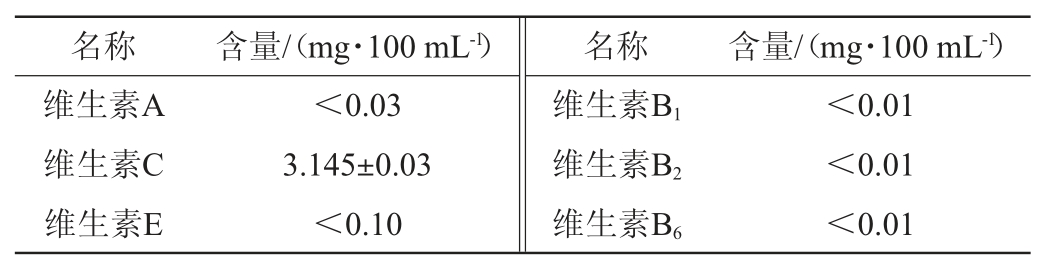
由表3可知,荔枝玫瑰酒以维生素C为主,含量达到3.145 mg/100 mL,其维生素C的含量略高于无花果果酒(3 mg/100 mL)和诺丽果酒(3.02 mg/100 mL)[29-30]。维生素C又称L-抗坏血酸,作为一种公认的抗氧化物质,可参与体内的氧化还原反应、组织胶原蛋白合成、延缓衰老和增强人体免疫功能[31]。果酒中的维生素通常来源于原料果实,荔枝果肉(15 mg/100 g)、玫瑰花瓣(88.93 mg/100 g)富含维生素C[32-33],但是极易腐败变质,而普通的酿造工艺会使得维生素大量流失,荔枝玫瑰酒通过对温度和原料配比的工艺优化不仅尽量保留了较丰富的维生素C,而且易于保存运输,大大提高了荔枝和玫瑰的资源利用率,能够获得巨大的经济效益。
通过荔枝玫瑰酒的营养物质与活性成分分析发现,荔枝玫瑰酒含有丰富的多酚、黄酮类物质、单宁及维生素C等活性成分,分别达到0.43g/L、0.25g/L、0.12g/L和3.145mg/100mL,其多酚含量明显高于市售常见樱桃酒(303 μg/mL)和桑椹红酒(1.659 μg/mL),与赤霞珠含量相近[34-36]。植物多酚、黄酮具有良好的抗氧化功能,能够直接清除机体内自由基,起到延缓衰老的目的。已有研究表明,水果多酚、黄酮类物质可通过抑制氧化应激、减少炎症、调控与疾病有关的基因表达等发挥干预作用[3];SARIN N B等[37]指出荔枝果肉酚类物质提取物可显著增加应激性肝损伤小鼠肝细胞内超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶等抗氧化酶的活性,减少线粒体ROS产生,发挥体内抗氧化应激损伤活性。
2.2 荔枝玫瑰酒对小鼠体质量的影响
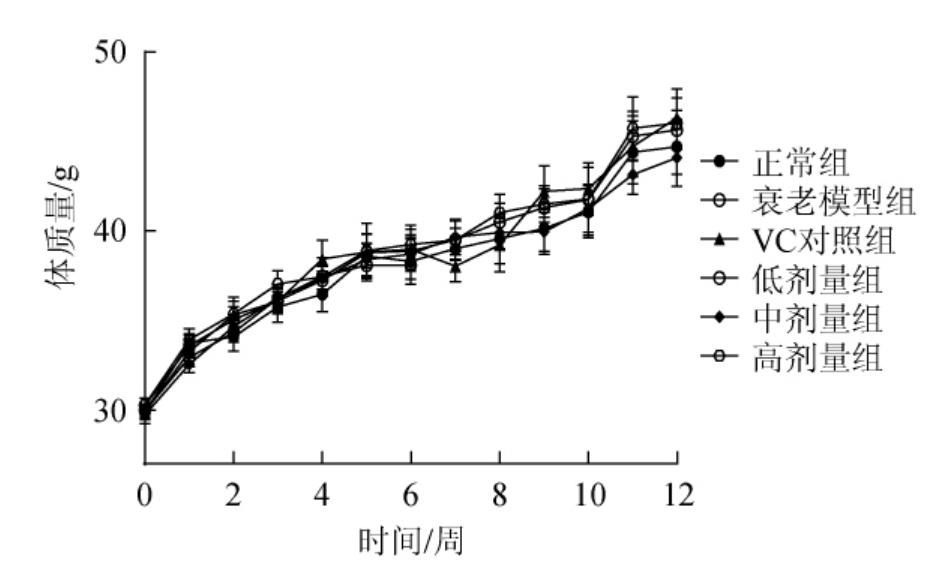
图1 荔枝玫瑰酒对小鼠体质量的影响
Fig.1 Effect of litchi rose wine on body mass of mice
由图1可知,小鼠饲喂12周后,各组体质量增加但均无显著性差异(P>0.05),说明饲喂荔枝玫瑰酒对衰老小鼠体质量无显著影响。
2.3 荔枝玫瑰酒的皮肤抗氧化功效结果分析
2.3.1 荔枝玫瑰酒对小鼠皮肤组织理化指标和氧化还原状态的影响
胶原蛋白是皮肤的重要组成成分,是由真皮中的成纤维细胞所分泌的,对维持皮肤的张力起重要作用[38]。活性氧(ROS)是人体能量代谢的副产物,在健康机体内处于动态平衡状态[39]。当机体发生氧化应激,过剩的ROS在体内累计导致氧化损伤,成纤维细胞生长和更新速度减慢,胶原和弹性纤维合成能力下降,使得皮肤胶原蛋白流失,水分含量减少,皮肤衰老[40]。当机体处于衰老状态时,体内的抗氧化酶活性降低,总抗氧化能力(T-AOC)和谷胱甘肽(GSH)下降,动态平衡失调,导致蛋白质氧化,进一步加速衰老[41]。
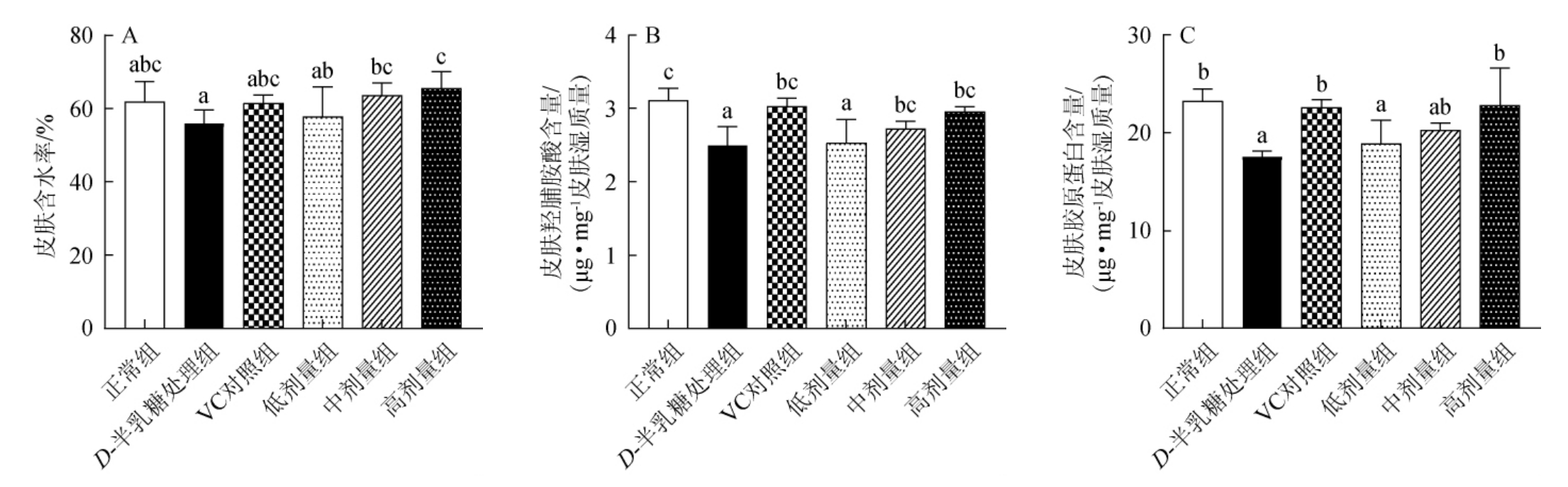
图2 荔枝玫瑰酒对小鼠皮肤理化指标的影响
Fig.2 Effect of litchi rose wine on physical and chemical indexes of mice skin
不同小写字母表示差异显著(P<0.05)。下同。
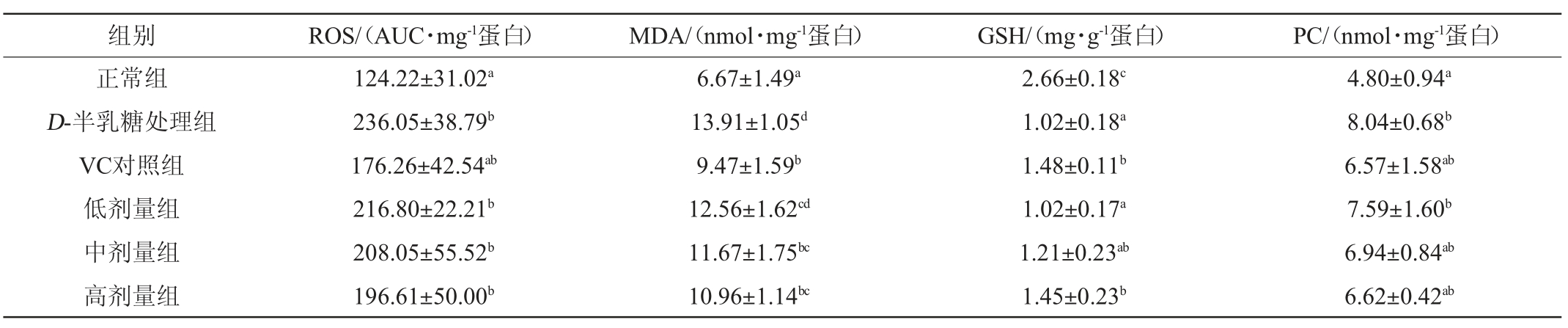
表4 荔枝玫瑰酒对小鼠皮肤氧化还原指标的影响
Table 4 Effect of litchi rose wine on redox indexes of mice skin
注:同列肩不同小写字母表示差异显著(P<0.05)。下同。
表5 荔枝玫瑰酒对小鼠皮肤抗氧化酶活性的影响
Table 5 Effect of litchi rose wine on antioxidant enzyme activity of mice skin
由图2、表4及表5可知,与正常组相比,连续注射D-半乳糖可使小鼠皮肤含水率、羟脯胺酸、胶原蛋白含量显著降低(P<0.05),引起皮肤ROS、MDA和PC水平显著提高(P<0.05),T-AOC能力、GSH 水平以及抗氧化酶活性(GSH-Px、SOD和CAT)显著降低(P<0.05),表明D-半乳糖注射诱导小鼠皮肤衰老和氧化损伤。与之相反,和D-半乳糖处理组相比,饲喂高剂量荔枝玫瑰酒能显著提高小鼠皮肤含水率、羟脯胺酸和胶原蛋白含量(P<0.05),降低MDA含量、GSH-Px酶活性,提高GSH含量、SOD和CAT酶活性(P<0.05),且高剂量荔枝玫瑰酒效果与VC相当。结果表明,一定剂量的荔枝玫瑰酒可改善衰老小鼠皮肤氧化还原稳态,提高抗氧化能力,降低ROS和过氧化产物生成,显著恢复皮肤含水率、羟脯胺酸和胶原蛋白。
2.3.2 荔枝玫瑰酒对小鼠皮肤胶原蛋白合成分解相关基因表达的影响
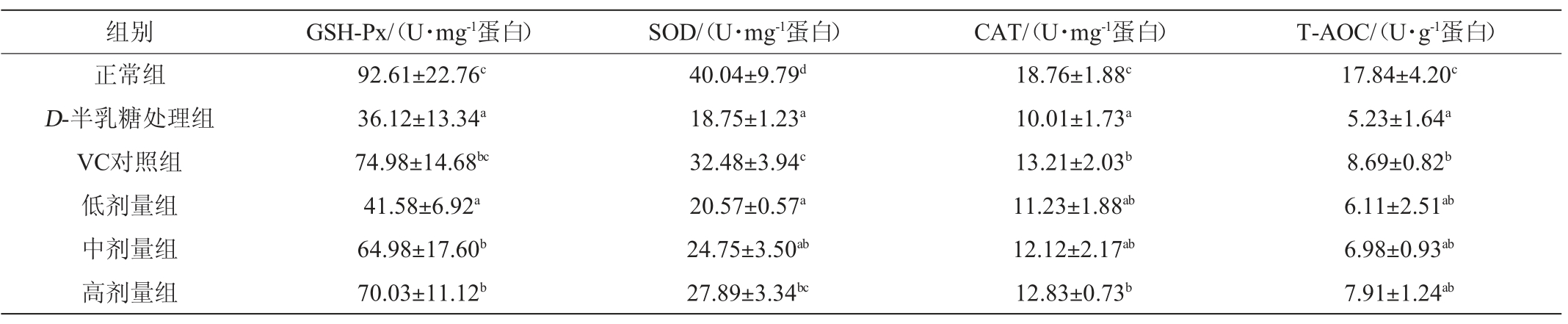
胶原蛋白是皮肤中含量最多的一种蛋白质,对于表皮基底层和真皮层的粘附均具有重要作用,使细胞丰满水盈,赋予皮肤韧性和弹力,是维持皮肤形态和结构的重要物质。胶原蛋白主要包括Ⅰ型胶原蛋白(85%~90%)和Ⅲ型胶原蛋白(10%~15%)。转化生长因子-β1(transforming growth factor-β1,Tgf-β1)是组织纤维化的调控者,能够有效刺激成纤维细胞和间叶母细胞的迁移和增殖分化,促进Ⅰ型和Ⅲ型胶原蛋白的合成。基质金属蛋白酶(matrix metalloproteinase,MMPs)是一组降解胶原蛋白的锌依赖性内肽酶,负责稳态组织的修复和胶原蛋白的降解,Mmp-1和Mmp-8分别对Ⅲ型和Ⅰ型胶原蛋白具有较高的水解活性[42-43]。
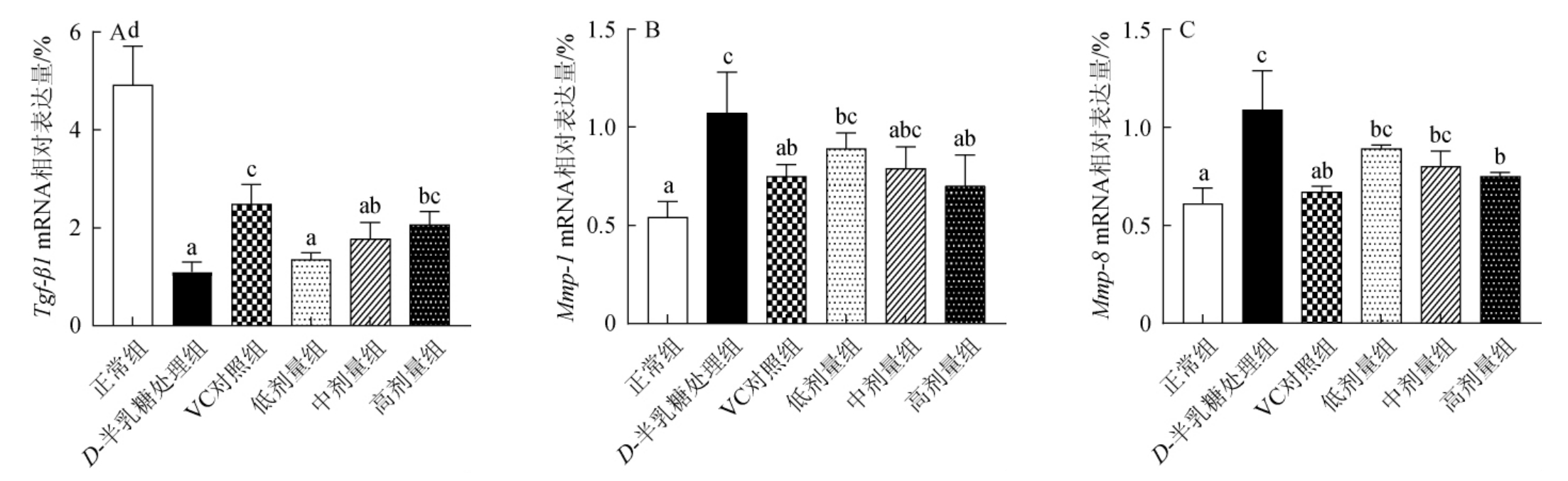
图3 小鼠皮肤胶原合成分解相关基因mRNA表达水平
Fig.3 mRNA expression level of genes related to collagen synthesis and decomposition in mice skin
由图3可知,小鼠连续注射D-半乳糖12周,显著降低了胶原合成基因Tgf-β1的mRNA表达水平,提高了分解基因Mmp-1及Mmp-8 mRNA表达水平(P<0.05),进而使皮肤胶原蛋白分解增强,导致胶原蛋白含量减少。与之相反,衰老小鼠饲喂高剂量荔枝玫瑰酒可显著恢复皮肤胶原蛋白合成及分解相关基因mRNA表达水平,即显著上调基因Tgf-β1,抑制基因Mmp-1及Mmp-8的表达(P<0.05)。
2.3.3 荔枝玫瑰酒对小鼠皮肤抗氧化相关基因表达水平的影响
Nrf2/Gsk-3β信号通路是细胞内重要的抗氧化通路,对机体调节氧化还原状态的酶具有重要的调节作用[44]。ROS等应激物通过促进Keap1上半胱氨酸残基的氧化,诱导Nrf2的释放和活化,启动多种下游靶蛋白的表达,如血红素加氧酶1(Heme oxygenase-1,Ho-1),还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶(nicotinamide adenine dinucleotide phosphatequinone oxidoreductase1,Nqo1)等[45]。Gsk-3β是一种糖原合成激酶,通过细胞核中Fyn的磷酸化,促进Nrf2的磷酸化,使其被降解,进而抑制抗氧化信号通路[46]。由图4可知,与正常组相比,长期注射D-半乳糖氧化损伤小鼠皮肤,引起Nrf2、Ho-1及Nqo-1基因mRNA表达水平显著下调,Gsk-3β基因表达水平显著上调(P<0.05)。而衰老小鼠饲喂高剂量荔枝玫瑰酒可显著上调皮肤Ho-1及Nqo-1基因表达水平(P<0.05),但对Nrf2、Gsk-3β基因表达无显著性作用(P>0.05)。
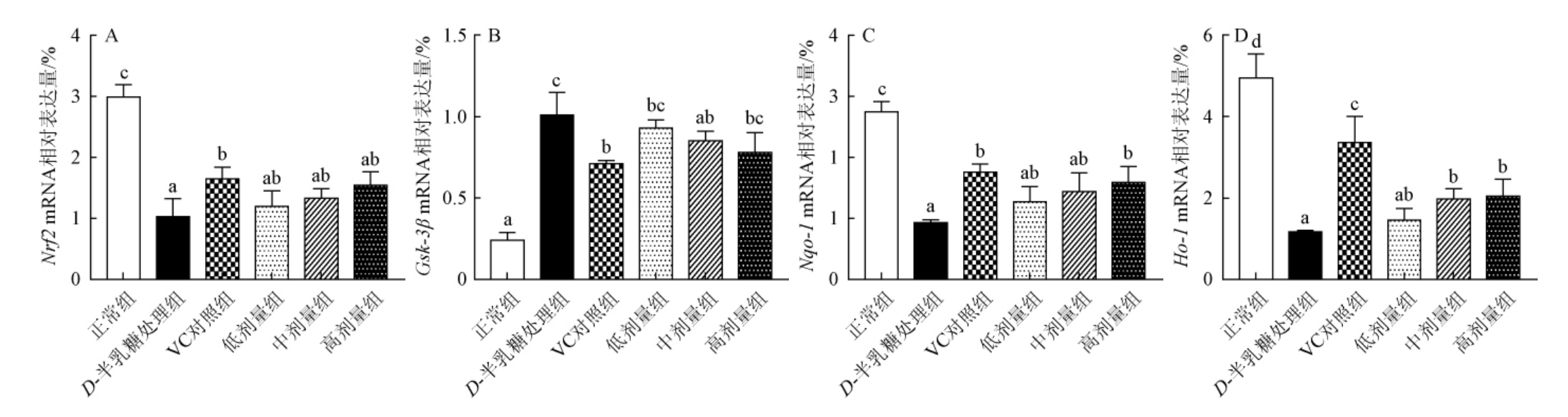
图4 小鼠皮肤抗氧化相关基因mRNA表达水平
Fig.4 mRNA expression level of genes related to antioxidant in mice skin
谢璟[41]报道杨梅黄酮能降低光老化小鼠皮肤中Mmp-1基因的表达,增强抗氧化酶活性来修复皮肤损伤;高爱莉等[47]研究发现,茶多酚可激活Nrf2信号通路,增加抗氧化酶表达,对无毛鼠皮肤具有光防护的重要作用,与本研究结果一致。由此可见,荔枝玫瑰酒可能通过调节小鼠皮肤抗氧化相关基因表达,增强了抗氧化酶活性和抗氧化能力,平衡了皮肤氧化还原稳态,进而缓解了衰老小鼠胶原分解,增强胶原蛋白合成能力,这可能与其含有丰富的多酚、黄酮等活性成分有关。
3 结论
本研究通过检测荔枝玫瑰酒中的营养活性成分,发现该酒保留了丰富的多酚、黄酮、单宁及维生素C等活性成分,分别达到0.43 g/L、0.25 g/L、0.12 g/L和3.15 mg/100 mL。为进一步探究其是否具有抗皮肤衰老的功效,进行了动物实验。结果表明,小鼠饲喂12周后,各组体质量增加但均无显著性差异(P>0.05),饲喂高剂量荔枝玫瑰酒可显著提高D-半乳糖诱导的衰老小鼠皮肤含水率、羟脯胺酸和胶原蛋白含量,降低MDA含量、GSH-Px酶活性,提高GSH含量、SOD和CAT酶活性(P<0.05);同时通过提高衰老小鼠皮肤抗氧化基因Ho-1及Nqo-1 mRNA表达水平,恢复皮肤胶原蛋白合成基因Tgf-β1及分解基因Mmp-1及Mmp-8表达水平,抑制小鼠皮肤氧化损伤和胶原分解,相关结果可为荔枝玫瑰酒的深入开发和推广提供有价值的理论参考。
[1]张黎.玉米幼芽提取物对皮肤氧化损伤的保护作用及其机制研究[D].杨凌:西北农林科技大学,2007.
[2]HARMAN D.Aging:A theory based on free radical and radiation chemistry[J].J Gerontol,1956,11(3):298-300.
[3]SOHAL R S,MOCKETT R J,ORR W C.Current issues concerning the role of oxidative stress in aging:A perspective[M].Berlin:Springer-Verlag,2000:29.
[4]王怀玲.蓝莓多酚化合物抗衰老活性及作用机制研究[D].广州:华南理工大学,2018.
[5]苏东晓,张瑞芬,张名位,等.荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J].中国农业科学,2014,47(14):2897-2906.
[6]SABRINR M,IBRAHIM,GAMAL A.Mohamed,litchi chinensis:medicinal uses,phytochemistry,and pharmacology[J].J Ethnopharmacol,2015,174:492-513.
[7]周秋艳,唐方华,饶日昌,等.荔枝及荔枝多酚物质的研究进展[J].安徽农业科学,2017,45(29):77-79,130.
[8]姜楠,王蒙,韦迪哲,等.植物多酚类物质研究进展[J].食品安全质量检测学报,2016,7(2):439-444.
[9]NG T B,HE J S,NIU S M,et al.A gallic acid derivative and polysaccharides with antioxidative activity from rose (Rosa rugosa) flowers[J].J Pharm Pharmacol,2004,56(4):537-545.
[10]王多宁.玫瑰花的综合利用及开发前景[J].黑龙江农业科学,2010(1):117-120.
[11]LÓPEZ-OTÍN C,BLASCO M A,PARTRIDGE L,et al.The hallmarks of aging[J].Cell,2013,153(6):1194-1217.
[12]JIANG Y,WONG J H,PI Z F,et al.Stimulatory effect of components of rose flowers on catalytic activity and mRNA expression of superoxide dismutase and catalase in erythrocytes[J].Environ Toxicol Phar,2009,27(3):396-401.
[13]杨新征,杨德,张跃华.玫瑰的价值及开发前景[J].新疆农业科学,2004(2):110-112.
[14]柴莹莹,何霞,宫颖慧,等.玫瑰花色苷分子稳定性及其生物活性研究进展[J].中国野生植物资源,2017,36(3):37-41.
[15]丁莹,李亚辉,蒲青,等.我国果酒行业发展现状及前景分析[J].酿酒科技,2019(4):104-107.
[16]叶春苗.我国果酒研究发展现状[J].农业科技与装备,2016(3):60-61.
[17]马姗婕,徐维盛,王鑫,等.果酒中功效成分研究[J].现代预防医学,2015,42(14):2543-2545,2552.
[18]王进,宋先华,郭正忠,等.荔枝酒稳定性探讨[J].酿酒科技,2008(7):76-77,82.
[19]LI X C,WU X T,HUANG L.Correlation between antioxidant activities and phenolic contents of radix Angelicae sinensis(Danggui)[J].Molecules,2009,14(12):5349-5361.
[20]JIA Z S,TANG M C,WU J M.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chem,1999,64(4):555-559.
[21]陈佩,李平,郝艳宾,等.柿果成熟过程中可溶性果胶和单宁含量的变化[J].中国农业大学学报,2012,17(1):88-92.
[22]马忠明.芦笋醋饮料的研制及其降血脂实验研究[J].食品科技,2009,34(7):51-54.
[23]XU Y C,YANG Y H,SUN J,et al.Dietary methionine restriction ameliorates the impairment of learning and memory function induced by obesity in mice[J].Food Funct,2019,10(3):47-50.
[24]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[25]郭爱伟,刘莉莉,杨亚晋,等.植物多酚的生物活性及其在家禽生产中的应用[J].动物营养学报,2019,31(2):491-499.
[26]程然,生吉萍.草莓多酚类植物化学物研究进展[J].食品安全质量检测学报,2015,6(2):575-584.
[27]杨硕,徐元庆,邢媛媛,等.植物源黄酮类化合物对动物免疫和抗氧化功能影响的研究进展[J].动物营养学报,2019,31(7):2958-2964.
[28]舒畅,赵韩栋,焦文晓,等.植物单宁的生物活性研究进展[J].食品工业科技,2018,39(17):328-334.
[29]孙小华.无花果(Ficuscarica L.)果酒酿造工艺研究及抗氧化活性评价[D].哈尔滨:东北农业大学,2018.
[30]张凯,孟君,李晓娟,等.诺丽酒营养成分与体外抗氧化活性分析[J].食品与发酵工业,2018,44(4):212-215.
[31]曾翔云.维生素C 的生理功能与膳食保障[J].中国食物与营养,2005(4):52-54.
[32]PAREEK S.Nutritional composition of fruit cultivars nutritional and biochemical composition of lychee(Litchi chinensis Sonn.)cultivars[J].Nutr Compos Fruit Cultivars,2016:395-418.
[33]郑淑彦,王伟,董金金,等.食用玫瑰营养保健功能及产品开发研究进展[J].食品研究与开发,2016,37(23):206-211.
[34]郑凤锦,孙健,方晓纯,等.广西桑椹红酒与葡萄红酒抗氧化能力比较研究[J].食品工业,2016,37(8):95-99.
[35]缪冰旋.野生葡萄及葡萄酒抗氧化活性和抗菌性研究[D].广州:暨南大学,2014.
[36]AL-YAFEAI A,BELLSTEDT P,BÖHM V.Bioactive compounds and antioxidant capacity of Rosa rugosa depending on degree of ripeness[J].Antioxidants,2018,7(10):40-44.
[37]SARIN N B,PRASAD U S,KUMAR M,et al.Litchi breeding for genetic improvement[M].New York:Springer,2009:217-245.
[38]朱琳玲.骨胶原肽对高脂膳食小鼠抗氧化能力及皮肤和骨骼胶原代谢的影响[D].无锡:江南大学,2012.
[39]SIES H.Oxidative stress:a concept in redox biology and medicine[J].Redox Biol,2015,4:180-183.
[40]周小平.补益营卫延缓皮肤衰老的理论和实验研究[D].北京:北京中医药大学,2007.
[41]谢璟.杨梅黄酮对紫外线诱导的皮肤光老化保护作用及潜在机制研究[D].济南:山东大学,2019.
[42]VIOUX-CHAGNOLEAU C,LEJEUNE F,SOK J,et al.Reconstructed human skin:From photodamage to sunscreen photoprotection and antiaging molecules[J].J Dermatol Sci Sup,2006,2(1):S1-S12.
[43]SOBEL H,HEWLETT M J,HRUBANT H E.Collagen and glycosaminoglycans in skin of aging mice[J]. J Gerontol,1970,25(2):102-104.
[44]BUENDIA I,MICHALSKA P,NAVARRO E,et al.Nrf2-ARE pathway:An emerging target against oxidative stress and neuroinflammation in neurodegenerative diseases[J].Pharmacol Therapeut,2016,157:84-104.
[45]JUNG K A,KWAK M K.The Nrf2 system as a potential target for the development of indirect antioxidants[J].Molecules,2010,15(10):7266-7291.
[46]LI W,MA J G,MA Q Y,et al.Resveratrol inhibits the epithelial-mesenchymal transition of pancreatic cancer cells via suppression of the PI-3K/Akt/NF-κB pathway[J].Curr Med Chem,2013,20(33):8244-8265.
[47]高爱莉,周欣,江娜,等.Nrf2 及其下游抗氧化因子在茶多酚防御UVB致无毛鼠皮肤急性光损伤中的表达及意义[J].中国皮肤性病学杂志,2017,31(8):26-29.