中国独创的固态法白酒酿造,通过酿酒微生物的繁殖代谢产生的各种呈香呈味物质和健康因子,赋予了白酒独特的香、醇、甘、美的特点,而含有众多微生物及其产生的多种酶的酿酒微生物作为酿制传统大曲酒的糖化剂、发酵剂与增香剂,对白酒的质量、香型起到了决定性作用[1-5]。
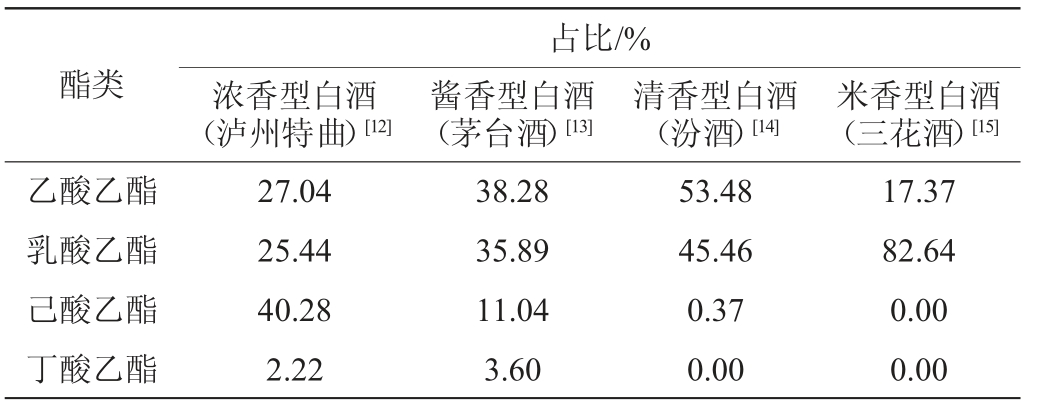
白酒中目前已发现的四大主要酯类是乙酸乙酯、乳酸乙酯、己酸乙酯和丁酸乙酯[6-7]。作为白酒香气的重要来源,这四种酯类均带有类似花香或果香的气味。酯类物质的含量是区分白酒香型的重要因素,因此,不同香型的白酒中酯类物质的含量和比例大相径庭(表1)[8]。其中清香型白酒和老白干香型白酒的主体香均为乙酸乙酯和适量的乳酸乙酯,但清香型白酒的乳酸乙酯与乙酸乙酯比例为1∶0.6~1∶0.8,而老白干型白酒的乳酸乙酯与乙酸乙酯比例≥1∶0.8[9]。由此可见,酯类物质对白酒香型风格的形成至关重要,酯含量和比例的不同将会影响白酒的风格特征[10-11]。
在白酒发酵过程中,由酿酒酵母催化合成的酰基酯类物质众多,本文对白酒中产酯酵母、酿酒酵母酰基酯合成途径中的关键酶基因,包括醇酰基转移酶和酯酶基因,以及其酶学性质、晶体结构学进行分析,并对酶的作用机理和机制等研究现状进行综述。同时,对其在中国白酒中的应用前景进行了展望。
表1 不同香型白酒中酯类物质占总酯量的比例
Table 1 Proportion of esters in total esters in different flavor Baijiu
1 白酒中产酯酵母
在白酒发酵过程中,存在着多种产酯微生物,包括酵母菌、霉菌、细菌等,其中酵母菌是主要的产酯微生物[16-17],其中包括产酯酵母类群和产酒精酵母类群[3,11]。白酒酿造过程中,产酯酵母通过代谢产生的酯类不仅是白酒重要的呈香呈味物质,其中某些酯类还被证明是白酒中对人体有益的健康功能因子[18-20]。产酯酵母又称为生香酵母,是一大类能通过代谢产生酯类物质的酵母菌总称,其中包括酵母属(Saccharomyces)、假丝酵母属(Candida)、汉逊酵母属(Hansenula)、毕赤酵母属(Pichia)、球拟酵母属(Torulopsis)等[21-22]。在发酵过程中,产酯酵母菌通过吸收外界的糖分和氨基酸,将其转化为醇、脂肪酸、辅酶等物质,通过酰基转移酶合成乙酸乙酯等酯类物质[23-25]。
2 酿酒酵母酯代谢通路
酿酒大曲中早已发现并分离的产酒产香酿酒酵母(Saccharomyces cerevisiae),是目前在食品发酵中使用最广泛的酵母[26-27]。通过国内外学者多年的研究,酿酒酵母细胞在发酵过程中负责合成酯类化合物的各种酶及合成通路正逐步被发现。目前,已发现的酵母酯代谢通路有三条:(1)醇酰基辅酶A和醇在醇酰基转移酶的催化下合成酯类[28];(2)烟酰胺腺嘌呤二核苷酸(nicotinamideadeninedinucleotide,NAD+)或烟酰胺腺嘌呤二核苷磷酸(nicotinamide-adenine dinucleotide phosphate,NADP+)作为氢受体的存在条件下,醇脱氢酶将通过醇和醛亲核加成反应合成的半缩醛脱氢形成酯类[29];(3)通过脂肪酶或酯酶将醇和酸酯化成酯[30]。酵母菌醇酰基转移酶来源较为广泛,其中包括酿酒酵母、克鲁维氏酵母(Kluyveromyces)、巴氏酵母(Saccharomyces bayanus)和葡萄汁酵母(Saccharomyces uvarum)等,不同的来源其呈现出不同的酶活力和底物选择性;目前主要报道的是酿酒酵母和葡萄汁酵母中的醇酰基转移酶[31-32]。
酿酒酵母代谢产生的芳香活性酯依据成分来源分为两类:一类是由高级醇和乙酰辅酶A为底物合成的乙酸酯,目前酿酒酵母中已发现Atf1p、Atf2p和LgAtf1p(现已从不同的酵母背景中克隆,包括啤酒酵母)三种醇酰基转移酶负责催化乙酸酯的合成;另一类是由酰基辅酶A活化的中链脂肪酸和乙醇为底物合成的乙基酯,酿酒酵母中催化乙基酯的醇酰基转移酶为Eeb1p和Eht1p[33]。酿酒酵母通过醇酰基转移酶途径合成乙酸酯和乙基酯的简明合成通路见图1[33-35]。其中,合成乙酸酯的高级醇主要包括两个来源:一是埃利希(Ehrlich)途径,即氨基酸通过转氨形成α-酮酸,进而还原形成高级醇[34];二是哈里斯(Harris)途径,即α-酮酸来源于葡萄糖等碳水化合物的代谢,并经2-酮基酸脱羧酶和脱氢酶分别脱羧脱氢形成高级醇[35]。另外需要强调的是,α-酮丁酸不仅可以由丙酮酸代谢合成,一些氨基酸如天冬氨酸、高丝氨酸、苏氨酸也是α-酮丁酸合成的前体物质[36]。在酒精发酵过程中,酵母菌代谢产生乙酸酯等不饱和脂肪酸以增强膜的流动性;由于中链脂肪酸对细胞的毒性,乙基酯的形成属于酵母细胞一种自我保护机制,两种酯类物质的产生受酵母细胞控制互不影响。
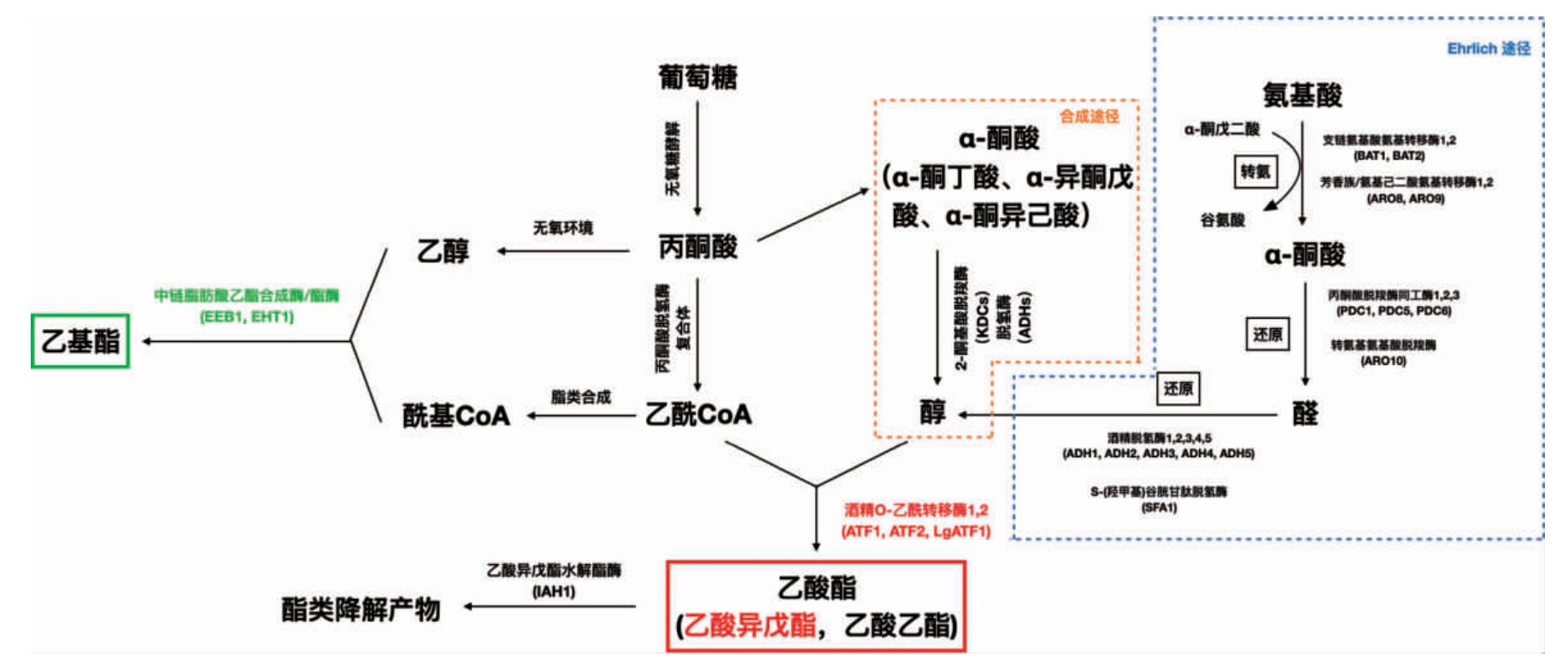
图1 酿酒酵母醇酰基转移酶途径合成乙基酯和乙酸酯类物质通路
Fig.1 Synthesis pathway of ethyl esters and acetate esters by alcohol acyltransferase pathway in Saccharomyces cerevisiae
2.1 醇酰基转移酶Atf1p、Atf2p和LgAtf1p负责酿酒酵母乙酸酯的合成
2.1.1 醇酰基转移酶Atf1p、Atf2p的来源、分布和序列信息
1993年,MINETOKI T T等[37]首次通过多次色谱纯化,在酿酒酵母的微粒体组分中获得醇酰基转移酶Atf1p,该蛋白分子质量大小为61.1 kDa,编码525个氨基酸;ATF1基因的同源基因Lg-ATF1随后也在Saccharomyces uvarum中被发现[38],但是对于该基因目前尚无具体研究。酿酒酵母醇酰基转移酶Atf1p与其他酵母如假丝酵母(Candida)、巴氏酵母和乳酸克鲁维氏酵母的酰基转移酶序列比对显示2个潜在的必需区域:WRLICLP基序和ATF1基因编码的198~202位氨基酸表达的高度保守的HXXXD区域[39];醇酰基转移酶Atf1p C端与N端的两亲性螺旋,决定了醇酰基转移酶Atf1p在内质网中与脂滴的结合[40-41];ATF2基因由NAGASAWA N T等[42]于1998年成功克隆。细胞低表达量的醇酰基转移酶Atf2p含535个氨基酸,分子质量大小为61.9 kDa,与ATF1基因序列相似度为36.9%,也被认为是内质网膜蛋白[31,41,43]。Atf2p的C端与N端的两亲性螺旋,决定了醇酰基转移酶Atf2p在内质网中与脂滴的锚定[41-42]。
通过对酿酒酵母ATF1基因进行无义突变发现,ATF1基因无义突变酵母仍能保留40%乙酸乙酯和75%苯乙酸乙酯的合成能力,但乙酸异戊酯合成能力大幅降低,降低80%,确定醇酰基转移酶Atf1p主要负责酿酒酵母细胞中异戊醇酰辅酶A的转移,并催化乙酸异戊酯的生物合成[44-45];而基因ATF1与ATF2双敲除酿酒酵母则完全不合成乙酸异戊酯,证明了基因ATF1和ATF2参与了酿酒酵母细胞所有的乙酸异戊酯催化合成,同时也说明乙酸异戊酯的生物合成由醇酰基转移酶Atf2p与Atf1p共同催化[31,46]。
2.1.2 醇酰基转移酶Atf1p、Atf2p的酶学性质、调控机制与生理功能
通过ATF1基因的克隆表达[38,47]、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)[38,47]和生理生化检测[38,47]等试验表明,其中ATF1基因的表达量较低,且醇酰基转移酶Atf1p的催化活性能被多种重金属离子(Cd2+、Cu2+、Zn2+、Hg2+)和巯基试剂抑制[37];异戊醇为催化限制因子,通风、非饱和脂肪酸的加入均可抑制Atf1p的活性[47]。生化实验表明,醇酰基转移酶Atf2p也具有广泛的酰基转移酶的活性,但比酶活只有醇酰基转移酶Atf1p的50%,然而非饱和脂肪酸不能完全抑制醇酰基转移酶Atf2p的酶活[42,48]。醇酰基转移酶Atf1p能催化多种酯的合成,但更倾向于使用长链醇和直链醇作为合成底物[47];醇酰基转移酶Atf1p对温度敏感,这可能与醇酰基转移酶Atf1p中含14个半胱氨酸有关[41,47];醇酰基转移酶Atf1p体外实验显示出额外的硫酯酶活性,且在HXXXD区域中组氨酸的突变无法完全消除该活性[37-41,47,49]。
ATF1基因5'端上游碱基长度约150 bp的基因序列参与了醇酰基转移酶Atf1p的表达调控,已完全阐明的调控机制包括缺氧抑制因子阻遏物Rox1p及阻遏复合物Tup1p-Ssn6p(Rox1p-Tup1p-Ssn6p)复合物对ATF1基因在富氧环境下的表达抑制、富氮环境下通过蛋白质激酶Sch9p激活培养基诱导的发酵生长(fermentable-growth-medium-induced,FGM)通路与下游的Rap1p蛋白来调控ATF1基因的转录、以及葡萄糖能通过Ras-cAMP/PKA信号通路(ras-protein kinase a pathway,Ras/cAMP/PKA)诱导无氧条件下碳源饥饿的酿酒酵母细胞的ATF1基因表达[50-51]。
基于上述调控机制,VERSTREPEN K J等[51]提出醇酰基转移酶Atf1p的生理功能可能是通过酯化某些膜组分的游离羟基,以优化在环境压力下的膜的性质。醇酰基转移酶Atf2p的生理功能见图2,功能性获得和缺失突变实验结果显示醇酰基转移酶Atf2p与锚定在细胞膜上的脱乙酰酶Say1p共同维持甾醇的稳态;脱乙酰酶Say1p决定了酰化的甾醇是否分泌以及是否脱酰基,醇酰基转移酶Atf2p则决定了甾醇荷尔蒙毒性前体如孕烯醇酮的酰化与分泌,二者在3-β-羟基类固醇的解毒过程中发挥了重要作用[52-53]。

图2 醇酰基转移酶Atf2p的生理功能
Fig.2 Physiological functions of alcohol acyltransferase Atf2p
2.2 醇酰基转移酶Eeb1p和Eht1p负责酿酒酵母乙基酯的合成
2.2.1 醇酰基转移酶Eeb1p和Eht1p来源、分布和序列特征
由于在ATF1和ATF2双缺失基因中仍能检测出与出发菌株等量的乙基酯[31],MASON A B等[54]提出第四种酯合成酶,乙醇己酰基转移酶Eht1p,负责催化乙醇和己酰基-辅酶A生成己酸乙酯。SAERENS S M G等[55]于2006年报道了来自三成员基因家族的YBR177c/EHT1、YPL095c/EEB1和YMR210w基因,并证明了Eht1p和Eeb1p这两种醇酰基转移酶:醇-O-酰基转移酶(acyl-CoA ethanol O-acyltransferases,AEATases)催化酵母中大多数的酰基辅酶A和乙醇合成中链脂肪酸乙基酯,但是第三个家族成员Ymr210w在中链脂肪酸乙酯的形成中不发挥重要作用。
1999年,ATHENSTAEDT K等[56]研究发现,醇酰基转移酶Eht1p存在于脂质颗粒中[57]。该脂质颗粒由高度疏水的核心组成,核心则由中性脂质(三酰基甘油和甾醇酯)形成,脂质颗粒周围被磷脂单层包围,在磷脂层中仅嵌入了少量跨膜蛋白质。脂质颗粒用作能量来源和/或作为膜生物发生所需的脂肪酸和固醇的来源。与野生型菌株相比,EHT1基因高表达菌株含有更高含量的三酰基甘油和甾醇酯,然而Eeb1p的细胞定位暂时不确定[56]。
基因EEB1和EHT1的碱基长度分别为1 356 bp,1371 bp,其同源性>99.7%,分别编码451个氨基酸和456个氨基酸,分子质量分别为51.2 kDa、51.7 kDa,编码蛋白序列的同源性为57.68%,属于同一家族,其N端145个氨基酸非常相似,但目前还没有鉴定出二级结构,C端含有α/β水解酶折叠位点[55]。
SAERENS S M G等[55,58]预测Eht1p和Eeb1p蛋白含有酯化反应的关键催化域(Ser-Asp-His),其被认为是醇酰基转移酶的催化位点,即底物结合位点,其结构预测结果中得到催化三联体(Ser-Asp-His)见图3[55],该催化三联体负责酯交换反应,使这两种蛋白具有酯合成酶和酯酶活力;Eht1p蛋白的催化位点分别位于Ser-247、Asp-395、His-423,而Eeb1p蛋白的催化位点位于Ser-251、Asp-399、His-428。

图3 Eht1p催化三联体三维结构
Fig.3 Three-dimensional structure of Eht1p catalytic triad
2.2.2 醇酰基转移酶Eeb1p和Eht1p酶学性质及生理功能
关于合成乙基酯的关键酶,目前仍然存在争议。Eeb1p和Eht1p酶的含量影响己酸乙酯、辛酸乙酯和癸酸乙酯的生成,是酵母代谢控制中短链脂肪酸乙基酯合成的关键酶[59-60]。对从食源性物质中分离得到的酵母菌株进行产香挥发性成分检测,发现其中包含多种酯类物质如辛酸乙酯和己酸乙酯等[61]。FUKUDA K等[62]通过分析已筛选的酵母中控制酯类合成的酶,发现EHT1基因是酵母中合成中链脂肪酸的关键基因,并且有短链酯酶活力;通过检测EHT1和EEB1基因的分布情况时发现EHT1基因在所有菌株中均存在,而EEB1基因只在部分酵母菌株中存在,推测EHT1基因可能是酵母合成酯类物质的重要基因之一,同样也反映出EEB1基因是酿酒酵母的非必需基因[62]。而SAERENS S M G等[55]将敲除部分片段的菌株与野生菌株相比较发现,EEB1基因的缺失的菌株会导致丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯的含量大幅降低;而EHT1基因的缺失的菌株仅会导致己酸乙酯和辛酸乙酯的少量减少;当两个基因双缺失时产生的乙酯的量和基因EEB1缺失时产生量相差无几,这表明在生成中链脂肪酸乙基酯的过程中,Eht1p仅起次要作用,而Eeb1p起主要作用,这与上述FUKUDA K等[62]的观点不同。
SAERENS S M G等[55]研究发现,醇酰基转移酶Eht1p更大程度的控制了短链脂肪酸酯的合成,由醇酰基转移酶Eht1p催化形成的丁酸乙酯的含量是已酸乙酯的4倍;而醇酰基转移酶Eeb1p偏好利用辛酰辅酶A,是催化中链乙酯的主要酶;另外,当两个基因表达都受到抑制时,体内仍然检测到中链脂肪酸乙酯,推测在酿酒酵母内还存在有一种或多种负责中链脂肪酸乙基酯合成的醇酰基转移酶。体外酶活测定结果表明,醇酰基转移酶Eht1p和Eeb1p两者对长链脂肪酸酯几乎没有作用,推测可能由于酶的底物特异性,使得它们对底物的选择性也存在明显的不同;此外,醇酰基转移酶Eht1p对C6酯的分解效果最强,而在相同的底物浓度下,醇酰基转移酶Eeb1p催化合成辛酸乙酯的能力是Eht1p蛋白催化能力的10倍[55]。
近年来报道将醇酰基转移酶基因转入大肠杆菌(Escherichia coli)异源表达,在重组菌的大肠杆菌中,通过提高酰基辅酶A的生成量,并通过抑制其他消耗酰基辅酶A的路径,使得酯类物质含量增加[63]。通过体外实验证明,添加醇酰基转移酶作用底物(酰基辅酶A)能有效的提高相应酯类物质的合成量[48]。2014年,KNIGHT M J等[64]利用TOP10超级感受态对Eht1p蛋白进行异源表达及纯化,并通过连续偶联酶测定法去表征重组酶醇酰基转移酶Eht1p底物的偏好性和酶的动力学参数,通过动力学参数分析证明了其首选底物为辛酰基-辅酶A,并得到其对底物辛酰基-辅酶A表现出最高的亲和力,且直到酰基链长度增长到C14的时候其底物亲和力才略有降低。LILLY M等[59,64-67]通过在工业酵母分别对Eeb1p和Eht1p进行了过表达,结果却分别都能显著地提高中链脂肪酸乙酯,特别是己酸乙酯、辛酸乙酯的含量[68]。因此,根据现有报道的结果可以看出,对于过表达EEB1和EHT1基因是否同时具有相对平衡的酯合成和酯水解活性存在着争议,还有待后续实验的探究。
此外,醇酰基转移酶Eht1p还具有硫酯酶的活性,并且可以水解中链酰基辅酶A生成游离脂肪酸,但是,醇酰基转移酶Eht1p无法水解对硝基苯基酰基酯,无法充当通用水解酶;醇-O-酰基转移酶的主要代谢作用是从厌氧条件下开始,在酵母细胞逐渐积累中链酰基辅酶A的过程中回收游离的辅酶A;另外,游离的脂肪酸和乙醇均可抑制发酵和细胞生长,醇酰基转移酶Eht1p可能被隔离在脂质颗粒/线粒体内,以促进蛋白质与酰基辅酶A和乙醇的相互作用,这一过程可能有利于脂肪酸酯乙酯的合成,以使脂肪酸和乙醇解毒[69-70]。目前,醇酰基转移酶Eeb1p的动力学参数及酶学性质并未进行深入的研究,且醇酰基转移酶Eeb1p和Eht1p的三级结构,目前均未解析,未来通过结构生物学的方式对其结构和功能的研究将成为研究重点。
2.3 乙酸异戊酯水解酶Iah1p负责酿酒酵母乙酸酯的水解
2.3.1 乙酸异戊酯水解酶Iah1p的酶学性质
乙酸异戊酯水解酶(isoamylacetate-hydrolyzingesterase,Iah1p)是酵母发酵过程中酯类化合物代谢的一个关键酶,它与醇乙酰基转移酶(alcohol acetyltransferase,ATFase)共同调控着异戊醇与乙酰辅酶A缩合生成乙酸异戊酯的过程[61,71]。在乙基酯含量的影响下,与酯合成酶相比,酯水解酶研究较少。酯合成酶和酯酶之间的平衡,即酯水解酶,对乙酯的净积累量起着决定性的作用[62]。酯酶催化酯的裂解,在某些条件下,催化酯键的形成,它是一类不同的水解酶。在酯类分解中,酯酶催化反应为RCOOR+H2O→ROH+RCOOH[72]。
FUKUDA K等[61,73]于1996年对酵母乙酰异戊醇水解酶进行克隆并鉴定。LILLY M等[59,74]研究证实,在IAH1基因缺失的酵母菌株发酵过程中,其乙酸异戊酯和其他酯类物质的含量显著提高,但是当IAH1基因过表达时,乙酸乙酯、乙酸异戊酯、乙酸己酯和乙酸2-苯乙酯显著降低。当底物pH值属于中性范围时该酶具有合成酯酶和酯水解酶的活性。此外,通过活性位点抑制研究发现,丝氨酸和半胱氨酸残基均参与了乙酰异戊醇水解酶Iah1p酶的催化活性,且阻断与半胱氨酸残基相邻的丝氨酸残基会引起抑制,且Hg2+、对氯汞基苯甲酸酯(C7H5ClHgO2)和氟磷酸二异丙酯(C6H14FO3P)也同样能抑制酶的活性;当通过计算机分析表明,乙酰异戊醇水解酶Iah1p包含一个活性位点的巯基,可将其归为芳基酯酶[73]。
2.3.2 乙酸异戊酯水解酶Iah1p的结构分析
乙酰异戊醇水解酶IAH1基因长度为717 bp,编码238个氨基酸,蛋白的分子质量大小为27.3 kDa。研究报道,羧酸酯酶和脂肪酶在活性中心具有必需的丝氨酸残基,并且包含该丝氨酸残基的活性位点的共有氨基酸序列为Gly-Xaa-Ser-Xaa-Gly[75-77];而乙酰异戊醇水解酶Iah1p推测的活性位点基序具有与该描述共有序列相似的序列Ala85-Cys86-Ser87-Ala88-Gly89[61]。此外,AKOH C C等[78-79]研究发现,在乙酰异戊醇水解酶Iah1p的N端附近有一个独特的GDSL序列基序和四个保守的序列区。
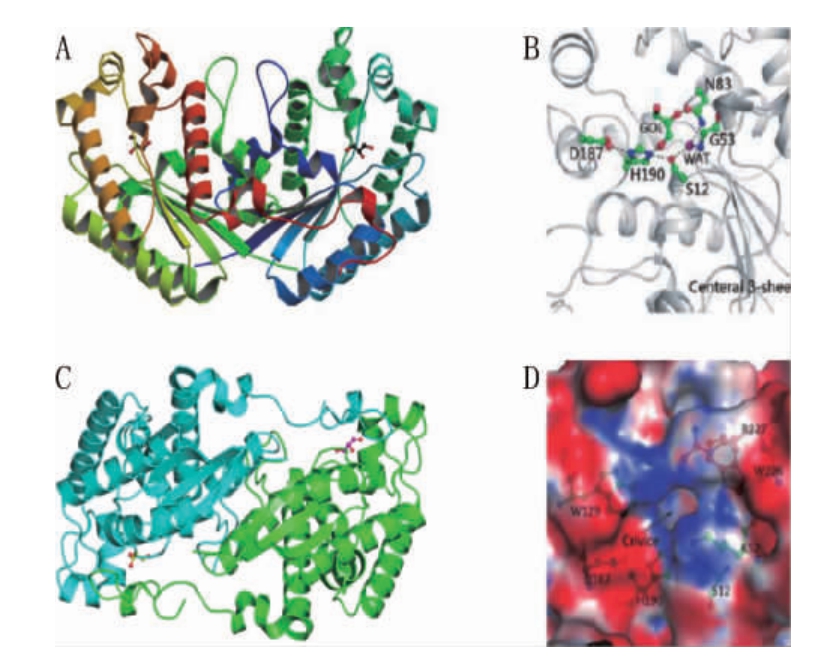
图4 乙酰异戊醇水解酶Iah1p的晶体结构(A)、中央β-折叠片(B)、同二聚体型式(C)及亚基酶活性口袋(D)
Fig.4 Crystal structure (A),central β-sheet (B),homodimer type (C)and subunit enzyme active pocket (D) of isoamyl acetatehydrolyticenzyme Iah1p
通过乙酰异戊醇水解酶Iah1p的晶体结构(图4A)研究发现,该酶属于SGNH-hydrolase家族;与同源序列对比后发现,其中央β-折叠片和催化活性残基具有高度保守的结构(图4B);此外,乙酰异戊醇水解酶Iah1p是该家族中目前发现的唯一以二聚体形式存在的蛋白(图4C),且不管是溶液还是晶体均是以同二聚体的形式存在,并通过实验证实,该同二聚体对于蛋白的酶活和底物特异性有着重要的意义。由于乙酰异戊醇水解酶Iah1p所特有的一段C-temimus使得通过二聚化作用形成了另一个亚基酶活性口袋(图4D),并首次发现二聚化作用参与了酶活性中心的形成并限制了酶的底物特异性[78]。
通过分析结构,可以将乙酰异戊醇水解酶Iah1p的活性口袋根据其功能分为三层,第一和三层(上下层)包含了结合酯类的疏水性侧链,第二层(中间层)进行催化三联体催化的水解反应。通过对结构模型进行分析,推测底物进入活性口袋后,其长的疏水性侧链应当更加倾向于留在活性口袋的上部,甚至延伸至溶剂区。根据其结果进一步推测乙酰异戊醇水解酶Iah1p的残基Lys52和Trpl29可以在底物进入活性中心后,为底物提供疏水性位点的侧链[79-80]。
3 结论与展望
本文阐述了合成酯类的一大类醇酰基转移酶,其中包括乙酸酯酶和乙基酯酶;乙酸酯酶的Atf1p和Atf2p主要负责乙酸乙酯和乙酸异戊酯等酯类物质的合成,由于两者酶学性质的不同及生理活性的差异,使得两者具有不同的生理功能:Atf1p比酶活力高于Atf2p,Atf2p有助于细胞解毒;乙基酯的Eht1p和Eeb1p主要负责己酸乙酯、辛酸乙酯和癸酸乙酯等中链脂肪酸的合成,通过过表达、序列预测及异源表达等方法,研究其酶学性质及序列。
近几年关于酿酒酵母酰基转移酶在葡萄酒、啤酒等应用中的报道较多,但在白酒中的研究和应用报道寥寥可数。对白酒发酵过程中发酵产酯、生香机理、机制分子层面的认识,可以使相关科研人员从根本上获得发酵过程中微生物分子水平层面作用的一些重要参数和指标,对于亟待国际化的中国白酒而言,迫切需要一套各项生产参数均可量化的标准。只有这样,中国白酒方能真正在国际上站稳脚跟,赢得世界范围内的白酒市场。
[1]信春晖,许玲,董乔娟,等.酿酒微生物对酒体质量及风格的影响[J].酿酒,2016,43(2):38-47.
[2]祝云飞,黄治国,邓杰,等.浓香型大曲中一株酵母菌的分离鉴定及其挥发性产物分析[J].四川理工学院学报(自然科学版),2016,29(1):7-11.
[3]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[4]唐贤华,张崇军,彭志云,等.大曲用量对浓香型白酒发酵糟醅质构特性的影响[J].酿酒,2019,46(3):36-40.
[5]王亚平,邢爽,孙中贯,等.液态法大曲酒发酵过程中高级醇影响因素的研究[J].天津科技大学学报,2019,34(5):39-44.
[6]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):16-19.
[7]邢爽,魏志阳,郭学武,等.不同香型大曲酯化酶的特性分析[J].现代食品科技,2018,34(5):87-92.
[8]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[9]霍丽娜,王运霄,李达.老白干香型原酒的微量成分与风格特点分析[J].酿酒科技,2015(10):70-72.
[10]乔翠红,仝佳平,欧婷婷,等.气相色谱-嗅闻-质谱联用分析兼香型白酒风味成分[J].食品研究与开发,2019,40(18):160-165.
[11]LI K,FU G,WU C,et al.Dynamics of eukaryotic microbial community succession during the traditional fermentation of special-flavor liquor[J].Food Sci,2017,38(22):131-136.
[12]沈小梅,刘国英.浓香型基酒主要香味成分快速测定方法的研究[J].酿酒,2019,46(4):74-77.
[13]李先贵,陈剑波,王莉,等.酱香型白酒中有机酸的分析[J].酿酒科技,2019(6):105-107.
[14]赵向东,翟旭龙,相里加雄,等.谈谈清香型白酒的风格[J].酿酒科技,2016(9):135-136.
[15]杨沁郁,李勇,邓全道,等.X 射线荧光光谱法测定米香型白酒中有机铝的形态[J].酿酒科技,2017(3):100-106.
[16]周金虎,管健,魏浩林,等.白酒中健康因子的研究进展[J].酿酒科技,2017(7):90-94.
[17]罗小叶,邱树毅,王晓丹.微生物发酵产酯化酶在浓香型白酒品质提升中研究进展[J].中国酿造,2019,38(8):6-8.
[18]祝霞,刘琦,赵丹丹,等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学,2019,40(16):115-123.
[19]崔小亮,邵小兵,钟和平,等.多粮浓香型白酒生产过程中可培养酵母菌多样性分析与优质功能菌筛选[J].中国酿造,2019,38(7):105-110.
[20]王珂佳,邱树毅.微生物代谢组学及其在白酒酿造中的应用研究进展[J].中国酿造,2019,38(9):1-6.
[21]刘源才,杨强,杨生智,等.清香型小曲白酒中产酯酵母的筛选及应用[C].太原:2015 年国际酒文化学术研讨会,2015.
[22]邢爽,王亚平,郭学武,等.发酵条件对5 种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[23]SAERENS S M,DELVAUX F,VERSTREPEN K J,et al.Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J].Appl Environ Microbiol,2008,74(2):454-461.
[24]富志磊,范光森.酵母相互作用及混菌发酵提高乙酸乙酯产量[C].青岛:中国食品科学技术学会第十五届年会,2018:656.
[25]郑楠,郭庆焕,何亚辉,等.乙酰辅酶A 含量对酿酒酵母乙酸乙酯合成的影响[J].中国酿造,2018,37(5):150-156.
[26]朱志明,朱旺明,蓝汉冰,等.酿酒酵母营养调控功能及其在水产饲料中的应用研究进展[J].动物营养学报,2014,26(12):3550-3560.
[27]GONZÁLEZ S S,BARRIO E,GAFNER J,et al.Natural hybrids from Saccharomyces cerevisiae, Saccharomyces bayanus and Saccharomyces kudriavzevii in wine fermentations[J]. FEMS Yeast Res,2006,6(8):1221-1234.
[28]WOLTER H,LIETZ P,BEUBLER A.Influence of temperature and yeast strain on the formation of fermentation amyl alcohol,isobutanol and ethyl acetate in fermenting malt wort [J].Folia Microbiol,1966,11(3):210-214.
[29]YURIMOTO H,LEE B,YASUDA F,et al.Alcohol dehydrogenases that catalyse methyl formate synthesis participate in formaldehyde detoxification in the methylotrophic yeast Candida boidinii[J].Yeast,2004,21(4):341-350.
[30]LIU S Q,HOLLAND R,CROW V L.Esters and their biosynthesis in fermented dairy products:A review[J].Int Dairy J,2004,14(11):923-945.
[31]VERSTREPEN K J,VAN LAERE S D,VANDERHAEGEN B M,et al.Expression levels of the yeast alcohol acetyltransferase genes ATF1, Lg-ATF1,and ATF2 control the formation of a broad range of volatile esters[J].Appl Environ Microbiol,2003,69(9):5228-5237.
[32]STRIBNY J,QUEROL A,PEREZ-TORRADO R.Differences in enzymatic properties of the Saccharomyces kudriavzevii and Saccharomyces uvarum alcohol acetyltransferases and their impact on aroma-active compounds production[J].Front Microbiol,2016,7:897.
[33]QUEROL A,PEREZ-TORRADO R,ALONSO-BEL-REAL J,et al.New trends in the uses of yeasts in oenology[J].Adv Food Nutr Res,2018,85:177-210.
[34]HAZELWOOD L A,DARAN J M,MARIS A J A V,et al.The ehrlich pathway for fusel alcohol production:Acentury of research on Saccharomyces cerevisiae metabolism[J]. Appl Environ Microbiol,2008,74(12):2259-2266.
[35]EDEN A,VAN NEDERVELDE L,DRUKKER M,et al.Involvement of branched-chain amino acid aminotransferases in the production of fusel alcohols during fermentation in yeast[J]. Appl Microbiol Biotechnol,2001,55(3):296-300.
[36]PARK S H,KIM S,HAHN J S.Metabolic engineering of Saccharomyces cerevisiae for the production of isobutanol and 3-methyl-1-butanol[J].Appl Microbiol Biotechnol,2014,98(21):9139-9147.
[37]MINETOKI T T,BOGAKI T,IWAMATSU A,et al.The purification,properties and internal peptide sequences of alcohol acetyltransferase isolated from Saccharomyces cerevisiae Kyokai No.7[J].Biosci Biotechnol Biochem,1993,57(12):2094-2098.
[38]FUJII T,NAGASAWA N,IWAMATSU A,et al.Molecular cloning,sequence analysis,and expression of the yeast alcohol acetyltransferase gene[J].Appl Environ Microbiol,1994,60(8):2786-2792.
[39]NANCOLAS B,BULL I D,STENNER R,et al.Saccharomyces cerevisiae Atf1p is an alcohol acetyltransferase and a thioesterase in vitro[J].Yeast,2017,34(6):239-251.
[40]VERSTREPEN K J,LAERE SDMV,VERCAMMEN J,et al.The Saccharomyces cerevisiae alcohol acetyl transferase Atf1p is localized in lipid particles[J].Yeast,2004,21(4):367-377.
[41]LIN J L,WHEELDON I.Dual N-and C-terminal helices are required for endoplasmic reticulum and lipid droplet association of alcohol acetyltransferases in Saccharomyces cerevisiae[J].PLoS One,2014,9(8):700-707.
[42]NAGASAWA N,BOGAKI T,IWAMATSU A,et al.Cloning and nucleotide sequence of the alcohol acetyltransferase II gene (ATF2) from Saccharomyces cerevisiae Kyokai No.7 [J].Biosci Biotechnol Biochem,1998,62(10):1852-1857.
[43]VAN LAERE S D,SAERENS S M,VERSTREPEN K J,et al.Flavour formation in fungi:characterisation of KlAtf,the Kluyveromyces lactis orthologue of the Saccharomyces cerevisiae alcohol acetyltransferases Atf1 and Atf2[J].Appl Microbiol Biotechnol,2008,78(5):783-792.
[44]FUJII T,YOSHIMOTO H,TAMAI Y.Cetate ester production by Saccharomyces cerevisiae lacking the ATF1 gene encoding the alcohol acetyltransferase[J].J Ferment Bioeng,1996,81(6):538-542.
[45]YOSHIMOTO H,FUKUSHIGE T,YONEZAWA T,et al.Genetic and physiological analysis of branched-chain alcohols and isoamyl acetate production in Saccharomyces cerevisae[J]. Appl Microbiol Biotechnol,2002,59:501-508.
[46]LI W,WANG J H,ZHANG C Y,et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J]. J Ind Microbiol Biotechnol,2017,44(6):949-960.
[47]FUJII T,KOBAYASHI O,YOSHIMOTO H,et al.Effect of aeration and unsaturated fatty acids on expression of the Saccharomyces cerevisiae alcohol acetyltransferase gene[J]. Appl Environ Microbiol,1997,63(3):910-915.
[48]HORTON C E,HUANG K X,BENNETT G N,et al.Heterologous expression of the Saccharomyces cerevisiae alcohol acetyltransferase genes in Clostridium acetobutylicum and Escherichia coli for the production of isoamyl acetate[J].J Ind Microbiol Biotechnol,2003,30(7):427-432.
[49]STEYER D,ERNY C,CLAUDEL P,et al.Genetic analysis of geraniol metabolism during fermentation[J]. Food Microbiol,2013,33(2):228-234.
[50]FUJIAWARA D,YOSHIMOTO H,SONE H,et al.Transcriptional coregulation of Saccharomyces cerevisiae alcohol acetyltransferase gene,ATF1 and delta-9 fatty acid desaturase gene,OLE1 by unsaturated fatty acids[J].Yeast,1998,14(8):711-721.
[51]VERSTREPEN K J,DERDERDELINCKX G,DUFOUR J P,et al.The Saccharomyces cerevisiae alcohol acetyl transferase gene ATF1 is a target of the cAMP/PKA and FGM nutrient-signalling pathways[J]. FEMS Yeast Res,2003,4(3):285-296.
[52]CAUET G,DEGRYSE E,LEDOUX C,et al.Pregnenolone esterification in Saccharomyces cerevisiaea potential detoxification mechanism[J].Eur J Biochem,1999,261(1):317-324.
[53]TIWARI R,KOFFEL R,SCHNENITER R.An acetylation/deacetylation cycle controls the export of sterols and steroids from S.cerevisiae[J].Embo J,2007,26(24):5109-5119.
[54]MASON A B,DUFOUR J P.Alcohol acetyltransferases and the significance of ester synthesis in yeast[J].Yeast,2000,16(14):1287-1298.
[55]SAERENS S M G.The Saccharomyces cerevisiae EHT1 and EEB1 genes encode novel enzymes with medium-chain fatty acid ethyl ester synthesis and hydrolysis capacity[J].J Biol Chem,2006,281(7):4446-4456.
[56]ATHENSTAEDT K,ZWEYTICK D,JANDROSITZ A,et al.Identification and characterization of major lipid particle proteins of the yeast Saccharomyces cerevisiae[J].J Bacteriol,1999,181(20):6441-6448.
[57]ZHU J,SCHWARTZ C,WHEELDON I.Controlled intracellular trafficking alleviates an expression bottleneck in S.cerevisiae ester biosynthesis[J].Metab Eng Comm,2019,8:e00085.
[58]HOLMQUIST M.Alpha Beta-hydrolase fold enzymes structures,functions and mechanisms[J].Curr Protein Pep Sci,2000,1(2):209-235.
[59]LILLY M,BAUER F F,LAMBRECHTS M G,et al.The effect of increased yeast alcohol acetyltransferase and esterase activity on the flavour profiles of wine and distillates[J].Yeast,2006,23(9):641-659.
[60]TAKAHASHI T,OHARA Y,SUENO K.Breeding of a sake yeast mutant with enhanced ethyl caproate productivity in sake brewing using rice milled at a high polishing ratio[J].JBiosci Bioeng,2017,123(6):707-713.
[61]FUKUDA K,KUWAHATA O,KIYOKAWA Y,et al.Molecular cloning and nucleotide sequences of isoamyl acetate-hydrolyzing esterase gene(EST2)from Saccharomyces cerevisiae[J].J Ferment Bioeng,1996,82(1):8-15.
[62]FUKUDA K,YAMAMOTO N,KIYOKAWA Y,et al.Brewing properties of sake yeast whose EST2 gene encoding isoamyl acetate-hydrolyzing esterase was disrupted[J].J Ferment Bioeng,1998,85(1):101-106.
[63]VADALIR V,BENNETT G N,SANK Y.Applicability of CoA/acetyl-CoA manipulation system to enhance isoamyl acetate production in Escherichia coli[J].Metab Eng,2004,6(4):294-299.
[64]KNIGHTM J,BULLI D,CURNOW P.The yeast enzyme Eht1 is an octanoyl-CoA:Ethanol acyltransferase that also functions as a thioesterase[J].Yeast,2014(31):463-474.
[65]YIN H,LIU L P,YANG M,et al.Enhancing medium-chain fatty acid ethyl ester production during beer fermentation through EEB1 and ETR1 overexpression in Saccharomyces pastorianus[J].J Agr Food Chem,2019,67(19):5607-5613.
[66]CHEN Y,LI F,GUO J,et al.Enhanced ethyl caproate production of Chinese liquor yeast by overexpressing EHT1 with deleted FAA1[J]. JInd Microbiol,2014,41(3):563-572.
[67]李锋,陈叶福,郭建,等.过表达EHT1 基因对酿酒酵母己酸乙酯生产能力的影响[J].现代食品科技,2014,30(3):93-98.
[68]ZHUANG S,FU J,POWELL C,et al.Production of medium-chain volatile flavour esters in Pichia pastoris whole-cell biocatalysts with extracellular expression of Saccharomyces cerevisiae acyl-CoA:ethanol O-acyltransferase Eht1 or Eeb1[J].Springerplus,2015,4(1):467.
[69]SAERENS S M,DELVAUX F R,VERSTREPEN K J,et al.Production and biological function of volatile esters in Saccharomyces cerevisiae[J].Microb Biotechnol,2010,3(2):165-177.
[70]BARDI L,CRIVELLI C,MARZONA M.Esterase activity and release of ethyl esters of medium-chain fatty acids by Saccharomyces cerevisiae during anaerobic growth[J].Can J Microbiol,1999,44(12):1171-1176.
[71]DANK A,SMID E J,NOTEBAART R A.CRISPR-cas genome engineering of esterase activity in Saccharomyces cerevisiae steers aroma formation[J].BMC Res Notes,2018,11(1):682.
[72]PEDDIE H A B.Ester formation in brewery fermentations[J].J I Brewing,1990,96(5):327-331.
[73]FUKUDA K,KIYOKAWA Y,YANAGIUCHI T,et al.Purification and characterization of isoamyl acetate-hydrolyzing esterase encoded by the IAH1 gene of Saccharomyces cerevisiae from a recombinant Escherichia coli[J].Appl Microbiol Biotechnol,2000,53(5):596-600.
[74]KURITA O.Increase of acetate ester-hydrolysing esterase activity in mixed cultures of Saccharomyces cerevisiae and Pichia anomala[J].J Appl Microbiol,2008,104(4):1051-1058.
[75]DAVID B.More of the catalytic triad[J].Nature,1990,343(6260):694-695.
[76]KAWAGUCHI Y,HONDA H,TANIGUCHI-MORIMURA J,et al.The codon CUG is read as serine in an asporogenic yeast Candida cylindracea[J].Nature,1989,341:164-166.
[77]SCHRAG J D,LI Y,WU S,et al.Ser-His-Glu triad forms the catalytic site of the lipase from Geotrichum candidum[J].Nature,1991,351(6329):761-764.
[78]AKOH C C,LEE G C,LIAW Y C,et al.GDSL family of serine esterases/lipases[J].Prog Lipid Res,2004,43(6):534-552.
[79]MA J,LU Q,YUAN Y,et al.Crystal s tructure of isoamyl acetate-hydrolyzing esterase from Saccharomyces cerevisiae reveals a novel active site architecture and the basis of substrate specificity[J].Proteins,2011,79(2):662-668.
[80]马金鸣.酵母乙酸异戊酯水解酶和V 型ATP 酶F 亚基的结构生物学研究[D].合肥:中国科学技术大学,2010.