由于全球能源危机和化石燃料供应有限,可再生能源受到越来越多的关注。生物燃料作为当前研究最热且最广泛的新能源之一,是以生物质作为载体,产生固、液、气等绿色可持续发展的能源[1]。目前应用最多的生物燃料是生物柴油和生物乙醇,生物丁醇与乙醇相比具有腐蚀性低、蒸汽压力低、可以与汽油以任意比例混合等优点[2],因此受到了广泛的关注。工业上生产丁醇主要采用化学合成和生物发酵两种方法,化学合成法主要包括羰基合成法和醇醛缩合法,但是这些方法反应条件复杂,对技术和设备要求较高。生物发酵法是以淀粉和糖质等为原料,利用丁醇梭菌生产丁醇,与化学合成法相比具有众多优势,包括投资小、技术设备要求低、发酵条件温和等[3]。发酵法因其产物为丙酮(acetone)、丁醇(butanol)和乙醇(ethanol),所以又称之为ABE发酵。ABE发酵分为产酸和产溶剂两个阶段:发酵初期,菌体迅速繁殖,并产生大量有机酸(乙酸、丁酸),使发酵液酸度迅速升高,同时伴随生产CO2和H2两种气体;当菌体繁殖到平稳期,酸度达到一定值后(pH达到4.3~4.5),进入产溶剂期,此时有机酸被菌体还原,酸度开始降低,同时产生溶剂(丙酮、丁醇、乙醇)[4]。目前,发酵法生产丁醇面临的三个主要问题是(1)菌株对氧的耐受性低。用于ABE发酵生产丁醇的菌株大多是厌氧菌,在发酵时要提供一个严格厌氧的环境,大大增加了试验和操作成本,因此提高丁醇生产菌株的耐氧能力是降低丁醇生产成本的关键措施之一;(2)生产原料成本高。研究表明,丁醇发酵过程中原料成本占总成本的70%~80%[5],廉价且易于利用的原料是丁醇发酵所需的;(3)丁醇的转化率和浓度低。目前,从自然界中筛选得到的丁醇生产菌通过ABE发酵生产丁醇的产量一般不超过20 g/L,转化率低于0.3 g/g[6]。造成这种现象的原因是发酵生成的溶剂(尤其是丁醇)对丁醇生产菌有致命的毒害作用,造成丁醇转化率和浓度较低,因此微生物对丁醇耐受性低是阻碍发酵法生产丁醇的最大瓶颈之一。本文从丁醇生产菌对氧的耐受性、发酵原料的选择、丁醇生产菌对溶剂的耐受性差导致的丁醇转化率和浓度低以及丁醇的原位提取等方面综述了生物丁醇生产的研究现状,讨论了ABE发酵存在的问题并提出改进策略,以期为丁醇生产菌株的定向改造及发酵过程控制优化提供借鉴。ABE发酵代谢途径如下:

①丙酮酸:铁氧还蛋白氧化还原酶;②硫解酶;③β-羟丁酰CoA脱氢酶;④丁烯酰CoA水解酶;⑤丁酰CoA脱氢酶;⑥CoA转移酶;⑦乙酸激酶;⑧辅酶A转移酶。
1 丁醇生产菌对氧的耐受性
用于ABE发酵的梭菌大多属于专性厌氧菌,氧对于这些细菌是有害甚至是致命的,当有氧气存在时,细胞内容易产生性质不稳定的![]() 会破坏各种具有生物活性的大分子,对细胞造成致命的伤害[7]。最新研究表明,在产丁醇梭菌中存在一类调控蛋白称为过氧化物还原机制调节抑制因子(peroxide repressor,PerR),在有氧环境下,它们可以抑制厌氧梭菌启动自身的氧化应激防御系统来清除氧和活性氧,导致它们无法在有氧环境下生存[8]。利用关键基因过表达或基因敲除技术对产丁醇梭菌进行遗传改造,可以提高菌株的耐氧能力以及丁醇产量。裴建新等[9]研究应用Ⅱ组内含子敲除技术敲除丙酮丁醇梭菌perR(超氧化物阻遏蛋白)基因,对突变菌株进行摇瓶发酵试验,突变菌株提高了对分子氧的耐受能力,降低厌氧环境要求,在生产发酵过程中可降低成本。肖川[8]利用二型内含子插入法成功敲除拜氏梭菌产溶剂退化菌株Clostridium beijerincki DS中参与过氧化物还原机制调节的PerR抑制子基因Cbei_1336,获得一株耐氧的兼性厌氧突变株,该突变株不但可以在有氧环境中生长良好,与出发菌株相比,丙酮和丁醇质量浓度分别提高至4.7 g/L和10.01 g/L。
会破坏各种具有生物活性的大分子,对细胞造成致命的伤害[7]。最新研究表明,在产丁醇梭菌中存在一类调控蛋白称为过氧化物还原机制调节抑制因子(peroxide repressor,PerR),在有氧环境下,它们可以抑制厌氧梭菌启动自身的氧化应激防御系统来清除氧和活性氧,导致它们无法在有氧环境下生存[8]。利用关键基因过表达或基因敲除技术对产丁醇梭菌进行遗传改造,可以提高菌株的耐氧能力以及丁醇产量。裴建新等[9]研究应用Ⅱ组内含子敲除技术敲除丙酮丁醇梭菌perR(超氧化物阻遏蛋白)基因,对突变菌株进行摇瓶发酵试验,突变菌株提高了对分子氧的耐受能力,降低厌氧环境要求,在生产发酵过程中可降低成本。肖川[8]利用二型内含子插入法成功敲除拜氏梭菌产溶剂退化菌株Clostridium beijerincki DS中参与过氧化物还原机制调节的PerR抑制子基因Cbei_1336,获得一株耐氧的兼性厌氧突变株,该突变株不但可以在有氧环境中生长良好,与出发菌株相比,丙酮和丁醇质量浓度分别提高至4.7 g/L和10.01 g/L。
2 生物丁醇发酵原料
2.1 淀粉质原料
富含淀粉的物质是生产生物燃料的第一代原料,如玉米、木薯等(表1)。将这些原料经预处理得到富含还原糖的水解液,然后经ABE发酵、发酵液精馏后得到正丁醇[10]。宋钢等[11]利用木薯粉发酵生产丁醇,结果表明最佳培养基为木薯粉120 g/L,乙酸铵6 g/L,此时5 L发酵罐中丁醇产量达到13.5 g/L,总溶剂达到22.8 g/L。虽然富含淀粉的物质是丁醇发酵的良好底物,但生物燃料生产对这些底物需求的增加也提高了这些原料的价格,因此需要寻找廉价且适宜的原料用于丁醇的生产。
表1 不同菌株和底物的丁醇发酵情况
Table1 Butanol fermentation of different strains and substrates
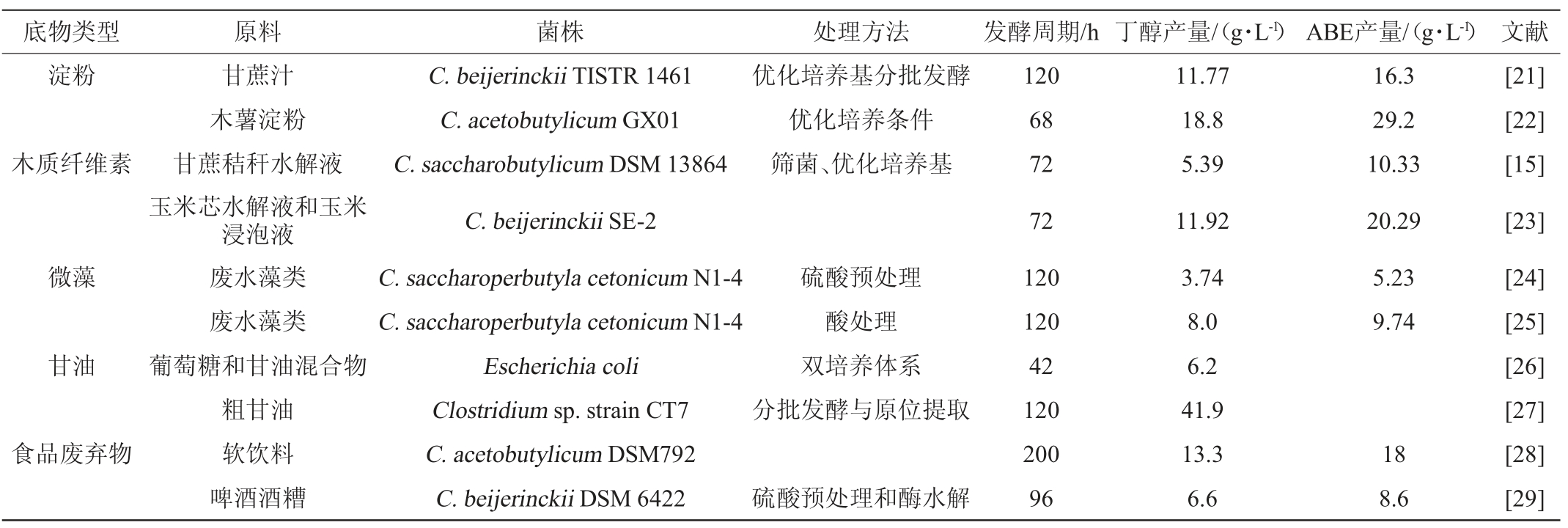
2.2 木质纤维素
木质纤维素是生产生物燃料的第二代原料,是典型的高效发酵基质的良好替代品。但是,从这些木质纤维素材料中获得可发酵性糖是非常困难的,木质纤维素在用作发酵底物之前,需要经过物理、化学或生物预处理,同时会产生弱酸类、呋喃类和酚类化合物等对微生物有毒害作用的副产物[12]。MAGALHAES B L等[13]从甘蔗秸秆水解液中筛选出产丁醇的梭状芽孢杆菌,通过优化培养基提高了该菌对木质纤维素水解物的耐受性,避免在水解物中过早的停止发酵,并使菌株能在79%的纯木质纤维素水解物中培养,最终总溶剂产量达到10.22 g/L。目前阻碍大规模利用木质纤维素作为生物丁醇发酵基质的直接因素是预处理过程成本过高,因此迫切需要开发从木质纤维素生物质中获得可发酵糖的有效技术,以获得比玉米等易水解原料更低的成本优势。
2.3 微藻和甘油
微藻是生产生物燃料的第三代原料,利用微藻生产生物丁醇,具有广阔的前景[13]。微藻含有的碳水化合物主要是以淀粉的形式存在的,经过简单的酸处理或者碱处理就可以获得大量的还原糖。微藻中含有较少半纤维素和木质素,这可以降低预处理成本。纤维素原料预处理时,会释放出一系列的有害物质,干扰发酵过程,而微藻生物质酸水解产物只含有微量的糠醛和5-羟甲基糠醛(0.5 g/L)。研究表明,丁醇发酵的菌株可以耐受1 g/L糠醛和2 g/L 5-羟甲基糠醛,因此微藻水解液不会对丁醇发酵产生影响,是发酵生产丁醇的理想原料[14]。微藻预处理技术主要有四种,包括热处理、机械处理、化学和生物(酶法)方法。WANG Y等[15]以小球藻(Chlorella vulgaris)JSC-6作为原料,利用C.acetobutylicum ATCC824生产丁醇,先经过1%NaOH处理再经过3%硫酸处理得到小球藻的水解液,经分批培养后得到13.1 g/L的丁醇。
甘油是一种重要的可再生碳源,在工业生产中被广泛用作发酵的底物。以甘油为唯一碳源进行发酵的第一个溶剂生产菌是巴氏梭菌,甘油通过磷酸化和氧化两种途径,部分转化为可用于糖酵解途径的二羟基丙酮磷酸盐(dihydroxyacetone phosphate,DHAP)[10]。粗甘油用于生产丁醇的主要问题是杂质的抑制作用,在酯交换后,甘油通常含有不同浓度的甲醇(生物柴油甲基化过程的残留物)、硫酸盐或氯盐、游离脂肪酸(free fatty acid,FFA)、脂肪酸甲酯(fatty acid methyl ester,FAME)和肥皂(作为氢氧化物酯交换催化剂和FFA的副产品)。解决这种抑制作用的方式有两种,第一种是通过粗甘油的纯化来消除这种抑制作用,但是会增加成本;另一种方式是获得对粗甘油有适应能力的菌株,但是该菌株只适应于一种特定类型的粗甘油,对于含有其他杂质的粗甘油也可能有毒性。因此,可以选择固定化微生物及其凝胶基质的保护,消除粗甘油的毒性作用[16]。VLADIMIR K等[17]研究以甘油为原料,利用巴氏梭菌生产丁醇,采用固定化细胞重复分批发酵并与自由细胞发酵对比,结果表明采用聚乙烯醇(polyvinyl alcohol,PVA)颗粒固定化细胞发酵明显缩短了发酵时间,丁醇产率提高了6.3倍。
3.4 食品废弃物
目前,从食品废弃物中生产丁醇受到了广泛的关注。与昂贵的淀粉质原料相比,利用食品废弃物生产丁醇,不仅能解决环境问题,也为丁醇生产提供了廉价的原材料。SIREN L G等[18]以西米果仁渣为原料,经酶解后通过丙酮丁醇梭菌进行ABE发酵,研究发现将西米果仁渣水解物增至50 g/L时,加入0.5 g/L酵母菌抽提物,ABE产量为8.84 g/L。王永林等[19]利用糖乙酸丁酸梭菌N1-4,将餐厨垃圾直接发酵生产丁醇,在固液比1∶1(g∶mL)的条件下,餐厨垃圾直接发酵丁醇产量达到12.1 g/L,证明了餐厨垃圾发酵生产丁醇的可行性。QIU Z D等[20]分离出一种可以自主分泌淀粉酶并生产丁醇的梭状芽孢杆菌(Closridium sp.)HN4,在食品废弃物中添加碳酸钙和吐温80可以显著提高菌株的淀粉酶表达能力,在进行分批发酵和原位提取后丁醇产量达到35.63 g/L。
3 丁醇转化率和浓度
ABE发酵生产丙酮、丁醇、乙醇等有机溶剂,其中丁醇对细胞伤害最大,由于丁醇生产菌对丁醇的耐受性差导致丁醇转化率和浓度低。有机溶剂对大多数微生物都具有毒害作用,它们会在细胞膜中积累并破坏其结构,导致细胞内的离子和代谢物丢失,pH和膜电位发生改变,最终导致细胞死亡[30]。但在一些情况下,微生物也可以通过自身的抗性机制在有机溶剂中存活,例如细菌可以通过细胞膜修饰来降低溶剂的渗透性;溶剂进入细胞会引发应激反应,其中涉及许多分子伴侣,一些微生物还可以通过降解化合物产生能量来对抗溶剂的毒性,外排泵也对细胞中去除有机溶剂起关键作用[31]。丁醇生产菌对丁醇的耐受机制如图1所示。(1)细胞膜:在亚致死浓度下(通常为5~15 g/L),丁醇引发复杂的应激反应,包括膜流动性的增加、膜脂中饱和/不饱和脂肪酸比例发生变化;当丁醇质量浓度>15 g/L时会导致膜功能受损,三磷酸腺苷(adenosine triphosphate,ATP)泄露和pH梯度被破坏,最终导致细胞死亡[32]。因此可以通过改变膜的生理特性或转运系统来抵御丁醇胁迫,例如增加外膜的脂多糖含量使细胞表面疏水性降低,阻碍有毒疏水化合物进入胞质等。(2)外排泵:天然的外排系统不能结合丁醇使之排出胞外,而定位于细胞质膜上的转运蛋白耐药结节细胞分化(resistance-nodulation-cell division,RND)外排泵能将胞内有毒化合物泵出胞外。FISHER M A等[33]的研究结果表明,改变RND家族的外排泵的AcrB蛋白中的一个氨基酸时,能够有效地排出丁醇,证明定向进化改变外排泵底物特异性,是有效的排出丁醇的一种方法。(3)应激蛋白过表达:丁醇生产菌所产生的应激反应在许多方面与热休克所产生的应激相似,因此它也可能与各种热休克蛋白(heat shock proteins,HSPs)的产生有关,这些热休克蛋白参与蛋白质折叠、运输、修复受损或错误折叠的蛋白质的过程,并且具有分子伴侣的活性。研究发现GroESL伴侣体系过表达,丁醇耐受性和产量提高,并可由丙酮丁醇梭菌(C.acetobutylicum)ATCC 824中调控的6S RNA过表达触发。过表达HSPs、GrpE和HtpG也可显著提高C.acetobutylicum ATCC 824的丁醇耐受性[32]。(4)其他调控机制:有研究表明添加微量锌离子一方面增强菌体对数生长、碳源利用、有机酸重吸收及溶剂代谢,提高丁醇产率;另一方面增强菌体对甲酸、乙酸、丁酸及丁醇的胁迫耐受性,有效缓解代谢迟滞,丁醇耐受水平得到提高[34]。

图1 丁醇生产菌对丁醇的主要耐受机制
Fig.1 Main tolerance mechanism of butanol-producing strain to butanol
目前提高菌株对于丁醇的耐受性主要有三种方式:(1)物理或化学诱变;(2)基因改造;(3)人工驯化。LI H G等[35]通过分离和连续富集的方法获得一株耐丁醇突变株SE36,与野生菌株相比突变株对丁醇的耐受能力从20 g/L提高到35 g/L,经发酵后的丁醇和总溶剂产量分别比野生菌提高了24.3%和23.6%。SHU B L等[36]为获得耐溶剂性和产丁醇能力较强的菌株,采用亚硝基胍诱导与基因组重排相结合的诱变方法,在连续四轮基因组重组之后,重组菌株C.acetobutylicum GS4-3表现出较强发酵性能,优化后丁醇产量为20.1 g/L,丁醇产率为0.35 g/(L·h),分别比野生型菌株GX01增加了23.3%和40.0%。
4 丁醇分离提取技术
4.1 吸附
吸附是通过将丁醇吸附到合适的表面吸附剂上,然后增加温度或使用置换剂浓缩丁醇溶液,从而选择性地从发酵液中分离丁醇的方法。在选择合适的吸附剂时,需要考虑许多因素:吸附速率、吸附容量、易降解性,对所需产品的选择性和成本等[37-38],目前常用的吸附材料主要有活性炭、聚合树脂、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)等。XUE C等[39]研究了各种吸附剂对丁醇的吸附性能,发现活性炭对于丁醇的吸附效果最佳,通过活性炭原位吸附和补料分批发酵得54.6 g/L丁醇,与没加吸附剂的对比,产量增加了230%。吸附法能耗低、操作简单,但对丁醇吸附容量较低,仍需要进一步通过其他方法浓缩丁醇。
4.2 液液萃取
液液萃取法(liquid-liquid extraction,LLE)是通过选择对微生物毒性较低的水不溶性萃取剂,并与发酵液混合,选择性的提取丁醇的方法。在选择萃取剂时要考虑三个因素:萃取剂对每个产品(尤其是丁醇)的分配系数、选择性和毒性[40]。研究发现,越是对丁醇有较高的分配系数的液体萃取剂对细胞的毒性就越大。因此,影响液液萃取法对丁醇进行萃取分离的一个关键因素是萃取剂的毒性。潘贺鹏等[41]研究利用小麦淀粉废水生产生物丁醇,通过考察丁醇发酵的影响因素,得出最佳培养基条件,在7 L发酵罐中结合生物柴油进行萃取发酵,总溶剂和丁醇产量分别达到29.38 g/L和15.13 g/L,相比萃取之前分别提高了27%和12%。液液萃取可以直接从发酵液中提取丁醇,而不需要移除底物、水或者营养物质。但是在使用过程中也会出现一些问题,例如:萃取剂的毒性、乳状液的形成、萃取过程中生物质的积累等,因此液液萃取法的工业化应用目前仍受到一定限制。
4.3 渗透汽化
渗透汽化是利用膜对液体混合物中各组分的溶解与扩散速度的不同而实现分离的过程。所用膜主要包括高聚物膜、陶瓷膜和液体膜等。其中,聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜由于其超疏水性以及良好的热稳定性和机械稳定性而被广泛研究。WU H等[42]采用PDMS-陶瓷复合膜在丁醇分批发酵过程中进行原位提取,丁醇产量提高33%。渗透汽化作为一种新型膜分离技术具有选择性高、能耗低、产品纯度高等优势,但是其分离性能很大程度上是取决于膜的性质,由于生物分子、介质成分和细胞引起的膜污染会导致渗透汽化性能下降[56],一定程度上限制了其工业化应用,高性能膜的制备和发现还需要更多的研究。
4.4 气提
气提法是通过向发酵液中通入无氧氮或发酵气体(H2和CO2),从而脱去丙酮、丁醇和乙醇的方法[37]。CAI D等[43]以甜高粱汁为原料,采用连续气提补料分批发酵,最终获得丁醇质量浓度达到112.9 g/L。EZEJI T C等[44]利用拜氏梭菌BA101进行间歇式发酵与气提相结合的方法生产丁醇,经发酵后丁醇产量达到151.7 g/L。气提法操作简单、适用范围广、设备能耗低、与发酵耦合可以实现在线同时分离,但是处理效率会受到载气回收速率、气泡大小和消泡剂等众多影响,因此有待进一步研究。
4.5 混合提取
吸附、气提、液液萃取以及渗透汽化等方法都能在一定程度上回收丁醇,但是由于ABE发酵中丁醇质量浓度通常小于20 mg/L,这些分离技术对丁醇的纯化没有足够的选择性。因此,根据现有的资料,从技术和经济的角度来看,需要进行更多的研究来开发一种综合工艺,使用一种或多种不同的提取方式的组合,从发酵液中分离丁醇。LU K M等[45]采用新型的原位萃取-气体汽提工艺结合ABE发酵,在发酵过程中首先用油醇提取丁醇,同时在油醇相中对丁醇进行气提,最终的得到丁醇质量浓度为93~113 g/L。CAI D等[46]为提高丁醇质量浓度,降低产品分离成本,建立了气提-渗透蒸发(gas stripping-pervaporation,GS-PV)一体化工艺,将间歇渗透汽化技术与补料分批ABE发酵气提系统相结合,获得丁醇质量浓度为482.55 g/L,丁醇回收率达到98.8%。
表2 不同分离提取方法的丁醇发酵情况
Table 2 Butanol fermentation with different separation and extraction methods

5 展望
丁醇作为一种燃料具有广阔的发展前景,它可以成为替代汽油的可再生能源。丁醇发酵存在原料成本高、菌株对氧以及溶剂的耐受性差导致的丁醇转化率和浓度低等缺点,使得丁醇发酵的竞争力低于其他生物燃料的生产。但是这些障碍正在通过以下方式得到改善:(1)通过筛选出耐氧能力强的菌株,或者通过过表达、敲除/下调以及在代谢途径中插入编码关键酶的基因等方法来提高产丁醇菌的耐氧性和丁醇产量;(2)寻找廉价且易于水解的原料作为丁醇发酵底物,或是利用废弃物发酵生产丁醇(3)利用基因工程和代谢工程技术,解除代谢过程中可能存在的产物或者中间产物抑制,提高菌种对丁醇的耐受性,强化丁醇生产中的关键酶,弱化丙酮、乙醇的生成代谢途径,提高丁醇在溶剂中比例;(4)采用混合提取的策略,弥补单一提取方法的不足,消除发酵过程中丁醇的抑制作用,提高丁醇的回收率。
[1]高越,郭晓鹏,杨阳,等.生物丁醇发酵研究进展[J].生物技术通报,2018,34(8):33-40.
[2]顾春凯.木质纤维素水解液中抑制物对丁醇发酵抑制机理的研究[D].无锡:江南大学,2016.
[3]徐飞.丙酮丁醇梭菌的改造、发酵以及产物分离[D].大连:大连理工大学,2017.
[4]苏增平.Ca2+对玉米秸秆水解液丙酮丁醇发酵的影响[D].郑州:河南农业大学,2018.
[5]王文博.木薯原料制生物丁醇发酵技术研究[D].杭州:浙江大学,2017.
[6]骆芝婷.氮源调控丙酮丁醇梭菌合成丁醇的机制研究[D].南宁:广西大学,2018.
[7]HILLMANN F,FISCHER R J,SAINTPRIX F,et al.PerR actsas a switch for oxygen tolerance in the strict anaerobe Clostridium acetobutylicum[J].Mol Microbiol,2008,68(4):848-860.
[8]肖川.拜氏梭菌耐氧突变及黄姜糖液发酵高产丁醇机理分析[D].武汉:华中科技大学,2018.
[9]裴建新,庞浩,左文朴,等.perR 基因的敲除对丙酮丁醇梭菌摇瓶发酵的影响[J].食品与发酵工业,2014(2):94-98.
[10]JANG Y S,MALAVIVA A,CHO C,et al.Butanol production from renewable biomass by clostridia[J].Bioresour Technol,2012,123:653-663.
[11]宋钢,郑璞,倪晔,等.木薯发酵产丁醇的研究[J].生物加工过程,2012,10(2):6-10.
[12]刘欢欢.木质纤维素水解液中抑制剂对丙酮丁醇梭菌发酵生产正丁醇的胁迫机制研究[D].天津:天津大学,2017.
[13]MAGALHAES B L,GRASSI M C B,PEREIRA G A G,et al.Improved n-butanol production from lignocellulosic hydrolysate by Clostridium strain screening and culture-medium optimization[J].Biomass Bioenerg,2018,108:157-166.
[14]YEONG T K,JIAO K L,ZENG X H,et al.Microalgae for biobutanol production-technology evaluation and value proposition[J]. Algal Res,2018,31:367-376.
[15]WANG Y,GUO W,CHENG C L,et al.Enhancing bio-butanol production from biomass of Chlorella vulgaris JSC-6 with sequential alkali pretreatment and acid hydrolysis[J].Bioresour Technol,2016,200:557-564.
[16]TAN H W,ABDULAZIZ A R,AROUA M K.Glycerol production and its applications as a raw material:A review[J].Renew Sust Energ Rev,2013,27:118-127.
[17]VLADIMIR K,MICHAL P,MARR A C,et al.Intensified crude glycerol conversion to butanol by immobilized Clostridium pasteurianum[J].Biochem Eng J,2018,134(15):114-119.
[18]SIREN L G,PHANG L Y,WASHO H,et al.Acetone-butanol-ethanol production by Clostridium acetobutylicum ATCC 824 using sago pith residues hydrolysate[J].Bioenerg Res,2013,6(1):321-328.
[19]王永林,高明,ABO B O,等.餐厨垃圾直接发酵生产生物质丁醇的研究[J].环境工程,2019,37(4):140-145.
[20]QIU Z D,DUNS G J,TING P,et al.Consolidated processing of biobutanol production from food wastes by solventogenic,Clostridium sp.strain HN4[J].Bioresource Technol,2018,264:148-153.
[21]CHAMAIPORN K,KHANITTHA F.Optimization of key factors affecting butanol production from sugarcane juice by Clostridium beijerinckii TISTR 1461[J].Energ Procedia,2017,138:157-162.
[22]LI S B,GUO Y,LU F Z,et al.High-level butanol production from cassava starch by a newly isolated Clostridium acetobutylicum[J].Appl Biochem Biotechnol,2015,177(4):831-841.
[23]JIE Z,BAO L J.Enhanced butanol production using,Clostridium beijerinckii,SE-2 from the waste of corn processing[J]. Biomass Bioenerg,2018,115:260-266.
[24]CASTRO Y A,ELLIS J T,MILLER C D,et al.Optimization of wastewater microalgae saccharification using dilute acid hydrolysis for acetone,butanol,and ethanol fermentation[J].Appl Energy,2015,140:14-19.
[25]ELLIS J T,HENGGE N N,SIMS R C,et al.Acetone,butanol,and ethanol production from wastewater algae[J].Bioresource Technol,2012,111:491-495.
[26]MUKESH S,LIN L J,CHIANG C J,et al.Effective production of n-butanol in Escherichia coli utilizing theglucose-glycerol mixture[J].J Taiwan Inst Chem Eng,2017,81:134-139.
[27]CHEN T P,XU F L,ZHANG W M,et al.High butanol production from glycerol by using Clostridium sp.strain CT7 integrated with membrane assisted pervaporation[J].Bioresource Technol,2019,288:121530.
[28]RAGANATI F,PROCENTESE A,MONTAGNARO F,et al.Butanol production from leftover beverages and sport drinks[J].Bio Energ Res,2015,8(1):369-379.
[29]PLAZA P E,GALLEGOMORALES L J,PEUELA V,et al.Biobutanol production from brewer's spent grain hydrolysates by Clostridium beijerinckii[J].Bioresource Technol,2017,244(1):166-174.
[30]王庆利.有机溶剂对细胞的毒害及细胞的耐受性机制[J].微生物学通报,2002,29(4):81-85.
[31]SEGURA A,LAZARO M,FILLET S,et al.Solvent tolerance in Gramnegative bacteria[J].Curr Opin Biotechnol,2012,23(3):415-421.
[32]PATAKOVA P,KOLECK J,SEDLAR K,et al.Comparative analysis of high butanol tolerance and production in clostridia[J]. Biotechnol Adv,2017,36(3):721-738.
[33]FISHER M A,BOYARSKIY S,YAMADA M R,et al.Enhancing tolerance to short-chain alcohols by engineering the Escherichia coli AcrB efflux pump to secrete the non-native substrate n-butanol[J].Acs Synthetic Biol,2014,3(1):30-40.
[34]吴又多.锌离子对丙酮丁醇梭菌发酵的调控作用及机制[D].大连:大连理工大学,2017.
[35]LI H G,OFOSU F K,LI K T,et al.Acetone,butanol,and ethanol production from gelatinized cassava flour by a new isolates with high butanol tolerance[J].Bioresource Technol,2014,172:276-282.
[36]SHU B L,YI Q,ZHENG W L,et al.Enhanced butanol production from cassava with Clostridium acetobutylicum by genome shuffling[J].World J Microbiol Biotechn,2016,4:32-53.
[37]ABDENAGH N,TEZEL F H,THIBAULT J.Separation techniques in butanol production:Challenges and developments[J].Biomass Bioenerg,2014,60(350):222-246.
[38]SUN D Z,FENG H S,XIN F,et al.Feasibility of ionic liquid as extractant for bio-butanol extraction:Experiment and simulation[J]. Separat Purif Technol,2019,215:287-298.
[39]XUE C,LIU F F,XU M M,et al.Butanol production in acetone-butanol-ethanol fermentation with in situ product recovery by adsorption[J].Bioresource Technol,2016,219:158-168.
[40]DALLEAVE G,ADAMS T A.Techno-economic comparison of acetonebutanol-ethanol fermentation using various extractants[J].Energy Convers Manag,2018,156(15):288-300.
[41]潘贺鹏,罗玮,顾秋亚,等.小麦淀粉废水发酵生产丁醇[J].生物加工过程,2015(3).
[42]WU H,CHEN X P,LIU G P,et al.Acetone-butanol-ethanol (ABE)fermentation using Clostridium acetobutylicum XY16 and in situ recovery by PDMS/ceramic composite membrane[J].Bioproc Biosyst Eng,2012,35(7):1057-1065.
[43]CAI D,WANG Y,CHEN C,et al.Acetone-butanol-ethanol from sweet sorghum juice by an immobilized fermentation-gas stripping integration process[J].Bioresource Technol,2016,211:704-710.
[44]EZEJI T C,QURESHI N,BLASCHEK H P.Acetone butanol ethanol(ABE) production from concentrated substrate:reduction in substrate inhibition by fed-batch technique and product inhibition by gas stripping[J].Appl Microbiol Biotechn,2004,63(6):653-658.
[45]LU K M,LI S Y.An integrated in situ extraction-gas stripping process for acetone-butanol-ethanol (ABE) fermentation[J]. J Taiwan Inst Chem Eng,2014,45(5):2106-2110.
[46]CAI D,CHEN H D,CHEN C J,et al.Gas stripping-pervaporation hybrid process for energy-saving product recovery from acetone-butanol-ethanol(ABE)fermentation broth[J].Chem Eng J,2016,287:1-10.
[47]王风芹,程翔,谢慧,等.萃取耦合技术对玉米秸秆水解液发酵产丁醇的影响[J].生物工程学报,2013,29(10):1515-1526.
[48]GAO K,REHMANN L.Combined detoxification and in-situ product removal by a single resin during lignocellulosic butanol production[J].Sci Rep,2016,6:30533.
[49]庄伟,赵向雨,杨静,等.自产气气提与纤维床反应器耦合发酵生产丁醇[J].化工学报,2014,65(5):1821-1827.
[50]刘晓洁,沈兆兵,刘莉,等.渗透汽化原位分离耦合拜氏梭菌丁醇发酵的研究[J].食品科学,2015,36(17):118-123.
[51]陈啸鹏,吴昊,刘公平,等.基于pH 调控的渗透汽化原位分离耦合丁醇发酵的研究[J].南京工业大学学报(自然科学版),2013,35(1):1-76.
[52]HAO W,GAO H,TAO Z,et al.Hybrid pervaporation and salting-out for effective acetone-butanol-ethanol separation from fermentation broth[J].Bioresource Technol Rep,2018,2:45-52.