瘦肉精是一类药物的统称,任何能够抑制动物脂肪生成,促进瘦肉生长的物质都可以成为“瘦肉精”,能够实现此类功能的物质主要是一类称为β-受体激动剂的药物。西马特罗是继盐酸克仑特罗、沙丁胺醇、莱克多巴胺、硫酸沙丁胺醇、盐酸多巴胺、硫酸特布他林等药物之后的新型瘦肉精。自2011年瘦肉精事件爆发以来,引起了国内外的高度重视,为了保证畜产品质量安全,保护人类健康,许多国家都禁止在食源性动物生产中使用瘦肉精,我国政府对瘦肉精药物的监管力度不断加大,虽然在2000年提出禁止使用瘦肉精,但在畜牧业生产中瘦肉精的使用仍屡禁不止,不法养殖户急于寻求新型瘦肉精,西马特罗就是其中之一。西马特罗能够促进动物体蛋白质沉积、促进脂肪分解抑制脂肪沉积,提高瘦肉率。但其代谢速度较慢,可能导致上市后药物残留量较大,消费者食用后可能会出现心率加快,面部潮红,面颈、四肢肌肉颤动,手抖,不能站立,头晕,乏力,口干,呕吐、腹痛等症状。基于上述情况,农业部明确了西马特罗等瘦肉精品种禁用于养殖动物[1-3]。经查阅文献,检测瘦肉精残留的常用方法有超高效液相色谱法-串联质谱法[4-8]、毛细管区带电泳法[9]、液相色谱-串联质谱法[10-14]、高效液相色谱法等[15]。仪器方法准确性高,但是需要高成本大型仪器,并由专业人员进行操作,耗时久,以至于基层检测实验室无法承担资金成本和时间成本均较高的仪器方法。本实验通过制备西马特罗半抗原,载体蛋白与之偶联合成免疫原,免疫原用于免疫动物,获得抗西马特罗单克隆抗体,目的在于利用酶联免疫吸附原理,将其用于研制出检测猪尿中西马特罗残留的酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)快速检测试剂盒,该试剂盒能够解决上述的仪器高成本问题,较好地解决了基层实验人员的日常检测难题。
1 材料与方法
1.1 材料与试剂
西马特罗、溴布特罗、克伦特罗、溴氯布特罗、塞布特罗、马布特罗、克伦潘特、沙丁胺醇、莱克多巴胺、克伦巴胺、特布他林、妥布特罗、马喷特罗、氯丙那林、羟甲基克伦特罗、喷布特罗、盐酸班布特罗、菲诺特罗、齐帕特罗标准品(纯度均≥99%):北京标准物质研究中心;甲醇、乙酸乙酯、氢氧化钠、卵清蛋白、血蓝蛋白(均为分析纯)、辣根过氧化物酶:北京百欣试剂公司;猪尿:来自养殖场;浓缩洗涤液:北京勤邦生物技术有限公司;Balb/c小鼠:斯贝福(北京)生物技术有限公司。
1.2 仪器与设备
MK3酶标仪(最大量程为4.0):上海雷勃分析仪器有限公司;MX-F涡旋仪:湖南湘立科学仪器有限公司。
1.3 方法
1.3.1 制备抗原
西马特罗半抗原合成见图1。
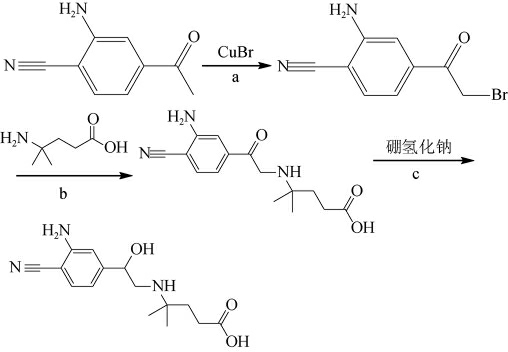
图1 西马特罗半抗原合成
Fig.1 Synthesis of cimaterol hapten
(1)制备半抗原
a:取苄腈-4乙酰基-2-氨1.0 g,加60 mL三氯甲烷溶解,加溴化铜1.41 g,加热回流反应4 h,停止反应,加水50 mL,振荡,静置分层,分去水相,有机相蒸干,正己烷∶二氯甲烷(3∶1,V/V)70 mL,重结晶,得到α-溴代-3-氰基-4-氨基苯乙酮1.3 g,收率87.25%。
b:取α-溴代-3-氰基-4-氨基苯乙酮1.3 g,加乙腈80 mL溶解,加KOH 0.46 g,碘化钠0.21 g,搅拌,加4-氨基-4-甲基戊酸0.86 g,加热,回流反应12 h,停止反应,旋蒸,除去乙腈,加水80 mL,加1 mol/L盐酸调节pH值至6,乙酸乙酯100 mL×3,萃取3次,合并有机相,浓缩蒸干,二氯甲烷∶环己烷(1∶3,V/V)90 mL重结晶,得到丙酸西马特罗酮基中间产物1.2 g,收率76.4%。
c:取丙酸西马特罗酮基中间产物1.2 g,加甲醇60 mL溶解,冷却至0~5 ℃,在搅拌下,加硼氢化钠0.31 g,搅拌2 h,停止反应,恢复至室温,旋蒸,除去甲醇,加水100 mL,加1 mol/L盐酸调节pH值为6,加100 mL乙酸乙酯萃取,有机相水洗,蒸干,上硅胶柱,二氯甲烷∶甲醇(10∶1,V/V)洗脱分离,得到丙酸西马特罗半抗原产物0.91 g,收率75.8%[16-19]。
(2)制备免疫原
取丙酸西马特罗半抗原产物5.8 mg,加二甲基甲酰胺(dimethylformamide,DMF)1 mL溶解,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)11 mg,N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)7 mg,室温反应2 h,得到半抗原活化液A液;取血蓝蛋白(keyhole limpet hemocyanin,KLH)20mg,加3 mL磷酸盐缓冲液(phosphate buffer solution,PBS)溶解,得到B液,将A液滴加到B液中,4 ℃反应8 h,0.02 mol/L PBS透析纯化72 h,透析袋截留分子质量为8~14 kDa,每天换液3次,得到西马特罗-KLH偶联物免疫原,分装,-20 ℃保存备用。
(3)制备包被原
取丙酸西马特罗半抗原产物6.4 mg,加DMF 1 mL溶解,加EDC 13 mg,加NHS 9 mg,室温反应2 h,得到半抗原活化液A液;取卵清蛋白(ovalbumin,OVA)50 mg,加6 mL PBS缓冲液溶解,得到B液,将A液滴加到B液中,透析纯化、保存等方法同上述免疫原。
1.3.2 制备酶标记抗体
将免疫原注入Balb/c小鼠体内,获得抗血清。测定小鼠血清效价,效价结果达到1∶2 000~1∶1 000,取小鼠脾细胞,按照8∶1的配比和SP2/0骨髓瘤细胞融合,利用间接竞争酶联免疫法测定细胞上清液,进行阳性孔筛选。通过有限稀释法克隆化阳性孔,从而得到能够分泌西马特罗单克隆抗体的杂交瘤细胞株。用冻存液将单克隆杂交瘤细胞株制成细胞悬液,按照0.5 mL/只的灭菌石蜡油剂量注入Balb/c小鼠腹腔,一周后,按照5×105个/只的剂量向腹腔注射稳定的单克隆杂交瘤细胞株,一周后可采集腹水。可通过辛酸-饱和硫酸铵法纯化腹水。将1.3.1得到的鼠源抗体免疫无病原体羊,得到羊抗鼠抗抗体[20],利用过碘酸钠法,将其与辣根过氧化物酶(horseradish peroxidase,HRP)偶联[21],得到酶标记抗抗体。
1.3.3 优选抗原包被浓度、单克隆抗体浓度,制备酶标板
测定波长为450 nm,抗原稀释倍数依次为:1∶1 000,1∶3 000,1∶9 000;单克隆抗体稀释倍数依次为:1∶20 000,1∶40 000,1∶80 000,1∶160 000;酶标记抗体液的稀释倍数为1∶1 000。按照下列公式计算0、0.1 μg/L质量浓度的西马特罗标准品的百分吸光率:
将100 μL抗原包被液(pH值为9.6,0.05mol/L的碳酸盐缓冲液)包被于酶标板中,37 ℃孵育2 h,清洗酶标板之后,加入150 μL质量分数为0.05%牛血清白蛋白(albumin from bovine serum,BSA)的0.02 mol/L PBS,37 ℃孵育2 h,即制备完成酶标板。
1.3.4 样本的前处理方法
取50 mL 清亮猪尿样直接测定(如尿样浑浊必须通过过滤或室温3 000×g以上离心10 min 直至清亮)。
1.3.5 酶标板检测
依次加入样本或标准品50 mL/孔,酶结合物工作液50 mL/孔,避光反应,洗涤干净,再加入显色液显色,避光反应后加入终止液,设定酶标仪于波长450 nm处,测定每孔吸光度值(OD450nm值)。
1.3.6 计算样本中西马特罗含量
以西马特罗标准品质量浓度为横坐标(x),标准品百分吸光率(y)为纵坐标,绘制西马特罗标准曲线,得到标准曲线回归方程。将样本的OD450nm值代入标准曲线回归方程,得到相应的浓度,该浓度乘以稀释倍数即能计算出样本中西马特罗残留量。
1.3.7 检测性能
(1)计算检测限
取20份空白猪尿样本,利用空白样本浓度的平均值加上3倍标准差,计算试剂盒的检测限(limit of detection,LOD),检测限指该检测方法可检测出的最低被测物浓度[17]。
(2)准确度和精密度
对样本添加西马特罗,使其质量浓度分别达到0.5μg/kg、1.0 μg/kg和2.0 μg/kg,测定添加回收率,用以评价试剂盒的准确度。同时,每个样本做4个平行,按照上述1.3.3制备3批酶标板,计算测定结果的相对标准偏差(relative standard deviation,RSD),用以评价试剂盒的精密度。
(3)稳定性的测定
测定试剂盒在不同温度条件下的稳定性,将试剂盒存储于4 ℃条件下,每个月测定最大吸光度值(0 μg/L)、半抑制浓度(half maximal inhibitory concentration,IC50)值、样本的回收率等性能指标,连续测定12个月。
(4)抗体特异性的测定
选择西马特罗的同类药物或结构类似物:溴布特罗、克伦特罗、溴氯布特罗、塞布特罗、马布特罗、克伦潘特、沙丁胺醇、莱克多巴胺、克伦巴胺、特布他林、妥布特罗、马喷特罗、氯丙那林、羟甲基克伦特罗、喷布特罗、盐酸班布特罗、菲诺特罗、齐帕特罗,测定药物的IC50值,根据下式计算该试剂盒对上述药物的交叉反应率:
2 结果与分析
2.1 优选抗原包被浓度、单克隆抗体浓度
测定质量浓度为0 μg/L和0.1 μg/L的西马特罗标准品的OD450nm值,结果见表1。
表1 抗原、抗体的筛选结果
Table 1 Screening results of antigen and antibody
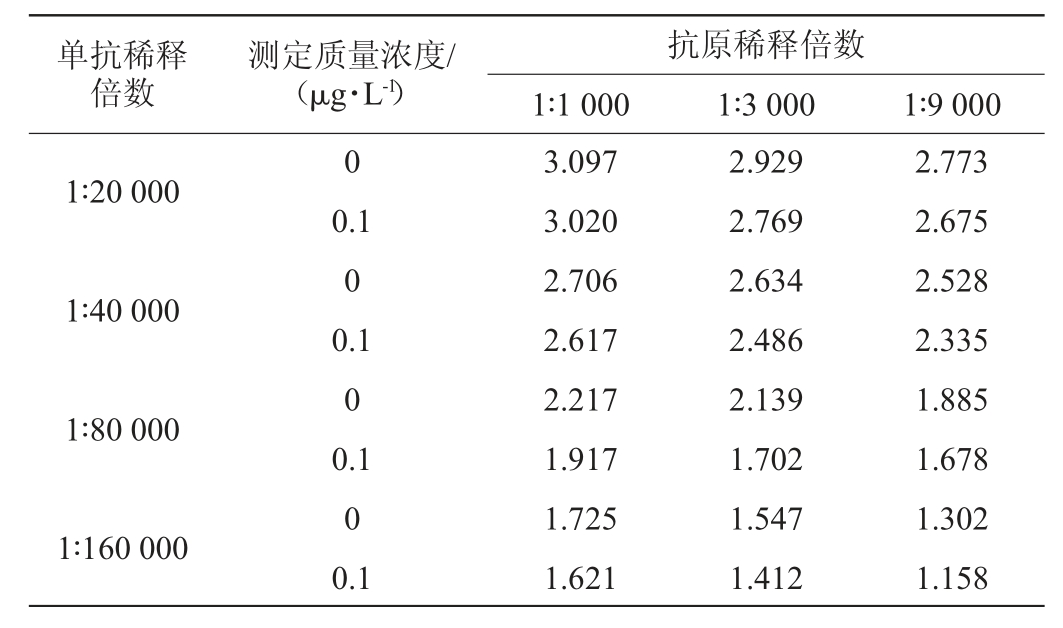
由表1可知,按照抗原、单克隆抗体的最佳稀释倍数的选择方法[22],即选择OD450nm值(0.1 μg/L)/OD450nm值(0 μg/L)的抑制率在70%~85%范围内,并且抗原、单克隆抗体的最大稀释倍数。结果表明,本研究应选择的抗原稀释倍数为3 000,最佳单克隆抗体稀释倍数为80 000。
2.2 西马特罗标准曲线的建立
以西马特罗标准品质量浓度(C)的对数值为横坐标(x),标准品百分吸光率(y)为纵坐标,绘制西马特罗标准曲线,结果见图2。
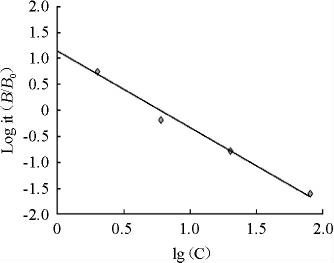
图2 西马特罗标准曲线
Fig.2 Standard curve of cimaterol
由图2可知,测定标准曲线的范围为0~8.1 μg/L,半抑制浓度IC50值为0.870 μg/L;标准曲线线性回归方程为y=-1.4736x+1.1476,相关系数为R2为0.994,表明二者线性关系良好。
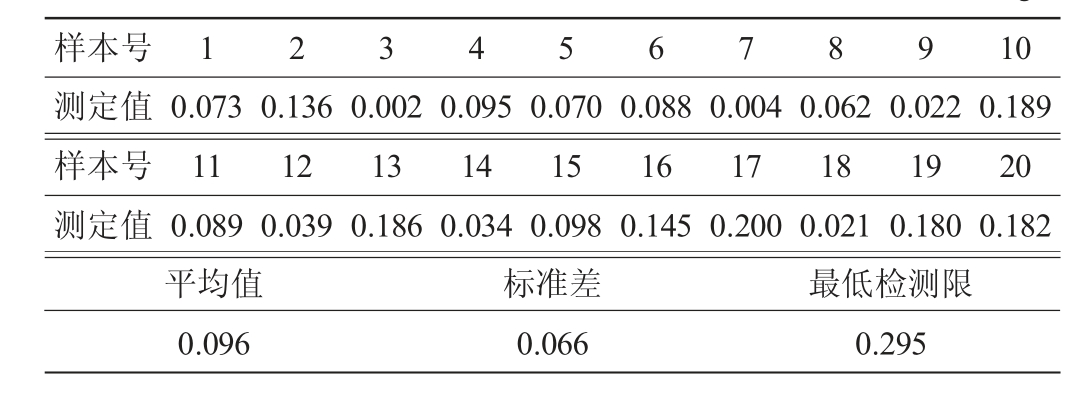
2.3 方法检出限
本研究对空白样本的检出限测定结果见表2。由表2可知,该检测方法检测限为0.295 μg/L。目前,检测西马特罗的方法主要是仪器方法,罗奕铭[23]建立了一种新型瘦肉精多残留胶体金检测卡的研制方法,对尿液中西马特罗的灵敏度为5 μg/L。张连明等[24]建立了一种西马特罗分子印迹荧光检测试纸条的研制方法,最低检测限为0.01 μg/mL。而本方法对猪尿中西马特罗的检出限为0.295 μg/L,优于上述指标。
表2 空白样本检测限测定结果
Table 2 Determinationresultsof detection limit of blank samples μg/L
2.4 方法准确度和精密度
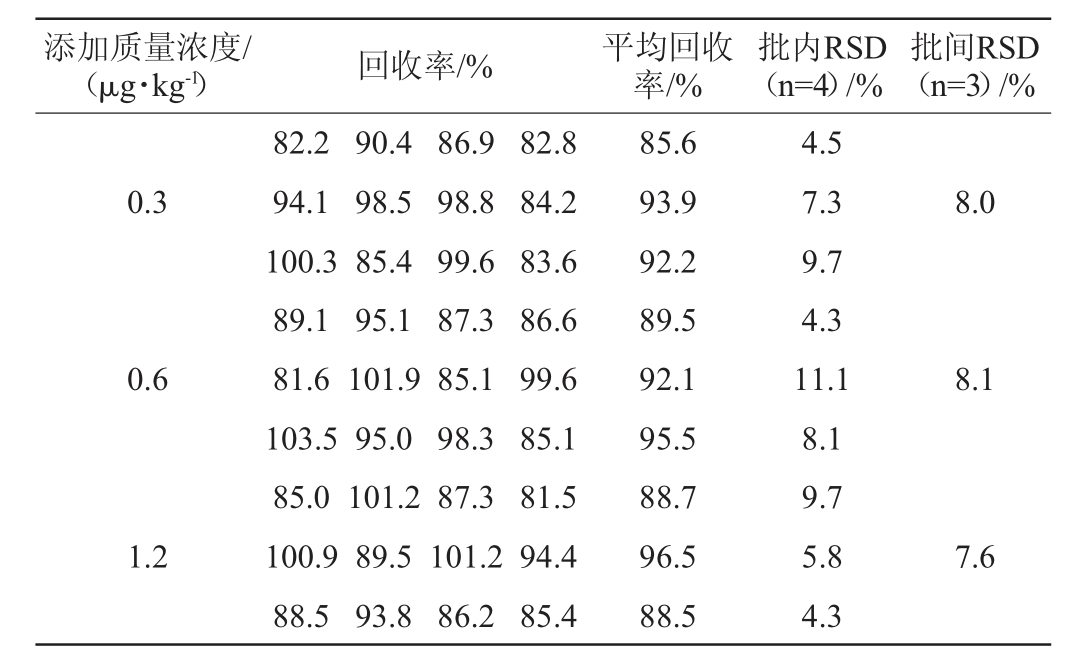
对含有不同浓度西马特罗的猪尿样本进行测定,结果见表3。由表3可知,该检测方法回收率范围是81.5%~103.5%,批内精密度试验结果相对标准偏差(RSD)为4.3%~11.1%;批间精密度试验结果相对标准偏差(RSD)为7.6%~8.1%,表明该检测方法准确度及精密度良好。
表3 精密度及准确度试验结果
Table 3 Results of precision and accuracy tests
2.5 方法稳定性
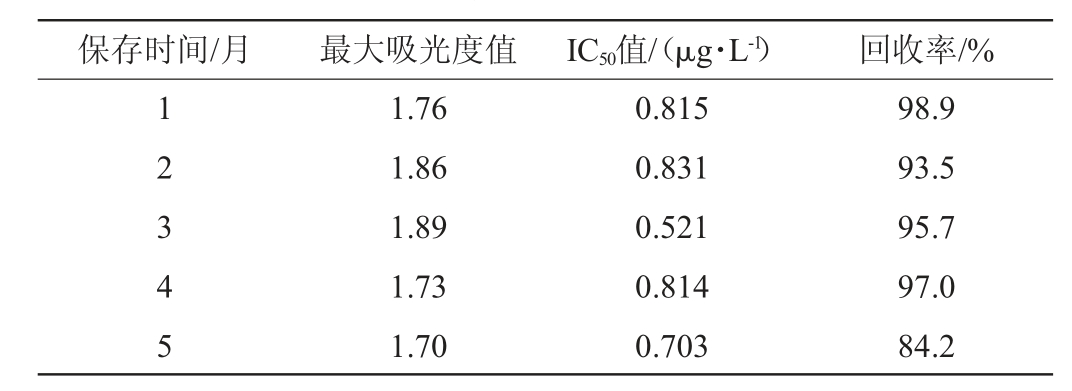
表4 试剂盒在4 ℃保存的稳定性
Table 4 Stability of the kit stored at 4 ℃
续表
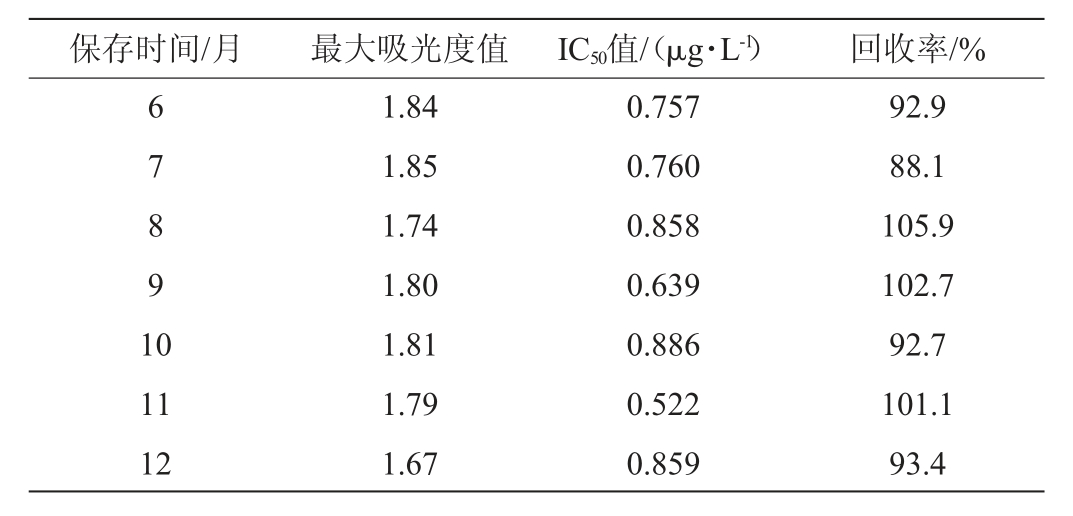
由表4可知,当试剂盒存储于4 ℃时,试剂盒的最大吸光度值(0 μg/L)范围是1.67~1.89,50%抑制浓度(IC50值)的范围是0.521~0.886 μg/L,回收率范围是84.2%~105.9%。综上可知,当试剂盒存储于4 ℃时,12个月内各指标均在正常范围之内,即该试剂盒在4 ℃条件下至少能够保存12个月。
2.6 方法抗体特异性
西马特罗抗体与溴布特罗、克伦特罗、溴氯布特罗、塞布特罗、马布特罗、克伦潘特、沙丁胺醇、莱克多巴胺、克伦巴胺、特布他林、妥布特罗、马喷特罗、氯丙那林、羟甲基克伦特罗、喷布特罗、盐酸班布特罗、菲诺特罗、齐帕特罗的交叉反应率结果见表5。
表5 交叉反应率试验结果
Table 5 Results of cross reaction rate tests
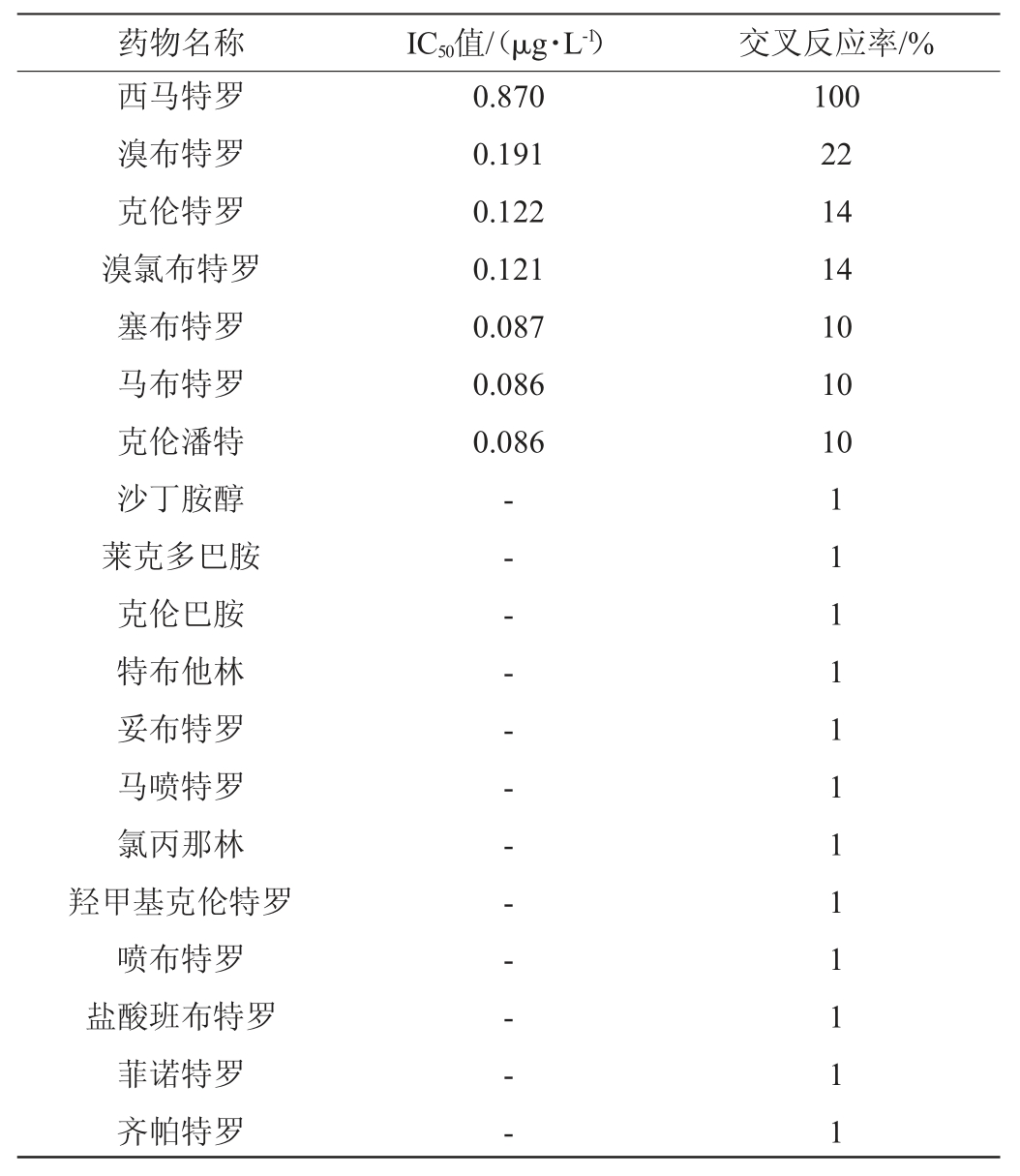
注:“-”表示药物浓度范围内不成曲线,IC50值无法测定。
由表5可知,西马特罗抗体与溴布特罗的交叉反应率为22%,克伦特罗、溴氯布特罗的交叉反应率为14%,塞布特罗、马布特罗、克伦潘特的交叉反应率10%,沙丁胺醇、莱克多巴胺、克伦巴胺、特布他林、妥布特罗、马喷特罗、氯丙那林、羟甲基克伦特罗、喷布特罗、盐酸班布特罗、菲诺特罗、齐帕特罗的交叉反应率<1%。可能由于免疫得到的西马特罗抗体与西马特罗的同类药物或结构类似物匹配度不同,因此导致了交叉反应率存在差异。结果表明,西马特罗抗体特异性良好,能够排除大多数同类药物或结构类似物的干扰。
3 结论
本研究通过制备西马特罗人工抗原免疫小鼠,得到了抗西马特罗单克隆抗体,将其应用于酶联免疫试剂盒的研制,通过实验优选出抗原包被浓度和单克隆抗体浓度,试剂盒的标准曲线范围0~8.1 μg/L,对猪尿中西马特罗的检测限为0.295 μg/L,回收率为81.5%~103.5%,批内精密度试验结果相对标准偏差为4.3%~11.1%;批间精密度试验结果相对标准偏差为7.6%~8.1%,表明该方法准确度及精密度良好。西马特罗单克隆抗体的特异性较好酶联免疫试剂盒在4 ℃能够储存12个月,稳定性较好[25],能够对该药物实现快速、便捷的低成本检测。
[1]熊琳,萍阎,高雅琴,等.肉品生产中禁用药物西马特罗研究进展[J].食品安全质量检测学报,2017,8(1):290-295.
[2]高先娟.荧光分光光度法测定猪肉中的盐酸克伦特罗的含量[J].中国酿造,2014,33(9):156-159.
[3]周悦榕,李丹妮,顾欣,等.酶联免疫吸附分析法测定猪、鸡粪便中11 种β2-受体激动剂残留的不确定度评定[J].中国兽药杂志,2016,50(8):24-32.
[4]李康柏,许均图,陈润发,等.UHPLC-MS/MS 测定动物源食品中14 种β-受体激动剂[J].广东化工,2018(14):215-216.
[5]代立勤,崔银仓.超高效液相色谱-串联质谱法测定猪肉中5 种β-受体激动剂残留[J].现代农业科技,2018,723(13):253-254.
[6]蔡英华,薛毅,张玥,等.UPLC-MS/MS 法测定动物源性食品中4 个四环素类药物和10 个β 受体激动剂类药物残留[J].药物分析杂志,2014,34(7):1223-1230.
[7]孙涛,刘圣红,乔昆云,等.超高效液相色谱-串联质谱法测定猪尿中9 种β-受体激动剂残留[J].分析仪器,2012,0(3):36-39.
[8]张雷,李应国,王国民,等.超高效液相色谱法同时测定饲料中盐酸多巴胺等五种β-兴奋剂[J].中国饲料,2011(1):33-35.
[9]段建平,陈红青,陈颖,等.毛细管区带电泳法同时测定饲料中西马特罗、盐酸克伦特罗和沙丁胺醇[J].色谱,2005,23(3):261-263.
[10]李丹妮,严凤,张文刚,等.液质串联法测定饲料中16 种β-受体激动剂[J].饲料研究,2011(12):43-47.
[11]刘建利,杨俊兴,曹琛福,等.液相色谱-串联质谱法测定家畜尿液中6 种β-兴奋剂残留的不确定度评定[J].上海畜牧兽医通讯,2017(4):19-23.
[12]李丹妮,潘娟,张婧,等.基于液相色谱-串联质谱法同时测定猪和鸡粪便中β-受体激动剂残留的研究[J].饲料研究,2017(4):25-31.
[13]贾涛,刘辉.液相色谱-串联质谱法同时检测饲料中13 种β-受体激动剂[J].饲料研究,2014,1(3):55-57.
[14] MASTRIANNI K R,METAVARAYUTH K,BREWER W E,et al.Analysis of 10 β-agonists in pork meat using automated dispersive pipette extraction and LC-MS/MS[J].J Chromatogr B,2018,1084:64-68.
[15]李玉芳,王彤,赵小阳,等.高效液相色谱法测定饲料中西马特罗的研究[J].中国饲料,2003(17):26-27.
[16]职爱民,刘庆堂,李青梅,等.西马特罗人工抗原的合成及鼠源多克隆抗血清的制备[J].华北农学报,2010,25(4):97-101.
[17]职爱民,李青梅,刘庆堂,等.西马特罗杂交瘤细胞株的建立及其单克隆抗体制备和鉴定[J].核农学报,2010,24(5):1011-1014.
[18]李君华,吴萌,程华,等.西马特罗单克隆抗体的制备及免疫学特性鉴定[J].畜牧与兽医,2016,48(3):123-126.
[19]李春生,李君华,武孝利,等.西马特罗免疫抗原合成方法的比较[J].畜牧与兽医,2014,46(8):61-64.
[20]杨利国,胡少昶,魏平华,等.酶联免疫技术[M].南京:南京大学出版社,1998:110-120.
[21]郭春祥,郭锡琼.介绍一种简单、快速、高效的辣根过氧化物酶标记抗体的过碘酸钠法[J].免疫学杂志,1983(33):97-100.
[22]董李学,冯才伟,冯静,等.抗氧氟沙星单克隆抗体的制备及ELISA快速试剂盒的初步研制[J].中国畜牧兽医,2014,41(8):90-94.
[23]罗奕铭.新型瘦肉精多残留胶体金检测卡的研制[J].现代食品科技,2018,34(1):233-238.
[24]张连明,黄小云,张英明,等.西马特罗分子印迹荧光检测试纸条的研制[J].分析化学,2016,44(10):1477-1481.
[25]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科技文献出版社,1996:99.