在浓香型白酒的生产过程中,因微生物因素引起的窖泥老熟慢严重制约优质白酒的产量[1]。为快速促进窖泥老熟,我国酒企纷纷致力于人工窖泥发酵剂(artificial pit mudstarter culture,APMSC)的制备[2-5]。人工窖泥发酵剂是将优质老熟窖泥在含有酒糟、曲药和黄水等成分的液体培养基中富集驯化而制成的复合微生态制剂[6]。其研发思路是充分富集并利用老熟窖泥中的酿酒有益微生物资源培养人工窖泥新建窖池或用于窖池养护。尽管应用效果显著,但要实现人工窖泥发酵剂的质量控制仍存在诸多困难。一是复合菌系的菌群结构及相互作用易受环境因素影响导致功效不稳定[7];二是人工窖泥发酵剂的原料来源不稳定,主要体现在优质老熟窖泥难获取[6];此外,不同来源酒糟、曲药等原料的菌群结构也存在明显差异,可能导致批次间发酵剂功效的不稳定[6]。
研究表明,酿造环境的选择作用造就了窖泥、曲药和酒糟之间微生物种群的相似性[8]。由此推测即使缺失某些培养原料,人工窖泥发酵剂的功能微生物也可能由其他原料补充,而原料种类的减少可降低原料因素对发酵剂功效的影响。本研究采用扩增子测序和色谱技术初步解析了培养原料种类的减少对人工窖泥发酵剂微生物群落结构及应用效果的影响。研究结果可为人工窖泥发酵剂原料配方的进一步优化完善提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试样品
样品包括前期开发的全配方人工窖泥发酵剂(intactartificial pit mud-starter culture,I-APMSC)及从其配方中分别取出老熟窖泥(窖龄>30年)、曲药、酒糟和黄水后形成的4个简化人工窖泥发酵剂(simplified-artificial pit mud-starter culture,S-APMSC)配方,见表1。所有培养原料均来自同一酒企,各组发酵剂样品(100 L)同时在30~35 ℃条件下静置培养15 d。白酒样品采自窖池养护后的第一轮酿造结束。窖池养护的主要流程是将窖池四壁的窖泥取下堆积在窖池中,按20%的接种量接种人工窖泥发酵剂后厌氧培养20 d。随后将发酵后的窖泥重新搭在窖池四壁用于酿酒生产。设置未养护窖池为对照组(CK)(n=3)。
表1 不同配方人工窖泥发酵剂的主要原料
Table 1 Main raw materials for artificial pit mud starter culture samples with different formulas
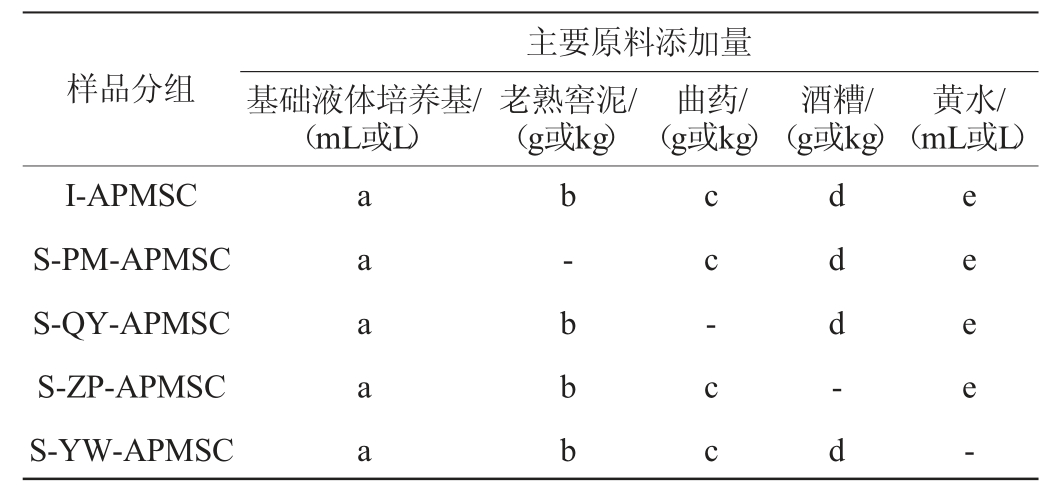
注:S-PM-APMSC、S-QY-APMSC、S-ZP-APMSC、S-YW-APMSC表示分别取出老熟窖泥、曲药、酒糟和黄水后发酵而成的简化配方。每行标注的a、b、c、d、e 分别表示相应原料的添加量,“-”表示未添加。
1.1.2 化学试剂
无水乙醇(分析纯):生工生物工程(上海)股份有限公司;气相色谱检测所用内标及酒体香味物质的标准品(均为色谱纯):美国Sigma-Aldrich公司;总脱氧核糖核酸(deoxyribonucleicacid,DNA)抽提试剂盒:美国MPBiomedicals公司。
1.1.3 培养基
基础液体培养基:1%乙酸钠、0.1%酵母膏、硫酸0.05%、磷酸二氢钾0.04%、硫酸镁0.02%和碳酸钙1%,自然pH,无需灭菌。
1.2 仪器与设备
5810R冷冻离心机:美国Eppendorf公司;Clarus 500气相色谱仪:美国PerkinElmer公司;HC-806H电热恒温培养箱:南通精跃翔智能设备有限公司;15 kg电子秤:无锡英衡电子有限公司。
1.3 实验方法
1.3.1 DNA基因组提取
取10 mL人工窖泥发酵剂样品于4 ℃、12 000 r/min离心去除上清,采用总DNA抽提试剂盒提取沉淀物中的微生物DNA。
1.3.2 PCR扩增及16S rRNA基因扩增子测序
利用带有测序接头的特异性引物5'-CCT ACG GRR BGC ASC AGK VRV GAA T-3'和5'-GGA CTA CNV GGG TWT CTA ATC C-3'扩增原核微生物16S rRNA V3-V4区。聚合酶链式反应(polymerase chain reaction,PCR)扩增体系及程序参照文献进行[9]。采用Illumina Miseq平台对PCR 产物进行2×300 bp双末端高通量测序。测序文库的构建及测序由GENEWIZ公司完成。
1.3.3 香味物质检测
人工窖泥发酵剂预处理:取10 mL样品于150 mL的三角瓶中,加入50 mL体积分数为65%乙醇溶液,振荡摇匀,常温下静置24 h,取浑浊液5 mL于12 000 r/min离心10 min,取上清液进行检测。白酒样品的预处理方法参照文献进行[10]。向2 mL 经预处理的人工窖泥发酵剂和白酒样品中各加入40 μL内标(叔戊醇0.43 g/L、乙酸正戊酯0.42 g/L、2-乙基丁酸0.46 g/L),采用气相色谱仪检测香味物质的含量,检测条件参照文献[9]。
1.3.4 数据分析
采用Qiime 软件对16S rRNA扩增子测序获得的原始序列进行优化处理[9]。根据97%相似性将序列聚类成为分类单元(operational taxonomic units,OTUs)[11],将每个OTU的代表序列于核糖体数据库项目(ribosomaldatabase project,RDP)[12]进行分类学比对,比对数据库为Silva 119[13]。采用Qiime软件计算多样性指数Chao1和Shannon以描述微生物物种的多样性[14],采用主成分分析(principal component analysis,PCA)表征人工窖泥发酵剂样品的微生物群落结构及白酒样品香味物质组成的多样性,通过STAMP软件完成,韦恩(Venn)分析通过R软件完成。微生物群落结构与香味物质含量的Pearson相关性分析、不同分组样品间的微生物多样性指数、相对丰度及香味物质含量间的单因素方差分析均由SPSS 20.0完成。
2 结果与分析
2.1 人工窖泥发酵剂的微生物多样性
不同配方人工窖泥发酵剂样品的微生物物种多样性指数见表2。由表2可知,除S-YW-APMSC外,其余简化配方人工窖泥发酵剂样品的Chao1指数均显著高于I-APMSC(P<0.05),并且I-APMSC的Shannon指数显著低于除S-ZPAPMSC 外的简化配方(P<0.05),说明简化配方菌剂样品中的微生物物种多样性水平普遍高于I-APMSC。这可能是由于I-APMSC某些原料的微生物之间具有相互抑制作用所造成,其原因还需进一步研究。
表2 不同配方人工窖泥发酵剂样品的微生物物种多样性指数
Table 2 Microbial diversity index in artificial pit mud starter culture samples with different formulas

注:实测值为3个重复试验数据的平均值±标准差。同行数值标注不同字母者差异显著(P<0.05)。
不同配方人工窖泥发酵剂样品微生物群落结构的主成分和韦恩分析见图1。由图1a可知,除I-APMSC外,其余样品均按分组的不同良好聚类,说明I-APMSC的微生物群落结构出现了明显的组内分化。由图1b可知,各分组样品共有的OTU为50个,占OTU总量的71.43%(共70个OTU);各组样品中均未检测到独有的OTU,表明各组样品的微生物种类高度相似。
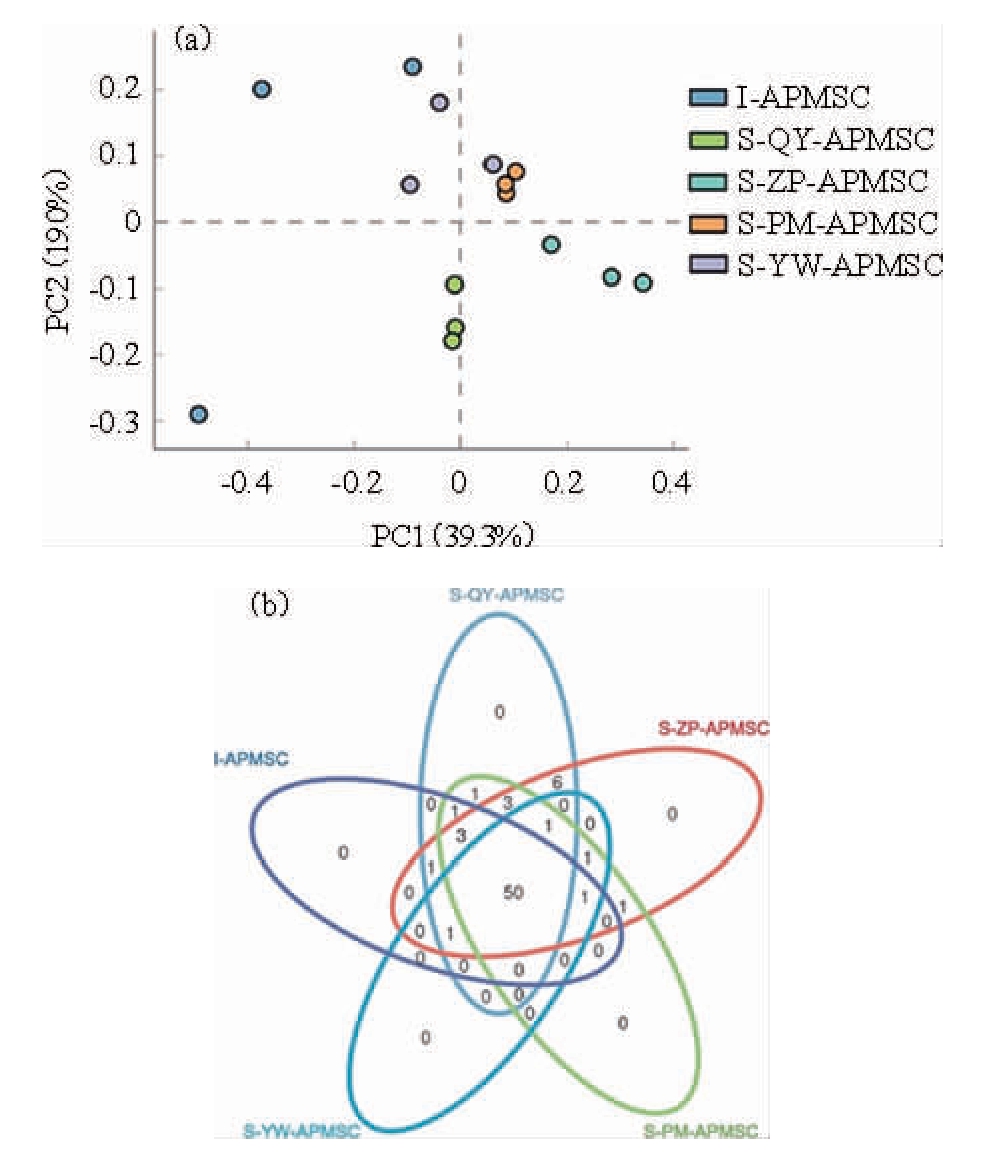
图1 基于OTU水平的不同配方人工窖泥发酵剂样品微生物群落结构的主成分分析(a)和韦恩图(b)
Fig.1 Principal component analysis (a) and Venn diagram (b) of the microbial community structure in artificial pit mud starter culture samples with different formulas based on OTU level
2.2 人工窖泥发酵剂微生物的群落结构组成
从所有人工窖泥发酵剂样品中检测到2 个细菌纲和16 个属。不同配方人工窖泥发酵剂微生物在纲水平的组成情况见图2。由图2可知,S-PM-APMSC和S-ZP-APMSC样品中梭菌纲(Clostridia)的相对丰度均显著高于I-APMSC(P<0.05),而芽孢杆菌纲(Bacilli)的相对丰度显著低于其余发酵剂样品(P<0.05)。研究表明,梭菌纲(Clostridia)中的许多物种以己酸乙酯、己酸和丁酸等白酒主体香味物质为代谢产物[15]。并且,窖泥质量与梭菌纲(Clostridia)在窖泥中的相对丰度显著正相关(P<0.05),与芽孢杆菌纲(Bacilli)的相对丰度显著负相关(P<0.05)[16-17]。

图2 不同配方人工窖泥发酵剂样品中梭菌纲(a)和芽孢杆菌纲(b)的相对丰度
Fig.2 Relative abundance of Clostridia and Bacilli in artificial pit mud starter culture samples with different formulas
在属水平上,本研究将在每组样品中平均相对丰度>1%的微生物类群定义为优势类群[17]。不同配方人工窖泥发酵剂样品中优势菌属的相对丰度见表3。由表3可知,不同配方人工窖泥发酵剂样品中优势菌属包括Caproiciproducens、梭菌属(Clostridium)、乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)、芽孢乳杆菌属(Sporolactobacillus)和鲁梅尔芽孢杆菌属(Rummeliibacillus)。虽然配方不同,但所有样品中都包含这些优势属,仅在相对丰度方面存在显著差异。其中,以己酸和丁酸为代谢产物的Caproiciproducens[18]在S-PM-APMSC样品的相对丰度显著高于其余发酵剂样品(P<0.05);以己酸乙酯、己酸和丁酸等为主要代谢产物的梭菌属(Clostridium)[15]在S-ZP-APMSC中的相对丰度显著高于除S-QY-APMSC外的其余发酵剂样品。Caproiciproducens和梭菌属(Clostridium)的平均总相对丰度在S-ZP-APMSC和S-PM-APMSC中分别达到90.47%和96.67%,均高于其余分组。除Caproiciproducens和梭菌属(Clostridium)外,乳杆菌属(Lactobacillus)在I-APMSC 中也保持较高相对丰度,并显著高于其余发酵剂样品(P<0.05)。有报道称,乳杆菌属(Lactobacillus)在窖泥中的大量累积可能是导致窖泥退化的原因之一[17,19]。结合纲水平的物种丰度组成可推测,S-PM-APMSC和S-ZP-APMSC对酿酒有益微生物的富集培养效果较好。
表3 不同配方人工窖泥发酵剂样品中优势菌属的相对丰度
Table 3 Relative abundance of dominant genera in artificial pit mud starter culture samples with different formulas
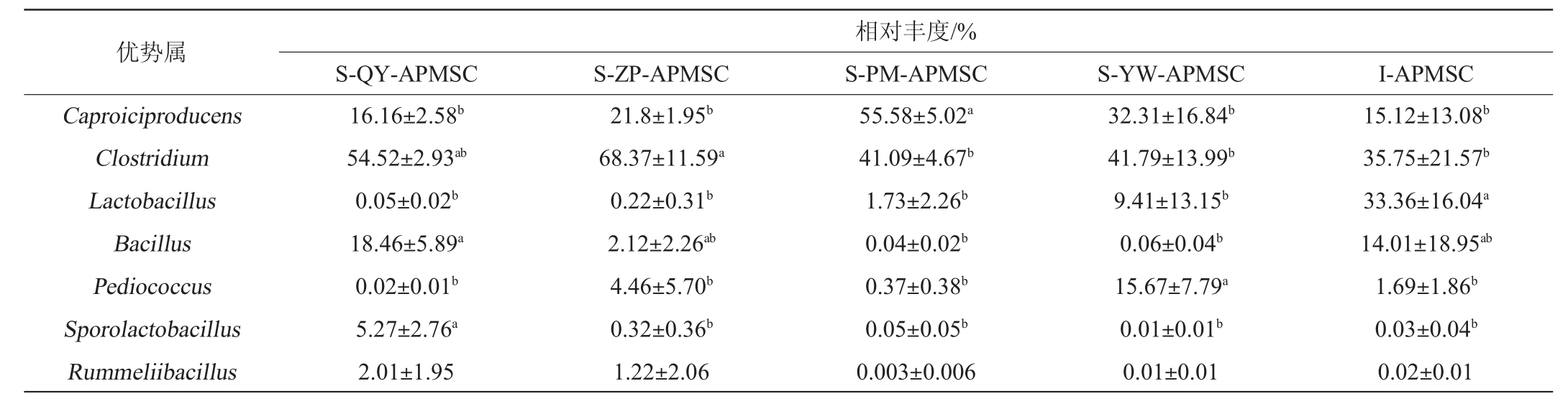
注:实测值为3个重复试验数据的平均值±标准差。同行数值标注不同字母者差异显著(P<0.05)。
2.3 人工窖泥发酵剂微生物群落结构与香味物质的相关性
不同配方人工窖泥发酵剂样品中的香味物质含量检测结果见表4,人工窖泥发酵剂微生物群落结构与香味物质的Pearson相关性分析结果见表5。
表4 不同配方人工窖泥发酵剂样品中的香味物质含量
Table 4 Contents of flavor compounds contents in artificial pit mud starter culture samples with different formulas
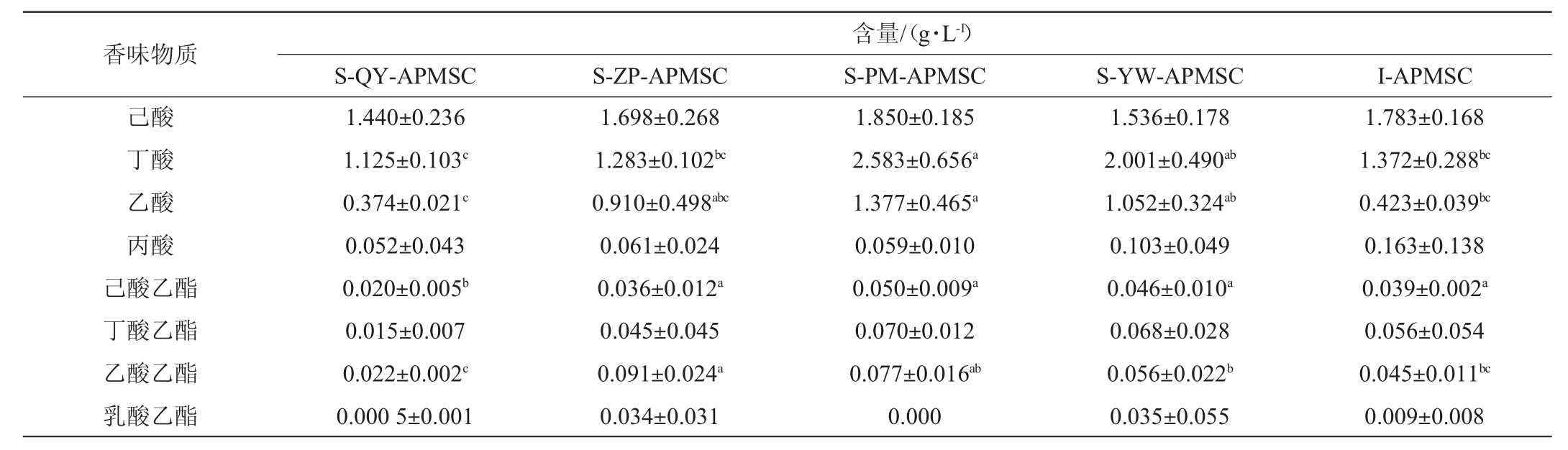
注:实测值为3个重复试验数据的平均值±标准差。同行数值标注不同字母者差异显著(P<0.05)。
表5 人工窖泥发酵剂样品中优势微生物相对丰度与香味物质含量的相关性
Table 5 Correlation of relative abundance and flavor compounds content of dominant microbe in artificial pit mud starter culture samples
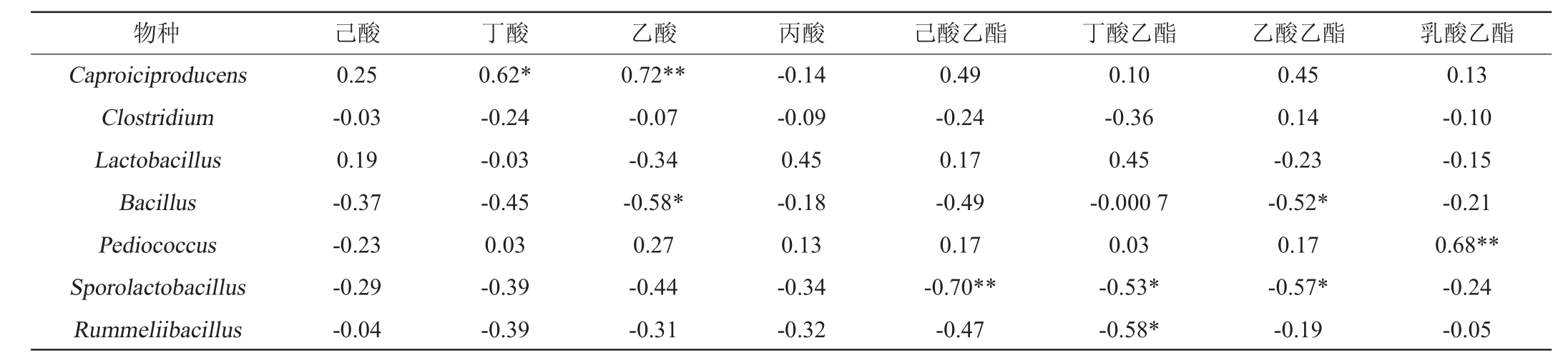
注:“*”表示显著相关P<0.05,“**”表示极显著相关P<0.01。
由表4可知,总体上S-PM-APMSC和S-ZP-APMSC样品中乙酸、己酸乙酯和乙酸乙酯含量均高于其余分组样品,S-QY-APMSC中的己酸乙酯含量显著低于其余分组样品(P<0.05)。I-APMSC样品中除己酸乙酯的含量较高,丁酸、乙酸和乙酸乙酯含量均处于中间水平。
由表5可知,Caproiciproducens与丁酸和乙酸的含量显著正相关(P<0.05);芽孢杆菌属(Bacillus)与乙酸、乙酸乙酯含量显著负相关(P<0.05);片球菌属(Pediococcus)与乳酸乙酯极显著正相关(P<0.01);芽孢乳杆菌属(Sporolactobacillus)与己酸乙酯、丁酸乙酯、乙酸乙酯的含量显著负相关(P<0.05)。鲁梅尔芽孢杆菌属(Rummeliibacillus)与丁酸乙酯含量显著负相关。同时作为己酸和丁酸乙酯合成的关键前体物[1],丁酸含量的提高有利于白酒质量的增强,而乳酸乙酯在酒体中的含量过高会严重削弱白酒的质量。在浓香型白酒的生产中,适当提高己酸乙酯和乳酸乙酯的含量比例是增强酒质的有效手段[1]。因此,片球菌属(Pediococcus)和芽孢乳杆菌属(Sporolactobacillus)在人工窖泥发酵剂中含量过高可能造成窖泥中乳酸含量的提高,导致酒质下降。
2.4 两种人工窖泥发酵剂应用效果的初步比较
利用S-PM-APMSC和I-APMSC进行窖池养护,并检测养护后第一轮酿造白酒样品中的38种香味物质含量。养护窖池酿造白酒样品的主成分分析结果见图3,香味物质含量见表6。由图3可知,各组白酒样品均未被较好的聚类,表明组内样品间的变异较大。由表6可知,在所检测的香味物质中,16 种香味物质的含量具有组间差异(P<0.05)。除甲酸乙酯外,S-PM-APMSC和I-APMSC白酒样品中的油酸乙酯、亚油酸乙酯、十四酸乙酯和葵酸乙酯的含量较对照组显著提高(P<0.05)。酸类物质中,S-PM-APMSC和I-APMS白酒样品中己酸含量有所提高,而丁酸显著下降(P<0.05)。虽未达到显著水平,S-PM-APMSC和I-APMSC 白酒样品中的己酸乙酯、乙酸乙酯、乳酸乙酯和丁酸乙酯含量均较高,其中己酸乙酯含量分别提高了32.51%和71.18%。其余指标如总酯、总醇和总酸等含量具有不同程度提高。
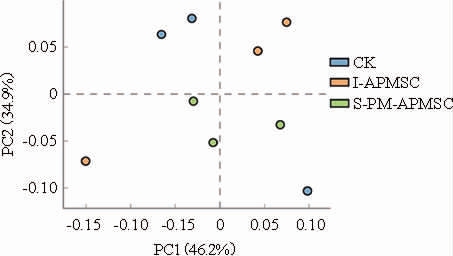
图3 不同配方人工窖泥发酵剂养护窖池酿造白酒样品的主成分分析
Fig.3 Principal component analysis of Baijiu samples fermented in cellars prepared by artificial pit mud starter culture with different formulas
CK(对照组)表示未养护的窖池。
表6 酿造白酒样品中的香味物质含量
Table 6 Content of flavor compounds in Baijiu samples

注:同行数值标注不同字母者差异显著(P<0.05)。
3 讨论
本课题组前期工作发现,即使保持培养条件一致,生产批次间甚至同一批次的人工窖泥发酵剂感官性状也会出现明显差异,其中感官正常的发酵剂以Caproiciproducens和梭菌属(Clostridium)占优,而劣质发酵剂以乳杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus)占优[20]。因此,课题组认为感官性状可在一定程度上反映人工窖泥发酵剂功能微生物的组成,并尝试从感官特征制定一种质量评价的方法。但本研究发现即使感官正常,I-APMSC中的乳杆菌属(Lactobacillus)仍保持显著优势,且该组样品在PCA图谱中未被良好聚类,说明组内样品间微生物群落结构的变异较大。这再次体现了要培养稳定高效的复合微生态制剂所面临的巨大难度,也说明人工窖泥发酵剂质量评价体系的制定应从感官和微生物群落结构等多方面着手。由于人工窖泥发酵剂的功能微生物主要来自培养原料,实现其品质控制的主要手段之一是要加强原料质量的控制[6]。基于原料间菌群结构的相似性[8],本研究认为即使去除某些培养原料,人工窖泥发酵剂的功能微生物也可由其他原料补充,而原料的精简是减少影响功效因素的重要途径。本研究结果也证实了这一推测。其中最有力的证据来自于韦恩分析中所有分组样品共享了占总量71.43%的OTU,且在各组样品中均未检测到独有的OTU。其次,各分组样品中的优势菌属均在其余分组中存在,唯一的区别体现在物种丰度的差异。如老熟窖泥的缺失造成Caproiciproducens相对丰度的显著提高,而老熟窖泥、黄水、酒糟和曲药的缺失均分别导致了乳杆菌属(Lactobacillus)相对丰度的显著下降(P<0.05)。基于此,本研究认为人工窖泥发酵剂培养原料种类的减少可能会导致某类微生物丰度的变化,但这可在将来通过优化培养条件来对物种丰度进行调控,以弥补原料缺失造成的影响。
利用S-PM-APMSC和I-APMSC进行窖池养护后,两组白酒样品中的己酸和己酸乙酯等主体香味物质含量均有提高,说明两种配方均取得了良好效果,从实践上再次证明了通过减少原料种类来改良人工窖泥发酵剂配方的可行性。
4 结论
本研究采用扩增子测序和色谱技术初步解析了培养原料种类的减少对人工窖泥发酵剂微生物群落结构及应用效果的影响。研究结果证实,即使缺失了某一种培养原料,人工窖泥发酵剂的主要微生物物种也可能由其他原料补充。其中,不以老熟窖泥为原料制备的发酵剂中酿酒有益微生物丰度和主体香味物质含量均较原配方发酵剂有所提高,其养护窖泥的应用效果未发生改变。本研究结果为人工窖泥发酵剂原料配方的进一步优化完善奠定了基础。
[1]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].Msystems,2020,Doi:10.1128/mSystems.00829-19.
[2]倪斌,任道群,唐玉明,等.浓香型酒人工窖泥酿造过程中微生物变化研究[J].中国酿造,2012,31(6):157-159.
[3]姚万春,唐玉明,任道群,等.功能性人工窖泥培养配方筛选研究[J].中国酿造,2014,33(8):63-68.
[4]苟静瑜,冯雅芳,王彩琴,等.绵柔西凤酒人工窖泥的培养研究[J].酿酒,2016,43(2):59-63.
[5]谢国排,程伟,汪焰胜,等.金种子浓香型白酒人工窖泥培养工艺分析与探讨[J].酿酒,2015,42(5):49-54.
[6]刘茂柯,唐玉明,赵珂,等.浓香型白酒窖泥微生物群落结构及其选育应用研究进展[J].微生物学通报,2017,44(5):1222-1229.
[7]文娅,赵国柱,周传斌,等.生态工程领域微生物菌剂研究进展[J].生态学报,2011,31(20):6287-6294.
[8] XU Y Q,SUN B G,FAN G S,et al.The brewing process and microbial diversity of strong flavour Chinese spirits:A review[J].J I Brewing,2017,123(1):5-12.
[9]LIU M K,TANG Y M,GUO X J,et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[10] ZHENG J,LIANG R,WU C,et al.Discrimination of different kinds of Luzhou-flavor raw liquors based on their volatile features[J].Food Res Int,2014,56:77-84.
[11] EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[12]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[13]QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J].Nucleic Acids Res,2012,41(D1):D590-D596.
[14]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[15]WANG C D,CHEN Q,WANG Q,et al.Long-term batch brewing accumulates adaptive microbes,which comprehensively produce more flavorful Chinese liquors[J].Food Res Int,2014,62:894-901.
[16]ZOU W,ZHAO C,LUO H.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Front Microbiol,2018,9:671.
[17]HU X L,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[18]KIM B C,JEON B S,KIM S I,et al.Caproiciproducens galactitolivorans gen.nov.sp.nov.,a bacterium capable of producing caproic acid from galactitol,isolated from a wastewater treatment plant[J].Int J Syst Evol Micr,2015,65(12):4902-4908.
[19]SUN Z K,CHEN C,HOU X G,et al.Prokaryotic diversity and biochemical properties in aging artificial pit mud used for the production of Chinese strong flavor liquor[J].3 Biotech,2017,7(5):335.
[20]LIU M K,TANG Y M,ZHAO K,et al.Contrasting bacterial community structure in artificial pit mud-starter cultures of different qualities,a complex biological mixture for Chinese strong-flavor Baijiu production[J].3 Biotech,2019,9(3):89.