近年来,随着我国水产养殖业的发展,虾的产量和消费量不断增长。工业上,虾主要加工成虾仁用于出口,产生的虾头、虾壳、虾尾等废弃物约占整虾质量的40%左右[1]。这些虾类废弃物如果不经适当的加工处理,不仅会产生难闻的气味,给环境带来严重污染,虾料中丰富的蛋白质、矿物质、虾青素和甲壳素等营养物质或生物材料也会白白浪费[2]。甲壳素是一种由N-乙酰-D-氨基葡萄糖通过β-1,4-糖苷键连接而成的聚合物,在自然界中的含量仅次于纤维素。从甲壳类废弃物中提取的甲壳素及其脱乙酰化壳聚糖在食品、医药、纳米材料、水处理、化妆品、环境等领域有广泛的应用[3-4]。
在虾壳废弃物中,甲壳素的含量约占20%~30%,蛋白质的含量约占20%~30%,矿物质的含量约占30%~40%[5]。虾壳甲壳素的提取,主要有脱蛋白和脱盐两个关键步骤。甲壳素提取方法分为化学法和生物法。化学法采用强酸将虾壳中难溶于水的盐类物质变成易溶于水的无机盐,从而达到去除虾壳中矿物质的目的,再使用强碱脱除虾壳中的蛋白质[6]。化学法提取甲壳素过程中,产生的大量酸碱废水难以处理,且强酸强碱还可能造成甲壳素发生部分解聚,影响其品质。而生物催化、生物转化和发酵法制备甲壳素的反应条件温和,且相同条件下制备的甲壳素的品质较为稳定[7],近年来,生物法制备甲壳素已逐步取代化学法,得到了科研工作者的广泛探究。利用微生物发酵产蛋白水解酶对虾壳进行脱蛋白,不仅是生物法制备甲壳素的重要过程,还能回收虾壳中的蛋白质[8]。发酵脱蛋白的微生物以芽孢杆菌居多,如地衣芽孢杆菌、枯草芽孢杆菌、蜡样芽孢杆菌、短芽孢杆菌等,对甲壳类废弃物的脱蛋白率均在75%以上[9-10]。其中蜡样芽孢杆菌是一种具有较高蛋白酶活性的微生物,郝凯[11]从凡纳滨对虾的肠道中分离出气单胞菌属、芽孢杆菌属、弧菌属等微生物,其中产蛋白酶活性最高的菌株是蜡样芽孢杆菌。目前,发酵法脱蛋白仍存在发酵时间长、操作复杂、脱蛋白效率较低等问题。对虾壳蛋白质脱除能力强的微生物,在甲壳素制备工艺中具有较好的应用价值。本研究从虾塘沉积物中分离并鉴定一株产蛋白酶的细菌,研究该菌株与枯草芽孢杆菌在不同条件下的脱蛋白作用,为微生物发酵法提取虾壳甲壳素提供较好的脱蛋白菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
南美白对虾虾壳:海南照丰水产有限公司;枯草芽孢杆菌(Bacillus subtilis)DX-2:本实验室保存。
1.1.2 化学试剂
酵母提取粉、胰蛋白胨(均为生化试剂):广东环凯生物科技有限公司;福林酚试剂:北京索莱宝科技有限公司。
1.1.3 培养基
营养琼脂(nutrient agar,NA):广东环凯生物科技有限公司。
筛选培养基:1%虾壳粉、5%葡萄糖、0.1%酵母膏、0.8%NaCl、0.15% CaCl2、0.07%K2HPO3、0.03% KH2PO3、0.05%MgSO4、2%琼脂,蒸馏水定容至1 000 mL。
虾壳发酵培养基:5%虾壳粉、5%葡萄糖,蒸馏水定容至1 000 mL。
Luria-Bertani(LB)肉汤培养基:0.5%酵母粉、1%胰蛋白胨、1%NaCl,pH 7.0。
以上培养基灭菌条件:121 ℃高压灭菌15 min。
1.2 仪器与设备
ZQLY-180N立式振荡培养箱:海知楚仪器有限公司;SH220F石墨消解仪:济南海能仪器股份有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 虾壳预处理
将去杂后的虾壳用水清洗干净,自然晾干后粉碎,过40目筛网,获得虾壳粉(蛋白质含量为30%左右),密封保存备用。
1.3.2 产蛋白酶菌株的分离
从虾塘沉积物中取样10 g,加入到装有90 mL无菌生理盐水的三角瓶中,搅拌均匀后,超净工作台中静置10 min。取上清液,用无菌水稀释至10-3、10-4、10-5 g/mL。吸入1 mL的上述稀释液至倒有筛选培养基的无菌培养皿表面,涂布均匀,35 ℃倒置培养1~2 d,观察菌落生长情况。
挑取生长良好的单一菌落,接种至LB肉汤培养基中,35 ℃、180 r/min培养1 d。培养好的菌液在倒有NA培养基的培养皿中划线分离,获得纯菌株。
1.3.3 菌株的鉴定
(1)菌落特征和菌体形态
将分离到的纯菌株划线于NA培养基表面,35 ℃培养1 d,观察菌落形态,并进行革兰氏染色[12]。
(2)生理生化特性
参照《常见细菌系统鉴定手册》[13],对分离到的具有较高蛋白酶活性的细菌进行生理生化特征的测定。
(3)分子生物学鉴定
通过测定菌株的16S rDNA基因序列进行分子生物学鉴定,具体参照潘晓倩等[14]的方法并稍作修改。按照细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒上的具体方法从分离到的纯菌株菌液中提取DNA,以提取的DNA作为模板,采用通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')进行聚合酶链式反应(polymerase chain reaction,PCR)。扩增产物委托上海派诺生物技术股份有限公司进行测序。将测得的序列结果与NCBI GenBank中序列进行BLAST比对,通过MEGA6.06软件构建系统发育树。
1.3.4 不同培养基组成对虾壳脱蛋白率的影响
(1)葡萄糖添加量对虾壳脱蛋白率的影响
将筛选菌株和枯草芽孢杆菌分别培养至OD600nm=1.0时,按照3%的接种量接种至虾壳发酵培养基中(装液量20 mL/100 mL),葡萄糖添加量分别为10 g/L、30 g/L、50 g/L、70 g/L、90 g/L,35 ℃、180 r/min发酵5 d,测定发酵液中虾壳的脱蛋白率。
(2)虾壳粉添加量对虾壳脱蛋白率的影响
在葡萄糖添加量优化的基础上,虾壳粉添加量分别为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L,35 ℃、180 r/min发酵5 d,测定发酵液中虾壳的脱蛋白率。
(3)酵母膏添加量对虾壳脱蛋白率的影响
在葡萄糖和虾壳粉添加量优化的基础上,酵母膏添加量分别为0、1 g/L、2 g/L、3 g/L、4 g/L、5 g/L,35 ℃、180 r/min发酵5 d,测定发酵液中虾壳的脱蛋白率。
1.3.5 发酵时间对虾壳脱蛋白的影响
在发酵培养基优化的基础上,按照3%的接种量,35 ℃、180 r/min分别发酵1 d、2 d、3 d、4 d、5 d、6 d、7 d,测定发酵液中蛋白酶活力和脱蛋白率的变化。
1.3.6 蛋白酶活力的测定
吸取一定量的发酵液,参照GB/T 23527—2009《蛋白酶制剂》测定蛋白酶的活性。蛋白酶酶活定义:在一定反应温度和时间条件下,1 mL发酵液在1 min内水解酪蛋白产生1 μg酪氨酸,为1个蛋白酶活力单位(U)。
1.3.7 虾壳粉脱蛋白率的测定
发酵结束后,取出三角瓶,抽滤,将沉淀水洗至上清液的OD600nm为0,获得的虾壳粉在60 ℃干燥箱内干燥24 h,参照GB 5009.5—2016《食品中蛋白质的测定》中的分光光度法测定总氮和蛋白质含量。按照如下公式计算虾壳发酵后的脱蛋白率:
其中:m0为三角瓶中原虾壳粉的质量,g;N0为原虾壳粉的含氮量,%;m为发酵后三角瓶中虾壳粉的质量,g;N为发酵后虾壳粉的含氮量,%;p为虾壳粉的蛋白质含量,%。
2 结果与分析
2.1 产蛋白酶菌株的鉴定
2.1.1 菌株形态特征
从虾塘中分离到的产蛋白酶菌株C1,通过平板划线得到的单菌落呈圆形,奶油色,不透明,且边缘粗糙。进一步通过革兰氏染色,显微镜下观察的形态见图1,结果表明,该菌株呈杆状,判断菌株C1是一株革兰氏阳性杆菌。
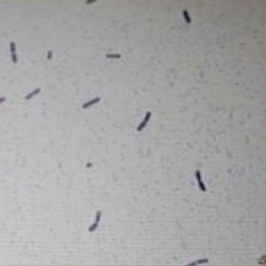
图1 菌株C1的细胞形态
Fig.1 Cell morphology of strain C1
2.1.2 生理生化鉴定
菌株C1的生理生化特性及对碳源的利用能力见表1所示。该菌株具有使明胶液化、牛奶胨化的能力,具有淀粉酶活性,VP试验、甲基红(methyl red,MR)试验呈阳性,但不能利用柠檬酸钠,最适温度为37 ℃,最适pH为7.5。菌株C1对葡萄糖、果糖、乳糖等大部分单糖、双糖或糖醇均能较好地利用,但不能以纤维素作为碳源。
表1 菌株C1的生理生化特征及碳源利用情况
Table 1 Physiological and biochemical characteristics and carbon source utilization ability of strain C1
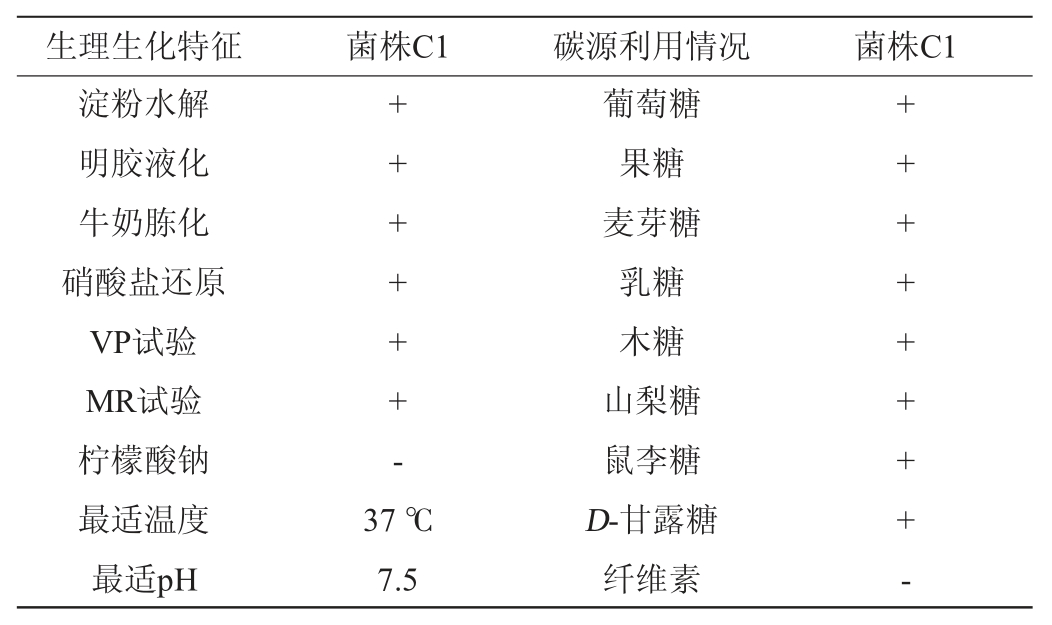
注:“+”代表结果阳性;“-”代表结果阴性。
2.1.3 分子生物学鉴定
菌株C1的PCR扩增产物采用1%琼脂糖凝胶电泳进行纯度及扩增片段大小的检测,结果见图2。由图2可知,菌株C1仅在1 500 bp附近显示一条明显的条带,说明扩增产物的纯度较高,菌株C1的16S rDNA被成功进行PCR扩增。
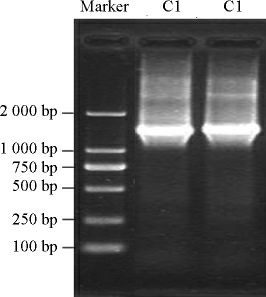
图2 菌株C1的16S rDNA PCR扩增产物电泳图
Fig.2 Electrophoresis patterns of PCR amplification products of 16S rDNA for strain C1
将待鉴定菌株的16S rDNA序列与NCBI中相似度高的已知序列构建成系统发育树,若两者的16S rDNA同源性达到99%,则认为它们是同一种菌[15]。菌株C1的16S rDNA系统发育树见图3所示。由图3可知,菌株C1与Bacillus cereus的亲缘关系最近,同源性达到99%,结合菌落形态和生理生化特征的结果,可确定菌株C1为一株蜡样芽孢杆菌(Bacillus cereus)。蜡样芽孢杆菌因其高蛋白酶活性具有一定的应用价值。于平等[16]从土壤中筛选的蜡样芽孢杆菌,能产中性蛋白酶,且耐热性较好,应用前景广阔。吴昱含等[17]从废铬污染的土壤中分离到一株产蛋白酶耐铬的蜡样芽孢杆菌,该菌株能有效清除含铬污水中的蛋白质,清除率高达91.9%,达到制革污水清洁化的目的。

图3 基于16S rDNA序列菌株C1的系统发育树
Fig.3 Phylogenic trees of strain C1 based on 16S rDNA sequences
2.2 不同培养基组成对虾壳脱蛋白率的影响
2.2.1 葡萄糖添加量对虾壳脱蛋白率的影响
虾壳中的蛋白质能为微生物的生长提供氮源,因此虾壳发酵培养基需要添加适当的碳源。葡萄糖添加量对蜡样芽孢杆菌和枯草芽孢杆菌发酵虾壳的脱蛋白率的影响见图4所示。由图4可知,虾壳发酵培养基中葡萄糖添加量为10~50g/L时,增加葡萄糖含量有利于虾壳中蛋白质的溶出,从而提高虾壳的脱蛋白率。当葡萄糖添加量为50~90g/L时,继续增加葡萄糖添加量,2株芽孢杆菌发酵虾壳的脱蛋白率反而下降。因此,对蜡样芽孢杆菌和枯草芽孢杆菌而言,虾壳发酵培养基中葡萄糖的添加量确定为50 g/L。此外,图4表明蜡样芽孢杆菌发酵虾壳的脱蛋白能力高于枯草芽孢杆菌,在虾壳发酵培养基中添加50 g/L的葡萄糖,蜡样芽孢杆菌和枯草芽孢杆菌的脱蛋白率分别为80.4%、75.6%。
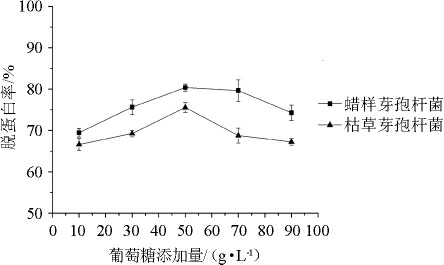
图4 葡萄糖添加量对虾壳脱蛋白率的影响
Fig.4 Effect of glucose addition on the deproteinization rate of shrimp shell
2.2.2 虾壳粉添加量对虾壳脱蛋白率的影响
发酵培养基中虾壳粉添加量对蜡样芽孢杆菌和枯草芽孢杆菌发酵虾壳的脱蛋白率的影响见图5所示。由图5可知,虾壳粉添加量为20 g/L时,2株芽孢杆菌发酵虾壳的脱蛋白率较高,分别达到85.1%、78.4%,虾壳粉添加量为10~50 g/L时,蜡样芽孢杆菌发酵虾壳的脱蛋白率均高于枯草芽孢杆菌。虾壳粉添加量高于20 g/L时,枯草芽孢杆菌发酵的脱蛋白率下降速率较大。因此,2株微生物的发酵培养基中,虾壳粉添加量确定为20 g/L。
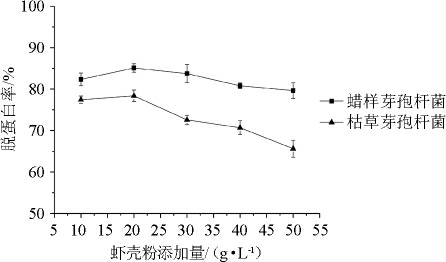
图5 虾壳粉添加量对虾壳脱蛋白率的影响
Fig.5 Effect of shrimp shell power addition on the deproteinization rate of shrimp shell
2.2.3 酵母膏添加量对虾壳脱蛋白率的影响
酵母膏中含有蛋白质、维生素和必需氨基酸等营养物质,是一种非常理想的微生物发酵原料[18]。在发酵初期,虾壳发酵培养基中能供微生物利用的可溶性蛋白质含量较低,不利于微生物生长。而添加一定量的酵母膏可能促进微生物的生长和脱蛋白作用。酵母膏添加量对蜡样芽孢杆菌和枯草芽孢杆菌发酵虾壳的脱蛋白率的影响见图6。
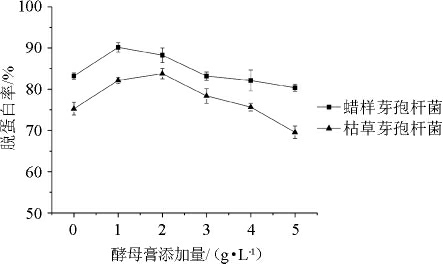
图6 酵母膏添加量对虾壳脱蛋白率的影响
Fig.6 Effect of yeast extract addition on the deproteinization rate of shrimp shell
由图6可知,添加0~5 g/L的酵母膏,蜡样芽孢杆菌对虾壳的脱蛋白率均高于枯草芽孢杆菌,且酵母膏添加量为1 g/L时,蜡样芽孢杆菌发酵虾壳的脱蛋白率达到最高(90.1%)。在此基础上增加酵母膏添加量,脱蛋白率不断下降,可能原因在于较高含量的酵母膏虽然有利于微生物的生长,但是产蛋白酶能力下降。因此确定酵母膏添加量为1 g/L。
2.3 虾壳发酵过程中蛋白酶活力及脱蛋白率的变化
枯草芽孢杆菌和蜡样芽孢杆菌发酵虾壳过程中,发酵液中蛋白酶活力及虾壳脱蛋白率的变化见图7所示。
由图7(a)可知,2株菌的酶活力均呈现先升高后下降的趋势,在发酵0~4 d,枯草芽孢杆菌的酶活力稍高,4 d后蜡样芽孢杆菌的酶活力较高。枯草芽孢杆菌在发酵第4天达到最高酶活力154.6 U/mL,而蜡样芽孢杆菌在发酵第5天的酶活力最高,达到220.8 U/mL,此时枯草芽孢杆菌的酶活力仅为145.7 U/mL。
由图7(b)可知,在蛋白酶的作用下,2株菌均对虾壳的脱蛋白率不断增加,0~5 d增加较快,5 d后缓慢增长。发酵第5天,枯草芽孢杆菌和蜡样芽孢杆菌对虾壳的脱蛋白率分别达到80.4%、90.8%。蜡样芽孢杆菌的脱蛋白作用明显强于枯草芽孢杆菌。通过微生物发酵提取虾壳中的甲壳素,脱蛋白率较高可以达到90%~95%[9],如灰色链霉菌发酵过程中产的蛋白酶对凡纳滨对虾虾壳进行脱蛋白作用,脱蛋白率为91.1%[19];通过沙雷氏菌发酵处理南美白对虾虾壳,脱蛋白率达到94.5%[20]。
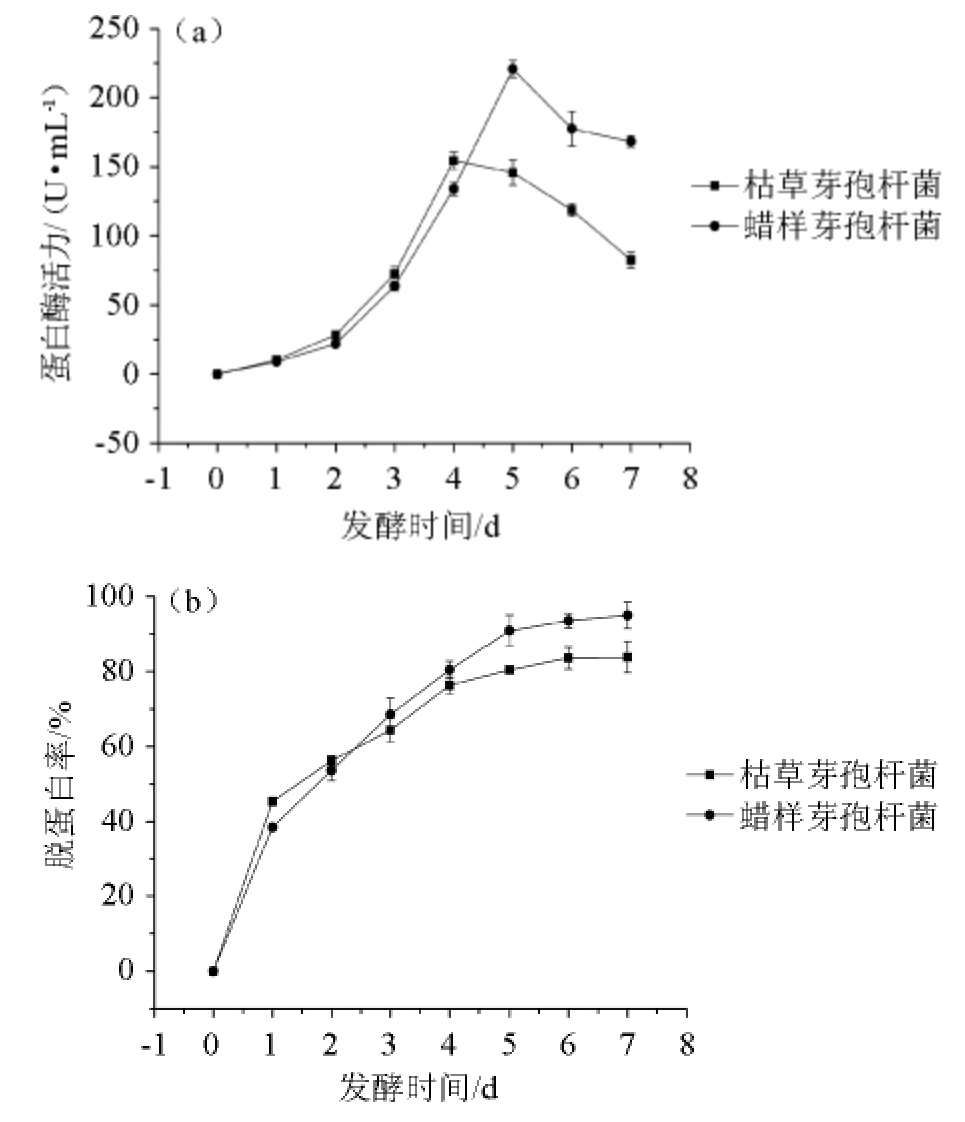
图7 虾壳发酵过程中蛋白酶活力(a)和脱蛋白率(b)的变化
Fig.7 Variation of protease activity (a) and deproteinization rate (b)during shrimp shell fermentation process
3 结论
从虾塘沉积物中分离到一株产蛋白酶的细菌C1,经鉴定其为蜡样芽孢杆菌(Bacillus cereus)。与枯草芽孢杆菌相比,本研究筛选到的蜡样芽孢杆菌对虾壳的脱蛋白能力更强。当虾壳发酵培养基中葡萄糖添加量为50 g/L时,虾壳粉20 g/L,酵母膏1 g/L,蜡样芽孢杆菌发酵虾壳的脱蛋白率较高;此条件下经蜡样芽孢杆菌发酵5 d,发酵液中的蛋白酶活力达到220.8 U/mL,虾壳脱蛋白率达到90.8%,而同等条件下枯草芽孢杆菌的脱蛋白率仅为80.4%。本研究筛选的蜡样芽孢杆菌,在发酵过程中能产生高活性的蛋白酶,高效脱除虾壳中的蛋白质,在虾壳甲壳素的生物提取工艺中具有较好的应用前景。
[1]龚钢明,顾慧,蔡宝国.鱼类加工下脚料的资源化与利用途径[J].中国资源综合利用,2003(7):23-24.
[2]高秀君,闫培生.海产品加工废弃物再利用研究进展[J].生物技术进展,2014,4(5):346-354.
[3] ARANDAY-GARCIA R,SAIMOTO H,SHIRAI K,et al.Chitin biological extraction from shrimp wastes and its fibrillation for elastic nanofiber sheets preparation[J].Carbohydr Polym,2019,213:112-120.
[4] YOUNES I,RINAUDO M.Chitin and chitosan preparation from marine sources.Structure,properties and applications[J].Marine Drug,2015,13,1133-1174.
[5]谢宇,胡金刚,魏娅,等.基尾虾虾壳中提取甲壳素工艺研究[J].食品工业科技,2009,30(1):37-41.
[6]施晓文.邓红兵,杜予民.甲壳素/壳聚糖材料及应用[M].北京:化学工业出版社,2015:37.
[7]GORTARI M C,HOURS R A.Biotechnological processes for chitin recovery out of crustacean waste:A mini-review[J].J Biotechnol,2013,16(3):1-18.
[8]段杉,李婷,毛颖超,等.蛋白酶对甲壳素制备的影响及不同甲壳素的性质比较[J].现代食品科技,2014,30(11):119-124.
[9] MAO X Z,GUO N,SUN J N,et al.Comprehensive utilization of shrimp waste based on biotechnological methods:A review[J].J Clean Prod,2017,143:814-823.
[10] DOAN C T,TRAN T N,NGUYEN V B,et al.Chitin extraction from shrimp waste by liquid fermentation using an alkaline protease-producing strain,Brevibacillus parabrevis[J].Int J Biol Macromol,2019,131:706-715.
[11]郝凯.南美白对虾专用益生菌研究[D].杨凌:西北农林科技大学,2013.
[12]夏天龙,易阳,王宏勋,等.低温下鲜切莲藕菌相分析及货架期评价[J].中国酿造,2014,33(1):86-90.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-399.
[14]潘晓倩,赵燕,张顺亮,等.中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J].食品科学,2016,37(7):93-98.
[15]张国庆,董晓芳,佟建明,等.一株芽孢杆菌的分离和鉴定[J].微生物学通报,2010,37(8):1159-1163.
[16]于平,吴赟婷,杨柳贞,等.蜡样芽孢杆菌高产新型中性蛋白酶发酵条件的优化[J].中国食品学报,2020,20(1):109-117.
[17]吴昱含,郭大鹏,李帅鹏,等.产蛋白酶耐铬菌株的刷选及应用研究[J].中国皮革,2019,48(6):59-63.
[18] MONTEAGUDO J M,RODRIGUEZ L,RINCON J,et al.Optimization of the conditions of the fermentation of beet molasses to lactic acid by Lactobacillus delbrueckii[J].Acta Biotechnol,1994,14(3):251-260.
[19] HONGKULSUP C,KHUTORYANSKIY VV,NIRANJAN K.Enzyme assisted extraction of chitin from shrimp shells(Litopenaeus vannamei)[J].J Chem Technol Biotech,2015,91,1250-1256.
[20]ZHANG H,JIN Y,DENG D,et al.Production of chitin from shrimp shell powders using Serratiamarcescens B742 and Lactobacillus plantarum ATCC 8014 successive two-step fermentation[J].Carbohydr Res,2012,362:13-20.