硫酸软骨素(chondroitin sulfate,CS)是糖胺多糖的一种,是以D-葡萄糖醛酸和2-乙酰氨基-2-脱氧硫酸-D-半乳糖通过β-1,3糖苷键相结合的双糖为基本单位,聚合而成的一类大分子多糖,双糖单位数目一般在50~70个,分子质量约在5~50 kDa之间。糖胺多糖作为蛋白聚糖的组成成分,主要分布在细胞外基质和细胞表面,用来指导很多生物过程,如细胞增殖、信号传输和炎症介导等[1-3]。
硫酸软骨素酶(chondrotinase,ChSase)是一类能将糖胺聚糖催化裂解为小分子多糖的酶,ChSase根据其作用底物的不同分为ChSase ABC、ChSase AC、ChSase B及ChSase C等类型。尽管CS已有很多的药效,但小分子的CS药效更为显著。小分子的硫酸软骨素(CS),以硫酸软骨素为主体构成的可聚蛋白聚糖在软骨基质中起着一种“分子弹簧”的作用,具有止痛,促进软骨再生的功效,可从根本改善关节问题。ChSase ABC还具有缓解视网膜变性[4],提高后肢运动能力[5],降解囊性纤维变性部位的黏液物,缓解突出椎间盘症状[6-8]。另外,LEE M C等[9]研究发现,当软骨用ChSase ABC处理后,移植的软骨细胞与软骨创面的黏附能力大大增强。
ChSase ABC分为I和II,ChSase ABC I的晶体结构与ChSase ABC II相似,主要包含三个主要的区域,N-端区域有双层的β-折叠,催化区域有双层的(α/α)5的折叠和C-端的反平行β-折叠区域[10],ChSase ABC I在相同底物的作用下催化效率比ChSase ABC II高,ChSase ABC I的米氏常数(Km)比ChSase ABC II低,最大反应速率(Vmax)比ChSase ABC II高[11]。
ChSase ABC I由997个氨基酸残基构成,ChSase ABC II由990个氨基酸残基构成[11]。通过重原子置换法和多波长反常散射法技术分析,ChSase ABC I在1.9Å 的分辨率下R因子和自由R因子分别为0.157和0.214,具有很好的立体化学性[12]。ChSase ABC I的N端是由1~210位的氨基酸构成的双层β折叠和一个短的α螺旋,该区域的氨基酸序列与裂解碳水化合物酶相似,如木聚糖酶和一些凝集素。中间区域是由211~593位氨基酸构成的15个α螺旋,是主要的催化区域。C端是由594~997位氨基酸构成的4个反向平行的β折叠,氨基酸序列与ChSase AC酶的C端有21%的相似性,与肺炎链球菌(Streptococcus pneumoniae)的透明质酸酶有17%~19%的相似性,ChSase ABC I的C端氨基酸的主要作用是裂解CS A、CS C 和透明质酸[13]。
ChSase ABC II的晶体结构与ChSase ABC I非常相似,主要包含3个主要的区域,N端是由14~170位的氨基酸构成的双层β折叠,且Ca2+结合在第二和第三个β链之间。中间区域是由171~593位氨基酸构成的双层的(α/α)5折叠,与ChSase AC,透明质酸裂解酶,黄原胶裂解酶和肝素酶II相似,有一个与底物结合区域。C端是由594~1 014位氨基酸构成的4个反向平行的β折叠[12,14]。与ChSase AC结构对比后,推测其活性位点为His454,Tyr461,Arg514和Glu628,同样通过定点突变实验验证了推测结果[15]。
目前也有许多关于ChSase ABC的固定化和稳定性的研究,但是这些酶大多都是从菌株中分离得到,分离步骤繁琐,且得到的酶活较低,酶的主要来源为彭氏变形杆菌(Proteus penneri)和温和气单胞菌(Aeromonas sobria),酶活为0.3 U/mL和0.9 U/mL[16-20]。目前重组菌构建越来越受到关注,ChSase ABC重组菌也越来越多,但是仍然面临着许多的困难:一方面通过菌体表达得到的重组酶,多数都以包涵体形式表达,再经过后续的包涵体分离纯化及复性,得到的酶量有限。另一方面ChSase ABC的分离纯化,常用的是硫酸铵沉淀法,这种方法的成本很高,是制约酶工业化生产的主要瓶颈。融合蛋白主要由两部分组成,即功能蛋白和连接肽。功能蛋白为所要融合的具有特定功能活性的原始蛋白,通常结构功能已知,选择上不存在困难。而连接肽由于其在融合蛋白整体结构中的重要性,在选择和设计上需要加以研究思考[21-23],从而确保融合蛋白的整体活性不变[24]。因此,本研究选用两种连接肽与目的蛋白进行融合,首次将来源于普通变形杆菌(Proteus vulgaris)KCTC 2579的ChSase ABC I与麦芽糖结合蛋白(maltose binging protein,MBP)分别用FFFFF和RRRRR两种连接肽连接,并克隆到pMAL-c2X载体上,在大肠杆菌(Escherichia coli)BL21(DE3)高效表达,并且利用直连淀粉柱实现了一步纯化,并探究了这两种柔性和刚性连接肽在ChSase ABC I表达中的影响。为该酶的基因改造提供一种新手段,为酶的性质优化和工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
普通变形杆菌(Proteusvulgaris)KCTC2579:韩国KCTC保藏中心;E.coli DH5α、E.coli BL21(DE3)感受态细胞:北京博迈德生物技术有限公司;pMAL-c2x:本实验室保存;FFFFF、RRRRR:北京普尔普乐生物技术有限公司合成;Q5TM High-Fidelity 2×Master Mix、T4连接酶和所有的限制性内切酶:New England Biolabs公司;硫酸软骨素A(分子质量为50 000):南京奥多福尼生物科技有限公司;细菌全基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒、柱回收试剂盒:美国OMEGA公司;其他试剂均国产分析纯。
Proteus vulgaris KCTC 2579采用牛肉膏蛋白胨培养基:牛肉膏提取物0.3%,蛋白胨0.5%,pH值自然,115 ℃灭菌30 min。
大肠杆菌培养采用LB培养基:胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH值自然,115 ℃灭菌30 min。
全合成的RRRRR基因序列为:5'-GTCGATGAAGCC CTGAAAGACGCGCAGACTGAGGCTGCCGCAAAGGAA GCGGCAGCGAAAGAGGCGGCCGCAAAAGAGGCAGC GGCGAAAGAAGCTGCGGCCAAGCTCGAGGCCACCAG CAATCCTGCATTTGATCCTAAAAATC-3'
全合成的FFFFF基因序列为:5'-CTGTCGATGAAGC CCTGAAAGACGCGCAGACTGGTGGTGGCGGCAGCGG TGGCGGCGGTAGCGGCGGTGGTGGATCCGGTGGCGG TGGTTCTGGTGGTGGTGGCAGCCTCGAGGCCACCAG CAATCCTGCATTTGATCCTAAAAATCTGAT-3'
1.2 仪器与设备
1-14K离高速冷冻离心机:美国Sigma公司;MBPTrapHP亲和柱(1 mL):美国GE Healthcare公司;HT-400B恒温培养箱:上海赫田科学仪器有限公司;ZQZY-78AV摇床:上海知楚仪器有限公司;DYCP-31CN型琼脂糖凝胶电泳仪:北京六一仪器厂;165-8001蛋白电泳仪:美国伯乐公司。
1.3 方法
1.3.1 重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMALc2x-RRRRR-ChSase ABC I的构建
将ProteusvulgarisKCTC2579从安培管中接入到牛肉膏蛋白胨培养基,37 ℃静置培养72 h,菌体12 000 r/min离心1 min,收集菌体,用OMEGA公司细菌全基因组提取试剂盒提取基因组,以此为模板,并采用Q5TMHigh-Fidelity2×Master Mix对ChSase ABC I进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。根据已知的ChSase ABC I基因序列(GenBank:GQ996964.1)设计PCR引物,ChSase ABC I-F:5'-GCCACCAGCAATCCTGCATTTGATCCTAAA-3',ChSase ABC I-R:5'-AGAGGATCCGAATTCTTATCAAGGGAGTGGCGAGAGTTTGATTTCT-3'。以pMAL-c2x为模板,以MBP-F:CCGTTTAGGTGTTTTCACGA,MBP-R:AGTCTGCGCGTCTTTCAGGG为引物,PCR获得MBP基因。
以MBP、FFFFF、ChSase ABC I 为模板,MBP-F/ChSase ABC I-R为引物,PCR 扩增得到MBP-FFFFF-ChSase ABC I基因;以MBP,RRRRR,ChSase ABC I 基因为模板,MBP-F/ChSase ABC I-R为引物,PCR扩增得到MBP-RRRRR-ChSase ABC I基因。
将扩增得到的MBP-FFFFF-ChSaseABCI,MBP-RRRRRChSase ABC I和pMAL-c2x基因均用Nde I/EcoR I酶切,酶切后进行胶回收。然后用T4 DNA连接酶进行连接,连接后转化到E.coli DH5α,并进行菌落PCR,酶切和测序验证。
1.3.2 重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I的表达
将重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMALc2x-RRRRR-ChSase ABC I转化到E.coli BL21(DE3)中,用接种环挑取一环菌体接种到预先灭菌的装有4 mL LB培养基和100 μg/mL氨苄青霉素的试管中,37 ℃、180 r/min振荡培养12 h后,作为种子液。按1%的接种量将种子液接到装液量为50 mL/250 mL含100 μg/mL氨苄青霉素的LB培养基中,37 ℃、180 r/min振荡培养至对数生长中期(OD600nm值为0.6左右)。加入一定量异丙基-β-D-硫代半乳糖苷(isopropylbeta-D-thiogalactoside,IPTG)至浓度为0.5 mmol/L,16 ℃、180 r/min诱导表达20 h。
1.3.3 重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I的纯化
将诱导表达20 h后的菌,6 000 r/min条件下离心6 min,并用适量的水洗菌体。加入适量的Tris-HCl,pH 7.4缓冲液重悬菌体,超声破碎菌体,超声条件为:超声5 s,间歇6 s,超声功率0.3 kW,破碎总时间为15 min。破碎时要保证低温破碎。破碎液离心后收集上清,并用0.22 μm滤膜过滤上清,过滤后置于冰上备用,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证蛋白大小。按照直链淀粉柱的说明书上的一步纯化的方法进行亲和分离纯化。
1.3.4 酶活及酶比活测定
重组酶MBP-FFFFF-ChSase ABC I 和MBP-RRRRRChSase ABC I可裂解底物硫酸软骨素A为4,5-不饱和糖醛酸产物,此产物在232 nm波长处有强烈吸收,故通过在波长232 nm处测定吸光度值,计算重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I的酶活[25-26]。蛋白浓度测定采用Bradford法。
2 结果与分析
2.1 PCR结果验证
PCR扩增得到MBP、ChSase ABC I、MBP-FFFFF-ChSase ABCI和MBP-RRRRR-ChSase ABC I的基因见图1。已知MBP基因片段的碱基长度为1 173 bp,ChSase ABC I基因片段的碱基长度为3 000 bp,RRRRR基因片段的碱基长度为145 bp,FFFFF基因片段的碱基长度为151 bp。所以可以计算得知,MBP-RRRRR-ChSaseABCI基因片段的碱基长度为4 318 bp,MBP-FFFFF-ChSase ABC I基因片段的碱基长度为4 324 bp。由图1可知,PCR扩增得到的MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSaseABCI的碱基长度与预期一致,故PCR扩增已成功获得MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I的基因。
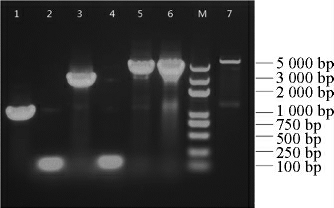
图1 琼脂糖凝胶电泳验证PCR结果
Fig.1 Results of PCR verification by agarose gel electrophoresis
M:DNA Marker;1:MBP基因片段(1 173 bp);2:RRRRR基因片段(145 bp);ChSase ABC I基因片段(3 000 bp);4:FFFFF基因片段(151 bp);5:MBP-RRRRR-ChSase ABC I基因片段(4 318 bp);6:MBP-FFFFFChSase ABC I基因片段(4 324 bp);7:pMAL-c2x经Nde I/EcoR I酶切产物(5 473 bp,1 173 bp)。
2.2 重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMAL-c2x-RRRRR-ChSase ABC I的构建
连接转化后获得的阳性转化子,通过提取质粒和酶切验证,用Nde I/EcoR I酶切验证重组质粒pMAL-c2x-FFFFFChSase ABC I和pMAL-c2x-RRRRR-ChSase ABC I,结果见图2。由图2可知,成功获得5 473 bp和4 318 bp,5 473 bp和4 324 bp的基因片段,表明已成功获得重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMAL-c2x-RRRRR-ChSase ABC I。测序结果同样表明已成功构建了重组质粒pMAL-c2x-FFFFFChSaseABC I和pMAL-c2x-RRRRR-ChSase ABC I。
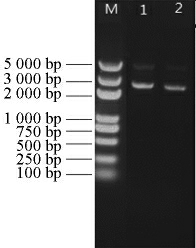
图2 重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMAL-c2x-RRRRR-ChSase ABC I经Nde I/EcoR I酶切产物
Fig.2 Enzyme-digested product of recombinant plasmids pMALc2x-FFFFF-ChSase ABC I and pMAL-c2x-RRRRRChSase ABC I by Nde I/EcoR I
M:DNA Marker;1:pMAL-c2x-FFFFF-ChSase ABC I经Nde I/EcoR I酶切产物(5 473 bp,4 318 bp);2:pMAL-c2x-RRRRR-ChSase ABC I经Nde I/EcoR I酶切产物(5 473 bp,4 324 bp)。
2.3 重 组 酶MBP-FFFFF-ChSase ABC I 和MBP-RRRRRChSase ABC I的表达
将重组质粒pMAL-c2x-FFFFF-ChSase ABC I和pMALc2x-RRRRR-ChSase ABC I分别转化到E.coli BL21(DE3)中,在相同的条件下诱导表达,结果见图3。分别测定蛋白浓度,酶活力和酶比活,结果见表1。
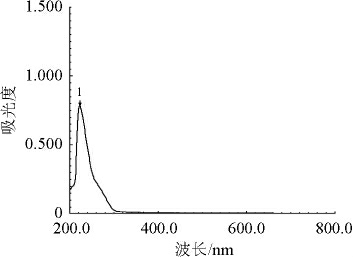
图3 重组质粒pMAL-c2x-FFFFF-ChSase ABC I裂解底物硫酸软骨素A后的全扫描图
Fig.3 Full scan of chondroitin sulfate cracked by recombinant plasmid pMAL-c2x-FFFFF-ChSase ABC I
峰1为降解产物4,5-不饱和糖醛酸在波长232 nm下的吸收峰。
由图3可知,重组酶MBP-FFFFF-ChSase ABC I和MBPRRRRR-ChSase ABC I可裂解底物硫酸软骨素A为4,5-不饱和糖醛酸产物,此产物在波长232 nm处有强烈吸收。结果表明,重组酶MBP-FFFFF-ChSase ABC I已成功表达,同样方法验证了重组酶MBP-RRRRR-ChSase ABC I也成功表达。
表1 重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I酶活、蛋白含量及比酶活
Table 1 Activities,protein contents and specific enzyme activities of recombinases MBP-FFFFF-ChSase ABC and MBPRRRRR-ChSase ABC I
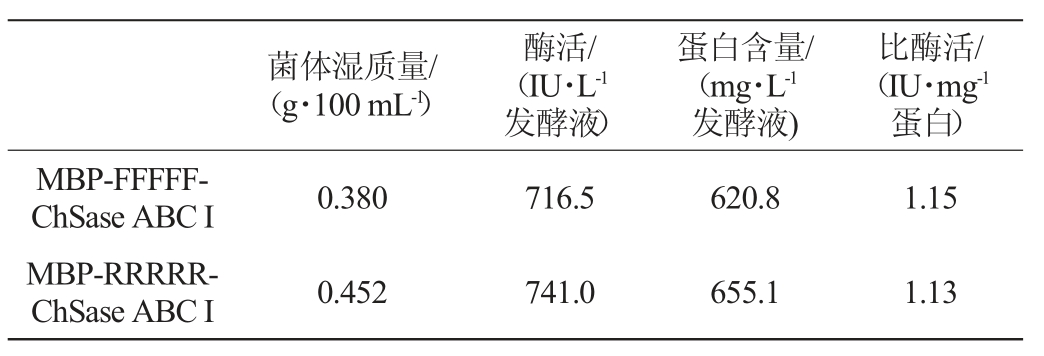
由表1可知,重组酶MBP-FFFFF-ChSase ABC I的酶活和比酶活分别为716.5 IU/L发酵液和1.15 IU/mg蛋白,重组酶MBP-RRRRR-ChSase ABC I的酶活和比酶活分别为741.0 IU/L发酵液和1.13 IU/mg蛋白。刚性连接肽RRRRR的总酶活比柔性连接肽FFFFF的总酶活高。刚性连接肽RRRRR的菌体量、蛋白含量比柔性连接肽FFFFF的高。
2.4 SDS-PAGE验证重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I的分子质量
SDS-PAGE测定重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I的分子质量,结果见图4。由图4可知,重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I已在BL21(DE3)中成功表达,并且获得了可溶性的重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I,上清液基本包含了90%以上的总蛋白。SDSPAGE结果表明,重组酶MBP-FFFFF-ChSase ABC I和MBPRRRRR-ChSase ABC I的分子质量均为130 kDa。
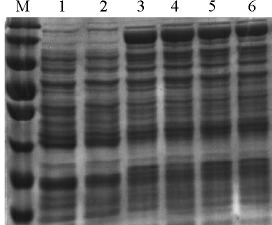
图4 SDS-PAGE验证重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I分子质量
Fig.4 Verification of molecular mass of recombinases MBP-FFFFFChSase ABC I and MBP-RRRRR-ChSase ABC I by SDS-PAGE
M:170kDa Marker;1,2:BL21(DE3)(pMAL-c2x)表达后的总蛋白和上清;3,4:BL21(DE3)(pMAL-c2x-FFFFF-ChSase ABC I)表达后的总蛋白和上清;5,6:BL21(DE3)(pMAL-c2x-RRRRR-ChSase ABC I)表达后的总蛋白和上清。
3 讨论
本研究通过一步亲和纯化的方法获得重组酶MBPFFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I。采用直连淀粉柱亲和MBP实现一步纯化,MBP可以与直链淀粉结合,从而吸附在直链淀粉柱上,再利用亲和力更强的麦芽糖将MBP-HepC融合蛋白洗脱,利用此特性实现重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC I的亲和纯化。本研究表明直链淀粉柱能够有效地吸附重组酶MBP-FFFFF-ChSase ABC I和MBP-RRRRR-ChSase ABC,通过一步亲和分离纯化,目标蛋白的纯度即可达95%以上,大大缩减了纯化步骤并降低了分离纯化成本。
ChSase ABC I的发展同样还受到诸多因素的限制,需从以下几方面入手来改变现状,首先,需要寻找新型菌株,表达策略及代谢途径来实现酶的高效分泌表达,避免后续的包涵体复性对酶活性的影响,实现其在工业化中的应用。其次,通过构建含有不同标签的融合表达载体来实现酶快速和高效分离纯化。最后,需研究新方法来增强酶的热稳定性,延长酶的保藏时间,如寻找耐热菌来源的ChSase ABC I等。另外,ChSase ABC I的固定化也是研究的一个重要方面,特别是在医药领域,如何找到能够承载ChSase ABC I的合适的药物载体,来协助其完成特定的药效功能是亟待解决的问题。
4 结论
ChSaseABCI是一类能够将硫酸软骨素、软骨素、透明质酸等糖胺多糖降解为寡糖及不饱和二糖的裂解酶。本研究所用的ChSase ABC I基因来源于Proteus vulgaris KCTC 2579,首次将ChSase ABC I与麦芽糖结合蛋白分别用FFFFF和RRRRR两种连接肽连接,并克隆到pMAL-c2x载体上,成功在E.coli BL21(DE3)高效表达。表达后重组酶MBP-FFFFFChSase ABC I的酶活和比酶活分别为716.5 IU/L发酵液和1.15 IU/mg蛋白,重组酶MBP-RRRRR-ChSase ABC I的酶活和比酶活分别为741.0 IU/L发酵液和1.13 IU/mg蛋白。SDS-PAGE表明MBP-FFFFF-ChSase ABC I和MBP-RRRRRChSase ABC I的分子质量均为130 KDa,并且基本都为可溶性蛋白。
[1] BERNFIELD M,GOTTE M,PARK P W,et al.Functions of cell surface heparan sulfate proteoglycans[J].Ann Rev Biochem,1999,68:729-777.
[2] SUGAHARA K,MIKAMI T,UYAMA T,et al.Recent advances in the structural biology of chondroitin sulfate and dermatan sulfate[J].Curr Opin Struc Biol,2003,13:612-620.
[3]BAO X,NISHIMURA S,MIKAMI T,et al.Chondroitin sulfate/dermatan sulfate hybrid chains from embryonic pig brain,which contain a higher proportion of L-iduronic acid than those from adult pig brain,exhibit neuritogenic and growth factor binding activities[J].J Biol Chem,2004,279:9765-9776.
[4] SHIELDS L B,ZHANG Y P,BURKE D A,et al.Benefit of chondroitinase ABC on sensory axon regeneration in a laceration model of spinal cord injury in the rat[J].Surg Neurol,2008,69(6):568-577.
[5]NICOLE J T,DENA R H.Chondroitinase ABC improves basic and skilled locomotion in spinal cord injured cats[J].Exp Neur,2008,209(2):483-496.
[6] BROWN M D.Method for treating intervertebral disc displacement with enzymes:US,4696816[P].1987-09-29.
[7]HENDERSON N,STANESCU V,CAUCHOIX J.Nucleolysis of the rabbit intervertebral disc using chondroitinase ABC[J].Spine,1991,16(2):203-208.
[8]KATO F,LWATA H,MIMATSU K,et al.Experimental chemonucleolysis with chondroitinase ABC[J].Clin Orthop Relat R,1990,253(2):301-308.
[9] LEE M C,SUNG K L,KURTIS M S,et a1.Adhesive force of chondrocytes to cartilage effects of chondroitinase ABC[J].Clin Orthop Relat R,2000,370(1):286-294.
[10]HUANG W,LUNIN V V,LI Y,et al.Crystal structure of Proteus vulgaris chondroitin sulfate ABC lyase I at 1.9Å resolution[J].J Mol Biol,2003,328:623-634.
[11]HAMAI A,HASHIMOTO N,MOCHIZUKI H,et al.Two distinct chon-droitin sulfate ABC lyases:an endoeliminase yielding tetrasaccharides and an exoeliminase preferentially acting on oligosaccharides[J].J Biol Chem,1997,272(4):9123-9130.
[12]HUANG W,LUNIN V V,LI Y,et al.Crystal structure of Proteus vulgaris chondroitin sulfate ABC lyase I at 1.9Å resolution[J].J Mol Biol,2003,328(3):623-634.
[13] FEATHIEARE J,EGGIMANN B,CYGLER M.Crystal structure of chondroitin AC lyase,a representative of a family of glycosaminoglycan degrading enzymes[J].J Mol Biol,1999,288(4):635-647.
[14]SHAYA D,HAHN B S,BJERKAN T M,et al.Composite active site of chondroitin lyase ABC accepting both epimers of uronic acid[J].Glycobiology,2008,18(3):270-277.
[15] SHAYA D,HAHN B S,PARK N Y,et al.Characterization of chondroitin sulfate lyase ABC from Bacteroides thetaiotaomicron WAL2926[J].Biochemistry,2008,47(25):6650-6661.
[16] MAHDIEH NR,KHOSRO K,MAHDI A,et al.Co-solvent mediated thermal stabilization of chondroitinase ABC I form Proteus vulgaris[J].Int J Biol Macromol,2012,50:487-492.
[17]MAHDIEH N R,KHOSRO K,MAHDI A,et al.Enhancement of thermal stability of chondroitinase ABC Ⅰby site-directed mutagenesis:An insight from Ramachandran plot[J].BBA-Bioenergetics,2013,1834(2):479-486.
[18] HUANG Y C,HSU S H,CHEN M T,et al.Controlled release of chondroitinase ABC in chitosan-based scaffolds and PDLLA microspheres[J].Carbohyd Polym,2011,84(2):788-793.
[19] PAKULSKA M M,VULIC K,SHOICHET M S.Affinity-based release of chondroitinase ABC from a modified methylcellulose hydrogel[J].J Control Release,2013,171(1):11-16.
[20] YAN H L,HE H Z,CAI S L,et al.Screening and purification of chondroitinase from chondroitinase producing strains[J].Acta Microbiol Sin,2004,44(1):79-82.
[21]于健,SARRA S,徐寒梅.连接肽在融合蛋白设计中的选择及应用[J].药物生物技术,2016,23(3):260-263.
[22]李剑芳,王春娟,邬敏辰.连接肽的设计及在融合蛋白中的应用[J].食品与生物技术学报,2015,34(11):1121-1127.
[23]王锐丽,刘敏杰,薛业敏.多功能融合酶基因Linker 的优化及表达[J].江苏农业科学,2016,44(4):31-36.
[24]王春娟,唐诗涵,邬敏辰,等.不同类型连接肽对β-甘露聚糖酶AuMan5A 酶学性质的影响[J].食品与生物技术学报,2017,36(9):938-943.
[25]GU K,LINHARDT R J,LALIBERTE M,et al.Purification,characterization and specificity of chondroitin lyases and glycuronidase from Flavobacterium heparinum[J].Biochem J,1995,312(Pt 2):569-577.
[26] YE F C,KUANG Y,CHEN S,et al.Characteristics of low molecular weight heparin production by an ultrafiltration membrane bioreactor using maltose binding protein fused heparinase Ⅰ[J].Biochem Eng J,2009,46(2):193-198.