黑树莓(Rubus mesogaeus)属于蔷薇科悬钩子属,多年生落叶灌木,果实为小浆果,富含多种活性物质成分(如多酚、鞣花酸、黄酮、维生素C等),具有抑菌、保护肝脏、抗氧化活性等功用[1-3]。黑树莓果实易破碎,也不耐贮藏和运输,加之如今的保鲜技术尚不完善,因此如果不能及时消化易导致巨大的经济损失。现今黑树莓鲜果除了少量被直接售卖外,大部分均需进行速冻保存或精深加工。黑树莓酒是黑树莓果实进行加工的一条有效途径,不仅保留了果实中大部分的营养物质,还具有促进人体的新陈代谢、改善心脑血管、抗衰老、保护肝脏等功能[4-6],具有广阔的市场发展前景,因此急需大力开发其相关产品。
在果酒的生产过程中,酿造微生物有着举足轻重的作用。一般而言,果酒的发酵过程包含两个阶段,即酒精发酵(alcoholic fermentation,AF)和苹果酸-乳酸发酵(malolactic fermentation,MLF)[7]。酒精发酵是在酿酒酵母的主导作用下进行,分解糖类形成酒精及其他代谢产物[8-9]。苹果酸-乳酸发酵主要由乳酸菌启动,旨在降低酒体中的酸度,提高酒的适口性,同时增加其生物稳定性[10-11]。果酒发酵可以自然进行,也可以在接种特定的酿造微生物后进行,两者各具有一定的优缺点。自然发酵的果酒能够最大限度地体现果实的风味特征,在凸显果酒的骨架感、复杂性和地域特色等方面优势明显,但是自然发酵往往存在起酵晚、易停滞、重复性低、挥发酸含量高等缺陷。现代果酒酿造工艺使用商业化酿造微生物保障发酵过程,具有快速、高效、质量稳定等优势,但也存在风味不够浓郁、地域特色缺乏及产品同质化等问题[8,12]。目前对于果酒自然发酵微生物多样性的研究中,越来越多学者使用高通量测序技术。作为新一代测序技术,高通量测序技术具有通量高,准确率高等优点[13]。阴芳冉[14]采用高通量测序技术对树莓自然发酵中真菌进行研究,结果显示两种样品中酿酒酵母属(Saccharomyces cerevisiae)和汉逊酵母属(Hanseniaspora uvarum)均为优势菌群。PINTO C等[15]对自然发酵的葡萄酒采用高通量测序技术检测发现,在酒精发酵阶段,酿酒酵母属(Saccharomyces)和梅奇酵母属(Metschnikowia)、汉逊酵母属(Hanseniaspora uvarum)、孢子丝菌属(Sporothrix)、念珠菌属(Candida)、裂殖酵母属(Schizosaccharomyces)等非酿酒酵母菌属为主要真菌。
本课题以自然发酵的黑树莓酒为研究对象,探究其自然发酵过程中的微生物群落构成、结构及演替变化规律,通过高通量测序技术分别测定黑树莓酒自然酒精发酵阶段的真菌群落结构和自然阶段苹果酸-乳酸发酵的细菌群落结构,关注优势菌群,以期为后续黑树莓酒发酵机理及品质提升提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
黑树莓(Rubus mesogaeus)(Hull,赫尔):2017年7月采摘,速冻后将其存贮于-20 ℃的冷库中,于2018年3月开始发酵。
1.1.2 化学试剂
果胶酶(30 000 U/g):山东隆大生物生物工程有限公司;E.Z.N.ATM Mag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:美国OMEGA公司;2×Taq Master Mix:南京诺唯赞生物科技有限公司;Qubit 3.0 DNA检测试剂盒:美国Thermo Fisher Scientific公司。
1.2 仪器与设备
SHP-250生化培养箱:上海精宏实验设备有限公司;5424台式高速离心机:德国Eppendorf公司;FE20K pH计:瑞士梅特勒-托利多公司;DYCP-31C水平电泳仪:北京市六一仪器厂;C1000聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 黑树莓酒酿造工艺流程及操作要点
黑树莓→解冻→挑选→破碎→酶解→成分调整→酒精发酵→离心出酒渣→苹果酸-乳酸发酵→黑树莓酒
操作要点:速冻黑树莓室温条件下解冻后破碎,置于20 L发酵瓶中,装液量为15 L。添加果胶酶30 mg/L、二氧化硫50 mg/L、适量的蔗糖至还原糖含量为210 g/L[16]。在24~26 ℃条件下进行自然酒精发酵,定期搅拌循环且跟踪监测黑树莓酒的还原糖浓度,待酒体的还原糖含量<4 g/L时,7 000 r/min离心15 min分离出酒渣,终止酒精发酵。而后控制温度为20~22 ℃,进行自然苹果酸-乳酸发酵,跟踪监测苹果酸浓度,待苹果酸质量浓度下降至0.5 g/L以下,终止苹果酸-乳酸发酵,12 000 r/min离心10 min,除去发酵残渣,得到黑树莓酒,并测定黑树莓酒的基本理化指标。
1.3.2 理化指标测定
还原糖、总酸、挥发酸、酒精度的测定参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》,具体方法如下:采用斐林试剂法测定还原糖(以葡萄糖计);采用氢氧化钠滴定法测定总酸(以苹果酸计)和挥发酸(以乙酸计);采用密度瓶法测定乙醇体积分数;采用酸度计测定pH值[17]。
1.3.3 微生物多样性分析
AF是在酵母作用下完成的,而MLF是由乳酸菌启动并完成的[18],即酵母菌和乳酸菌分别在AF阶段和MLF阶段中起主导作用。因此在AF的第1天、第3天以及第6天分别收集样品进行真菌多样性分析;在MLF发酵的第2天、第10天、第19天以及第28天收集样品进行细菌多样性分析。样品放置于-80 ℃冰箱保存。
根据E.Z.N.ATM Mag-Bind Soil DNA Kit的操作说明,提取各样品中的微生物总脱氧核糖核酸(deoxyribonucleic acid,DNA)。使用Qubit 3.0 DNA test kit检测提取的DNA质量和浓度。真菌多样性使用ITS1-2通用引物ITS1F(ccctacacgacgctcttccgatctn(标签)CTTGGTCATTTAGAGGAAGTAA)和ITS2R(gtgactggagttccttggcacccgagaattccaGCTGCGTTCTTCATCGATGC)进行PCR扩增;细菌多样性使用16S rRNA基因V3-V4区引物341F(5'-ccctacacgacgctcttccgatctg(标签)CCTACGGGNGGCWGCAG-3')和805R(5'-gactggagttccttggcacccgagaattccaGACTACHVGGGTATCTAATCC-3')进行PCR扩增;用磁珠纯化回收PCR扩增产物。送样至上海生工生物工程股份有限公司,使用Illumina Miseq平台运行PE300模式进行高通量测序分析。
使用软件Cutadapt、Pear和Prinseq对原始序列进行去除接头、序列拼接和质量剪切,通过软件Uchime进行嵌合体和非特异性扩增序列的去除。用Usearch软件按照97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类,在进一步分析之前,除去在总序列中占比少于0.01%的OTU[19]。选择丰度最高的序列作为OTU的代表性序列,利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,依据各样品物种丰富度情况,通过得到的OTU结果计算出样品中生物多样性指数、丰富度指数(Chao、ACE指数)、覆盖率指数(Coverage)、多样性指数(Shannon、Simpson指数)等[20]。
2 结果与分析
2.1 自然酒精发酵过程中的真菌多样性
黑树莓酒的自然AF共进行了7 d,发酵过程中通过测定还原糖浓度来监测发酵过程。由于酒精发酵过程中酵母是优势菌群,所以真菌多样性分析成为了黑树莓酒自然AF的研究重点。在AF的初期(第1天)、中期(第3天)和后期(第6天)分别取样,记为BU1、BU3和BU6,进行高通量测序后实施系统分析。
2.1.1 高通量测序结果
不同发酵时期样品的稀释性曲线和Shannon指数分析结果如图1所示。由图1可知,随着测序深度的不断增加,OTU的数量也随其增多,且样品的Shannon曲线都已进入平台期阶段。尽管随着测序量的增加可能会发现新的OTU,但是样品的真菌多样性不会再随着测序量的增加而发生变化,证明测序数量足够,并且能够反映出黑树莓酒自然酒精发酵过程当中的绝大多数真菌信息。
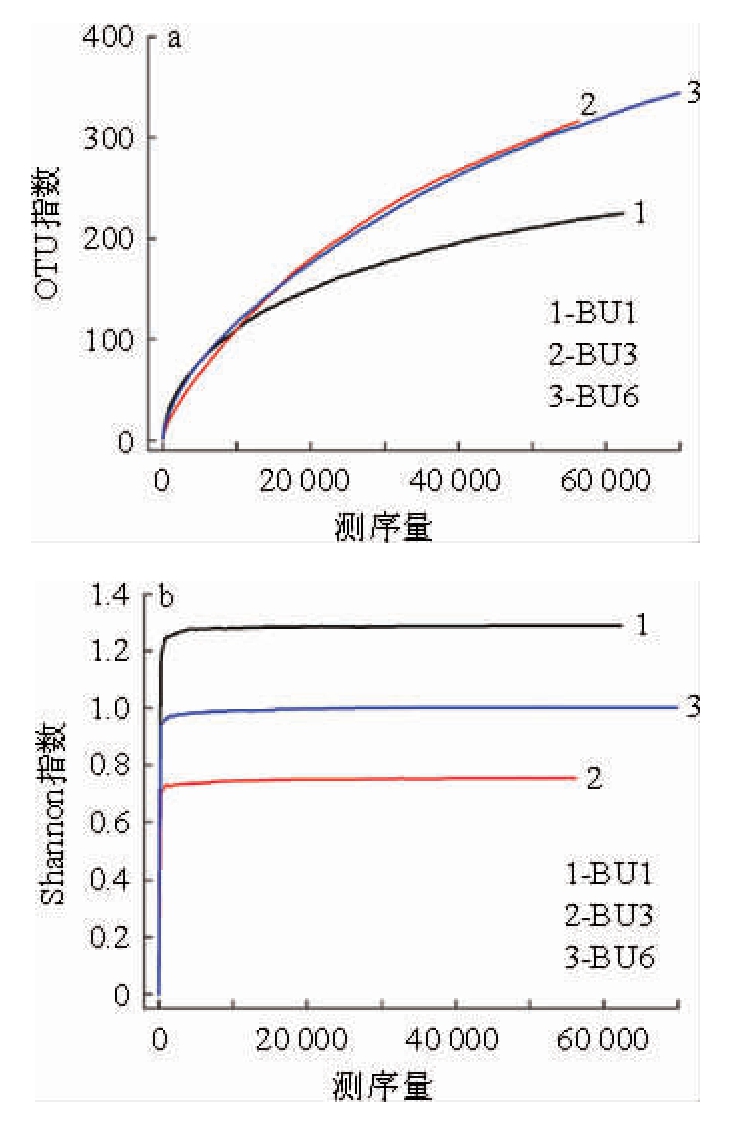
图1 自然酒精发酵过程中真菌的稀释性曲线(a)和Shannon指数(b)
Fig.1 Rarefaction curve (a) and Shannon index (b) of fungi during spontaneous alcohol fermentation
2.1.2 真菌丰度和多样性分析
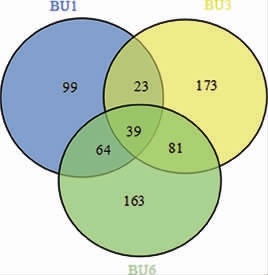
图2 自然酒精发酵过程中真菌OTU韦恩图
Fig.2 Venn diagram for fungal OTU during spontaneous alcoholic fermentation
由图1、图2可知,BU1、BU3和BU6组分别获得62 318、56 162、71 541条有效序列。按照97%的相似度,样品OTU数量分别为225、316和347,其中39个OTU在样品BU1、BU3和BU6同时出现,62个OTU在样品BU1和BU3中同时出现,120个OTU在样品BU3和BU6中同时出现。结果表明,BU6的物种丰度高于其他不同发酵时期样品,随着发酵的进行真菌群落多样性先下降再上升,发酵接近结束时真菌群落结构最为复杂。
2.1.3 真菌群落组成分析
对BU1、BU3和BU6不同发酵时期样品的真菌群落组成进行分析,结果见图3。由图3可知,酵母属(Saccharomyces)、弯担菌属(Curvibasidium)和木拉克酵母属(Mrakia)占绝对优势,枝孢菌属(Cladosporium)相对丰度也较高,其余真菌属的相对丰度均<2%。BU1样品中的优势真菌为Curvibasidium(64.91%)、Mrakia(27.2%)和Cladosporium(4.05%)。BOURRET T B等[21]在酿酒葡萄表皮曾分离获得Curvibasidium rogersii和Curvibasidium cygneicollum,该属真菌能产生冬孢子使其抗逆性更强,并抵御寒冷。Mrakia属的菌株大多分离于寒冷地区,属于耐寒微生物[22]。笔者推测,由于黑树莓果实长期贮存于-20 ℃冷库,适于耐寒类微生物富集培养,因此Cladosporium属和Mrakia属的真菌丰度较高。该结果也与前人的研究一致,DEL CARMENPORTILLO M等[23]研究发现,在发酵的初期阶段非酿酒酵母丰度较高,其后会逐步下降。在黑树莓酒自然AF中期(第3天),Curvibasidium和Mrakia的丰度迅速下降,而酵母属(Saccharomyces)成为优势菌,丰度最大达到82.18%。经进一步分析,确认该酵母在种的水平上是酿酒酵母(Saccharomyces cerevisiae),其利用糖类物质转化成为乙醇,是AF中最重要的微生物[24]。酿酒酵母在实现自身增殖的同时显著抑制了Curvibasidium、Mrakia及其他微生物的生长。在发酵的第6天,Saccharomyces的丰度略有下降(75.53%),但仍然是优势微生物,主导着发酵进程;其他真菌的丰度也有所变化,如Curvibasidium增长至15.65%,Mrakia继续下降至7.28%,而其他真菌的总比重不超过1.6%。
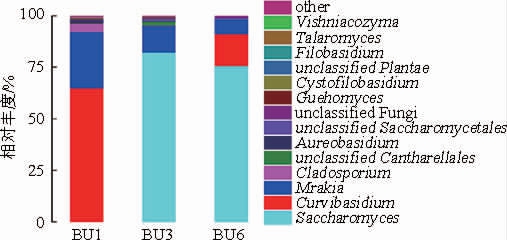
图3 基于属水平的样品真菌分布
Fig.3 Fungal community composition in samples at genus level
2.2 自然苹果酸乳酸发酵过程中的细菌多样性
酒精发酵结束后,离心除去真菌和酒渣,并于20~22 ℃开始自然苹果酸乳酸发酵(MLF)。MLF过程主要由降酸类的乳酸菌进行主导,将黑树莓酒中的苹果酸分解形成乳酸,解决酒体酸涩度过高的问题。黑树莓酒的MLF持续了31 d,在发酵的前期(第2天)、中期(第10天、第19天)和后期(第28天)分别取样,记为M2d、M10d、M19d和M28d,并进行多样性分析。由于MLF过程中细菌是优势菌,所以该发酵阶段重点关注细菌的多样性。
2.2.1 高通量测序结果
M2d、M10d、M19d和M28d不同发酵时期样品的稀释性曲线和Shannon指数分析结果见图4。由图4可知,随着测序深度的增加,OTU的数量随之增多,且样品的Shannon曲线都已经进入平台期阶段。结果表明,测序数量充足,并且能够反映出黑树莓酒MLF发酵过程当中绝大多数细菌的信息。
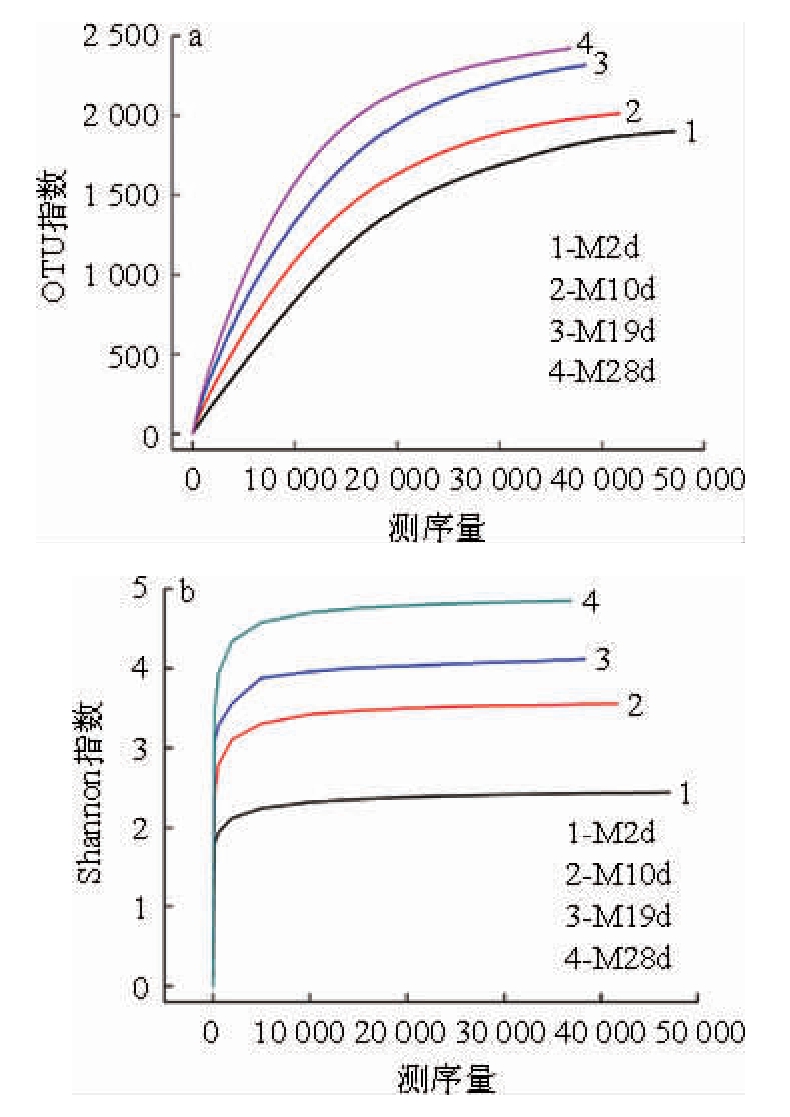
图4 自然苹果酸乳酸发酵过程中细菌的稀释性曲线(a)和Shannon指数(b)
Fig.4 Rarefaction curve (a) and Shannon index (b) of bacteria during spontaneous malolactic fermentation
2.2.2 细菌丰度和多样性分析
由图5可知,M2d、M10d、M19d和M28d组各获得47 089、41 714、38 345和36 881条有效序列。按照97%的相似度,样品中的OTU数目分别为1 900、2 012、2 315和2 420,其中221个OTU在所有样品中同时出现,454个OTU在样品M2d和M10d中同时出现,794个OTU在样品M10d和M19d中重复,976个OTU在样品M19d和M28d中同时出现。覆盖率范围为95%~97%之间,表明所测得的OTU能够反映样品的细菌组成。Shannon指数和Simpson指数结果一致,Shannon指数分别为2.44、3.56、4.12和4.85,Simpson指数分别为0.46、0.34、0.23和0.11,说明样品M28d的物种丰度明显高于样品M2d、M10d和M19d,可见随着发酵的进行细菌群落多样性逐渐上升,MLF发酵的第28天细菌群落结构最为复杂。
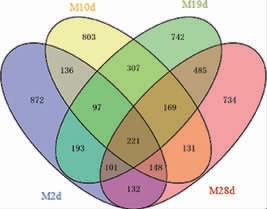
图5 自然苹果酸乳酸发酵过程中细菌OTU韦恩图
Fig.5 Venn diagram for bacterial OTU during spontaneous malolactic fermentation
由图6可知,在黑树莓自发进行的苹果酸-乳酸发酵过程中,在属的水平上,泛菌属(Pantoea)的相对丰度占绝对优势,酒球菌属(Oenococcus)、乳球菌属(Lactococcus)、酸土单胞菌属(Aciditerrimonas)和地芽孢杆菌属(Geobacillus)也占有较高的比例,而乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、短波单胞菌属(Brevundimonas)、消化链球菌(Peptostreptococcus)、不动杆菌属(Acinetobacter)和鞘氨醇杆菌属(Sphingobium)占有一定的比例。
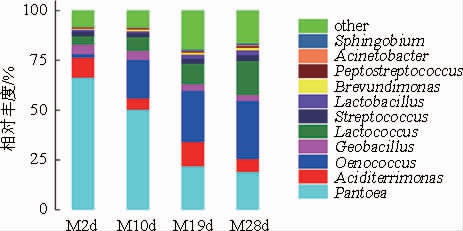
图6 基于属水平的样品细菌分布
Fig.6 Bacterial community composition in samples at genus level
在苹果酸-乳酸发酵初期(M2d),Pantoea(66.4%)占绝对优势,其次为Aciditerrimonas(10.1%)、Geobacillus(4.65%)和Lactococcus(4.44%)。发酵10 d时,Pantoea的相对丰度降低到50.28%,而Oenococcus的相对丰度则增加至19.4%,Lactococcus相对丰度上升为6.89%,而Geobacillus相对丰度(4.46%)变化不大。发酵19 d时,Pantoea含量进一步下降,相对丰度为21.84%;Oenococcus含量进一步增加,占比25.64%;Lactococcus也出现了小幅增长,相对丰度达到10.38%。进入发酵后期(M28d),Pantoea、Oenococcus和Lactococcus的相对丰度仍旧很高,占比分别达到18.94%、29.16%和17.11%,Aciditerrimonas含量较之发酵中期出现了下降,达到6.64%,而其他细菌包括Streptococcus、Brevundimonas、Peptostrep-tococcus、Sphingobium一直维持较低的丰度值,直至发酵结束,其总含量仍低于5%。
PINTO C等[15]研究发现,在葡萄酒苹果酸-乳酸发酵的起始、中间和终止阶段,泛菌属(Pantoea)的含量一般较高,与本研究结果一致。Oenococcus是完成苹果酸-乳酸发酵的重要菌属,一般具有优良的耐酸性,可将果酒中的苹果酸降解形成乳酸和CO2[25-26],从而降低果酒的酸度,产生其他代谢产物可增强果酒的风味,还可以增强酒中微生物的稳定性[27]。在自然发酵的果酒中,Lactococcus和Lactobacillus的检出率一般较高[28-29],本研究中Lactococcus的相对丰度一直维持在4.44%~17.11%,而Lactobacillus则含量较低,推测可能是黑树莓酒的高酸度环境抑制了乳杆菌生长,不利于其增殖[9,30]。
2.3 黑树莓酒理化指标分析
在酒精发酵以及苹果酸乳酸发酵完成之后,立即测定了黑树莓酒体的各项理化指标,结果见表1。由表1可知,AF完成后酒精度达到11.5%vol,还原糖质量浓度也已降低至2.2 g/L,说明树莓中天然存在的酿酒酵母能够有效的将糖类转化形成乙醇,完成酒精发酵。再者,较之树莓果实,AF完成后的酒体总酸含量出现了小幅下降,pH有小幅上升,说明自然AF也可以实现少量的生物降酸。
表1 黑树莓果实和黑树莓酒基本理化指标
Table 1 Basic physical and chemical indicators of black raspberry fruit and wine
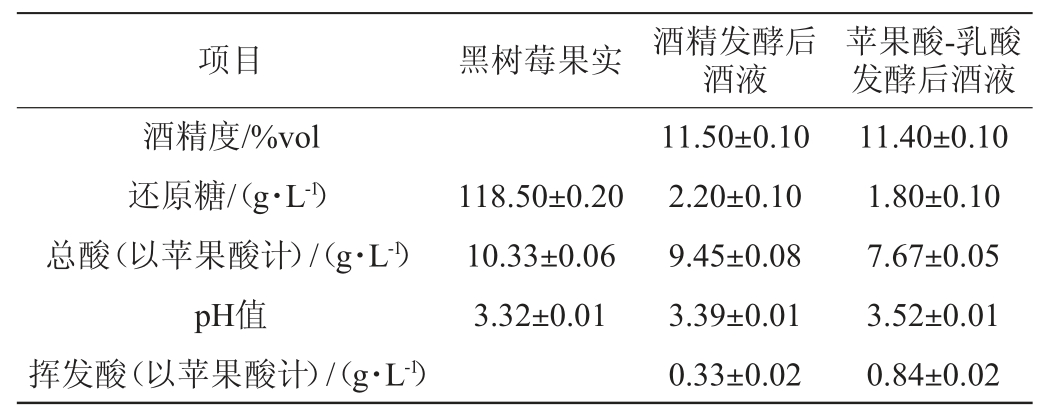
自然MLF后再次测定黑树莓酒的各项理化指标,结果显示,较之AF刚结束时,酒体的酒精度和还原糖含量未出现明显变化,但总酸含量下降明显,达到1.78 g/L,表明固有的乳酸菌发挥了其降酸功能,进而有效保障了MLF的顺利进行。此外,挥发酸含量有了明显提升,增幅达到0.51 g/L。依据国家标准GB 15038—2006《葡萄酒、果酒通用分析方法》中规定,酒体中挥发酸的质量浓度必须低于1.2 g/L,本实验的检测结果表明自然发酵的黑树莓酒挥发酸含量符合国标规定[31]。
3 结论
本研究应用高通量测序方法分析了自然发酵得到的黑树莓酒中微生物菌群多样性变化及其优势菌群演替过程。发酵过程主要分为自然酒精发酵和自然苹果酸发酵,前者主要测定真菌菌群多样性,后者主要测定细菌菌落组成。分析结果表明,在黑树莓酒自发的酒精发酵过程中,酿酒酵母(Saccharomyces cerevisiae)增殖最快,其在AF初期占比较低,但在中期和后期的相对丰度达到75%以上。在自发MLF过程中,泛菌属(Pantoea)、酒球菌属(Oenococcus)、乳球菌属(Lactococcus)等占有较高的比例,其中生长最旺盛的是Oenococcus,在发酵中期和后期的相对丰度均达到25%以上。自然发酵结束后测定黑树莓酒的各项理化指标,发现酒体成分符合国标要求,说明发酵成功。本实验中检测到的Oenococcus和Saccharomyces cerevisiae可能对黑树莓酒的发酵具有重要作用,后期可考虑对其进行针对性分离和筛选,以获得黑树莓酒发酵专用酿造菌株。
本研究结果对指导黑树莓酒生产、稳定酒的质量具有一定的理论指导和实践价值。在后续的探究中,可依据酒体中微生物菌群的演替情况,拟对发酵过程中的酒体理化指标和风味特征进行深入分析,为解释黑树莓酒的发酵机理提供理论支持。
[1] DJORDJEVIC′ R,GIBSON B,SANDELL M,et al.Raspberry wine fermentation with suspended and immobilized yeast cells of two strains of Saccharomyces cerevisiae[J].Yeast,2015,32(1):271-279.
[2]JAGTAP U B,BAPAT V A.Wines from fruits other than grapes:Current status and future prospectus[J].Food Biosci,2015,9:80-96.
[3]JUNG J,SON M Y,JUNG S,et al.Antioxidant properties of Korean black raspberry wines and their apoptotic effects on cancer cells[J].J Sci Food Agr,2009,89(6):970-977.
[4]ROMMEL A,WROLSTAD R E,HEATHERBELL D A.Blackberry juice and wine:processing and storage effects on anthocyan in composition,color and appearance[J].J Food Sci,1992,57(2):385-391.
[5]KIM B H,PARK S K.Volatile aroma and sensory analysis of black raspberry wines fermented by different yeast strains[J].J I Brewing,2015,121(1):87-94.
[6] KIM B H,PARK S K.Enhancement of volatile aromatic compounds in black raspberry wines via enzymatic treatment[J].J I Brewing,2017,123(2):277-283.
[7]LASIK-KURDYS′ M,MAJCHER M,NOWAK J.Effects of different techniques of malolactic fermentation induction on diacetyl metabolism and biosynthesis of selected aromatic esters in cool-climate grape wines[J].Molecules,2018,23(10):2549.
[8]RODRIGUEZ M E,LOPES C A,BARBAGELATA R J,et al.Influence of Candida pulcherrima Patagonian strain on alcoholic fermentation behaviour and wine aroma[J].Int J Food Microbiol,2010,138(1-2):19-25.
[9]SUN S Y,CHEN Z X,JIN C W.Combined influence of lactic acid bacteria starter and final pH on the induction of malolactic fermentation and quality of cherry wines[J].LWT-Food Sci Technol,2018,89(Supplement C):449-456.
[10]WANG P,LI A,SUN H,et al.Selection and characterization of Oenococcus oeni strains for use as new malolactic fermentation starter cultures[J].Ann Microbiol,2016,66(3):1285-1292.
[11]SUN S Y,GONG H S,LIU W L,et al.Application and validation of autochthonous Lactobacillus plantarum starter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiol,2016,55(5):16-24.
[12]SUN S Y,JIANG W G,ZHAO Y P.Evaluation of different Saccharomyces cerevisiae strains on the profile of volatile compounds and polyphenols in cherry wines[J].Food Chem,2011,127(2):547-555.
[13]张晓蒙,李德美,金玮鋆,等.西藏青稞酒酿造小曲微生物多样性分析[J].中国酿造,2018,37(9):28-33.
[14]阴芳冉.红树莓自然发酵过程中生物活性研究与微生物多样性分析[D].保定:河北农业大学,2019.
[15] PINTO C,PINHO D,CARDOSO R,et al.Wine fermentation microbiome:a landscape from different Portuguese wine appellations[J].Front Microbiol,2015,6:905-905.
[16]姜东琪,张云舒,武晓玮,等.酿酒酵母对樱桃酒挥发性组分及感官品质的影响[J].中国酿造,2019,38(8):94-99.
[17]李华敏,孙舒扬,黄萍萍,等.戴尔有孢圆酵母WA19 与酿酒酵母F33混合发酵在樱桃酒酿造中的应用[J].食品科学,2018,39(24):130-137.
[18]LU Y Y,CHUA J Y,HUANG D J,et al.Biotransformation of chemical constituents of durian wine with simultaneous alcoholic fermentation by Torulaspora delbrueckii and malolactic fermentation by Oenococcus oeni[J].Appl Microbiol Biot,2016,100(20):8877-8888.
[19]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[20]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):357-364.
[21] BOURRET T B,EDWARDS C G,HENICK-KLING T,et al. Curvibasidium rogersii,a new yeast species in the Microbotryomycetes[J].N Am Fungi,2012,7(12):1-8.
[22] TIQUIA-ARASHIRO S M,GRUBE M.Fungi in extreme environments:Ecological role and biotechnological significance[M].Germany:Springer,2019:145-156.
[23]DEL CARMEN PORTILLO M,MAS A.Analysis of microbial diversity and dynamics during wine fermentation of Grenache grape variety by highthroughput barcoding sequencing[J].LWT-Food Sci Technol,2016,72:317-321.
[24]BONCIANI T,SOLIERI L,DE VERO L,et al.Improved wine yeasts by direct mating and selection under stressful fermentative conditions[J].Eur Food Res Technol,2016,242(6):899-910.
[25]FIA G,MILLARINI V,GRANCHI L,et al.Beta-glucosidase and esterase activity from Oenococcus oeni:Screening and evaluation during malolactic fermentation in harsh conditions[J].LWT-Food Sci Technol,2018,89:262-268.
[26] FRANQU S J,ARAQUE I,PALAH E,et al.Presence of Oenococcus oeni and other lactic acid bacteria in grapes and wines from Priorat(Catalonia,Spain)[J].LWT-Food Sci Technol,2017,81:326-334.
[27]孙炜宁,张巧格,李兴兴,等.葡萄酒酿造过程中微生物多样性的研究现状[J].食品研究与开发,2014,35(18):365-368.
[28] LI H M,JIANG D Q,DAI Z G,et al.Aromatic property of cherry wine produced by malolactic fermentation of controlled and spontaneous on the bacterial evolution[J].Int J Food Prop,2019,22(1):1270-1282.
[29] BERBEGAL C,BORRUSO L,FRAGASSO M,et al.A metagenomicbased approach for the characterization of bacterial diversity associated with spontaneous malolactic fermentations in wine[J].Int J Mol Sci,2019,20(16):3980.
[30] DEVI A,ANU-APPAIAH K A.Diverse physiological and metabolic adaptations by Lactobacillus plantarum and Oenococcus oeni in response to the phenolic stress during wine fermentation[J].Food Chem,2018,268:101-109.
[31]中华人民共和国国家质量监督检验检疫总局.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.