中国白酒历史悠久、工艺独特、香型多样[1-3],且香型明显的地域特征本质上都是当地自然条件与物质条件在酿酒过程中的综合反映[4]。仰韶地处中原,独特的自然环境和微生态体系,造就了陶融型白酒“醹、雅、融”的风格特点[5]。近年来,随着对中国白酒科研的深入发展,酿酒功能微生物已成为科研人员的研究重点,其中对芽孢杆菌的相关研究被多次报道[6-9]。
芽孢杆菌是中国白酒酿造过程中的重要功能微生物,其繁殖代谢过程中能分泌白酒酿造中所需的酯化酶、蛋白酶等相关酶系,从而使酿酒原料在白酒酿造过程中产生种类众多的风味物质[10-11],这些物质对不同香型白酒的典型风格特点起着关键作用[12-14]。因此,筛选并应用具有优良性能的芽孢杆菌,对于构建白酒微生物菌种资源库及实现名优酒企异地复建具有重要意义[10,15]。王西等[16]从酱香型高温大曲中筛选到一株高产四甲基吡嗪的枯草芽孢杆菌(Bacillus subtilis);钟姝霞等[17]从酱香型酒醅中筛选到5株性能独特的芽孢杆菌;吴树坤等[7]从沉香型酒醅中筛选到4株具有产香功能的芽孢杆菌;王霜等[3]从浓酱兼香型酒醅中筛选到2株具有高碱性蛋白酶活力,且对乙醇具有高耐受性的芽孢杆菌;但目前对陶融型酒醅中产香芽孢杆菌的相关研究尚未见报道。
本研究以陶融型酒醅为研究对象,利用传统微生物筛菌方法,对出窖酒醅中的芽孢杆菌进行分离纯化[18],同时进行固态发酵产香试验,采用顶空固相微萃取-气相色谱-质谱(headspace solid-phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)[19-20]对香味成分突出的发酵产物进行分析,并对其相应的菌株进行形态学、生理生化特征分析和16S rDNA基因序列鉴定[21]、耐受性分析,为探寻功能微生物与陶融型白酒风味成分之间的内在关联,找到产香性能独特、突出的芽孢杆菌,进一步优化陶融型白酒酿造功能菌群,提高陶融型白酒品质奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 酒醅样品
酒醅样品采集于河南仰韶酒业有限公司,对不同车间、不同窖池的出窖酒醅进行取样,将取样窖池分为上、中、下3层进行,将3层酒醅样品混合均匀作为一个分析样品,冰盒运回,-20 ℃保藏备用。
1.1.2 培养基
营养琼脂培养基:北京奥博星生物技术有限责任公司。
种子培养基[12]:葡萄糖15 g/L,胰蛋白胨5 g/L,牛肉浸粉5 g/L,NaCl 5 g/L,纳他霉素1 g/L,pH 7.0,121 ℃灭菌20 min。
高粱小麦固体培养基[21]:取100 g高粱和100 g小麦,经适度粉碎充分混匀,加入总质量37%的蒸馏水,121 ℃灭菌20 min。
1.1.3 试剂
DL2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:大连宝生物工程有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、BioSpin试剂盒:西安热摩尔公司;T-19载体、大肠杆菌(Escherichia coli)DH5α感受态细胞:日本TAKARA公司;DNA快速抽提试剂盒、葡萄糖、NaCl、胰蛋白胨、牛肉浸粉、琼脂粉、淀粉、明胶、纤维素、麦芽糖、棉子糖、半乳糖、木糖、阿拉伯糖:上海生物工程股份有限公司。所有试剂均为分析纯或生化试剂。
1.2 仪器与设备
LDZM-80KCS-Ⅱ型立式压力蒸汽灭菌器:上海申安医疗器械厂;HH-4型数显恒温水浴锅:常州普天仪器制造有限公司;DHG-9123A型电热鼓风干燥箱、DHP 9272型电热恒温培养箱:上海一恒科学仪器有限公司;SW-CJ-VS2型超净工作台:无锡易纯净化设备有限公司;VEGA 3 SBU型扫描电子显微镜:德国NETZSCH公司;TGL-20M高速冷冻离心机:上海卢湘仪离心机仪器有限公司;K960PCR热循环仪:杭州晶格科学仪器有限公司;DYY-6C型电泳仪、WD-9403C型紫外仪:北京六一生物科技有限公司;Trace1310-ISQ气相色谱-质谱联用仪:美国Thermo Fishier公司。
1.3 试验方法
1.3.1 酒醅中芽孢杆菌的分离及纯化[22-23]
准确称取10g酒醅样品,无菌操作下迅速倒入装有90mL无菌生理盐水的三角瓶中,充分摇匀,80 ℃水浴60 min,然后逐级稀释至10-5。取10-3、10-4、10-5三个梯度的菌悬液分别涂布在营养琼脂培养基上,37 ℃培养24 h。待长出菌落后,挑选芽孢杆菌单菌落进行划线分离、纯化,试管斜面4 ℃保藏。
1.3.2 产香芽孢杆菌的筛选
将纯化的芽孢杆菌分别接入种子培养基中,37 ℃条件下培养18 h,调节种子液浓度至108 CFU/mL,按5%的接种量接种于高粱小麦固体培养基中,装料量为130 g/500 mL,37 ℃条件下培养7 d[12]。由5名国家级白酒评委和5名省级白酒评委组成评价小组,对各菌株的发酵产物进行感官评价[12,17],并采用HS-SPME-GC-MS对香味突出的发酵产物中的挥发性成分进行检测[17]。具体方法如下:
顶空固相微萃取条件:精确称取3.0 g发酵产物于20 mL顶空瓶中,60 ℃孵化10 min,萃取40 min;进样口温度设为260 ℃,解吸2 min后自动进样,进行GC-MS分析。
气相色谱条件:DB-FFAP毛细管色谱柱(60 m×250 μm×0.25 μm);260 ℃条件下自动不分流进样;升温程序为35 ℃保持3 min,5 ℃/min升至100 ℃、保持3 min,5 ℃/min升至150 ℃、保持3 min,10 ℃/min升至230 ℃、保持3 min;载气为高纯度氦气(He),流速为1.00 mL/min。
质谱条件:电子电离源(electron ionization,EI),电子能量70 eV,传输线温度280 ℃,离子源温度300 ℃,扫描范围30~550 u。
定性半定量:将芽孢杆菌固态发酵产物的挥发性风味物质质谱图与美国国家标准与技术研究院(national institute of standards and technology,NIST)05a.L标准谱库进行对比鉴定,匹配度>800的鉴定结果予以确认。以薄荷醇(2.5 μg/g)为内标进行半定量。
1.3.3 菌株鉴定
(1)形态观察
对筛选得到的菌株的菌落形态、革兰氏染色结果等进行观察记录;同时,对其菌体形态进行电镜观察,并根据《伯杰细菌鉴定手册》[24]完成形态学鉴定。
(2)生理生化试验
针对芽孢杆菌菌种特性,设计明胶液化、碳源利用、淀粉水解、硝酸盐还原和纤维素分解等生理生化试验[25],进行观察和记录。
(3)分子生物学鉴定
采用引物799F(5'-AACAGGATTAGATACCCT-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对筛选得到的菌株进行16S rDNA分子生物学鉴定[26-27]。将PCR扩增产物委托上海杰李生物技术有限公司进行测序,所得序列提交至美国国立生物技术信息中心(nationalcenter for biotechnology information,NCBI)的GenBank数据库中进行BLAST比对检索[28-29],利用MEGA 7.0.26软件中的邻接(neighbor-joining,NJ)法构建系统发育树[30-31]。
1.3.4 菌株耐受性分析
将产香芽孢杆菌接种于营养琼脂培养基中,于不同温度(40 ℃、45 ℃、50 ℃、53 ℃、55 ℃)下进行培养,观察菌落生长状况,检测其对温度的耐受性。
将产香芽孢杆菌分别接种于不同酒精度(1%vol、2%vol、4%vol、6%vol、8%vol)、pH值(5.5、6.0、6.5、7.0、7.5)、NaCl含量(2%、4%、6%、8%、10%)的营养琼脂培养基中,于37 ℃条件下恒温培养,检测其对酒精度、pH值、NaCl的耐受性。
2 结果与分析
2.1 陶融型酒醅中芽孢杆菌分离结果
将分离到的菌株菌落,通过多次划线纯化,最终从陶融型酒醅中共分离得到11株芽孢杆菌,编号为YSB01~YSB11。
2.2 芽孢杆菌固态产香试验结果
11株芽孢杆菌固态发酵产物的感官评价结果见表1。
表1 11株芽孢杆菌固态发酵产物的感官评价结果
Table 1 Sensory evaluation results of solid-state fermentation products of 11 strains of Bacillus sp.
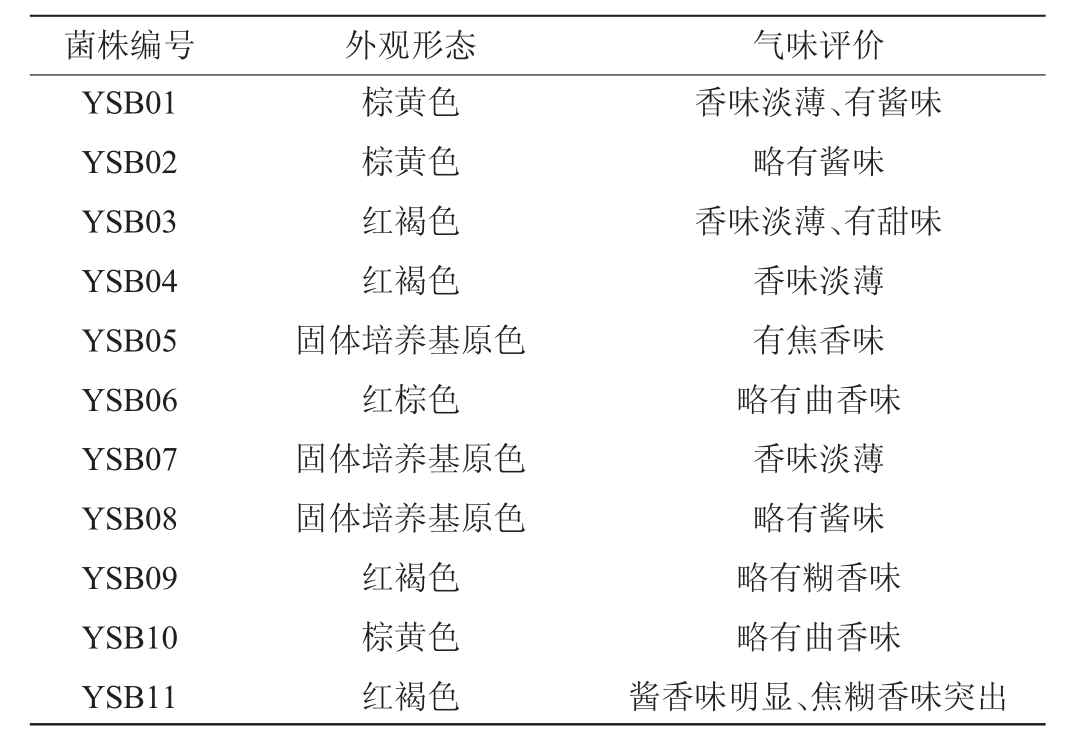
由表1可知,11株芽孢杆菌固态发酵产物的感官特征各异,其中菌株YSB11经过37 ℃发酵7 d后,菌体在培养基上长势良好,培养基呈红褐色,其发酵产物具有浓郁的焦糊香味和酱香味,其他菌株发酵产物虽有香味,但香味均不突出。综合评定,菌株YSB11可作为本次筛选的目标菌株。进一步采用HS-SPME-GC-MS对菌株YSB11固态发酵产物的挥发性成分进行分析,结果见图1及表2。
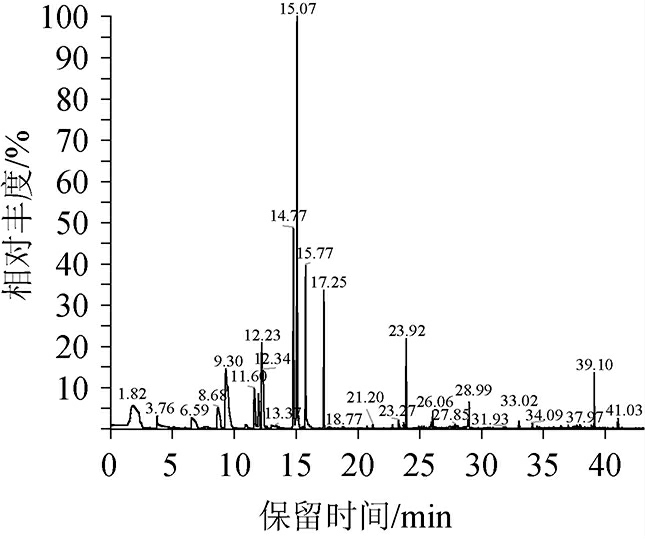
图1 菌株YSB11固态发酵产物挥发性物质分析GC-MS总离子流色谱图
Fig.1 Total ion chromatogram of volatile substances in the solid-state fermentation products by strain YSB11 analyzed by GC-MS
表2 菌株YSB11固态发酵产物挥发性物质测定结果
Table 2 Determination results of volatile substances in the solid-state fermentation products by strain YSB11
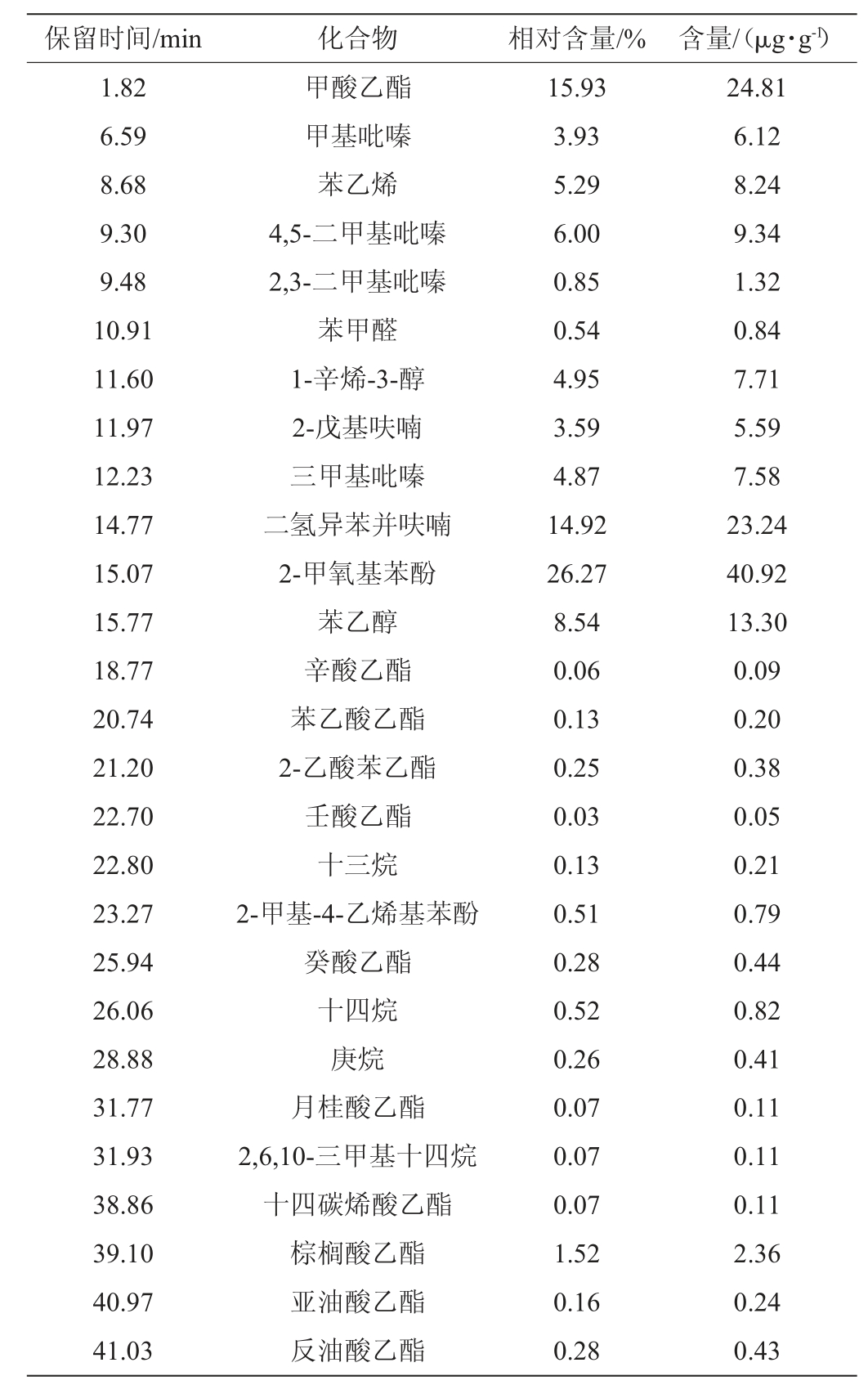
由表2可知,通过HS-SPMEP-GC-MS从菌株YSB11固态发酵产物中共检测到28种微量挥发性风味成分,含量最高的化合物为酚类物质,且以2-甲氧基苯酚为主,占26.27%,酚类化合物呈香阈值低,是酒体中水果香、辛香、丁香等风味的重要来源[32];吡嗪类化合物共检测到4种,占15.11%,这类化合物香味阈值低、香势强,具有烘焙和坚果的香气,赋予酒体醹雅、柔顺的风格[33];呋喃类化合物检测到2种,占18.51%,呋喃类是白酒中的重要风味化合物,主要贡献甜香、焙烤香和青草香等香气[12,17];芳香族化合物检测到3种,其中苯乙醇含量占8.54%,苯乙醇具有香味突出、香势强、阈值低、风味优雅等特点[34];酯类物质检测到11种,占18.78%,酯类物质是构成中国白酒特有口感的重要呈香呈味化合物。
综上所述,酵母菌株YSB11具有产酚类、吡嗪类、呋喃类、苯乙醇、酯类等多种香味物质的能力,这些物质对陶融型白酒的风味成分具有重要贡献作用,因此,可认定菌株YSB11为陶融型白酒的一株重要产香功能菌。
2.3 菌株YSB11的鉴定
2.3.1 形态观察
将菌株YSB11划线接种于营养琼脂培养基,37 ℃恒温培养48 h,其菌落及细胞形态见图2。
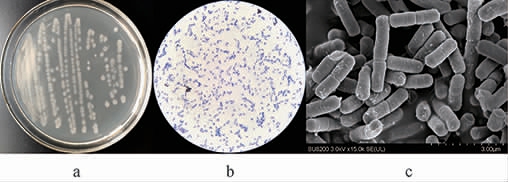
图2 菌株YSB11的菌落(a)及细胞形态(b、c)
Fig.2 Colony (a) and cell (b,c) morphology of strain YSB11
由图2可知,菌株YSB11在营养琼脂培养基上的菌落直径为2~3 mm,浅白色,菌落边缘呈锯齿状、正反面颜色一致、较干燥、无黏性、易挑取,革兰氏染色呈蓝紫色,即革兰氏阳性菌,细胞体呈棒状。
2.3.2 生理生化试验
菌株YSB11的生理生化试验结果见表3。
表3 菌株YSB11的生理生化试验结果
Table 3 Results of physiological and biochemical tests of strain YSB11
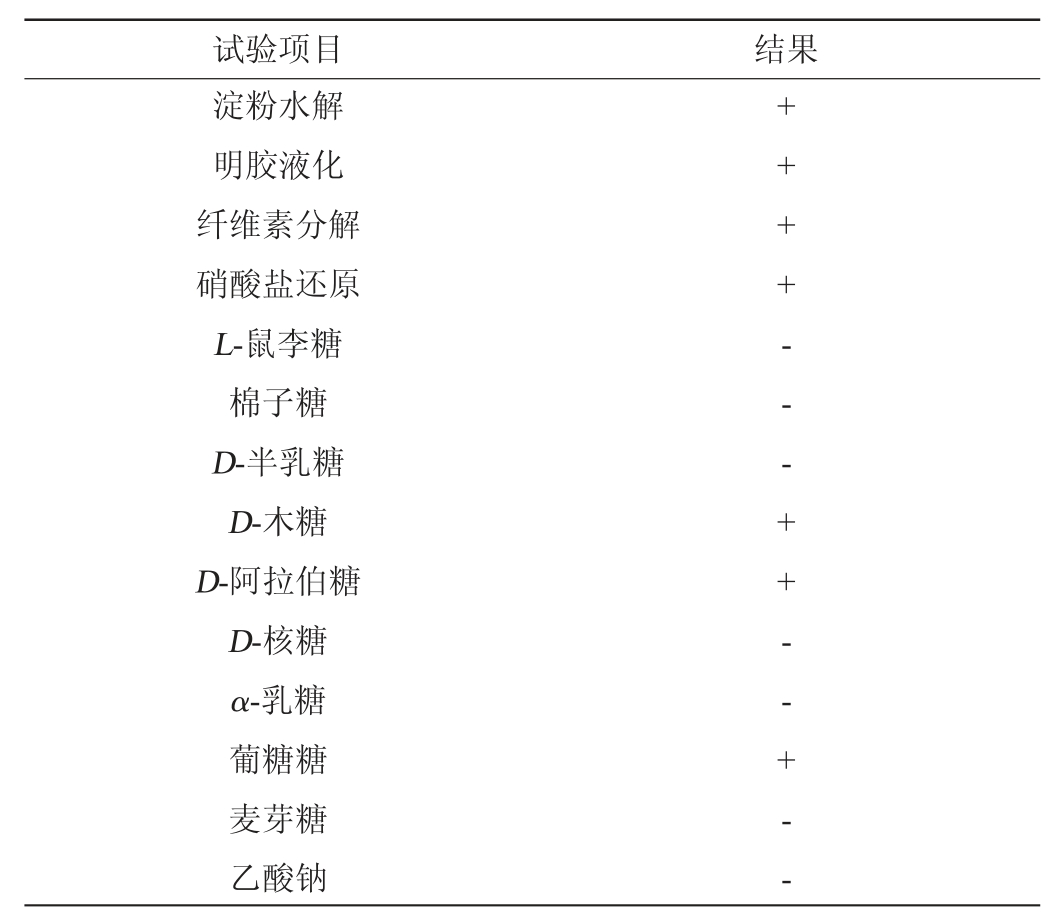
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
由表3可知,菌株YSB11具有淀粉水解、明胶液化、硝酸盐还原能力,同时具有利用纤维素、D-木糖、D-阿拉伯糖、葡萄糖4种碳源进行生长代谢能力。结合形态观察结果,根据《伯杰细菌鉴定手册》[24],初步判定菌株YSB11为芽孢杆菌属(Bacillus sp.)。
2.3.3 分子生物学鉴定结果
将菌株YSB11的16S rDNA PCR扩增产物测序结果提交至GenBank数据库中进行Blast搜索比对发现,菌株YSB11与贝莱斯芽孢杆菌(Bacillus velezensis)MH370470.1的16S rDNA序列相似性为100%。选取同源性较高的模式菌株的16S rDNA序列,利用MEGA 7.0.26软件中的NJ法构建菌株YSB11的系统发育树,结果见图3。

图3 基于16S rDNA序列菌株YSB11的系统发育树
Fig.3 Phylogenetic tree of strain YSB11 based on 16S rDNA sequences
由图3可知,菌株YSB11与贝莱斯芽孢杆菌(Bacillus velezensis)MH370470.1聚于一支,亲缘关系最近。结合菌株YSB11的形态观察、生理生化试验结果,鉴定菌株YSB11为贝莱斯芽孢杆菌(Bacillus velezensiss)。
2.4 菌株YSB11的耐受性试验结果
对白酒酿造过程中产香芽孢杆菌及其耐受性进行研究,有助于认识白酒生产过程中产香微生物对原料的作用机制,对进一步认识陶融型白酒生产过程中淀粉、蛋白质等大分子物质的生化代谢及特征风味物质的形成机理有着至关重要的指导意义。菌株YSB11对温度、酒精度、NaCl含量及pH值的耐受性结果见表4。
表4 菌株YSB11耐受性试验结果
Table 4 Tolerance tests results of strain YSB11

注:“+”表示能生长,“-”表示不能生长。
由表4可知,菌株YSB11的最高耐受温度为53 ℃,说明在相对高温的条件下也可进行正常生长代谢,耐高温菌株是大曲生产和白酒酿造过程中的关键微生物之一;菌株YSB11对NaCl含量的最大耐受度为8%,对最低pH值的耐受度为6.0,对乙醇的最高耐受度为6%vol,说明菌株YSB11在白酒酿造末期极端环境下仍具有极强的生存能力,可继续代谢产香。
3 结论
本研究从陶融型酒醅中共分离纯化得到11株产香芽孢杆菌,经固态产香试验筛选发现,菌株YSB11的固态发酵产物具有浓郁的焦香、糊香和酱香味,通过HS-SPME-GC-MS分析发现,菌株YSB11固态发酵产物中风味物质种类丰富,包含酚类、吡嗪类、呋喃类、芳香类、酯类等多种白酒中重要呈香物质,这些物质在陶融型白酒风味物质的组成中占有重要地位。通过形态观察、生理生化试验及分子生物学技术,鉴定菌株YSB11为贝莱斯芽孢杆菌(Bacillus velezensiss)。菌株YSB11具有较好的耐受性,可耐高温53 ℃、酒精度6%vol、NaCl含量8%及低pH值6.0。
[1]韩素娜,牛姣,侯建光.陶香型白酒与其他香型白酒差异分析[J].酿酒科技,2017(1):62-64.
[2]张治刚,张彪,赵书民,等.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[3]王霜,缪礼鸿,张明春,等.浓酱兼香型酒醅中产酱香芽孢杆菌的筛选及发酵风味成分分析[J].中国酿造,2017,36(10):61-65.
[4]陈蒙恩,樊建辉,侯建光.陶融型白酒酿造工艺优化研究[J].酿酒科技,2017(10):35-41.
[5]樊建辉,侯建光,郭福祥,等.仰韶陶融型白酒大曲可培养微生物多样性研究[J].中国酿造,2017,36(7):71-75.
[6]邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[7]吴树坤,杨磊,杨玲麟,等.沉香型酒醅中产香芽孢杆菌的分离鉴定及代谢产物分析[J].中国酿造,2018,37(1):35-40.
[8]陈漫.浓香型白酒功能曲品控标准及工艺影响因素的研究[D].北京:中国矿业大学,2016.
[9] YAO S,XU Y,XIN C,et al.Genome sequence of thermoactinomyces Daqus H-18,a novel thermophilic species isolated from high-temperature Daqu[J].Genome Announc,2015,3(1):01394-01414.
[10]陈蒙恩,樊建辉,侯建光,等.陶融型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2017,33(9):122-127.
[11]满都拉,郑逸飞,孙子羽,等.不同地区大曲中可培养细菌的分离与鉴定[J].食品研究与开发,2019,40(11):189-193.
[12]张宿义,许德富.泸型酒技艺大全[M].北京:中国轻工业出版社,2011.
[13] CHEN S,XU Y.The influence of yeast strains on the volatile flavour compounds of Chinese rice wine[J].J I Brewing,2010,116(2):190-196.
[14]YAO S,LIU Y,LI H,et al.Bacterial communities during the process of high-temperature Daqu production of roasted sesame-like flavour liquor[J].J I Brewing,2015,121(3):440-448.
[15]明红梅,郭志,周健,等.浓香型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2015,31(4):186-191.
[16]王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-74.
[17]钟姝霞,邓杰,汪文鹏,等.酱香型酒醅产香芽孢杆菌的分离鉴定及其代谢产物分析[J].现代食品科技,2017,33(4):89-95.
[18]周静,黄晓辉,肖冰梅,等.一株多功能芽孢杆菌的鉴定[J].中国微生态学杂志,2013,25(9):997-1000.
[19]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Litt Appl Microbiol,2013,57(1):11-18.
[20] FAN W L,SHEN H Y,XU Y.Quantification of volatile compounds in Chinese soy sauce aroma type liquor by stir bar sorptive extraction and gas chromatography-mass spectrometry[J].J Sci Food Agr,2011,91(7):1187-1198.
[21]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[22]赵长青,徐莎,杨阳,等.浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选[J].食品工业科技,2017,38(7):151-155.
[23]杨斌,周健,明红梅.浓香型大曲中1 株高发酵力芽孢杆菌的筛选和鉴定[J].酿酒科技,2018(5):17-28.
[24]BUKANNAN R E.伯杰细菌鉴定手册[M].8 版.北京:科学出版社,1984:1183-1207.
[25]刘洋,赵婷,姚粟,等.一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J].生物技术通报,2012(10):210-216.
[26]AO X,ZHANG X,ZHANG X,et al.Identification of lactic acid bacteria in traditional fermented yak milk and evaluation of their application in fermented milk products[J].J Dairy Sci,2012,95(3):1073-1084.
[27]WANG L T,LEE F L,TAI C J,et al.Comparison of gyrB gene sequences,16S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J].Int J Syst Evol Microbiol,2007,57(8):1846-1850.
[28] YOON S H,HA S M,KWON S,et al.Introducing EzBioCloud:a taxonomically united database of 16S rRNA gene sequences and wholegenome assemblies[J].Int J Syst Evol Microbiol,2017,67:1613-1617.
[29] CHUN J,LEE J H,JUNG Y,et al.EzTaxon:a webbased tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].Int J Syst Evol Microbiol,2007,57(10):2259-2261.
[30] TAMURA K,DUDLEY J,NEI M,et al.MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[31]KUMAR S,STECHER G,TAMURA K MEGA.Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Mol Biol Evol,2016,33(7):1870-1874.
[32] MO X L,XU Y.Ferulic acid release and 4-vinylguaiacol formation during Chinese rice wine brewing and fermentation[J].J I Brewing,2010,116(3):304-311.
[33] SHU K,SAKAI R,KUMAZAWA K,et al.Key aroma compounds in roasted in-shell peanuts[J].Biosci Biotechnol Biochem,2013,77(7):1467-1473.
[34] FAN W L,XU Y,ZHANG Y.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.