马克斯克鲁维酵母(Kluyveromyces marxianus)是一种能够利用乳糖进行生长的酵母,因此该酵母一般能够从乳源中分离出来[1-2]。马克斯克鲁维酵母不仅生长迅速、耐热性高、底物谱广以及能产生多种酶[3-6],而且具有通常被认为是安全的(generally recognized as safe,GRAS)的认证地位[1]。2013年该酵母被中国国家卫生和计划生育委员会批准为新食品原料[7-8]。由于马克斯克鲁维酵母具有以上这些特性,并且该酵母在某些营养特性方面与酿酒酵母类似[9],因此有望代替酿酒酵母利用廉价废弃物进行食品工业的生产。这就有必要对其生长特性进行深入研究。
Crabtree效应是指即使是在有氧条件下,较高的糖浓度也会使酵母细胞由呼吸型向发酵型(产乙醇)转变,也就是高速同化葡萄糖而引起的好氧呼吸阻遏作用[10]。Crabtree效应不利于酵母细胞进行有氧呼吸,会影响细胞的生长,并且乙醇对酵母菌的生长有较大的抑制作用[11]。值得注意的是,虽然马克斯克鲁维酵母被归类为Crabtree阴性菌株[12-13]。但是有报道指出该酵母确实携带有通过发酵生产乙醇所必需的基因[1],且具有良好的乙醇发酵能力[8,14]。王亮等[15]通过试验表明,当培养基中糖质量浓度>65 g/L时,马克斯克鲁维酵母的生长就会受到抑制,因此推测酵母可能受到Crabtree效应的影响。如此看来,文献中关于马克斯克鲁维酵母的Crabtree效应的报道不一致。因此有必要针对该情况对酵母的生理学特性进行研究。
本研究采用摇瓶分批培养和发酵罐分批培养从6株马克斯克鲁维酵母中筛选出一株生长能力较好的菌株。并进一步研究该菌株的生长和生理特性。在此基础上选择合适的补料策略对酵母进行补料分批培养以实现细胞的大量积累,对马克斯克鲁维酵母的产业化具有一定指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
马克斯克鲁维酵母(Kluyveromyces marxianus)A#、B#、C#、D#、E#、F#:由安琪酵母菌种保藏中心提供。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YEPD)培养基[16]:葡萄糖2%,酵母膏1%,蛋白胨1%。115 ℃灭菌20 min。
分批发酵培养基:葡萄糖6%,酵母浸粉1.2%,(NH4)2SO4 0.2%,KH2PO40.3%,MgSO40.03%。pH5.5,115℃灭菌20min。
1.2 仪器与设备
FUS-50 L型新概念发酵罐:上海国强生化工程装备有限公司;PAS7000型生物尾气分析仪:重庆哈特曼科技有限公司;ZHWY-211D脚踏开门型大容量全温度恒温摇床:上海智城生物科技有限公司。
1.3 方法
1.3.1 菌株活化及种子液制备
将保藏于甘油管的马克斯克鲁维酵母菌株接入装液量为20 mL/250 mL YEPD培养基中进行初次复壮,30 ℃、160 r/min条件下[15]培养20 h。再将初次复壮后的菌液接入分批发酵培养基作种子液。接种量10%,30 ℃、160 r/min条件下培养10 h。若是种子液用量较大,如用于发酵罐上的研究,则按相同的培养条件进行适当扩培。
1.3.2 摇瓶筛选试验
按10%的接种量分别将6株马克斯克鲁维酵母的种子液接入装液量为45 mL/250 mL分批发酵培养基中进行摇瓶分批培养,在30 ℃、160 r/min条件下培养18 h[15]。培养结束后测定细胞干质量(g/L),以细胞干质量为指标筛选出生长能力较好的菌株用于后续试验。
1.3.3 在3 L发酵罐中的分批培养
将酵母种子液按10%接种量接入装有1.8 L分批发酵培养基的3 L发酵罐中进行分批培养,培养条件为温度30 ℃,空气流量6 L/h,搅拌转速300 r/min。从0 h开始,每隔1 h取样,离线测定细胞干质量X、比生长速率μ、发酵液糖浓度和pH,直至细胞生长达稳定期。将各指标进行整理分析,以研究菌株在3 L发酵罐中的分批培养过程。其中比生长速率μ的计算公式如下:
式中:μ为细胞比生长速率,h-1;X为细胞干质量,g/L;t为培养
时间,h;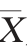 为两个时间点的细胞干质量的平均值,g/L。
为两个时间点的细胞干质量的平均值,g/L。
1.3.4 在50 L发酵罐中的分批培养
将酵母种子液按10%接种量接入装有18 L分批发酵培养基的50 L发酵罐中进行分批培养,培养条件为温度30 ℃,转速350 r/min[21],空气流量50 L/min,罐压0.045 MPa。从0 h开始,每隔1 h取样,离线测定细胞干质量、比生长速率、残糖、酒精含量,并利用发酵罐配备的pH电极、溶氧电极和尾气分析仪在线监测发酵液pH、溶氧水平、二氧化碳释放速率(carbon-dioxide escape rate,CER)、氧气摄取速率(oxygen uptake rate,OUR)和呼吸商(respiratory quotient,RQ),直至细胞生长达稳定期。将各指标进行整理分析,以研究菌株在50 L发酵罐的分批培养过程。
1.3.5 马克斯克鲁维酵母的补料分批培养
将酵母种子液按10%接种量接入装有18 L无菌蒸馏水(培养底水)的50 L发酵罐中进行补料分批培养。结合分批培养研究结果,采用合适的补料策略,流加糖蜜(27.5%)、氨水(16.5%)和磷酸二氢铵(10%)。培养温度30 ℃,初始发酵液pH值为5.0,初始搅拌转速200 r/min,空气流量恒定为50 L/min,罐压恒定为0.045 MPa。当发酵液体积达发酵罐的工作体积时结束发酵。对发酵液进行离心,对菌体进行洗涤并收集。测定菌体细胞的蛋白质、核糖核酸(ribonucleic acid,RNA)、海藻糖、灰分和各氨基酸等组分含量。
1.3.6 分析检测
细胞干质量测定采用质量法[16]。酒精含量的测定采用马丁仪滴定法[17]。采用生物传感器测定发酵液中糖浓度。CER、OUR和RQ等由Biostar 1.5在线分析控制系统计算。相关细胞组分的测定委托安琪酵母检测中心。
2 结果与分析
2.1 马克斯克鲁维酵母的摇瓶分批培养结果
六株马克斯克鲁维酵母在相同培养条件下的摇瓶生长情况,结果见图1。
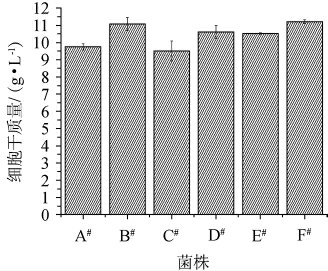
图1 6株马克斯克鲁维酵母菌株在摇瓶中的分批培养情况
Fig.1 Situation of batch culture of 6 strains of Kluyveromyces marxianus in shake flask
由图1可知,F#菌株的细胞干质量最高,可达(11.21±0.18)g/L。其次是B#菌株,其细胞干质量为(11.08±0.38)g/L。而A#和C#菌株的细胞干质量较低,分别为(9.75±0.18)g/L和(9.51±0.58)g/L。结果表明,菌株B#和F#生长情况较好,因此后续试验是采用3 L发酵罐对这两株菌株进行分批培养,研究其培养过程,比较两株菌的生长情况。
2.2 两株马克斯克鲁维酵母在3 L发酵罐中的分批培养过程对比
按1.3.3节方法对马克斯克鲁维酵母B#菌株和F#菌株进行分批培养,培养过程各指标变化结果见图2。
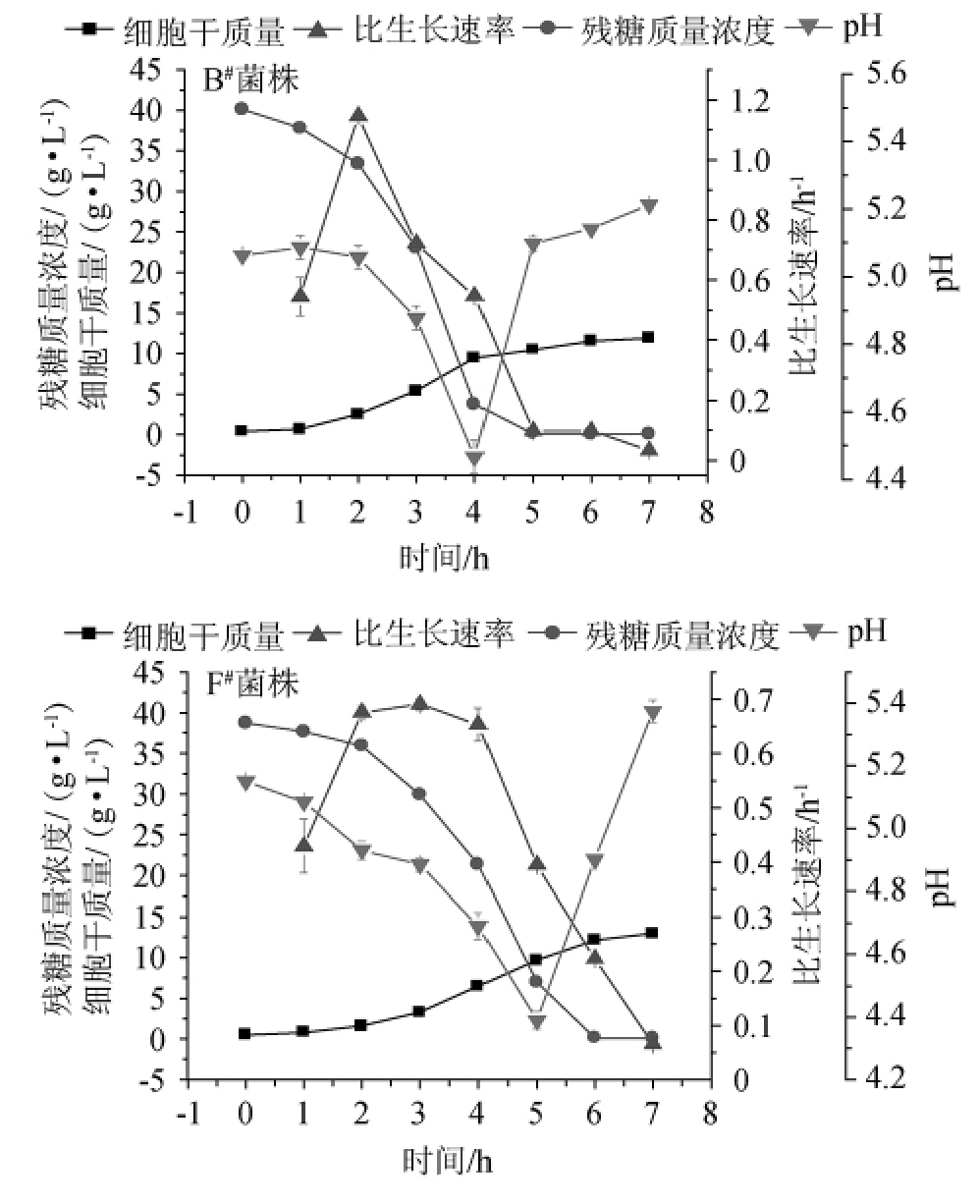
图2 菌株B#与F#在3 L发酵罐上的分批培养过程曲线
Fig.2 Batch culture process curve of strains B#and F#in 3 L fermenter
由图2可知,在分批培养过程中,B#菌株的比生长速率(μ)在2 h时达到最大,为1.15±0.01,而F#菌株的比生长速率(μ)是在3 h时达到最大,为0.69±0.04。但是在随后的培养中,由于B#菌株细胞积累较慢,其μ值急剧下降,而F#菌株细胞积累较快,其μ值呈现缓慢下降的趋势。B#菌株的耗糖速度比F#菌株快,当糖浓度处于较低水平时,发酵液pH开始回弹。菌株F#最终的细胞干质量为(12.96±0.03)g/L,高于菌株B#(11.93±0.04)g/L。因此,菌株F#相比菌株B#在生长方面更具优势,采用菌株F#进行后续试验。
2.3 马克斯克鲁维酵母在分批培养过程中的生长特性研究
采用带有尾气分析仪的50 L发酵罐按1.3.4节方法对马克斯克鲁维酵母F#菌株进行分批培养,其培养过程各指标的变化见图3。
由图3A可知,随着培养时间的延长,细胞比生长速率逐渐上升,并在培养时间3 h之后达最大值,为0.62±0.17。细胞进入了对数生长期,开始迅速生长。发酵液中糖浓度,pH和溶氧水平快速降低。由图3B可知,此时CER与OUR数值均较高,表明细胞呼吸强度较高。当发酵液中糖耗完时、pH微微回弹,溶氧水平迅速回升,CER与OUR快速下降,细胞生长进入静止期,细胞干质量最终达(20.9±0.18)g/L。在葡萄糖没有被耗完的时间里(0~5 h),CER高于OUR,RQ高于1.26,因此该时期内细胞不是进行完全的有氧呼吸,无氧呼吸强度较高。这导致酒精含量上升,并在5 h后升至较高水平(1.976±0.02)%。因此,马克斯克鲁维酵母F#菌株可能存在Crabtree效应:即较高的糖浓度可能诱发酵母细胞产生酒精,而这种发酵模式不利于细胞的积累。

图3 菌株F#在50 L发酵罐中的分批培养过程曲线
Fig.3 Batch culture process curve of strain F#in 50 L fermenter
为了进一步验证该菌株是否存在Crabtree效应,后续试验将选择合适的补料策略对F#菌株进行补料分批培养,使发酵液中糖浓度既能满足细胞生长需求,又不至于过高。在这种补料策略下研究细胞生长与酒精产生的趋势。
目前,有一种常用的补料技术就是根据乙醇的变化控制糖的进料速率,从而避免酵母细胞的Crabtree效应[10,16,18]。然而如果只采用乙醇含量这一离线参数作为主要的控制信号则可能导致补料速率调节的延迟效应,那么就会很容易错过最佳调控机会[19]。因此还需综合分析线上参数(RQ、溶氧和pH等),制定更合适的补料策略,才能有效避免这种延迟效应。
2.4 针对马克斯克鲁维酵母Crabtree效应的补料分批培养
采用1.3.5节方法,对F#菌株进行补料分批培养。具体的补料策略如下:①通过监测RQ的变化控制糖的补料速率。在培养前期,当RQ<1.00时,表明发酵液中糖浓度无法满足酵母细胞的生长。此时上调糖的补料速率。而RQ>1.15时,表明酵母细胞无氧呼吸强度较高,这是由发酵液中糖浓度较高引起的,因此适当下调糖的补料速率,使RQ逐渐降至1.00~1.15。另外根据2.3节的试验结果:培养前期为酵母细胞生长的延滞期,此时酵母对氧气的需求不大,溶氧水平较高,因此在补料分批培养试验中,将初始转速下调为200 r/min。到了培养中期,由于酵母细胞生长较快,耗糖速率开始增加,溶氧水平也会迅速降低,因此逐渐上调糖的补料速率同时上调转速以满足酵母生长需要,但仍然以RQ在1.00~1.15为准;②在酵母的培养过程中,发酵液pH会降低,故通过调节氨水的补料速率将pH维持在适合酵母生长的范围里(4.5~5.5),同时氨水还能作为被酵母利用的氮源;③培养过程中持续补充磷酸二氢铵以满足酵母对磷源和氮源的需求。有相关报道表明马克斯克鲁维酵母能利用糖蜜进行生长[20],故本研究采用安琪酵母股份有限公司的糖蜜作为流加碳源,以期对马克斯克鲁维酵母的产业化提供指导。上述所流加的营养物质(糖蜜、氨水与磷酸二氢铵)及其浓度的确定是基于前期相关的工作。培养过程各指标变化分别见图4和图5。
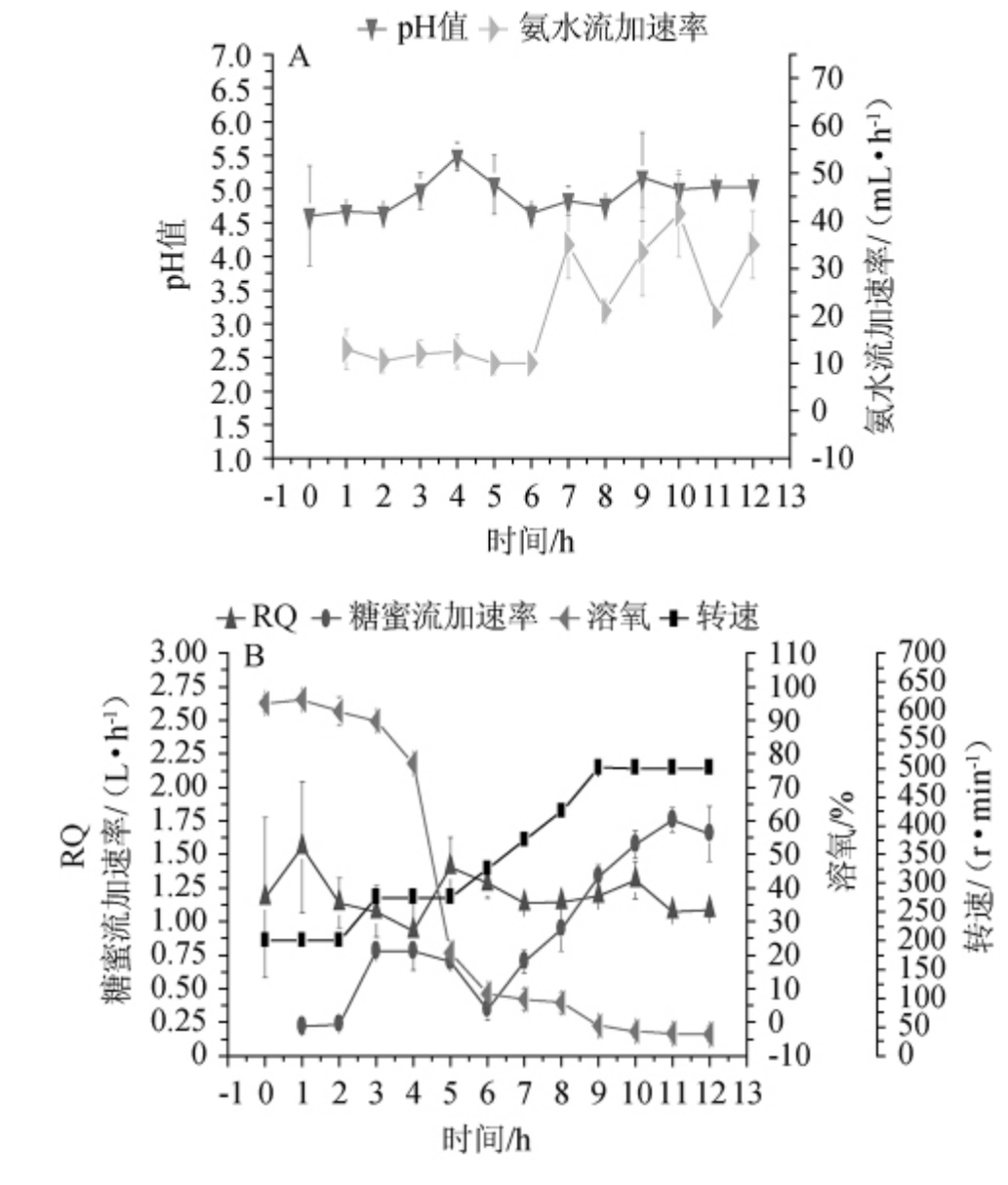
图4 菌株F#在补料分批培养过程中的发酵在线指标
Fig.4 Fermentation online indicators of strain F#in the fed batch culture process
由图4A和图4B可知,通过这种补料策略,使得RQ尽可能在1.00~1.15。RQ在这个范围内表明酵母细胞有氧呼吸强度较高,补充的碳氮源刚好可以满足酵母生长需求,同时又保证发酵液中没有过多的糖来诱发酵母细胞产酒精。因此发酵液中的糖浓度和酒精含量一直处于低水平(糖质量浓度最高不超过4.5 g/L,而酒精含量也一直处在0.2%vol以内)。再结合上2.3节的试验结果:糖浓度较高时,发酵液中的酒精含量上升。这表明马克斯克鲁维酵母菌株F#存在Crabtree效应,并且这一补料策略能有效地减弱酵母细胞的Crabtree效应,同时补充的营养源能够满足细胞生长需求,细胞干质量一直在上升(见图5)。
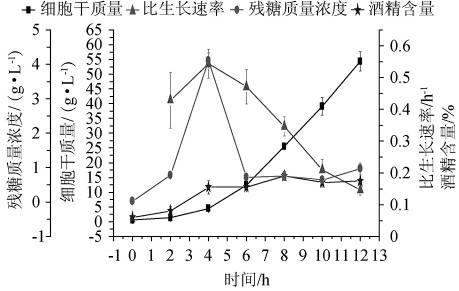
图5 菌株F#的补料分批培养过程曲线
Fig.5 Fed batch culture process curve of strain F#
到了培养中期,随着细胞生长,溶氧水平显著降低。5 h以后,发酵液中的溶氧水平较低(见图4B),此时酵母细胞的呼吸反应速率和生长速率均会受限,因此细胞比生长速率逐渐下降(见图5)。培养到12 h,发酵液体积达发酵罐的工作体积(33 L),结束培养,最终细胞干质量达(54.37±3.3)g/L。
培养结束后测定菌体的相关组分,结果见表1。由表1可知,细胞中灰分、蛋白质、RNA和海藻糖等含量分别为8.16%、47.41%、7.12%、1.21%,细胞中天冬氨酸、谷氨酸、亮氨酸、赖氨酸含量较高,而半胱氨酸和组氨酸含量较低。
表1 菌株F#在补料分批培养后的细胞组分
Table 1 Composition of cell after fed batch culture by strain F#
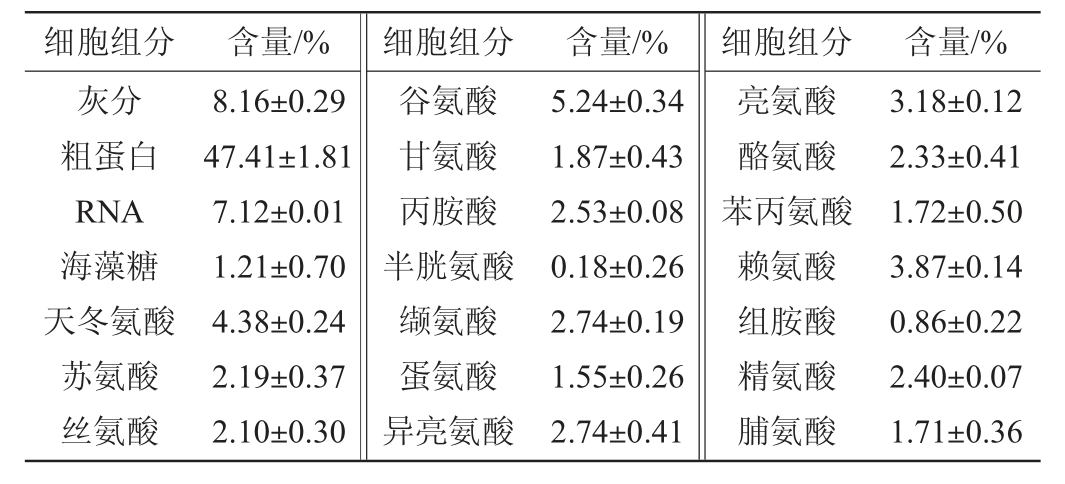
由以上结果可以看出,通过监测RQ的变化控制糖的补料速率以及补充氮源氨水调节pH,不仅可以使酵母细胞大量积累,并且还能有效减弱菌株F#的Crabtree效应。另外与菌株F#的分批培养结果(见2.3节)相比,采用这种补料策略培养菌株F#12 h,细胞干质量提高了160.29%。因此,对于这株菌的高细胞密度培养来说,这种补料策略具有一定的优势。
3 结论
本研究通过对马克斯克鲁维酵母进行中间试验,研究培养过程中该酵母的生长情况及相关呼吸参数和代谢产物的变化规律,以实现酵母细胞的大量积累。通过摇瓶和3 L发酵罐的分批培养从6株马克斯克鲁维酵母中确定了F#菌株在生长方面更具优势,培养后细胞干质量达(11.21±0.18)g/L。采用50 L发酵罐对菌株F#进行分批培养,进一步研究培养过程中酵母细胞的生理代谢变化情况。采用合适的补料策略对F#菌株进行补料分批培养。通过线上监测RQ,pH和溶氧的变化来调控糖蜜,氨水的补料速率以及转速。不仅满足了酵母的生长需要,实现细胞大量积累,同时使得发酵液中糖浓度较低,因此酒精含量也低于0.2%。这进一步证明了菌株F#的Crabtree效应。最终培养12 h,细胞干质量达(54.37±3.3)g/L,与菌株F#的分批培养结果相比,细胞干质量提高了160.29%。以廉价营养源实现了马克斯克鲁维酵母细胞的大量积累。本研究针对马克斯克鲁维酵母的Crabtree效应提供了合适的补料策略,对该菌株的工业生产具有一定指导意义。
[1]MELANIE M L,JOHN P M.Kluyveromyces marxianus:A yeast emerging from its sister's shadow[J].Fungal Biol R,2010,24(1-2):17-26.
[2]袁凤霞,田莎,曹晓虹,等.酸乳发酵中优良共生酵母菌的筛选[J].食品工业科技,2018,39(7):70-77.
[3]杨文丹.马克斯克鲁维酵母发酵麦麸面包烘焙与营养特性研究[D].无锡:江南大学,2018.
[4]侯胜博.马克斯克鲁维酵母的戊糖发酵[D].大连:大连理工大学,2017.
[5]LERTWATTANASAKUL N,KOSAKA T,HOSOYAMA A,et al.Genetic basis of the highly efficient yeast Kluyveromyces marxianus:Complete genome sequence and transcriptome analyses[J].Biotechnol Biof,2015,8(1):47-60.
[6]FONSECAGG,HEINZLEE,WITTMANNC,etal.Theyeast Kluyveromyces marxianus and its biotechnological potential[J].Appl Microbiol Biot,2008,79(3):339-354.
[7]莫文娟,郭超,吕红.马克斯克鲁维酵母的遗传与生理特征[J].中国科学:生命科学,2016,46(4):413-419.
[8]王冬梅,洪泂.在耐热的马克斯克鲁维酵母中构建微生物细胞工厂[J].生物学杂志,2020,37(1):1-10.
[9]LUKONDEHT,ASHBOLT N J,ROGERS P L.Evaluation of Kluyveromyces marxianus as a source of yeast autolysates[J].J Ind Microbiol Biot,2003,30(1):52-56.
[10]尚飞.酿酒酵母高密度发酵生产麦角固醇[D].北京:北京化工大学,2006.
[11]伍勇,肖泽仪,黄卫星,等.酿酒酵母的发酵优化与动力学研究[J].酿酒,2004,31(5):19-21.
[12]FONSECA G G,GOMBERT A K,HEINZLE E,et al.Physiology of the yeast Kluyveromyces marxianus during batch and chemostat cultures with glucose as the sole carbon source[J].Fems Yeast Res,2010,7(3):422-435.
[13]WARDROP F R,LITI G,CARDINALI G,et al.Physiological responses of Crabtree positive and Crabtree negative yeasts to glucose upshifts in a chemostat[J].Ann Microbiol,2004,54(1):103-114.
[14]陈小燕,许敬亮,袁振宏,等.马克斯克鲁维酵母制备生物质乙醇研究进展[J].新能源进展,2014,2(5):364-372.
[15]王亮,胡曼,王江月,等.马克斯克鲁维酵母高密度发酵条件的优化研究[J].食品工业科技,2017,38(17):111-118,124.
[16]俞灿,郑国斌,姚娟,等.富含核糖核酸酿酒酵母的选育及其高密度发酵工艺[J].中国酿造,2016,35(12):66-71.
[17]程奔,李啸,许超群,等.基于生理学参数的低糖酵母发酵过程优化[J].天津农业科学,2017,23(10):21-26.
[18]WANG Z,TAN T W,SONG J.Effect of amino acids addition and feedback control strategies on the high-cell-density cultivation of Saccharomyces cerevisiae for glutathione production[J].Process Biochem,2007,42(1):108-111.
[19]LI X,HUANG C,XU C Q,et al.High cell density culture of baker's yeast FX-2 based on pH-stat coupling with respiratory quotient[J].Biotechnol Appl Bioc,2019,66(3):1-8.
[20]ZÜMRIYE A,GNÜL D.The use of molasses in copper (II) containing waste waters:Effects on growth and copper(II)bioaccumulation properties of Kluyveromyces marxianus[J].Process Biochem,2000,36(5):451-458.
[21]BELEM M A F,GIBBS B F,LEE B H.Enzymatic production of ribonucleotides from autolysates of Kluyveromyces marxianus grown on whey[J].J Food Sci,1997,62(4):851-857.