浓香型白酒窖香浓郁、绵甜醇厚、香味协调、尾净余长,是最受消费者喜爱的白酒之一。浓香型白酒以高粱、大米、玉米等淀粉质谷粮为原料,以中温大曲为糖化发酵剂,经长时间的泥窖密封发酵后蒸馏而得,其中泥窖密封发酵是形成浓香型白酒风味的过程,也是多种微生物繁衍更替的过程[1-2]。窖泥是浓香型白酒制胜的法宝,也是生产必不可少的基础,其内含有大量的生香功能菌,这些功能菌代谢产生的有机酸类物质在酯化酶作用下合成的酯类物质是浓香型白酒窖香浓郁的根本[3-4]。因此,加强窖泥中的酯化菌的研究对提升窖内酒醅质量具有重要意义。
目前为止,对窖泥中厌氧微生物的研究已超过几百种,其中生香功能细菌主要包括己酸菌、芽孢杆菌、乳酸菌、羧酸菌等[5-7]。王春艳等[8-9]研究发现,梭状芽孢杆菌(Clostridium)对浓香型白酒的浓郁窖香具有重要贡献,其代谢产物主要为己酸和丁酸,同时伴随一些氢的产生。当甲烷菌与同产己酸的梭菌共生时能有效促进己酸乙酯生成,该研究对复合功能菌液和人工窖泥的改造培养提供了重要理论指导。此外,研究发现,窖池中的酯化菌以芽孢菌为主,岳元媛等[2]对泸州老窖不同窖龄的窖泥中产香的兼性厌氧菌进行分类计数,发现芽孢乳杆菌属(Sporolactobacillus)和芽孢杆菌属(Bacillus)为窖池优势菌属,其中大多菌株能产生丁酸和己酸等有机酸;侯小歌等[10]研究发现白酒在发酵中、后期,酒醅中的芽孢杆菌大量增殖,成为优势菌群,是重要的酯化生香菌。
针对窖泥酯化生香菌微生物多为厌氧芽孢杆菌[11],本试验以优质老窖泥为研究对象,厌氧条件下富集酯化菌,并对富集条件进行优化,通过顶空固相微萃取-气相色谱-质谱(headspace solid-phase microextraction-gas chromatographicmass spectrometry,HS-SPME-GC-MS)技术对富集液中的酯类物质及其含量进行检测,确定富集效果;再通过传统培养分离方法从中筛选产己酸乙酯和丁酸乙酯的菌株,采用形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并研究其生长特性,以期为提高浓香型白酒酒质奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
窖泥:无菌操作采集泸州某名优酒厂老窖池底泥,迅速置于冰盒运回实验室,4 ℃冰箱保存。
1.1.2 培养基
富集培养基:乙酸钠3.0 g/L、蛋白胨10.0 g/L、牛肉粉10.0g/L、L-半胱氨酸盐0.25g/L、酵母粉3.0g/L、葡萄糖5.0 g/L、可溶性淀粉1.0 g/L、氯化钠5.0 g/L、超纯水1 000 mL、pH值为6.0±0.1,121 ℃高压蒸汽灭菌15 min。
筛选培养基:葡萄糖10 g/L、氯化钠0.01 g/L、磷酸氢二钾0.5 g/L、硫酸亚铁0.01 g/L、磷酸二氢钾0.5 g/L、L-半胱氨酸盐酸盐0.25 g/L、硫酸锰0.01 g/L、硫酸镁0.2 g/L、甲基磺酸乙酯(ethyl methyl sulfonate,EMS)0.5 g/L、蛋白胨0.1 g/L、酵母膏1.0 g/L、琼脂20 g/L、三丁酸甘油酯4 mL(在倒平板前加入)、超纯水1 000 mL,自然pH值,121 ℃高压蒸汽灭菌15 min。液体培养基中不添加琼脂。
1.1.3 试剂
乙酸钠、蛋白胨、牛肉粉、酵母粉、葡萄糖、可溶性淀粉、氯化钠、磷酸氢二钾、硫酸亚铁、硫酸锰、硫酸镁、琼脂、三丁酸甘油酯(均为分析纯)、乙酸正丁酯(色谱纯):成都艾科达化学试剂有限公司;EMS、L-半胱氨酸盐酸盐(均为分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
HVE压力蒸汽灭菌锅:日本Hirayama公司;BF-2000M氮气吹浓缩仪:北京八方世纪科技有限公司;LRH-250恒温培养箱、HW326恒温水浴锅:上海一恒科技有限公司;M367983聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司;YIQI-125凝胶成像系统:德国VILBER公司;7890A-5975B气相色谱-质谱仪:美国安捷伦公司;α1860紫外分光光度计:上海普元仪器有限公司;AW200SG厌氧工作站:金坛市科技分析仪器有限公司。
1.3 方法
1.3.1 窖泥中酯化菌的富集方法
称取5 g窖泥装入含有45 mL无菌水的螺口瓶中,90 ℃恒温水浴处理30 min,冷却后于厌氧工作站按5%(V/V)的接种量接入富集培养基中,34 ℃条件下培养。
1.3.2 窖泥中酯化菌富集条件的确定
富集时间:样品同1.3.1处理后,分别于34 ℃培养箱中培养0 d、8 d、12 d、16 d、20 d、24 d、28 d,每组试验3组平行。
富集次数:样品同1.3.1处理后,在最佳富集时间下对富集液连续富集4次。
通过HS-SPME-GC-MS检测富集液中酯类物质含量及种类确定最佳富集时间和次数。
1.3.3 窖泥中酯化菌的分离纯化
将富集液于90 ℃恒温水浴处理30 min后,吸取1 mL富集液,按10倍梯度稀释至10-5,选取稀释梯度为10-2~10-5的菌液0.1 mL分别涂布至筛选培养基(已在厌氧工作站中静置24 h),34 ℃条件下培养2~10 d(期间观测菌落变化),挑选有透明圈的菌落进行分离、纯化。将纯化后的单菌株接种于富集培养基中(加入2%(V/V)乙醇),34 ℃培养15 d,通过GC-MS检测发酵产物中有无己酸乙酯或丁酸乙酯。
1.3.4 窖泥中酯化菌培养条件研究
种子液制备:于厌氧工作站中将目的菌株分别接种于液体筛选培养基中,34 ℃条件下严格厌氧培养48 h。
生长曲线:按5%(V/V)的接种量将不同菌株的种子液分别接种于液体筛选培养基,34 ℃条件下严格厌氧培养,每8 h取出8 mL培养液,采用紫外分光光度计在波长660 nm处测定吸光度值(OD660nm值)。
生长温度:按5%(V/V)的接种量将不同菌株的种子液分别接种于液体筛选培养基,分别置于20 ℃、30 ℃、34 ℃、37 ℃、41 ℃、45 ℃和60 ℃条件下严格厌氧培养48 h。
生长pH值:按5%(V/V)的接种量将不同菌株的种子液分别接种于不同pH值(2~10)的液体筛选培养基,34 ℃条件下严格厌氧培养48 h。
乙醇耐受性:按5%(V/V)的接种量将不同菌株的种子液分别接种于乙醇体积分数不同(2%~23%)的液体筛选培养基,34 ℃条件下严格厌氧培养48 h。
以上试验分别取8 mL发酵液,测定OD660nm值,且均以未接种的培养基为空白对照。
1.3.5 窖泥中酯化菌的鉴定
形态观察及生理生化试验:根据《伯杰氏细菌鉴定手册》[12]和《常见细菌系统鉴定手册》[13]对筛选的目的菌株选择性地进行形态观察和生理生化鉴定[14-15]。
分子生物学鉴定:提取目的菌株的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用细菌通用引物27F、1492r对目的菌株的16S rDNA基因序列进行PCR扩增[16-17],PCR扩增产物委托上海美吉公司进行测序。将测序结果提交至美国国家生物信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中进行Blast同源性比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 6.0软件的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.6 酯类物质的检测
取5 mL富集液或发酵液于顶空瓶中,再加入2 g NaCl和0.25 mL乙酸正丁酯(0.2 mg/mL)作为内标,混匀,置于55 ℃固相微萃取仪中平衡15 min后,插入萃取针头萃取30 min,参照文献[18]进行GC-MS检测。质谱图通过与美国Agilent公司提供的美国国家标准与技术研究院(national institute of standards and technology,NIST)05a.L标准谱库进行比对,利用匹配度均>800的特征离子进行定性分析;采用内标法进行半定量。
1.3.7 数据分析
结果以“平均值±标准偏差”表示。利用SPSS19.0软件进行方差分析,采用Origin 8.0软件作图。
2 结果与分析
2.1 窖泥中酯化菌富集方法的优化
窖泥经不同富集时间、不同富集次数富集后,采用HSSPME-GC-MS检测富集液中酯类物质含量和种类数的变化,结果见图1。
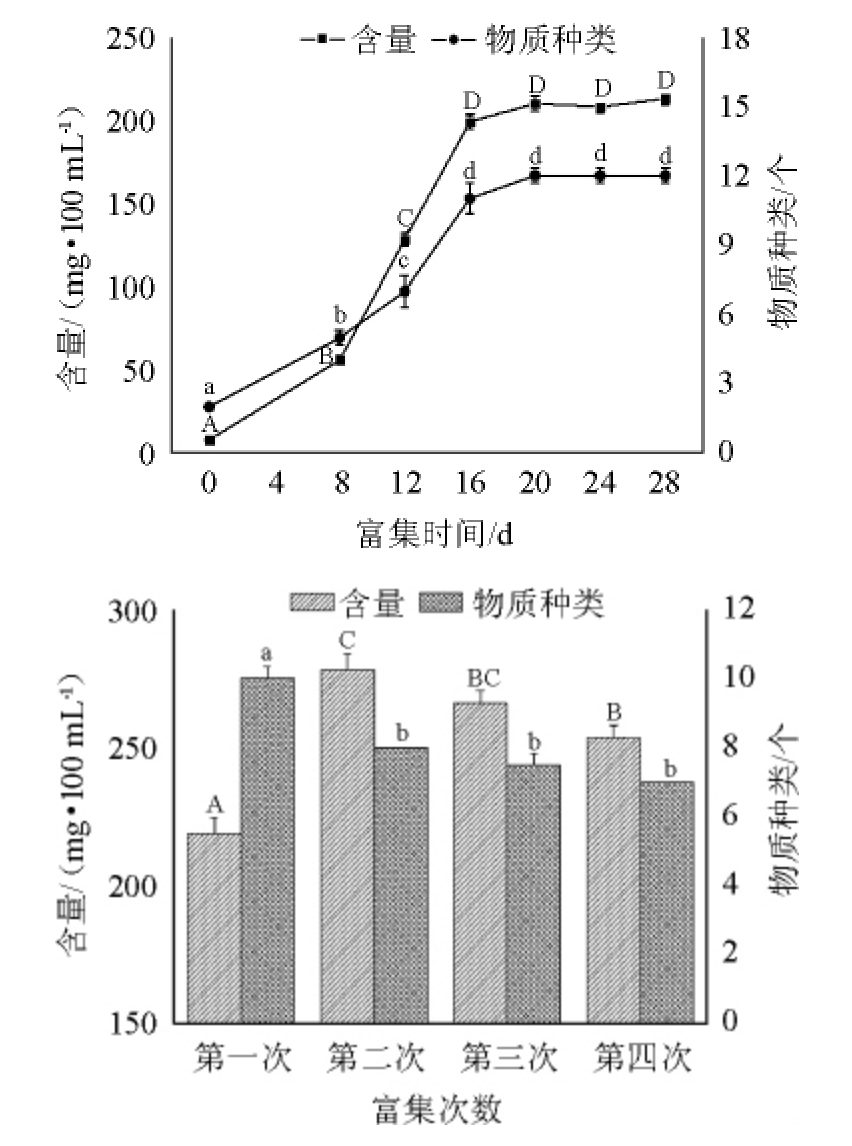
图1 富集时间(a)及富集次数(b)对富集液中酯类化合物含量和种类数的影响
Fig.1 Effect of enrichment time (a) and number of enrichment (b) on the content and type of ester compounds in esterified liquid
不同字母表示差异显著(P<0.05)。
由图1a可知,随着富集时间的延长,窖泥富集液中酯类物质种类数和含量均呈先增加后稳定的变化趋势。富集16 d时,窖泥富集液中酯类物质种类数达到11种,酯类物质总含量达到199 mg/100 mL,均显著高于富集前期(P<0.05)。富集16 d后,随着富集时间的延长,窖泥富集液中酯类物质种类数和含量均趋于稳定,变化不显著(P>0.05)。这可能是由于富集16 d后目标菌群进入稳定期,随着营养物质消耗及富集液中微生物代谢产物的积累,目标菌群生长受到抑制逐渐进入衰亡期。
由图1b可知,随着富集次数的增加,窖泥富集液中酯类物质含量呈先上升后降低的变化趋势,富集2次时,酯类化合物含量达到最大(280 mg/100 mL),显著高于1次富集(P<0.05);而酯类物质种类数随富集次数增加呈下降变化,富集2次时酯类物质种类数为8种,随后趋于稳定,变化不显著(P>0.05)。这可能是由于第一次富集液中产酯微生物种类丰富但生物量较少,导致其代谢产物酯类物质种类数多而含量较少,随着富集次数增加,富集液中微生物逐渐被驯化,部分微生物被淘汰,优势产酯微生物愈加的集中,使得富集液中的酯类物质种类数趋于稳定而含量升高[19]。因此,窖泥富集液富集培养16 d,富集2次有利于酯化菌的富集。但为保证目标微生物的富集效果,略微延长富集时间,选择富集时间为20 d。
2.2 窖泥中酯化菌的分离与筛选
采用稀释平板涂布法从优化后的窖泥富集液中分离出23株菌,再通过HS-SPME-GC-MS检测复筛出3株代谢生产己酸乙酯和丁酸乙酯的菌株,分别命名为Y1、Y2、Y3。
2.3 酯化菌的鉴定
2.3.1 形态观察
3株菌株的菌落、细胞形态及其革兰氏染色结果见图2。
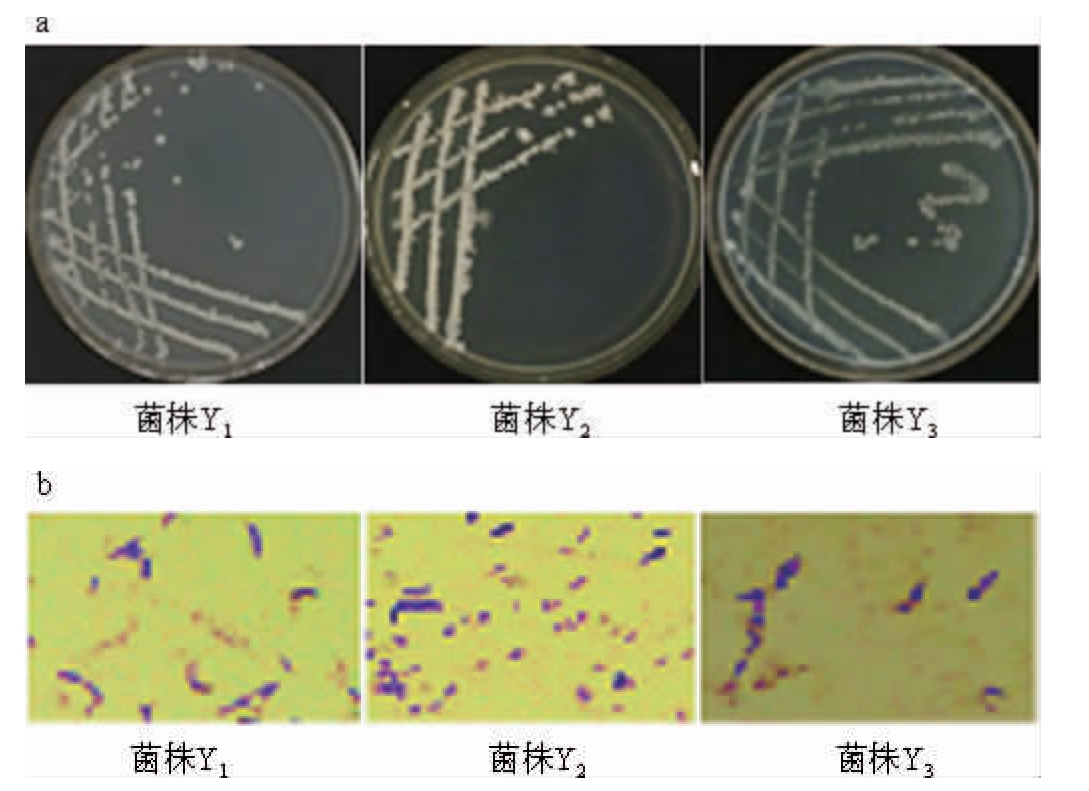
图2 3株菌株的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of 3 strains
由图2可知,3株菌皆为厌氧的革兰氏阳性(G+)白色杆状细菌。菌株Y1的菌落呈米白色、正反面颜色一致、边缘规整、圆形、外观形态小,细胞呈杆状、有一定的排列方式,革兰氏阳性,厌氧;菌株Y2的菌落呈灰白色、菌落中间颜色较浅、边缘颜色较白、较光滑、比较湿润、不易于挑取,细胞呈杆状,G+,厌氧;菌株Y3的菌落呈黄白色、湿润、光滑、不透明、外观形态小、易于挑取,细胞呈杆状,G+,厌氧。
2.3.2 生理生化鉴定结果
3株菌株的生理生化试验结果见表1。
表1 3株菌株的生理生化鉴定结果
Table 1 Results of physiological and biochemical identification of 3 strains
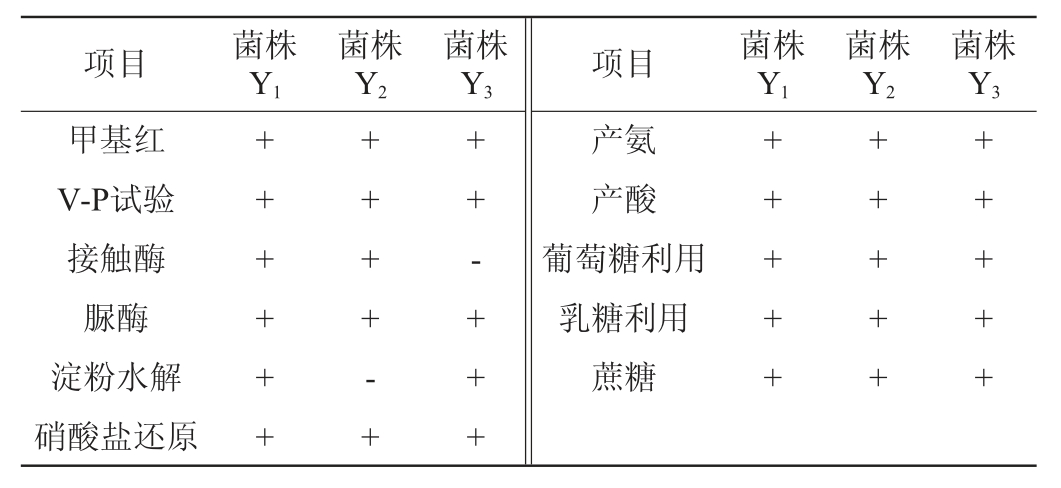
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
由表1可知,菌株Y2水解淀粉结果为阴性,菌株Y3的接触酶试验结果呈阴性,除此之外,3株菌株的其他生理生化反应试验结果均呈阳性。结合形态观察,初步鉴定菌株Y1、Y2、Y3均为厌氧梭菌属(Clostridium sp.)。
2.3.3 分子生物学鉴定结果
菌株Y1~Y3纯化后提取基因组DNA,以其为模板进行16S rDNA的扩增,采用1%琼脂糖凝胶进行检测,结果见图3。
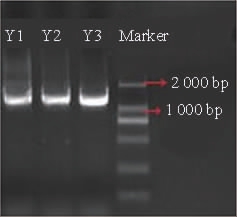
图3 3株菌株16S rDNA PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Results of agarose gel electrophoresis of 16S rDNA PCR product of 3 strains
由图3可知,3株菌株的16S rDNA PCR扩增产物的碱基长度为1 600 bp左右,与预期结果相符,委托上海美吉公司进行测序。将测序结果提交至NCBI的GenBank数据库中进行Blast比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 6.0中的NJ法构建系统发育树,结果见图4。
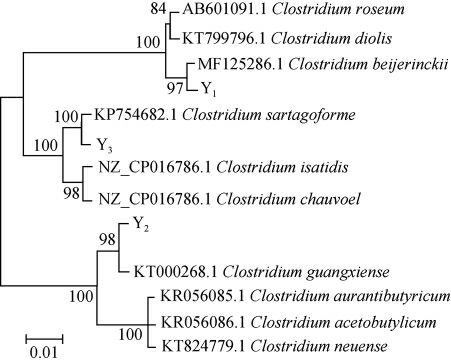
图4 基于16S rDNA基因序列3株菌株的系统发育树
Fig.4 Phylogenetic tree of 3 strains based on 16S rDNA gene sequences
由图4可知,菌株Y1与拜氏梭菌(Clostridium beijerinckii)聚于一支,亲缘关系最近;菌株Y2与Clostridium guangxiense聚于一支,亲缘关系最近;菌株Y3与Clostridium sartagoforme聚于一支,亲缘关系最近。结合形态观察及生理生化试验结果,鉴定菌株Y1、Y2、Y3分别为拜氏梭菌(Clostridium beijerinckii)、Clostridium guangxiense、Clostridium sartagoforme。有文献报道,C.beijerinckii、C.guangxiense能发酵产丁醇,特别是C.beijerinckii能够利用糖质和木质素水解液发酵产丁醇,在用生物法来生产丁醇中得到广泛应用[20-21];C.sartagoforme是一种纤维素(和几丁质)降解细菌[22]。
3株酯化菌均为厌氧梭菌,这可能是由于梭菌在优质窖泥中已经是优势微生物[23-26],经过富集培养基多轮次富集,在富集液中占据主导地位,这也表明窖泥中的梭菌可能为浓香型白酒酿造中重要的酯化生香菌。因此,加强这3株菌的研究对提升白酒质量具有重要意义。
2.4 酯化菌培养条件试验结果
2.4.1 3株菌株的生长曲线
为了解菌株Y1、Y2、Y3的生长情况,在厌氧条件下测定3株菌株的生长曲线,结果见图5。
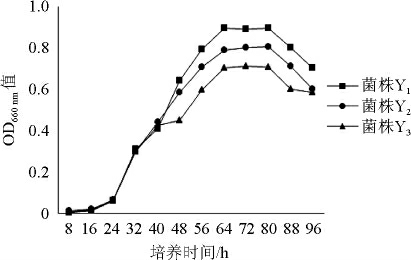
图5 3株菌株厌氧条件下的生长曲线
Fig.5 Growth curve of 3 strains in the anaerobic condition
由图5可知,3株菌株的生长趋势一致,生物量均呈先上升后稳定再下降的变化趋势,其中前24 h为延滞期;24~64 h为对数生长期;64~80 h为平稳期;80 h后进入衰亡期。这可能是由于前24 h菌株正在适应新的培养液环境,大量合成细胞分裂所需的酶类及其他细胞成分,细胞生长但不分裂,培养液中生物量不变;24 h后菌株已适应新的生长环境,丰富的营养物质使它们快速生长繁殖;64 h后培养液中的大部分营养物质被消耗以及代谢产物的累积,使得部分微生物消亡,此时微生物的增长和消亡趋于稳定,3株菌株生物量保持稳定;80 h后培养液中可利用营养物质完全被利用,微生物逐渐消亡。
2.4.2 3株菌株最适生长温度、pH及耐乙醇能力试验
通过紫外分光光度计检测菌株Y1~Y3经不同温度、不同pH值及不同体积分数乙醇培养后的OD660nm值,结果见图6。
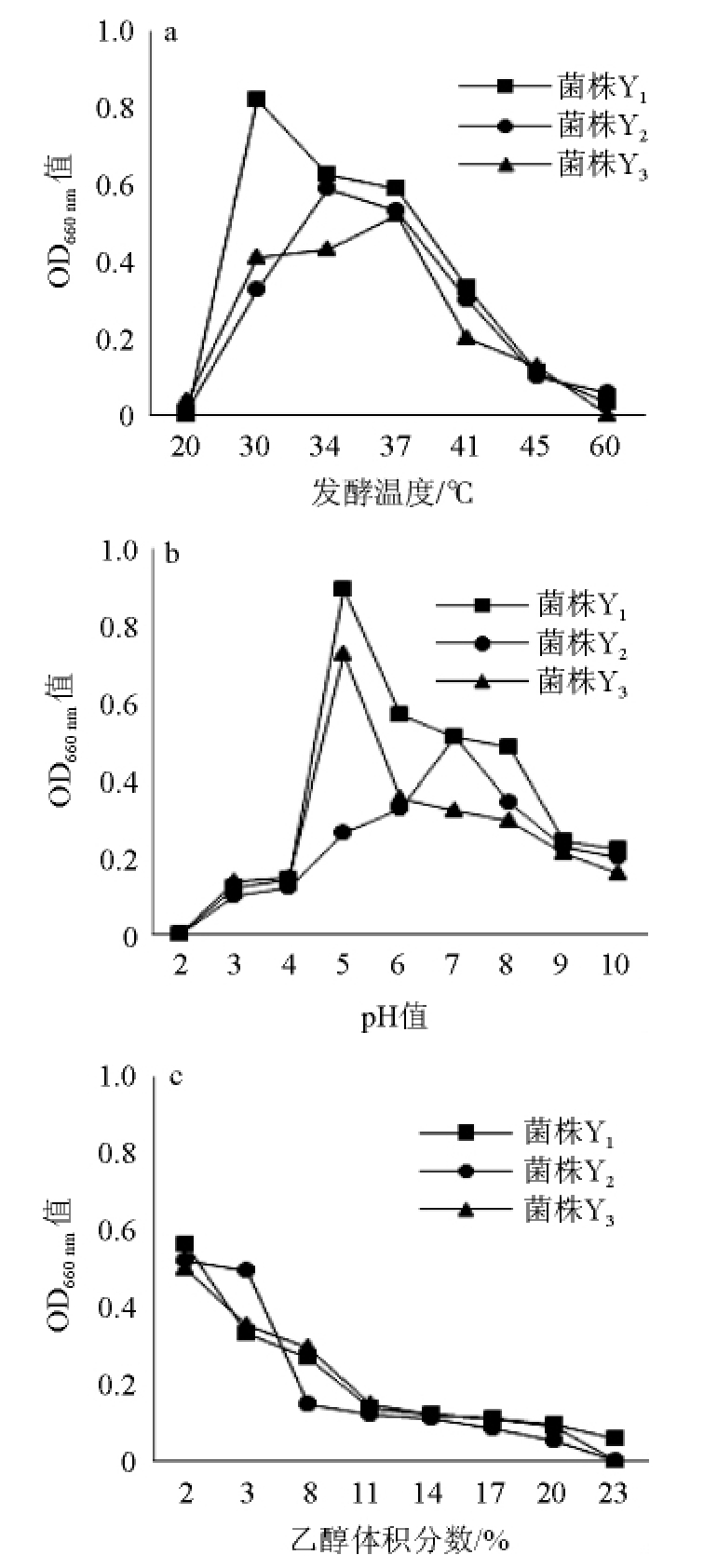
图6 温度(a)及pH值(b)对3株菌株生长的影响及其耐乙醇能力(c)
Fig.6 Effect of temperature (a) and pH (b) on 3 strains growth and its ethanol tolerance (c)
由图6可知,随着培养温度、pH值的升高,3株菌株的生物量均呈先增加后降低的趋势,且3株菌株均在温度为30~41 ℃、pH值为5~10、乙醇体积分数为2%~8%的范围内生长良好。其中,菌株Y1的最佳生长温度为30 ℃、最适生长pH值为5、耐受乙醇体积分数为23%;菌株Y2的最佳生长温度为34 ℃、最适生长pH值为7、耐受乙醇体积分数为20%;菌株Y3的最佳生长温度为37 ℃,最适生长pH值为5、耐受乙醇体积分数为20%。
3株菌株均能在窖池环境中良好生长,这与筛选环境有关。菌株Y1~Y3来自浓香型窖池底部的优级窖泥,长期处于酿酒环境使得3株菌不断被驯化,具有较高的耐乙醇能力[27]。此外,这3株菌的最佳生长温度在30~37 ℃,这可能表明它们主要生长在浓香型白酒的发酵的高温期,窖池内糟醅发酵温度分为“前缓、中挺、后缓落”三个阶段,其中中挺阶段发酵温度一般在30 ℃以上[28]。
3 结论
本试验对窖泥酯化菌的富集方法进行优化,发现富集液培养20 d、连续富集2次,富集液中酯化菌的富集效果最好。采用传统分离方法从优化富集液中分离、筛选得到3株产己酸乙酯和丁酸乙酯较强的酯化菌,经形态观察、生理生化试验及分子生物学技术鉴定菌株Y1为Clostridium beijerinckii、Y2为Clostridium guangxiense、Y3为Clostridium sartagoforme。通过对3株菌株的生长特性研究发现,菌株Y1的最佳生长温度为30 ℃、最适生长pH值为5、耐受乙醇体积分数为23%;菌株Y2的最佳生长温度为34 ℃、最适生长pH值为7、耐受乙醇体积分数为20%;菌株Y3的最佳生长温度为37 ℃,最适生长pH值为5、耐受乙醇体积分数为20%。3株菌株均能在浓香型白酒窖内进行很好的生长繁殖,加强这3株菌株的研究对提升浓香型白酒糟醅质量具有重要作用。
[1]高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
[2]岳元媛,张文学,刘霞,等.浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J].微生物学通报,2007,34(2):251-255.
[3]叶光斌,罗惠波,杨晓东,等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学,2013,34(17):176-181.
[4]吴文睿,李安军,汤有宏,等.古井贡酒窖泥功能厌氧菌发酵风味物质的研究[J].酿酒科技,2015(12):57-61.
[5]王明跃,张文学,王海英,等.不同窖龄窖泥细菌的系统发育多样性分析[J].食品科学,2013,34(11):177-181.
[6]任聪,辜杨,杜海,等.基于新老窖泥的微生物菌群结构判定浓香型白酒生产中的主体己酸菌[J].食品与发酵工业,2018,44(12):8-14.
[7]张志伟,王燕,刘英杰,等.浓香型白酒窖泥中主要产香菌的鉴定及正交试验优化产己酸工艺[J].齐鲁工业大学学报,2018,32(3):12-16.
[8]王春艳,宋建阳,吕慧鑫,等.基于高通量测序的宋河浓香型白酒不同窖龄窖泥细菌群落结构分析[J].中国酿造,2019,38(9):163-166.
[9]王赞,李光辉,罗惠波.浓香型白酒窖泥厌氧细菌的分离鉴定[J].四川理工学院学报:自然科学版,2014,27(1):16-18.
[10]侯小歌,王俊英,李学思,等.浓香型白酒窖池主要功能性微生物的研究进展[J].酿酒科技,2013(2):96-101.
[11]李聪聪.浓香型白酒窖泥梭菌群落多样性及高产丁酸梭菌发酵特性研究[D].郑州:郑州轻工业学院,2018.
[12]BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:729-792.
[13]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-370.
[14] DRANCOURT M,DRANCOURT M,BOLLET C,et al.16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J].J Clin Microbiol,2000,38(10):3623-3630.
[15]JAND J M,ABBOTT S L.Bacterial identification for publication:when is enough[J].J Clin Microbiol,2002,40(6):1887-1891.
[16]刘梅,邓杰,谢军,等.基于微生物群落结构相关的窖泥品质理化指标的筛选[J].食品科学,2018,39(19):44-50.
[17]韩军萍,黄雅燕,叶静,等.一株转化琼胶为新琼寡糖菌株的筛选及鉴定[J].微生物学报,2015,55(9):1126-1132.
[18]汪文鹏,王艳丽,吴树坤,等.浓香型白酒窖泥中3 株厌氧菌的分离鉴定及代谢产物分析[J].食品科技,2018,43(2):15-20.
[19]邓杰.基于高通量测序的浓香型白酒窖泥微生物群落结构研究[D]:自贡:四川轻化工大学,2015.
[20] AGU C V,UJOR V,EZEJI T C.Metabolic engineering of Clostridiumbeijerinckii to improve glycerol metabolism and furfural tolerance[J].Biotechnol Biof,2019.doi:10.1186/s13068-019-1388-9.
[21]杨华,胡晨,张宏嘉,等.丙酮丁酸梭菌ATCC 55025 与醇溶剂的生物相容性与毒性机理研究[J].当代化工,2016,45(7):1372-1374.
[22] LI C,LAI Q,FU Y,et al. Galbibacter marinus sp.nov.,isolated from deep-sea sediment[J].Int J Syst Evol Micr,2013,63(Pt 4):1427-1430.
[23]LIANG H P,LI W F,LUO Q C,et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].J Sci Food Agr,2015,95(13):2729-2735.
[24] ZHENG J,LIANG R,ZHANG L Q,et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.
[25]DING X F,WU C D,ZHANG L Q,et al.Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J].World J Microbiol Biotechnol,2014,30(2):605-612.
[26]LIANG H P,LUO Q C,ZHANG A,et al.Comparison of bacterial community in matured and degenerated pit mud from Chinese Luzhou-flavour liquor distillery in different regions[J].J I Brewing,2016,122(1):48-54.
[27]朱莉莉,罗惠波,黄治国,等.浓香型白酒窖泥质量评价理化指标的筛选[J].中国酿造,2018,37(12):33-39.
[28]王媚.浓香型白酒糟醅窖内外发酵动态因子的初步研究[D].贵阳:贵州大学,2015.