氨基甲酸酯类农药具有广谱性、高效性。由于具有杀虫效果明显、残留期短、分解快、代谢迅速、能显著刺激作物生长等特点,氨基甲酸酯类农药是农作物防治虫害的常用农药[1]。但是由氨基甲酸酯类农药的杀虫机理可知,它能够抑制昆虫进行神经传导乙酰胆碱酯酶的活性,所以它同时又是一种抑制体内胆碱酯酶的神经毒素,具有潜在致癌、致畸、致突变的作用[2-4]。近几年,氨基甲酸酯类农药的过量使用造成人畜中毒现象经常发生,所以许多国家都制定了其在食品中残留量的限量标准,因此对氨基甲酸酯类农药的残留检测非常关注[5-6]。目前常用的氨基甲酸酯类农药有克百威(呋喃丹)、灭多威、仲丁威、抗蚜威、甲萘威等。
农药残留常用的检测方法有气相色谱法[7]、气相色谱-质谱法[8]、高效液相色谱法[9]、高效液相色谱-质谱法[10-11]、超临界流体色谱法[12]等;常用的前处理方法有液液萃取、固相萃取、固相微萃取等。传统的前处理方法比较耗时费力,而QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)法即为“快速、简易、廉价、有效、稳定、安全”的萃取方法[13-16],该方法是ANASTASSIADES M等[17]于2003年发明的一种用于农产品中多农药残留分析的前处理方法。QuEChERS方法具有技术要求低、操作简单、无需使用大量有机溶剂、分析过程快速等优点。
本试验采用QuEChERS-高效液相色谱(high performance liquid chromatography,HPLC)-二极管阵列检测器(diode array detector,DAD)法,利用二极管阵列检测器(DAD)的可变波长功能,对本实验中选定的4种氨基甲酸脂类农药残留进行分离与检测。旨在为食品中检测氨基甲酸酯类农药残留提供一种更快速、简便的检测方法和技术参考。
1 材料与方法
1.1 材料与试剂
甲醇(色谱级):天津市康科德科技有限公司;乙腈(色谱级):天津市光复精细化工研究所;无水硫酸镁、氯化钠(纯度≥99%):天津市永大化学试剂有限公司;灭多威标准品(纯度≥99%)、克百威标准品(纯度≥98%):北京金宝在线科技有限公司;仲丁威(纯度≥99.6%)、抗蚜威(纯度≥99%):湖南海利化工股份有限公司;N-丙基乙二胺吸附剂(primary secondary amine,PSA)和石墨化炭黑(graphitized carbon black,GCB)吸附剂:Agela Technologies公司;黄瓜、苹果和小米:市售。
1.2 仪器与设备
Waters 1525-2988高效液相色谱仪:美国沃特世科技有限公司;SK5200LHC型超声波清洗器:上海科导超声器有限公司;LD-52A低速离心机:北京雷勃尔离心机有限公司;PHS-3C型pH计:上海精密仪器有限公司;Millipore Synergy_超纯水机:法国Millipore公司。
1.3 方法
1.3.1 样品处理方法
分别称取10.000 g果蔬样品(市售),磨碎或切碎,加入5.000 g无水硫酸镁(谷物中不加)除去过多的水分,用20 mL乙腈溶解,进行提取(分两次提取),定容至30 mL,涡旋混匀后5 000 r/min离心5 min,取5 mL上清液加入1 g无水硫酸镁、0.5 g PSA和0.2 g GCB净化,涡旋混匀后5 000 r/min离心5 min,取1 mL过0.45 μm微孔滤膜,超声脱气后备用[20]。
1.3.2 色谱条件
色谱柱promosilR C18(5 μm,4.6 mm×250 mm);流动相:甲醇-水溶液(75:25,V/V),流速:1 mL/min;进样量:20 μL;柱温:25 ℃;检测波长范围:190~300 nm。
1.3.3 标准储备液的配制
分别准确称取抗蚜威、仲丁威、灭多威和克百威各150 mg,用甲醇溶解后分别定容于100 mL容量瓶中,储存备用。
2 结果与分析
2.1 检测波长的选择
通过紫外光谱测量可知,克百威、灭多威、抗蚜威和仲丁威的最大吸收波长分别为198 nm、234 nm、260 nm和270 nm。由于本试验采用二极管阵列检测器,为了提高检测灵敏度,充分发挥二极管阵列检测器的优势,依据4种目标物的最大吸收波长,确定检测波长范围在190~300 nm。
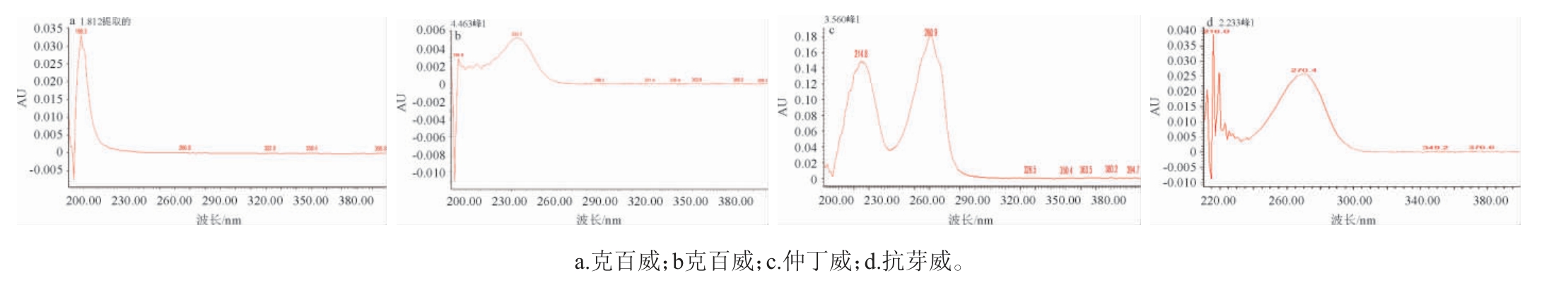
图1 4种氨基甲酸酯类农药扫描图
Fig. 1 Scintigram of four kinds of carbamate pesticides
2.2 流动相的选择
本试验以甲醇-水作为流动相,考察了不同比例的甲醇和水(体积比分别为70∶30、75∶25、80∶20)对4种氨基甲酸酯类农药保留行为的影响。如图2a所示,流动相中当甲醇与水体积比为70∶30时,4种氨基甲酸酯类农药的保留时间会偏长;如图2b所示,当甲醇与水的比例为75∶25时,4种氨基甲酸酯类农药出峰比较快,而且分离效果好;如图2c所示,当甲醇与水体积比为80∶20时,则4种氨基甲酸酯类农药中,灭多威和克百威不能完全分离。所以本试验选择体积比为75∶25的甲醇-水为流动相。
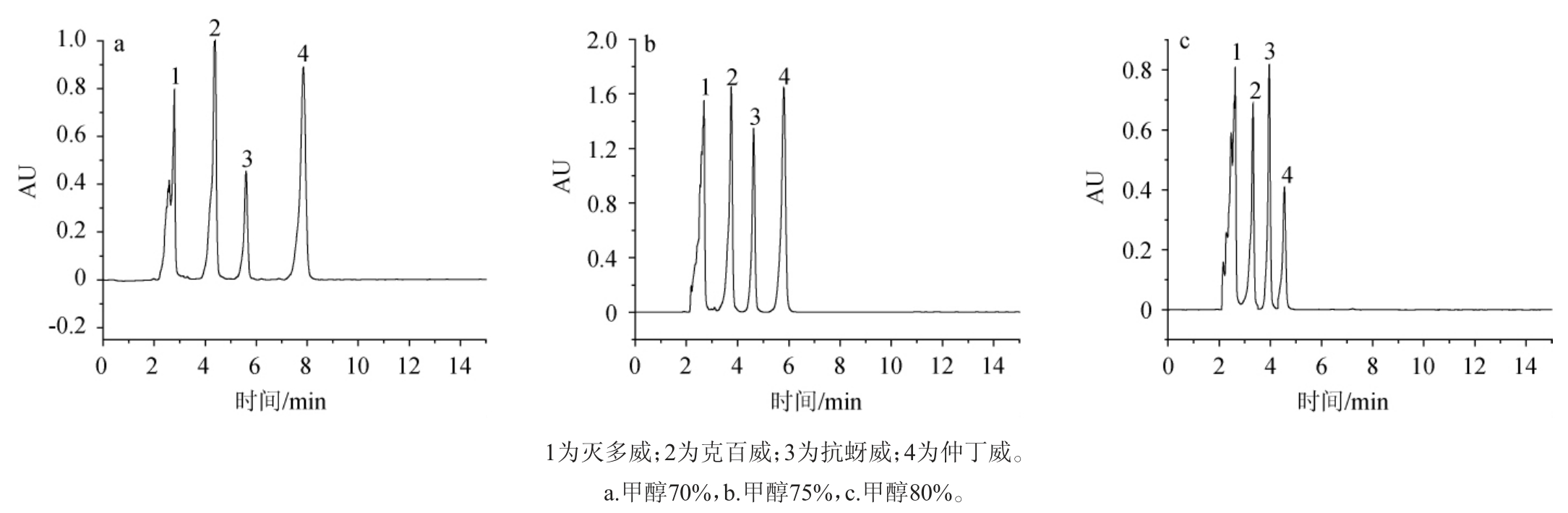
图2 4种氨基甲酸酯类农药混合标液色谱图
Fig. 2 Chromatogram of four carbamate pesticides mixed standard solution
2.3 流速的选择
试验考察了流速对被测物保留行为的影响,分别考察了流速为0.5 mL/min、0.8 mL/min、1 mL/min和1.2 mL/min时四类农药的分离情况。当流速为0.5 mL/min和0.8 mL/min时,被测物出峰时间较长,峰形较宽;当流速为1.2 mL/min时,尽管分析时间大大缩短,但这时柱压较高,分离效果欠佳,而当流速为1 mL/min时,被测物出峰时间较短,分离效果好。故最佳流速为1 mL/min。
2.4 线性关系和检出限
将4种氨基甲酸酯类农药分别配制成质量浓度为1~200 μg/kg的一系列不同浓度的标准溶液,在1.3的色谱条件下进行测定。以物质的质量浓度作为横坐标,被测组分的峰面积(Y)为纵坐标作图,得到线性(X)方程和线性相关系数,并计算检出限,结果如表1所示。
表1 4种氨基甲酸酯线性关系及检出限
Table 1 Linear relationships and detection limits of four kinds of carbamate
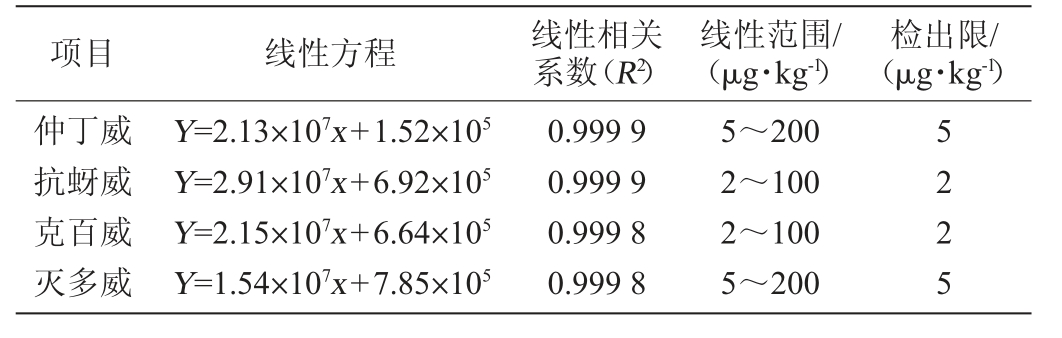
项目 线性方程 线性相关系数(R2)线性范围/(μg·kg-1)检出限/(μg·kg-1)仲丁威抗蚜威克百威灭多威Y=2.13×107x+1.52×105 Y=2.91×107x+6.92×105 Y=2.15×107x+6.64×105 Y=1.54×107x+7.85×105 0.999 9 0.999 9 0.999 8 0.999 8 5~200 2~100 2~100 5~200 5 2 2 5
由表1可知,克百威和抗蚜威的线性范围为2~100μg/kg,仲丁威和灭多威的线性范围为5~200 μg/kg,线性相关系数(R2)≥0.999 8。该方法的检出限在2~5 μg/kg。由于有效地发挥了二极管阵列检测器(DAD)的优势,与相关文献[18-19]比较,对被分析物质检测的灵敏度明显提高。
2.5 回收率试验
表2 加标回收率试验结果
Table 2 Results of standard recovery tests
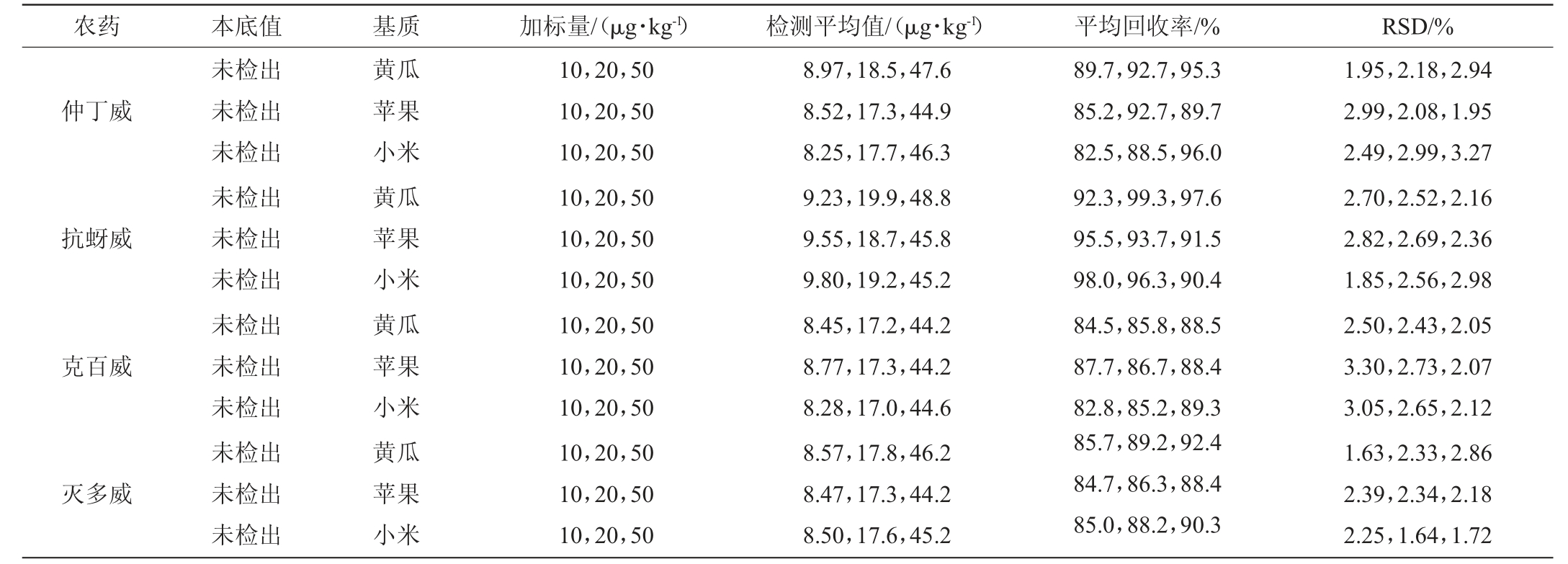
农药 本底值 基质 加标量/(μg·kg-1) 检测平均值/(μg·kg-1) 平均回收率/% RSD/%仲丁威抗蚜威克百威灭多威未检出未检出未检出未检出未检出未检出未检出未检出未检出未检出未检出未检出黄瓜苹果小米黄瓜苹果小米黄瓜苹果小米黄瓜苹果小米10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 8.97,18.5,47.6 8.52,17.3,44.9 8.25,17.7,46.3 9.23,19.9,48.8 9.55,18.7,45.8 9.80,19.2,45.2 8.45,17.2,44.2 8.77,17.3,44.2 8.28,17.0,44.6 8.57,17.8,46.2 8.47,17.3,44.2 8.50,17.6,45.2 89.7,92.7,95.3 85.2,92.7,89.7 82.5,88.5,96.0 92.3,99.3,97.6 95.5,93.7,91.5 98.0,96.3,90.4 84.5,85.8,88.5 87.7,86.7,88.4 82.8,85.2,89.3 85.7,89.2,92.4 84.7,86.3,88.4 85.0,88.2,90.3 1.95,2.18,2.94 2.99,2.08,1.95 2.49,2.99,3.27 2.70,2.52,2.16 2.82,2.69,2.36 1.85,2.56,2.98 2.50,2.43,2.05 3.30,2.73,2.07 3.05,2.65,2.12 1.63,2.33,2.86 2.39,2.34,2.18 2.25,1.64,1.72
向空白黄瓜、苹果、小米样品基质中分别添加10 μg/kg、20 μg/kg、50 μg/kg 的3个浓度的农药标品,每个浓度设置3个重复。通过基质标准曲线定量,进行回收率实验,结果见表2。由表2可知,以黄瓜为基质的试验结果平均回收率在84.5%~99.3%之间,以苹果基质的试验结果平均回收率在84.7%~95.5%之间,以小米基质的试验结果平均回收率在82.5%~98.0%之间,说明方法的回收率良好。黄瓜基质、苹果基质、小米基质的回收率结果相对标准偏差(relative standarddeviation,RSD)分别为1.63%~2.94%、1.95%~3.30%、1.64%~3.27%,表明该方法可行。
2.6 精密度试验
选取本底中不含有这四种农药的黄瓜、苹果、小米样品,分别按10 μg/kg和20 μg/kg 2个浓度的水平添加,每个水平检测6次,得到方法的精密度结果见表3~表5。由表3可知,黄瓜基质的相对标准偏差(RSD)在1.68%~3.15%之间(n=6),由表4可知,苹果基质的相对标准偏差(RSD)在1.64%~3.30%之间(n=6),由表5可知,小米基质的相对标准偏差(RSD)在1.91%~3.07%之间(n=6)。在3种基质中测定的实验结果相对标准偏差均<5%,说明方法的精密度良好。
表3 以黄瓜为基质的精密度试验结果
Table 3 Precision test results using cucumber as substrate
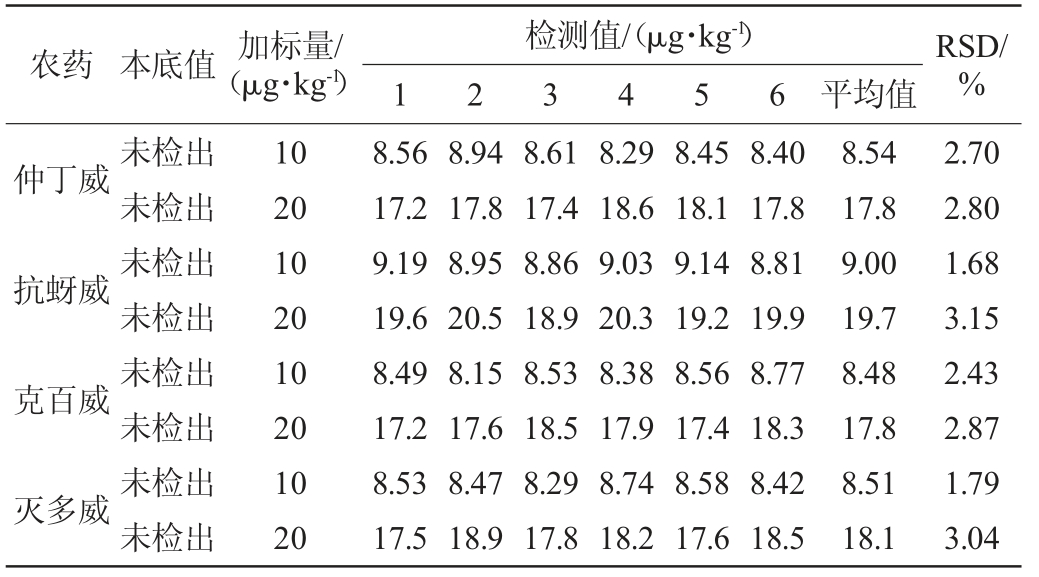
农药 本底值 加标量/(μg·kg-1)检测值/(μg·kg-1)1 2 3 4 5 6 平均值RSD/%仲丁威抗蚜威克百威灭多威未检出未检出未检出未检出未检出未检出未检出未检出10 20 10 20 10 20 10 20 8.56 17.2 9.19 19.6 8.49 17.2 8.53 17.5 8.94 17.8 8.95 20.5 8.15 17.6 8.47 18.9 8.61 17.4 8.86 18.9 8.53 18.5 8.29 17.8 8.29 18.6 9.03 20.3 8.38 17.9 8.74 18.2 8.45 18.1 9.14 19.2 8.56 17.4 8.58 17.6 8.40 17.8 8.81 19.9 8.77 18.3 8.42 18.5 8.54 17.8 9.00 19.7 8.48 17.8 8.51 18.1 2.70 2.80 1.68 3.15 2.43 2.87 1.79 3.04
表4 以苹果为基质的精密度试验结果
Table 4 Precision test results using apple as substrate
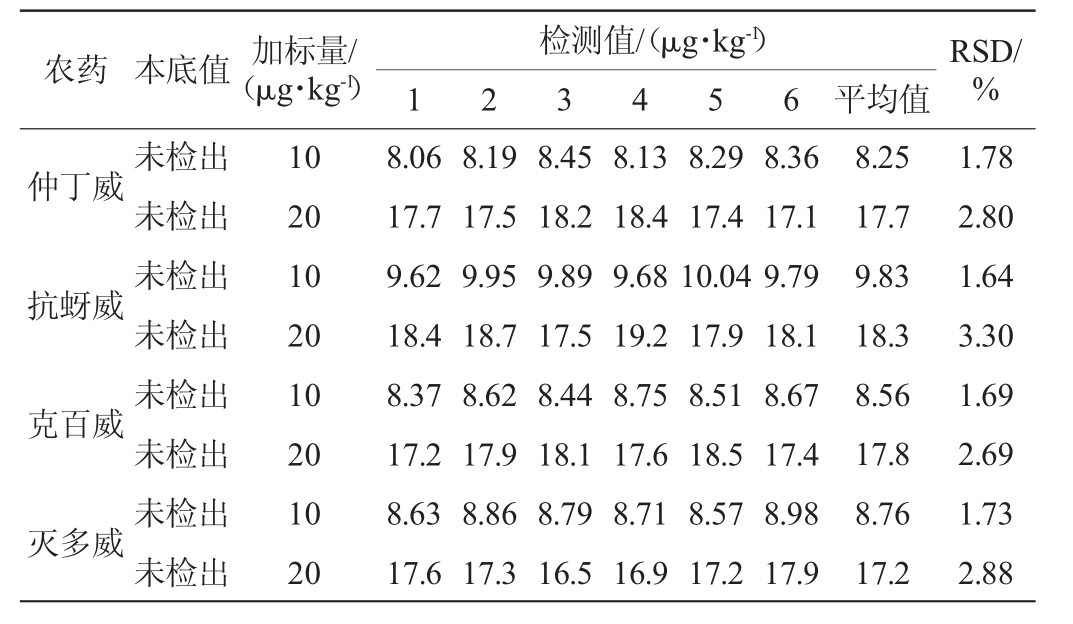
农药 本底值 加标量/(μg·kg-1)检测值/(μg·kg-1)1 2 3 4 5 6 平均值RSD/%仲丁威抗蚜威克百威灭多威未检出未检出未检出未检出未检出未检出未检出未检出10 20 10 20 10 20 10 20 8.06 17.7 9.62 18.4 8.37 17.2 8.63 17.6 8.19 17.5 9.95 18.7 8.62 17.9 8.86 17.3 8.45 18.2 9.89 17.5 8.44 18.1 8.79 16.5 8.13 18.4 9.68 19.2 8.75 17.6 8.71 16.9 8.29 17.4 10.04 17.9 8.51 18.5 8.57 17.2 8.36 17.1 9.79 18.1 8.67 17.4 8.98 17.9 8.25 17.7 9.83 18.3 8.56 17.8 8.76 17.2 1.78 2.80 1.64 3.30 1.69 2.69 1.73 2.88
表5 以小米为基质的精密度试验结果
Table 5 Precision test results using millet as substrate
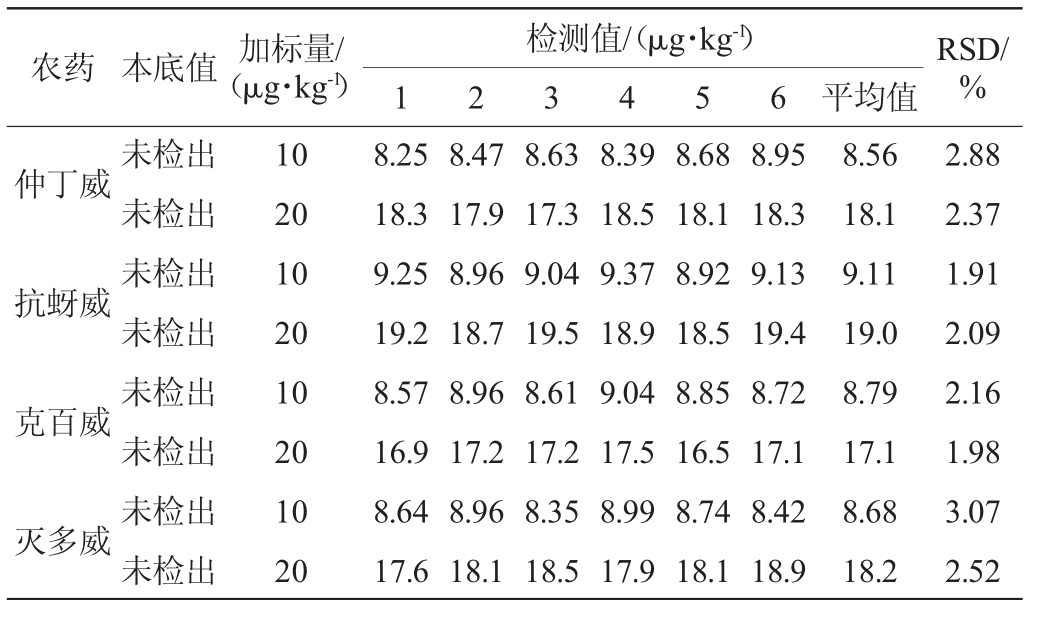
农药 本底值 加标量/(μg·kg-1)检测值/(μg·kg-1)1 2 3 4 5 6 平均值RSD/%仲丁威抗蚜威克百威灭多威未检出未检出未检出未检出未检出未检出未检出未检出10 20 10 20 10 20 10 20 8.25 18.3 9.25 19.2 8.57 16.9 8.64 17.6 8.47 17.9 8.96 18.7 8.96 17.2 8.96 18.1 8.63 17.3 9.04 19.5 8.61 17.2 8.35 18.5 8.39 18.5 9.37 18.9 9.04 17.5 8.99 17.9 8.68 18.1 8.92 18.5 8.85 16.5 8.74 18.1 8.95 18.3 9.13 19.4 8.72 17.1 8.42 18.9 8.56 18.1 9.11 19.0 8.79 17.1 8.68 18.2 2.88 2.37 1.91 2.09 2.16 1.98 3.07 2.52
2.6 样品测定
样品按照1.3.1中样品处理方法处理,在1.3.2色谱条件下进行测定。结果表明,在黄瓜、苹果和小米中未检出此4种农药。
3 结论
该研究建立了同时测定4种氨基甲酸脂类农药的高效液相色谱-二极管阵列检测方法。依据保留时间定性,外标法定量。通过对该方法的回收率、精密度等方法学技术指标的研究,表明该方法具有较好的精密度和准确性,样品加标平均回收率在82.5%~99.3%之间,精密度试验结果RSD在1.64%~3.30%之间。且方法的前处理简单,可为定性和定量分析样品中氨基甲酸脂类农药残留提供一种准确有效的检测方法。
[1]刘旭凌,李壹,熊晓辉.高效液相色谱-串联质谱法检测橘子中10 种氨基甲酸酯类农药残留[J].科学技术与工程,2015,15(9):10-14.
[2]杨华,马光,冯泉.正确认识农药,科学使用农药[J].北方果树,2006(2):34-35.
[3]FOUMIER D,MUTEM A.Comparative biochemistry and physiology part C:pharmacology[J].Toxicol Endocrinol,1994,108(1):19-31.
[4]张昊,刘传志,徐影,等.生物荧光传感器检测环境水样中氨基甲酸酯类农药残留[J].分析化学,2014,42(1):104-108.
[5]陈建波,张颂函,马琳,等.高效液相色谱法测定农药产品中非法添加的限制性农药氨基甲酸酯的含量[J].理化检验(化学分册),2019,55(1):74-78.
[6]张帆,李忠海,王利兵,等.食品中氨基甲酸酯类农药残留的检测方法研究进展[J].中国食物与营养,2010(2):64-67.
[7]张妮,王敏.气相色谱法检测农药残留过程中基质效应的研究[J].安徽农业科学,2014,42(21):7073-7075.
[8]李志,焦彦朝,王兴宁.气相色谱-质谱联用法测定茶叶中21 种农药残留[J].中国酿造,2019,38(3):181-186.
[9]何丛薇,李亚丽,高文惠.高效液相色谱法同时检测饲料中6 种农药残留[J].中国饲料,2015(15):26-28.
[10]姚丽君,杨璐,代弟,等.液相色谱-串联质谱法同时检测蔬菜中克百威和3-羟基克百威残留[J].食品安全质量检测学报,2017(4):294-299.
[11]GOLGE O,KABAK B.Determination of 115 pesticide residues in oranges by high-performance liquid chromatography-triple-quadrupole mass spectrometry in combination with QuEChERS method[J]. J Food Compos Anal,2015,41:86-97.
[12]陈静. 果蔬农产品中农药残留检测的研究进展[J]. 安徽农学通报,2015(19):116-117.
[13]林永强,林林,刘广桢,等.QuEChERS-SPE-UHPLC-MS/MS 测定瓜蒌中156 种农药残留[J].中国现代应用药学,2018,35(1):17-23.
[14]杨明,伊鋆,许晴,等.QuEChERS-HPLC-MS 测定蔬菜中29 种农药残留[J].中国酿造,2019,38(9):190-195.
[15]PAU C,FEMANDO C,ENRIQUE S,et al.Efficiency of QuEChERS approach for determining 52 pesticide residues in honey and honey bees[J].Methods,2016,3:452-458.
[16]SCHMIDT M L,SNOW N H.Making the case for QuEChERS-gas chromatography of drugs[J].Trac Trend Anal Chem,2016,75:49-56.
[17] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J].J Aoac Int,2003,86(2):412.
[18]赫彩霞,王姣姣,高文惠.高效液相色谱-DAD 法检测粮谷作物中多种菊酯类农药残留[J].粮食与油脂,2015,28(4):58-60.
[19]王洁莲,董燕飞.高效液相色谱法同时检测蔬菜中7 种农药残留方法的分析[J].中国农学通报,2015,31(12):267-272.
[20]王敏,李广益,宋丰江,等.高效液相色谱法测定蔬菜中氨基甲酸酯类农药[J].食品研究与开发,2018,39(1):122-125.