红茂草[Dicranostigma leptodum(Maxim.)Fedde(DLF)]在《本草纲目》中记载为秃疮花、石长生等,且为野生,始于兽用,是陕甘地区民间习用药材,在甘肃秦岭南北、渭水流域分布最为广泛[1-3]。其可用于治疗羊口疮、创伤性炎症、皮肤毛囊炎、扁桃腺炎,咽喉肿痛、淋巴结核、秃疤疥癣等症[4-7]。近年来,有学者主要针对红茂草生物碱、挥发油、黄酮类等有效成分进行分离提取,制成不同的药物剂型,从免疫学、毒理学、病理学等方面对其进行了大量的基础研究,尤其发现红茂草生物碱抑菌抗炎作用十分显著[8-10]。
多糖具有多种重要生物活性,有研究表明,红茂草制剂有促进小鼠脾细胞增殖,使T细胞增殖与活化;刺激巨噬细胞活化及细胞因子分泌;诱导并促使IL-2的分泌,增加红细胞免疫功能;对小鼠实验性肝损伤有保护作用,对化学试剂诱发的溶血有一定的抑制作用;小鼠腹腔注射红茂草提取物后,与模型组比较,红细胞数目增加,血红蛋白含量提高,白细胞数目减少,血浆丙二醛含量降低,四项指标均接近正常组[11-14]。为系统了解红茂草多糖的生物学功能,该研究通过正交法确定了红茂草多糖的提取工艺,将其作用于环磷酰胺诱导的免疫功能低下小鼠,并对其免疫功能进行研究,为该药材的深层次开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
红茂草:采于甘肃省天水市甘谷县新兴镇北山阳坡,经甘肃省畜牧兽医研究所鉴定。
1.1.2 试剂
葡萄糖标准品(纯度≥98%):北京索莱宝科技有限公司;小牛血清(规格100 mL)、补体(豚鼠血清)(纯度≥99%)、巴比妥酸(纯度≥98%):上海麦克林生物试剂公司;环磷酰胺(cyclophosphamide,CY)(纯度≥98%):山西普德药业有限公司;巴比妥钠(纯度≥99%)、酚红(分析纯)、微孔滤膜(0.22 μm):广州捷倍斯生物科技有限公司;Hank's液(pH=7.2~7.4)、氢氧化钠、浓硫酸、无水乙醇等均为国产分析纯。
1.1.3 试验动物
40日龄BALB/c试验小鼠(18~20 g)100只,雌雄各半购自甘肃省畜牧兽医研究所。
1.2 仪器与设备
UV-751GD型紫外-可见光分光光度计:上海分析仪器厂;RE52-99型旋转蒸发仪:上海亚荣生化仪器厂;AB104-S型电子分析天平:瑞士梅特勤公司;TD5A-WS型低速离心机:湖南湘仪试验室仪器开发有限公司;CR21G II型高速冷冻离心机:天美科技有限公司;CL-40S型全自动高压灭菌镉:日本ALP公司;51型笔式pH酸度计:上海牧晨电子技术有限公司。
1.3 试验方法
1.3.1 红茂草多糖提取工艺流程及操作要点

称取红茂草干草粉末50g,经风干、粉碎、过筛,用150mL体积分数95%乙醇溶液浸泡24 h后,转入索氏提取器,70 ℃回流热处理2 h,进行抽滤,50 ℃真空干燥,得到预处理样品(粗品)。再将预处理得到的红茂草样品加入100 mL蒸馏水,80 ℃索氏回流提取2 h,转入旋转蒸发仪浓缩、抽滤,滤液再经浓缩后加入等体积无水乙醇进行醇沉。静置、抽滤,沉淀依次用无水乙醇、丙酮、乙醚润洗,将沉淀转入真空干燥箱中干燥,得红茂草多糖。
1.3.2 多糖含量的测定
葡萄糖标准曲线的绘制:分别取质量浓度为0、20μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL[15]、120 μg/mL葡萄糖标准品溶液1 mL置于试管中,各加6%苯酚溶液1.8 mL,摇匀,分别再迅速滴加浓硫酸7.5 mL,摇匀后水浴20 min,冷却至室温。另以蒸馏水作空白试验。紫外分光光度计于波长483 nm处测吸光度值,以吸光度值(Y)对葡萄糖质量浓度(X)绘制葡萄糖标准曲线,得标准曲线回归方程Y=0.004 7X+0.010 2,相关系数R2=0.990 5。
按照标准曲线回归方程计算样品中多糖含量,并计算多糖产率[8],其计算公式如下:

1.3.3 多醣提取条件优化正交试验[15-17]
在单因素试验的基础上,以超声波处理时间、料液比、索氏回流时间、醇沉时间、酸碱度和乙醇体积分数为影响红茂草多糖提取效果的主要考察因素,采用正交试验设计,其因素与水平见表1。
表1 红茂草多糖提取条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization of Dicranostigma leptodum polysaccharides
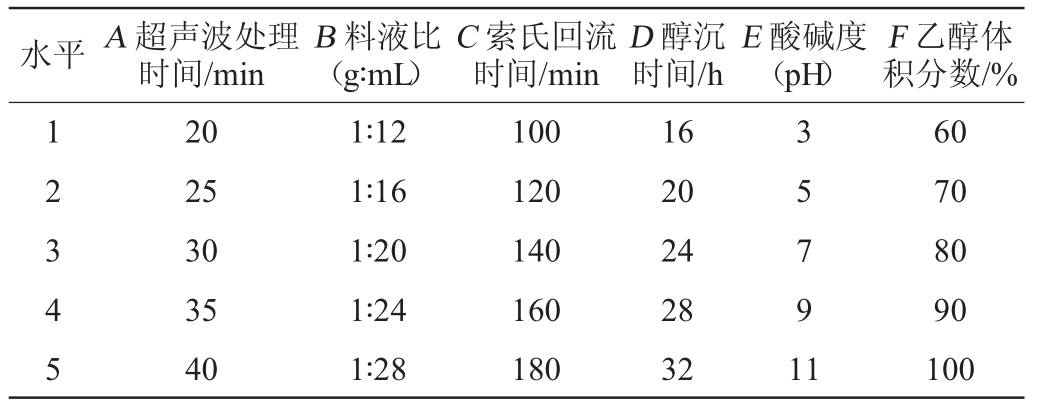
水平A 超声波处理时间/min B 料液比(g∶mL)C 索氏回流时间/min D 醇沉时间/h E 酸碱度(pH)F 乙醇体积分数/%1 2 3 4 5 20 25 30 35 40 1∶12 1∶16 1∶20 1∶24 1∶28 100 120 140 160 180 16 20 24 28 32 3 5 7 9 1 1 60 70 80 90 100
1.3.4 红茂草多糖对小鼠免疫功能的影响
(1)动物免疫抑制模型
选取50只BALB/c试验小鼠(18~20 g),雌雄各半,一周适应性喂养后,随机分为5组,每组10只。第1组为生理盐水对照组,每天灌胃无菌生理盐水0.5 mL;第2组为环磷酰胺阳性对照组,每天灌胃0.9%的生理盐水0.5 mL,连续灌胃3 d后,隔天腹腔注射100 mg/kg环磷酰胺,共注射5次;第3、4、5组为红茂草多糖试验组,各组分别按100 mg/kg、200 mg/kg、400 mg/kg的剂量每天灌胃红茂草多糖,连续灌胃3 d后,各试验组灌胃的同时隔天腹腔注射100 mg/kg环磷酰胺,共注射5次[18]。
(2)胸腺指数和脾脏指数的测定
按照1.3.4(1)方法构建模型,最后一次注射环磷酰胺3 d后,将建模小鼠称质量、处死,摘取胸腺、脾脏,生理盐水漂洗,滤纸吸干水分,称质量,计算胸腺指数和脾脏指数,其公式如下:
(3)对免疫功能低下小鼠迟发型变态反应、抗体生成细胞和血清溶血素含量的影响
按照1.3.4(1)方法构建的动物模型,最后一次注射环磷酰胺3 d后,全部小鼠腹腔注射2%绵羊红细胞(sheep red blood cells,SRBC)0.2 mL/只,当小鼠经2%的SRBC免疫3 d后,测量全部小鼠左后足趾的厚度,而后在其足趾皮下注射20%的SRBC 20 μL(约1×108 SRBC),并与注射后24 h、48 h各测一次同一部位的足趾厚度,免疫5 d后将所有供试小鼠称质量,眼眶采血,室温条件下放置30 min,2 500 r/min离心10 min,取血清分装,备用;小鼠断颈椎处死,无菌条件下取其脾脏,生理盐水漂洗,滤纸吸干水分,称质量。参考张锦锦等[19]的方法,分别测定红茂草多糖对免疫功能低下小鼠迟发性变态反应、对抗体生成细胞的影响和对血清半数溶血值(50%hemolytic value,HC50)的影响。
SRBC半数溶血值:取10%SRBC,0.25 mL,加SA液至4 mL,测定OD540nm值。
(4)巨噬细胞吞噬功能的检测
按照1.3.4方法构建模型,最后一次注射环磷酰胺48 h后,每只小鼠腹腔注射5%鸡红细胞1 mL,2 h后颈椎脱臼法处死小鼠,腹腔中注射含5%小牛血清的Hank's液2 mL,轻揉小鼠腹部1 min,在腹部剖一小口,用吸管吸取腹腔液,将各处理组小鼠腹腔液混合,涂片,将其放入垫有湿纱布的瓷盘中,置于37 ℃恒温箱中30 min,而后用生理盐水冲洗悬浮的细胞,室温条件下晾干,Giemsa染色10 min,蒸馏水冲洗多余染料,晾干、计数,每片计数200个吞噬细胞,计算吞噬率和吞噬指数[20-21]。

1.3.5 数据处理
SPSS 22.0统计软件,对各组数据进行差异显著性分析。
2 结果与分析
2.1 多糖提取工艺优化正交试验
在单因素试验的基础上,以超声波处理时间、料液比、索氏回流时间、醇沉时间、酸碱度和醇沉浓度为影响红茂草多糖提取效果的主要考察因素,采用正交试验设计优化多糖提取条件,正交试验结果与分析见表2,正交试验结果方差分析见表3。
表2 红茂草多糖提取条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization of Dicranostigma leptodum polysaccharides
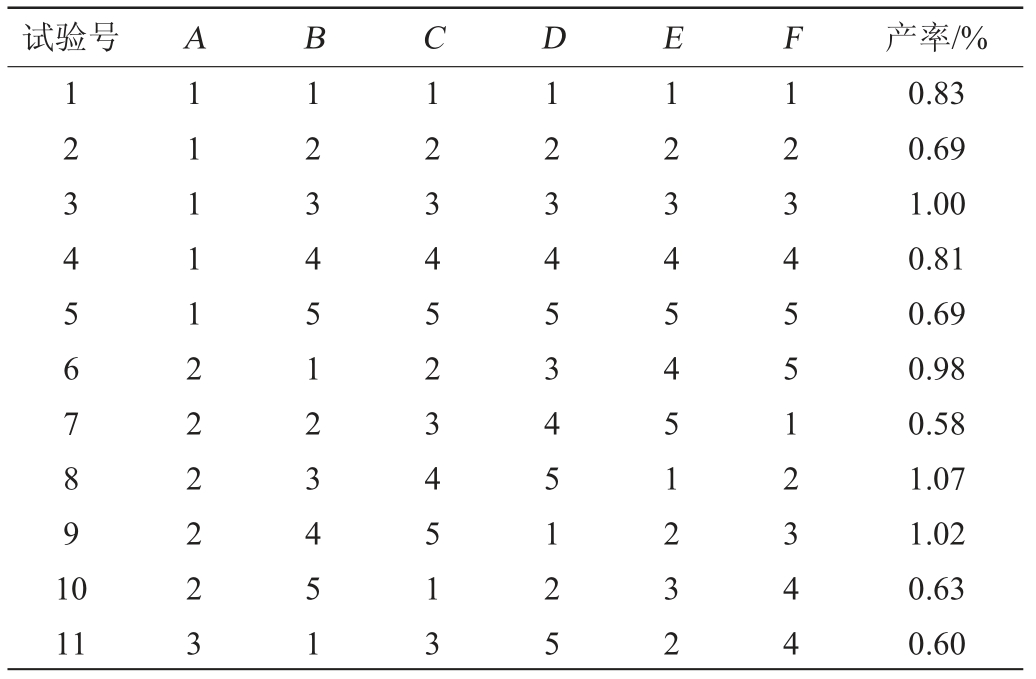
试验号 A B C D E F 产率/%1234567891 0 11 11111222223 12345123451 12345234513 12345345125 12345451232 12345512344 0.83 0.69 1.00 0.81 0.69 0.98 0.58 1.07 1.02 0.63 0.60
续表
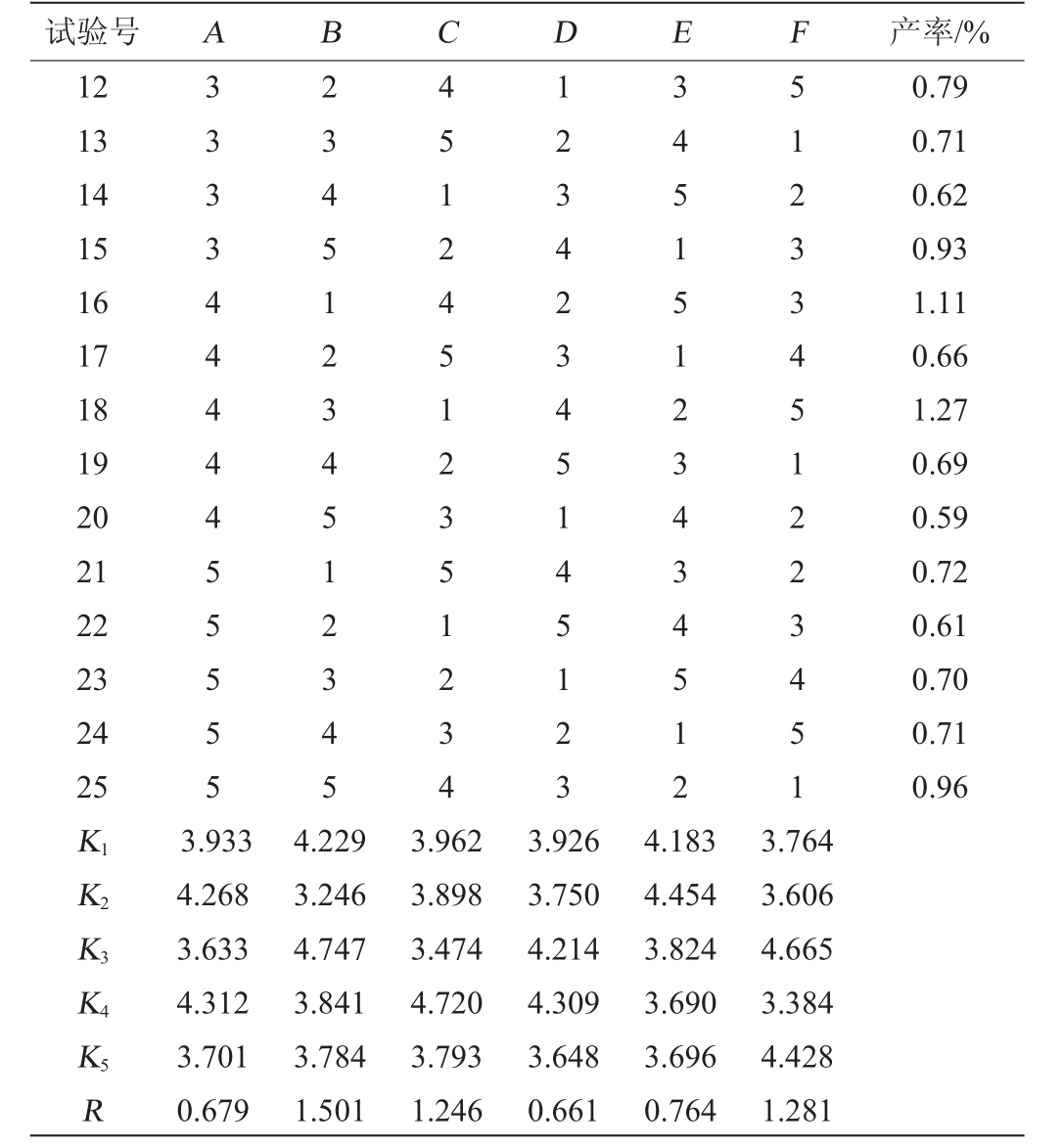
率/%17 18 19 20 21 22 23 24 25 444455555 234512345 512351234 345145123 123434512 451223451.79.71.62.93.11 0.66 1.27 0.69 0.59 0.72 0.61 0.70 0.71 0.96 K1K2K3K4K5R 3.933 4.268 3.633 4.312 3.701 0.679 4.229 3.246 4.747 3.841 3.784 1.501 3.962 3.898 3.474 4.720 3.793 1.246 3.926 3.750 4.214 4.309 3.648 0.661 4.183 4.454 3.824 3.690 3.696 0.764 3.764 3.606 4.665 3.384 4.428 1.281
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
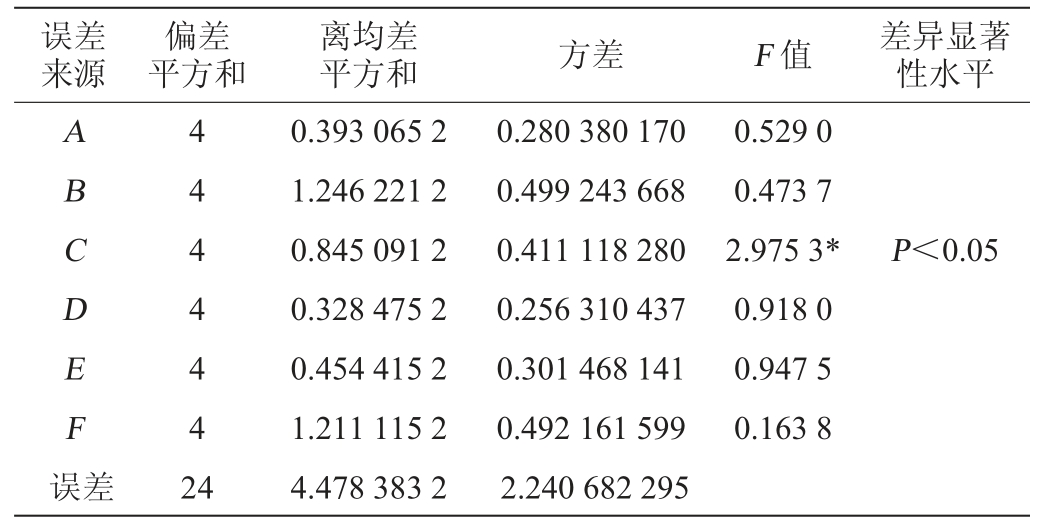
注:“*”表示差异显著(P<0.05)。
误差来源偏差平方和平方和 方差 F 值 差异显著性水平离均差ABCDEF误差4 4 4 4 4 4 2 4 0.393 065 2 1.246 221 2 0.845 091 2 0.328 475 2 0.454 415 2 1.211 115 2 4.478 383 2 0.280 380 170 0.499 243 668 0.411 118 280 0.256 310 437 0.301 468 141 0.492 161 599 2.240 682 295 0.529 0 0.473 7 2.975 3*0.918 0 0.947 5 0.163 8 P<0.05
由表2可知,影响红茂草多糖产率的主次因素为B>F>C>E>A>D,优选出的最佳提取工艺组合为A4B3C4D4E2F3,即超声波处理35 min、料液比为1∶20(g∶mL)、索氏回流160 min、醇沉28 h、pH为5和乙醇体积分数80%。按此工艺条件其多糖产率可达1.19%。由表3可知,仅C因素对结果影响达显著水平(P<0.05)。
2.2 对小鼠胸腺指数和脾脏指数的影响
以环磷酰胺为免疫抑制剂,100 mg/kg剂量连续对小鼠腹腔注射5次,成功构建小鼠免疫抑制模型。由表4可知,与对照组相比,CY组胸腺指数和脾脏指数均明显下降,说明免疫抑制造模成功。不同浓度的红茂草多糖灌胃配合CY腹腔注射处理组,与CY组相比,100 mg/kg、200 mg/kg、400 mg/kg的红茂草多糖可对抗CY造成的免疫抑制,对脾脏指数和胸腺指数有不同程度的提升作用,差异极显著(P<0.01)。给免疫功能低下小鼠灌服红茂草多糖溶液,在100~400 mg/kg质量浓度范围内,红茂草多糖对小鼠胸腺指数和脾脏指数呈明显上升趋势,能显著提高小鼠脾脏指数和胸腺指数(P<0.05),表明红茂草多糖促进了小鼠脾脏和胸腺的生长发育,进而增强机体免疫功能。
表4 红茂草多糖对免疫功能低下小鼠胸腺指数、脾指数的影响
Table 4 Effect of Dicranostigma leptodum polysaccharides on thymus index and spleen index of low immune mice
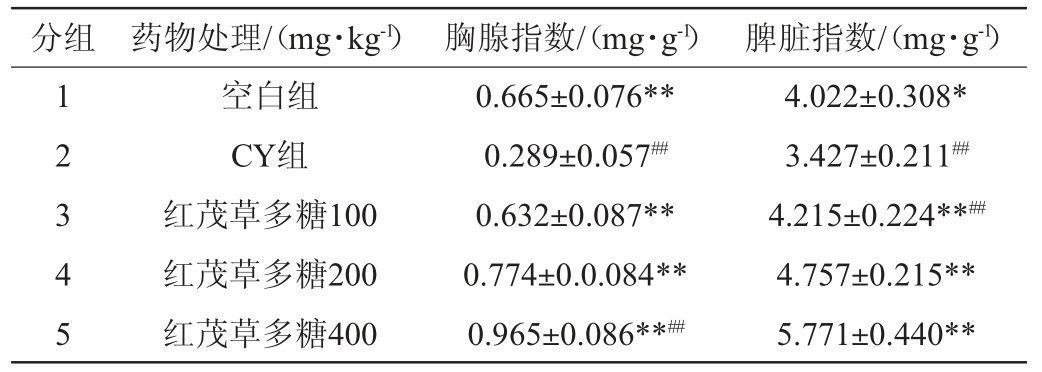
注:与阳性组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);与空白组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01)。下同。
分组 药物处理/(mg·kg-1) 胸腺指数/(mg·g-1) 脾脏指数/(mg·g-1)1 2 3 4 5空白组CY组红茂草多糖100红茂草多糖200红茂草多糖400 0.665±0.076**0.289±0.057##0.632±0.087**0.774±0.0.084**0.965±0.086**##4.022±0.308*3.427±0.211##4.215±0.224**##4.757±0.215**5.771±0.440**
2.3 对免疫功能低下小鼠的影响
2.3.1 对免疫功能低下小鼠迟发型变态反应的影响
小鼠足趾皮下注射10%SRBC前、注射10%SRBC 24 h和48 h后各测量一次试验鼠足趾厚度。由表5可知,CY组能显著降低小鼠迟发性变态反应的能力,空白对照组24 h和48 h足趾厚度与CY组相比均有极显著差异(P<0.01),说明CY能够降低迟发性变态反应的能力,造模成功。与CY组相比,红茂草多糖三个剂量组对小鼠迟发型变态反应作用在24 h和48 h均极显著提高(P<0.01),说明红茂草多糖能够提高免疫低下小鼠迟发性变态反应。
表5 红茂草多糖对免疫功能低下小鼠迟发型变态反应的影响
Table 5 Effect of Dicranostigma leptodum polysaccharides on delayed allergic reaction of low immune mice
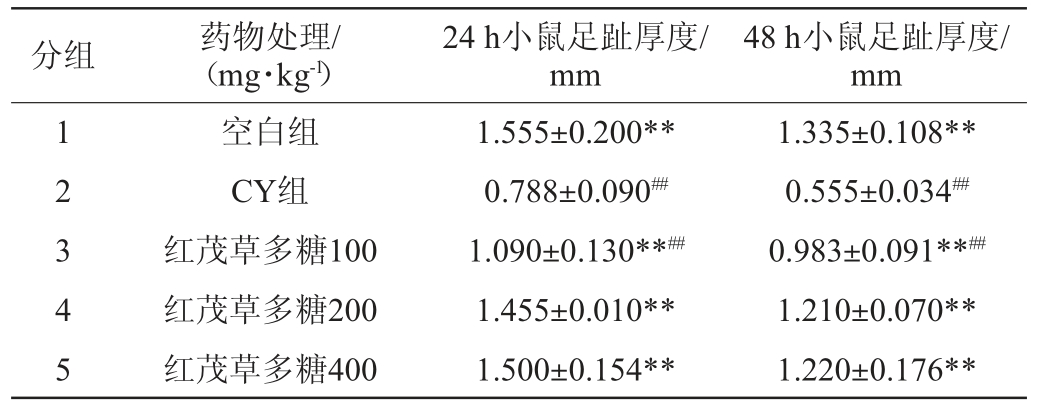
分组 药物处理/(mg·kg-1)24 h小鼠足趾厚度/mm 48 h小鼠足趾厚度/mm 1 2 3 4 5空白组CY组红茂草多糖100红茂草多糖200红茂草多糖400 1.555±0.200**0.788±0.090##1.090±0.130**##1.455±0.010**1.500±0.154**1.335±0.108**0.555±0.034##0.983±0.091**##1.210±0.070**1.220±0.176**
2.3.2 对免疫功能低下小鼠抗体生成细胞的影响
通过定量溶血分光光度法测定红茂草多糖对免疫功能低下小鼠抗体生成细胞的影响。由表6可知,与空白对照组相比,CY组小鼠脾淋巴细胞光密度差值极显著降低(P<0.01),说明CY可抑制小鼠脾淋巴细胞的增殖转化,建模成功;红茂草多糖处理组与CY组相比,小鼠脾淋巴细胞光密度差值极显著升高(P<0.01),且随红茂草多糖剂量的提高而增大,表明红茂草多糖能提高免疫功能低下小鼠抗体生成细胞分泌抗体的能力,和剂量呈正相关性,反映高浓度多糖对免疫功能低下小鼠抗体生成细胞分泌抗体的促进作用更加明显,红茂草多糖能一定程度上逆转CY所致的小鼠淋巴细胞增殖转化能力的降低,增强小鼠的细胞免疫功能。
表6 红茂草多糖对免疫功能低下小鼠抗体生成细胞的影响
Table 6 Effect of Dicranostigma leptodum polysaccharides on antibody-producing cells of low immune mice

分组 药物处理/(mg·kg-1) OD540 nm值1 2 3 4 5空白组CY组红茂草多糖100红茂草多糖200红茂草多糖400 1.496±0.080**0.774±0.018##1.060±0.018**##1.485±0.042**1.518±0.067**
2.3.3 对免疫功能低下小鼠血清溶血素含量的影响
血清半数溶血值(HC50)变化是评定药物对体液免疫作用效果的一个重要指标。由表7可知,与CY组相比,100 mg/kg、200 mg/kg、400 mg/kg的红茂草多糖均能显著提高小鼠血清半数溶血值,100 mg/kg差异显著(P<0.05),200 mg/kg和400 mg/kg组差异极显著(P<0.01);与空白对照组比较,红茂草多糖处理组均低于空白组,100 mg/kg和200 mg/kg差异极显著(P<0.01),400 mg/kg无显著差异性(P>0.05)。表明红茂草多糖可以提高免疫功能低下小鼠血清溶血素含量,高浓度条件下可以使免疫功能低下小鼠血清溶血素接近正常水平。
表7 红茂草多糖对免疫功能低下小鼠血清溶血素的影响
Table 7 Effect of Dicranostigma leptodum polysaccharides on serum hemolysin of low immune mice
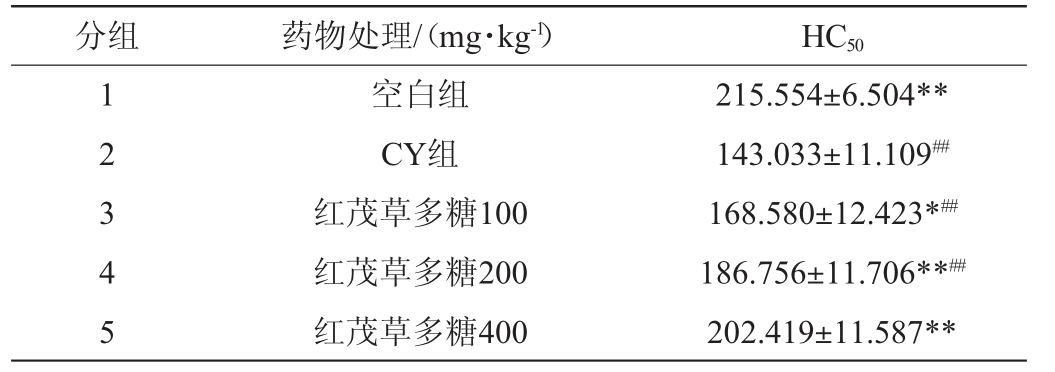
分组 药物处理/(mg·kg-1) HC50 1 2 3 4 5空白组CY组红茂草多糖100红茂草多糖200红茂草多糖400 215.554±6.504**143.033±11.109##168.580±12.423*##186.756±11.706**##202.419±11.587**
2.3.4 对免疫低下小鼠腹腔巨噬细胞的影响
由表8可知,与空白对照组相比,CY组巨噬细胞吞噬百分率极显著降低(P<0.01),说明免疫功能低下小鼠模型建立成功;红茂草多糖200 mg/kg组的吞噬百分率与CY组相比显著提高(P<0.05),红茂草多糖400 mg/kg组胞的吞噬百分率与CY组相比极显著提高(P<0.01),红茂草多糖100 mg/kg组的吞噬百分率与CY组相比有所提高,但无显著差异(P>0.05);红茂草多糖处理组的吞噬指数与CY组相比有一定程度的提高,但无显著差异性(P>0.05),空白对照组吞噬指数略高于CY组,但也无统计学意义。表明红茂草多糖作用于免疫抑制小鼠主要是促进巨噬细胞的增值和激活巨噬细胞,但对巨噬细胞本身的吞噬效率没多大影响,红茂草多糖能促进小鼠非特异性免疫功能。
表8 红茂草多糖对免疫功能低下小鼠腹腔巨噬细胞的影响
Table 8 Effect of Dicranostigma leptodum polysaccharides on peritoneal macrophage of low immune mice
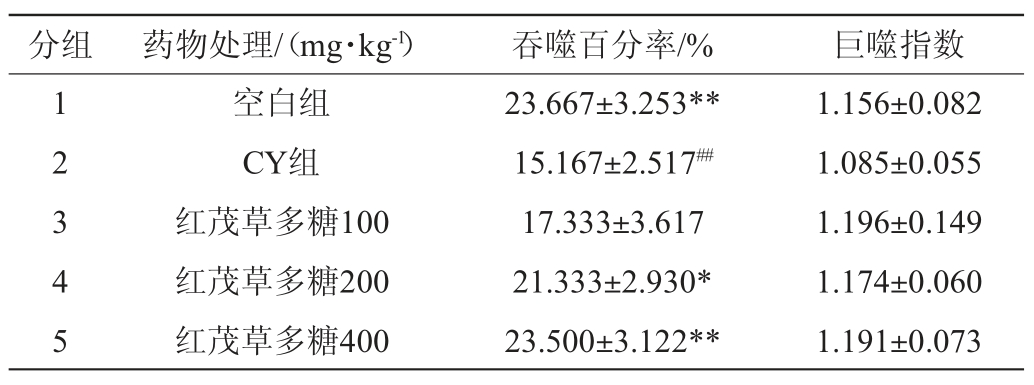
分组 药物处理/(mg·kg-1) 吞噬百分率/% 巨噬指数1 2 3 4 5空白组CY组红茂草多糖100红茂草多糖200红茂草多糖400 23.667±3.253**15.167±2.517##17.333±3.617 21.333±2.930*23.500±3.122**1.156±0.082 1.085±0.055 1.196±0.149 1.174±0.060 1.191±0.073
3 结论
通过对红茂草多糖提取的一系列影响因素进行考察,确定其最佳正交提取工艺为超声波处理35 min、料液比为1∶20、索氏回流160 min、醇沉28 h、pH为5和体积分数80%的乙醇,按此工艺条件其多糖产率可达1.19%,对提取物进行性质检测,确定其为多糖成分。将100 mg/kg的红茂草多糖通过刺激巨噬细胞的增殖和活化来提高CY抑制小鼠的吞噬能力,从而使免疫功能低下小鼠非特异性免疫能力得以恢复,在100~400 mg/kg范围内有剂量效应。400 mg/kg的红茂草多糖可以提高CY抑制小鼠细胞免疫反应能力,从而使免疫功能低下小鼠非特异性免疫能力得以恢复,在100~400 mg/kg范围内有剂量效应。红茂草多糖通过刺激B淋巴细胞增殖的途径来提高CY抑制小鼠细体液免疫反应能力,从而使免疫功能低下小鼠非特异性免疫能力得以恢复,从而提高免疫低下小鼠的免疫功能。
天然药物成分中绝大多数多糖,不仅对正常细胞无毒副作用,而且能够提高机体免疫功能,具有抗病毒、抗辐射、抗癌、降血糖、减肥和清除氧化自由基作用,其药用潜力巨大。本研究为天然药用植物红茂草资源的深层次开发和利用,提供了一定的理论参考,也为该药物今后的临床应用提供了可靠的试验依据。
[1]赵强.我国秃疮花属植物资源及利用[J].中国兽医科学,2019,38(1):28-30.
[2]赵强.红茂草生物碱对黏虫卵的杀灭作用[J].畜牧与饲料科学,2016,37(1):10-11.
[3]ZHANG A,SUN H,WANG X.Recent highlights of metabolomics for traditional Chinese medicine[J].Pharmazie,2012,67(8):667-675.
[4]王廷璞,高义霞,赵强.红茂草生物碱对肺炎克雷伯菌的抑菌作用及机理初探[J].天水师范学院学报,2018,38(2):24-27.
[5]王廷璞,关倩,方继利.红茂草生物碱对金黄色葡萄球菌的抑菌作用研究[J].中兽医医药杂志,2017,6:13-16.
[6]赵强,王廷璞.野生药用红茂草挥发油提取及抗氧化活性研究[J].草地学报,2014,24(2):473-478.
[7]赵强,余四九,王廷璞.响应面法优化秃疮花中生物碱提取工艺及抑菌活性研究[J].草业学报,2012(8):206-214.
[8] ZHAO Q. Endophyte and their relationship with alkaloid synthesis in the Dicranostigma leptopodum (Maxim.) Fedde[J]. J Adv Oxidat Technol,2018,6(2):94-97.
[9]赵强,王廷璞,余四九.红茂草生物碱正交提取工艺模式优化及清除自由基作用的研究[J].草地学报,2011,8(4):206-214.
[10]赵强.利用模拟生物膜识别红茂草黄酮类化合物的药物效能[J].中兽医医药杂志,2016(4):14-18.
[11]魏明,王晨,杨超英.酶法协同超声波提取米糠多糖及其抗氧化活性研究[J].中国油脂,2015,40(1):78-82.
[12]王振吉,杨申明,许云香,等.酶法协同超声波提取米糠多糖及其抗氧化活性研究[J].中国酿造,2019,38(9):185-189.
[13]WANG L,LI Y,ZHU L,et al.Antitumor activities and immunomodulatory of rice bran polysaccharides and its sulfates in vitro[J].Int J Biol Macromol,2016,88:424-432.
[14]赵强,赵海福.红茂草中氨基酸组分及矿物质元素含量的测定[J].中国酿造,2016,35(2):148-152.
[15]李翠丽,王炜,张英.中药多糖提取、分离纯化方法的研究进展[J].中国药房,2016,27(19):2700-2703.
[16]乔丽洁,王安平,阿依夏古丽·巴斯卡.响应面法优化天山岩黄芪多糖提取工艺[J].食品安全质量检测学报,2020,11(1):59-64.
[17]文喜艳,邵晶,王兰霞.正交设计结合3 种比色法优选黄芪多糖提取工艺[J].中华中医药杂志,2018,33(4):1562-1566.
[18] JI P, WEI Y, HUA Y, et al. A novel approach using meTableolomics coupled with hematological and biochemical parameters to explain the enriching-blood effect and mechanism of unprocessed Angelica sinensis and its 4 kinds of processed products[J].J Ethnopharmacol,2017,6:123-125.
[19]张锦锦,陈菲菲,严展鹏.灵芝β-葡聚糖的碱提取及其抗肿瘤免疫调节研究[J].药学学报,2020(1):17.
[20]刘贝女,张屏,吴迎香.悬钩子木多糖的分离纯化及免疫调节活性研究[J].中草药,2019(24):5941-5949.
[21]马玉芳,郑小香,衣伟萌.金线莲多糖对免疫抑制小鼠脾淋巴细胞体外增殖、分泌NO 及细胞因子的影响[J].天然产物研究与开发,2018(30):21-26.