白酒在中国有着源远流长的历史,深受人民群众喜爱,经久不衰[1]。它是以谷粮为制酒原料,酒曲为糖化发酵剂,经蒸馏、贮存和勾调而成[2],是世界著名六大蒸馏酒之一。酯类是白酒中的主要香气成分,大多以乙酯形式存在,对白酒风格的形成起关键作用。其中乙酸乙酯是清香型白酒的主体香气成分,适量的乙酸乙酯可以使酒体丰满、柔和,香气协调,其含量的高低直接影响清香型白酒的品质[3]。
在传统清香型白酒的酿造过程中,酿酒酵母(Saccharomyces cerevisiae)主要产乙醇,产生的乙酸乙酯很少。产香酵母是产乙酸乙酯的主要发酵微生物,但其产乙醇的能力较低[3-4]。为了获得一定量的乙酸乙酯,通常会增加粮耗、延长发酵周期。长期采取这种方式效率低、成本高。为了改善这一状况,构建新型产乙酸乙酯酿酒酵母菌株,使其在发酵过程中保持优良酒精发酵特性的同时生产基础酯香物质乙酸乙酯,对于白酒产品风味特征的维持与强化,以及白酒质量的提高与稳定具有重要意义。酵母中产酯的途径主要有两条,一是通过自身含有的少量酯化酶催化酸和醇直接形成酯;另一条是通过醇酰基转移酶(alcohol acyltransferase,AAT)将酰基辅酶A中的酰基转移到醇类底物形成酯,后者是酵母产酯的主要途径[5]。相关研究表明,醇酰基转移酶基因ATF1、ATF2的表达水平对乙酸乙酯和乙酸异戊酯的合成影响很大[6-8]。LILLY M等[9]在工业菌株中过表达ATF1基因,以葡萄汁发酵培养基进行发酵,最终葡萄酒中的乙酸乙酯浓度提高了20%~90%,乙酸异戊酯浓度提高了30%~110%。SAERENS S M等[10-11]证明了酿酒酵母中的醇酰基转移酶EHT1、EEB1在发酵过程中主要负责中链脂肪酸乙酯的生物合成,同时对乙酸乙酯这类短链酯也有一定的催化活性。目前,国内对酿酒酵母的研究中,大多是对内源醇酰基转移酶基因进行过表达以提高乙酸乙酯的产量,关于引入外源尤其是绿色植物来源的醇酰基转移酶基因以达到大幅提高乙酸乙酯产量的研究较少。同时,绿色植物作为一个巨大且丰富的天然AAT库,存在可开发用于提高酿酒酵母酯合成的潜力。
另一方面,白酒发酵过程中产生的高级醇具有独特的呈味特征,对酒的风味形成发挥着不可替代的作用[12]。适量的高级醇不仅可以衬托出酯的香气,赋予酒类特殊的香味,还可以使酒的口感更加柔和、醇厚,给人以圆润、丰满、协调的感觉[13]。但高级醇含量过高,会使白酒产生令人不愉快的异杂味[14],一般白酒中高级醇含量要求<0.2 g/100 mL(按60%vol计)[15]。此外,高级醇在人体内的氧化速度比乙醇慢,停留时间较乙醇长,其对人体的毒害作用也远远高于乙醇。在白酒工业生产中,一般通过改善工艺条件来控制高级醇的产量。孙金旭[16]研究表明,增加大曲用量和添加糖化酶可以降低高级醇的产量。罗惠波等[17]研究表明,适当减少水用量、加糠量以及投粮量,均可以降低高级醇的产生。另外通过代谢工程提升高级醇的利用率,构建新型高产酯低产高级醇的酿酒酵母菌株,也是目前工业微生物育种的研究方向之一[14]。
本研究将来自绿色植物猕猴桃和草莓的醇酰基转移酶基因AeAT9[18]、VAAT[19-20]分别引入酿酒酵母AY12-α,并通过强启动子PGK1p对其进行过表达。对获得的重组菌株进行白酒液态模拟发酵,分析两基因对酿酒酵母产乙酸乙酯和高级醇的影响,为通过引入外源AAT提高酿酒酵母产酯能力的研究提供理论与实验参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本实验所用菌株和质粒见表1。
表1 实验中所用菌株和质粒
Table 1 Strains and plasmids used in this study

菌株和质粒 基因型 来源菌株大肠杆菌(Escherichia coli)DH5a酿酒酵母(Saccharomyces cerevisiae)AY12 AY12-α α-VAAT α-AeAT9质粒PUG6 pGAPza Yep352-PGK Yep352-PGK(VAAT)Yep352 PGK(AeAT9)PUC57-AeAT9 PUC57-VAAT supE44 ΔlacU169 Φ80 lacZΔM15 hsdR17 recAl endAl gyrA thi-1 relA1工业白酒酵母营养双倍体AY12的单倍体,α型AY12-α、Gal80::PGK1P-VAAT-PGK1T-loxP-KanMX-loxP AY12-α、Gal80::PGK1P-AeAT9-PGK1T-loxP-KanMX-loxP Apr、Kanr、loxP-KanMX-loxP Apr、Cre-loxp操作体系Apr、PGK1P-PGK1T Apr、PGK1P-VAAT-PGK1T Apr、PGK1P-AeAT9-PGK1T Kanr、AeAT9 Kanr、VAAT本实验室安琪酵母股份有限公司本实验室本研究本研究本实验室本实验室本实验室本研究本研究本研究本研究
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸粉10g/L、蛋白胨20 g/L、葡萄糖20 g/L,pH自然,121 ℃高压灭菌15 min。固体培养基添加琼脂粉2 g/L。
LB培养基:酵母浸粉5 g/L、蛋白胨10 g/L、氯化钠10 g/L,pH自然,121 ℃高压灭菌15 min。固体培养基添加琼脂粉2 g/L。
半乳糖诱导培养基[21]:酵母浸粉10 g/L、蛋白胨20 g/L、半乳糖20 g/L,pH自然,121 ℃高压灭菌15 min。
玉米水解液[22]:玉米粉碎颗粒和65~70 ℃的水按料液比1∶3(g∶mL)混合,放置20 min,使颗粒充分吸水膨胀;加入适量液化酶(α-淀粉酶)(2×104 U/mL),在85~90 ℃水浴液化1.5 h,每隔一段时间搅拌一次;液化完成后降温至60 ℃,加入适量糖化酶(1×105 U/mL),在55~60 ℃水浴糖化20 h;待糖化液降温后,用三层纱布过滤,得到澄清滤液即玉米水解液,pH自然,105 ℃灭菌20 min,备用。
一级发酵种子培养基[21]:调节玉米水解液的糖度为8°Bx,加入0.5%酵母浸粉,105 ℃灭菌20 min。
二级发酵种子培养基[21]:调节玉米水解液的糖度为12°Bx,加入0.5%酵母浸粉,105 ℃灭菌20 min。
发酵培养基[21]:调节玉米水解液的糖度为18°Bx,添加MgSO4 150 g/L、KH2PO4 75 g/L、尿素81 g/L,105 ℃灭菌20 min。
1.1.3 主要试剂
酵母浸粉、蛋白胨、琼脂(均为生化试剂):北京奥博星生物技术有限公司;葡萄糖(生化试剂):天津市永大化学试剂开发中心;硫酸镁、磷酸二氢钾、尿素、氯化钠(均为分析纯):天津市北方天医化学试剂厂;耐高温糖化酶(2×104 U/mL)、液化酶(1×105 U/mL)、酸性蛋白酶(5×104 U/mL):丹麦Novozymes公司;PrimeSTAR Max高保真脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、rTaq聚合酶(5 U/μL)、限制性核酸内切酶XhoI(5 U/μL):大连宝生物工程有限公司;ClonExpressTMⅡ重组克隆试剂盒:南京诺唯赞生物科技有限公司;卡那霉素(kanamycin,Kan):美国Amreco公司;遗传霉素(G418):美国Merck公司;质粒提取试剂盒、DNA纯化回收试剂盒、切胶回收试剂盒:北京Solarbio科技有限公司。
1.2 仪器与设备
PCT-200聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、DYY-4c电泳仪:美国BIO-RAD公司;Agilent 7890气相色谱(gas chromatography,GC)仪、Agilent 1100高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司;Bioscreen全自动生长曲线测定仪:芬兰Bioscreen公司。
1.3 方法
1.3.1 重组菌株的构建
(1)引物设计
根据美国国立生物技术信息中心(national center for biotechnology information,NCBI)中GenBank数据库中报道的Gal80、AeAT9、VAAT基因的核苷酸序列,运用Primer 5.0软件设计实验中所需的PCR扩增引物,见表2。所有引物均由金维智生物科技有限公司合成。
表2 实验中所用引物
Table 2 Primers used in this study

注:“U”表示上游引物,“D”表示下游引物,下划线表示酶切位点。
引物名称 引物序列(5'→3') 酶切位点PGK1P-U PGK1P-D PGK1T-U PGK1T-D AeAT9-U AeAT9-D VAAT-U VAAT-D GA-U GA-D GB-U GB-D Kr-U Kr-D PP-U PP-D D1-U DA-D DV-D DA-U DV-U D2-D D3-U D3-D CGGGATCCTCTAACTGATCTATCCAAAACTGA GAGATCTGGAATTCCGATCTTGTTTTATATTTGTTG GAATTCCAGATCTCCTCGAGGGATCTGCGATAGATCAAT ACGCGTCGACGTAACGAACGCAGAATTTTC ATCGGAATTCCAGATCTCCTCGAGATGGCTTCATCTGTCAGG TTGATCTATCGCAGATCCCTCGAGTTAAGAGTATGGAGATCTA GGAATTCCAGATCTCCTCGAGATGAACAAAATTGAAGTTTC ATCTATCGCAGATCCCTCGAGTTAATATCTAGATATCAA TCAAGATACAGAACCTCCTC TTCAGTTTTGGATAGATCAGTTAGACATTAGGCACGGTTGA TATCAGATCCACTAGTGGCCTATGCAAATGGCGGTTGGTAC GTGGAGCCCATCATGTTAC TAACTCGAAAATTCTGCGTTCGTTACAGCTGAAGCTTCGTACGCTGC TTCGTAGCCGTACCAACCGCCATTTGCATAGGCCACTAGTGGAT TCTTCGGTCTCAACCGTGCCTAATGTCTAACTGATCTATCCAAAAC CCTGCAGCGTACGAAGCTTCAGCTGTAACGAACGCAGAATTTTC CATCAATGTCCCTCACC TTAAGAGTATGGAGATCTA TTAATATCTAGATATCAA ATGGCTTCATCTGTCAGG ATGAACAAAATTGAAGTTTC GCATAGGCCACTAGTGGAT CAGCTGAAGCTTCGTACGCTGC AGCACGGGTATGAAGATC BamHI EcoRI、BglII SalI XhoI XhoI XhoI XhoI-
(2)重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)的构建
以Yep352-PGK作为基础质粒分别构建重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT),构建流程见图1。具体方法:在NCBI上分别找到猕猴桃和草莓的醇酰基转移酶蛋白序列(AIC83789.1、CAC09062.1),并交由苏州金唯智公司完成酿酒酵母的密码子优化和基因合成,优化后的AeAT9基因序列如下:
GAAAACAACAGCAGCAACAAAATGGCAAGCTCT GTACGACTAGTGAAAAAGCCTGTCCTGGTCGCTCCCG TAGATCCCACACCGTCCACCGTCCTCTCTCTCTCCTCC CTCGACTCGCAGCTCTTCCTCCGCTTCCCCATCGAGT ACTTACTCGTCTACGCCTCACCCCACGGCGTAGACCG GGCCGTCACTGCTGCTCGCGTAAAGGCTGCTCTTGCT CGAAGCCTGGTGCCTTACTACCCCTTGGCGGGCCGAG TCAAAACCCGGCCAGACAGCACTGGACTCGACGTGG TGTGTCAAGCTCAGGGCGCGGGGTTACTGGAGGCGG TGTCAGATTACACCGCGTCGGACTTTCAACGGGCCCC ACGGTCCGTGACCGAGTGGAGGAAGTTGTTATTGGTT GAGGTTTTCAAAGTAGTCCCGCCACTGGTGGTTCAGC TGACGTGGCTTTCGGACGGTTGTGTGGCTTTGGGGGT TGGGTTTAGTCACTGTGTCATCGACGGCATTGGAAGC TCCGAATTTCTCAATTTGTTCGCTGAGTTAGCCACTG GCAGAGCCAGACTCAGTGAGTTTCAACCCAAACCGG TCTGGGACCGTCACCTTCTCAACTCAGCGGGTCGGAC CAATCTAGGAACTCACCCCGAGTTCGGCCGAGTCCCT GACCTTTCTGGGTTCGTGACACGGTTTACCCAAGAGC GACTCAGTCCCACTTCAATCACATTCGACAAAACATG GCTTAAAGAATTGAAAAATATCGCCATGTCAACGAGT CAACCCGGTGAGTTCCCCTACACGTCGTTTGAAGTTC TCTCAGGTCATATTTGGAGAAGCTGGGCGAGATCGTT AAACTTACCGGCGAAACAAGTTTTAAAGCTTCTCTTC AGTATCAACATACGAAACCGAGTCAAGCCGAGTCTA CCCGCTGGTTACTACGGCAACGCATTCGTACTCGGCT GCGCGCAAACGTCCGTTAAGGACTTAACGGAGAAGG GGTTGGGTTATTGTGCTGATTTAGTGAGGGGTGCGAA GGAGCGAGTCGGGGACGAGTACGCGAGAGAAGTGGT GGAATCGGTGAGTTGGCCGAGGCGGGCGAGTCCGGA CTCGGTGGGCGTGTTGATTATTTCGCAGTGGTCGAGG CTTGGGCTGGACCGGGTTGACTTTGGGCTGGGCAGGC CGGTCCAAGTGGGGCCAATCTGCTGCGATCGGTACTG CTTGTTTCTGCCGGTTCGCGAATCGACGGAGTCCGTG AAGGTGATGGTGGCGGTCCCTACCAGCGCCGTTGATC GATACGAGTATTTTATCAGGAGCCCCTACTCGTGATC ATGATTGGATCGTGGTTCTTTGACTTTTTGTTGTTTGA CTTTTGAATTCTTTTCTTGATGGGTCTTATTCTGCTTC TGATGCAAAGAATTTTATTTTTCTGGGATGTAATCGT CACACCCGAGTTTTGCCCCCCATGTCGGTTGCTTTGTA GGGACACGTGGTGTTTACTAAATGGAAAAAAAATCTA GTGTTA CTATTGCTCAAAAAAAAAAAA
优化后的VAAT基因序列如下:
ATGAACAAAATTGAAGTTTCAATTATTTCTAAGC ATACAATTAAACCATCTACATCTTCTTCACCATTACA GCCATATAAATTGACATTGTTGGATCAATTGACTCCA CCATCTTACGTCCCAATGGTCTTCTTCTATCCAATAAC TGGTCCAGCTGTTTTCAATTTGCAAACTTTGGCAGATT TAAGGCATGCATTGTCTGAAACTTTAACATTGTATTA TCCATTATCTGGTAGAGTCAAAAATAATTTGTATATT GACGACTTCGAGGAGGGTGTCCCATATTTAGAAGCTA GGGTTAACTGTGATATGAACGATTTTTTAAGATTGCC TAAAATAGAATGTTTAAATGAATTTGTTCCAATTAAG CCATTTTCTATGGAAGCTATTTCTGATGAAAGATACC CATTGTTGGGTGTTCAAGTTAATATTTTCAACTCTGGT ATAGCAATTGGTGTTTCAGTTTCACATAAATTGATTGA TGGAAGAACTTCTGATTGTTTTTTAAAGTCTTGGTGCG CTGTTTTCAGGGGTTCTAGAGATAAAATTATTCATCCA AACTTGTCTCAAGCAGCTTTGTTGTTTCCACCAAGAG ATGATTTACCAGAAAAGTATGCAAGACAGATGGAAG GTTTGTGGTTCGTCGGTAAGAAGGTCGCTACTAGGAG GTTCGTCTTCGGTGCTAAGGCTATATCTGTCATTCAGG ATGAGGCTAAGTCTGAGTCTGTCCCAAAGCCATCTAG GGTCCAGGCTGTCACATCTTTCTTATGGAAACATTTG ATTGCTACTTCTAGAGCTTTGACTTCAGGTACTACATC TACTAGATTGTCTATTGCAACACAAGTCGTTAATATT AGATCAAGAAGAAATATGGAAACTGTTTGGGATAAC GCAATTGGTAACTTGATTTGGTTCGCTCCAGCTATTTT GGAATTATCTCACACAACTTTAGAAATATCTGATTTG AAGTTATGTGATTTAGTTAACTTATTGAATGGTTCTGT TAAACAATGTAACGGTGATTACTTCGAAACTTTCATG GGTAAGGAAGGTTATGGATCTATGTGCGAATATTTGG ATTTTCAAAGGACAATGTCATCTATGGAACCAGCTCC AGAAATTTACTTGTTTACTTCATGGACTAACTTCTTTA ATCAATTGGATTTTGGTTGGGGTAGGACATCTTGGAT TGGTGTTGCTGGTAAAATTGAATCTGCTTTTTGCAATT TAACAACTTTGGTCCCAACTCCATGCGACACAGGTAT TGAGGCTTGGGTCAATTTGGAGGAGGAGAAGATGGC TATGTTGGAGCAGGACCCACAGTTTTTGGCTTTGGCT TCTCCTAAGACTTTGATATCTAGATATTAA
以含有合成基因的质粒PUC57-AeAT9、PUC57-VAAT为模板,分别用引物AeAT9-U/AeAT9-D、VAAT-U/VAAT-D进行PCR扩增,得到AeAT9基因和VAAT基因。采用限制性核酸内切酶XhoI对质粒Yep352-PGK进行酶切,将线性化质粒Yep352-PGK切胶纯化回收后,采用ClonExpressTMⅡ重组克隆试剂盒将其分别与AeAT9基因、VAAT基因进行体外重组,得到重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)。
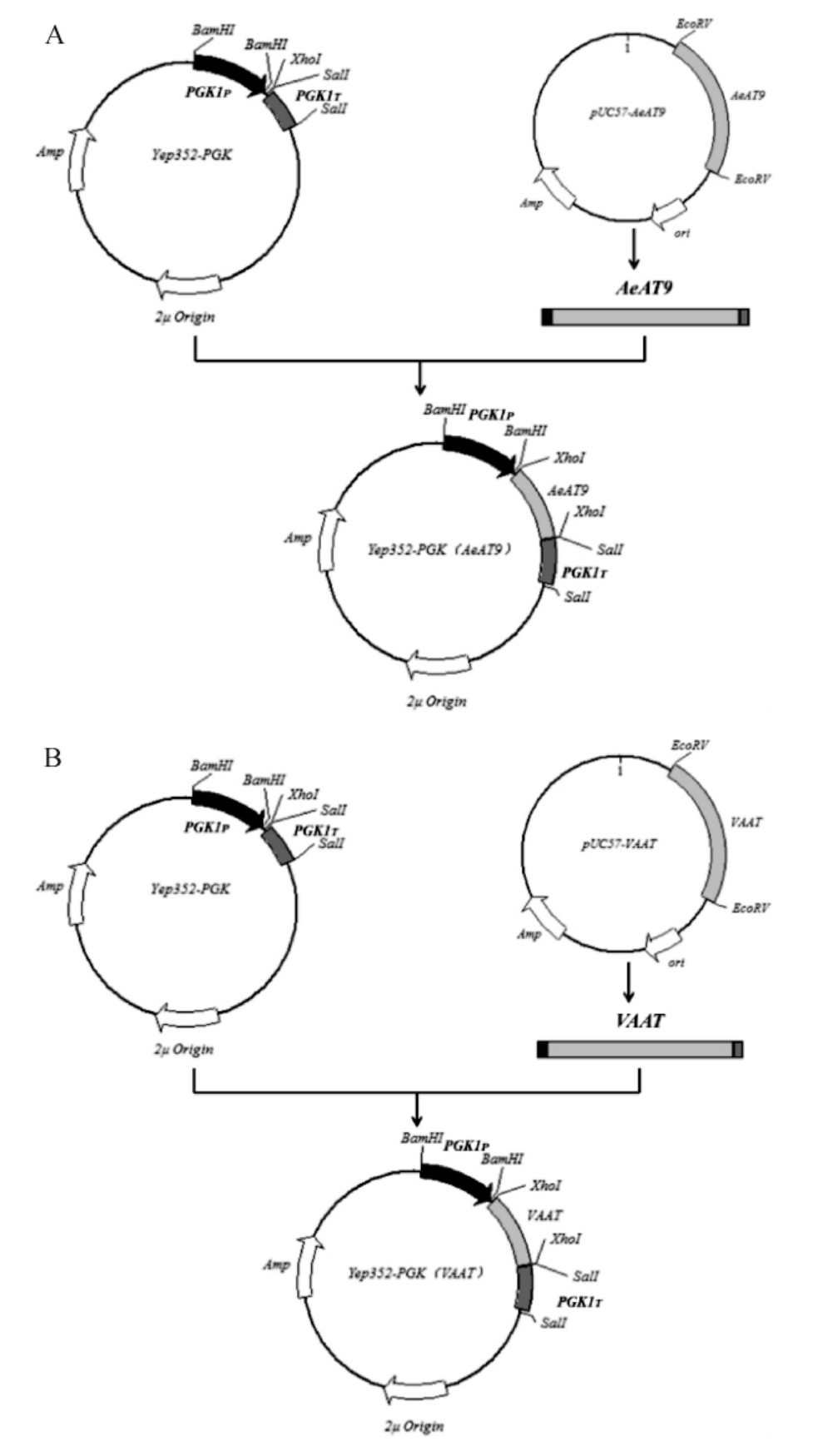
图1 重组质粒Yep352-PGK(AeAT9)(A)和Yep352-PGK(VAAT)(B)的构建
Fig. 1 Construction of recombinant plasmids Yep352-PGK(AeAT9)(A) and Yep352-PGK(VAAT) (B)
(3)过表达AeAT9、VAAT基因重组菌株的构建
以酿酒酵母AY12-α的基因组为模板,分别使用引物GA-U/GA-D和GB-U/GB-D PCR扩增得到Gal80基因上游同源臂GA基因片段以及下游同源臂GB基因片段;以质粒pUG6作为模板,使用引物Kr-U/Kr-D PCR扩增得到loxp-KanMX-loxp基因片段;分别以质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)作为模板,使用引物PP-U/PP-D PCR扩增得到PGK1P-AeAT9-PGK1T基因片段及PGK1P-VAATPGK1T基因片段。将PCR扩增得到的基因片段GA、PGK1PAeAT9-PGK1T、loxp-KanMX-loxp和GB及GA、PGK1P-VAATPGK1T、loxp-KanMX-loxp和GB纯化回收后,采用醋酸锂转化法[23]分别导入酿酒酵母AY12-α中,经过胞内同源重组后获得酿酒酵母单倍体重组菌株α-AeAT9和α-VAAT。同源重组过程见图2。
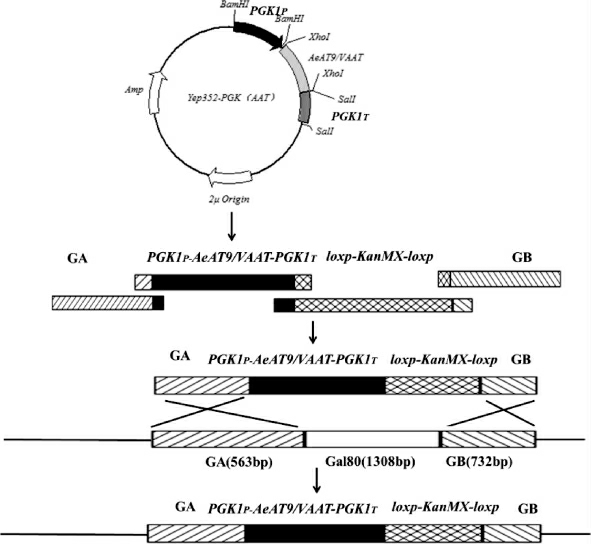
图2 转化片段的同源重组过程
Fig. 2 Homologous recombination process of converted fragments
转化后的菌液经修复培养后,适当稀释涂布于含有300 μg/mL G418抗性的YEPD培养基,30 ℃条件下培养2~3 d,挑取转化子扩培后,提取基因组进行PCR扩增验证。
(4)转化子筛选标记的去除
用醋酸锂化学转化的方法将带有Cre重组酶的pGAPza质粒导入重组菌株获得转化子;挑取转化子的单菌落于半乳糖培养基中诱导12 h,稀释涂布于YEPD培养基,30 ℃培养2 d。将长出的单菌落在YEPD培养基和含300 μg/mL G418抗性的YEPD培养基上进行影印点板,挑出在YEPD培养基上生长而在G418抗性培养基上不生长的菌株,提取其基因组进行PCR扩增验证。若以该基因组为模板扩增KanMX片段,无法得到1 600 bp左右的条带,而以转化前的重组菌株的基因组为模板则能扩增得到该基因片段,证明菌株成功去除KanMX筛选标记。
1.3.2 生长曲线的测定
分别从斜面上挑取一环菌株AY12-α、α-AeAT9和α-VAAT接种于5 mL YEPD液体培养基中,30 ℃、180 r/min培养12 h,混匀,分别取10 μL、12 μL、14 μL和16 μL菌液依次加入含有390μL、388μL、386μL和384μLYEPD液体培养基的100孔板的孔中,取400 μL YEPD液体培养基做空白对照。将100孔板放置于全自动生长曲线测定仪中,30 ℃培养,每隔1 h测定波长600 nm处的吸光度值(OD600nm值)。以培养时间(X)为横坐标,OD600nm值(Y)为纵坐标,绘制生长曲线。
1.3.3 白酒液态模拟发酵[21]
以亲本菌株AY12-α作为对照,取一环保藏在固体斜面上的待发酵菌株α-AeAT9、α-VAAT接种于装有5 mL一级发酵种子培养基的试管中,30 ℃条件下静置培养24 h。将一级培养物全部转入45 mL二级发酵种子培养基中,30 ℃静置培养16~17 h。测定菌液OD600 nm值,取相应体积换算成相同菌体数量(1.8×109 CFU/mL)接种到135 mL发酵培养基中,在30 ℃培养箱中静置发酵。发酵期间,每隔12 h称一次质量,称质量前充分摇晃三角瓶,尽量将瓶中的CO2排净,当两次失质量<1 g,表明发酵结束。发酵结束后对各菌株的CO2失质量、酒精度、还原糖、高级醇和酯类物质的产量进行测定。
1.3.4 测定方法
CO2失质量、酒精度、还原糖含量的测定:按照参考文献[24]的方法进行。
乙酸含量的测定[21]:将发酵液进行10倍稀释,经0.22 μm的滤膜过滤后,采用高效液相色谱仪测定。HPLC条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm×9 μm),柱温为60 ℃,进样量为10 μL,流动相为5 mmol/L的稀硫酸,流速为0.6 mL/min,检测器为示差折光检测器。
高级醇和酯类含量的测定[25]:将100 mL发酵液和100 mL水混匀后进行蒸馏,蒸馏出100 mL的酒样。将酒样经0.22 μm的滤膜过滤后,采用气相色谱仪测定。GC条件:Agilent1909N-213(30 m×0.32 mm×0.5 μm)毛细血管色谱柱,检测器为氢火焰离子化检测器(flame ionization detector,FID),进样口温度为200 ℃,检测器温度为200 ℃,进样量为1 μL,分流比为10∶1,载气为高纯度的氮气(N2),流速为2.0 mL/min,程序升温(起始柱温50 ℃,保持8 min,再以5 ℃/min的升温速度上升至120 ℃,保持5 min)。
2 结果与分析
2.1 重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)的构建
为了以强启动子PGK1p对来自猕猴桃和草莓的醇酰基转移酶基因AeAT9、VAAT进行过表达,构建重组质粒Yep352-PGK(AeAT9)和质粒Yep352-PGK(VAAT),采用PCR扩增进行验证,PCR扩增产物经0.8%琼脂糖凝胶电泳,结果见图3。
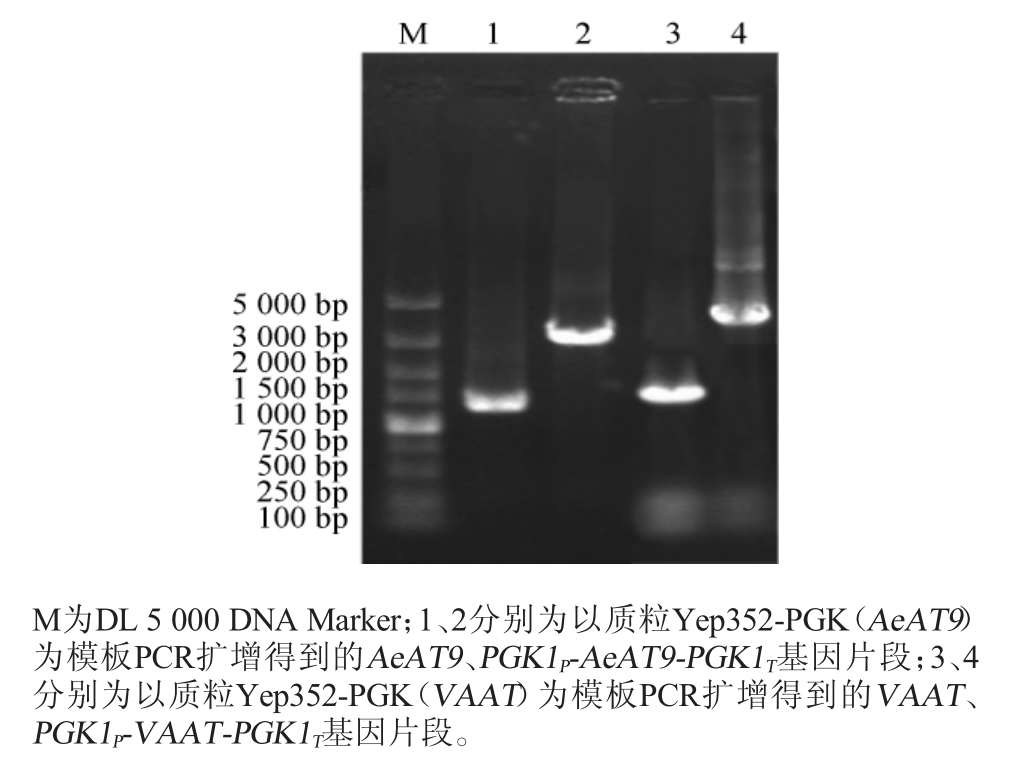
图3 重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)的PCR验证结果
Fig. 3 PCR verification results of recombiant plasmids Yep352-PGK(AeAT9) and Yep352-PGK(VAAT)
由图3可知,以重组质粒Yep352-PGK(AeAT9)为模板PCR扩增得到碱基长度为1 299 bp的AeAT9基因片段和碱基长度为3 036 bp的PGK1P-AeAT9-PGK1T基因片段,以重组质粒Yep352-PGK(VAAT)为模板PCR扩增得到碱基长度为1 368 bp的VAAT基因片段和碱基长度为3 105 bp的PGK1P-VAAT-PGK1T基因片段。PCR验证结果与理论预期一致,表明PGK1P-AeAT9-PGK1T基因片段和PGK1P-VAATPGK1T基因片段成功插入Yep352-PGK质粒的多克隆位点处,重组质粒Yep352-PGK(AeAT9)和Yep352-PGK(VAAT)构建成功。
2.2 过表达醇酰基转移酶基因AeAT9、VAAT重组菌株的构建
2.2.1 过表达AeAT9、VAAT基因转化子的获得
采用引物D1-U/DA-D、DA-U/D2-D、D3-U/D3-D和D1-U/DV-D、DV-U/D2-D、D3-U/D3-D分别对重组菌株α-AeAT9和α-VAAT进行上、中、下游定点PCR验证,PCR扩增产物经0.8%的琼脂糖凝胶电泳检测,结果见图4。
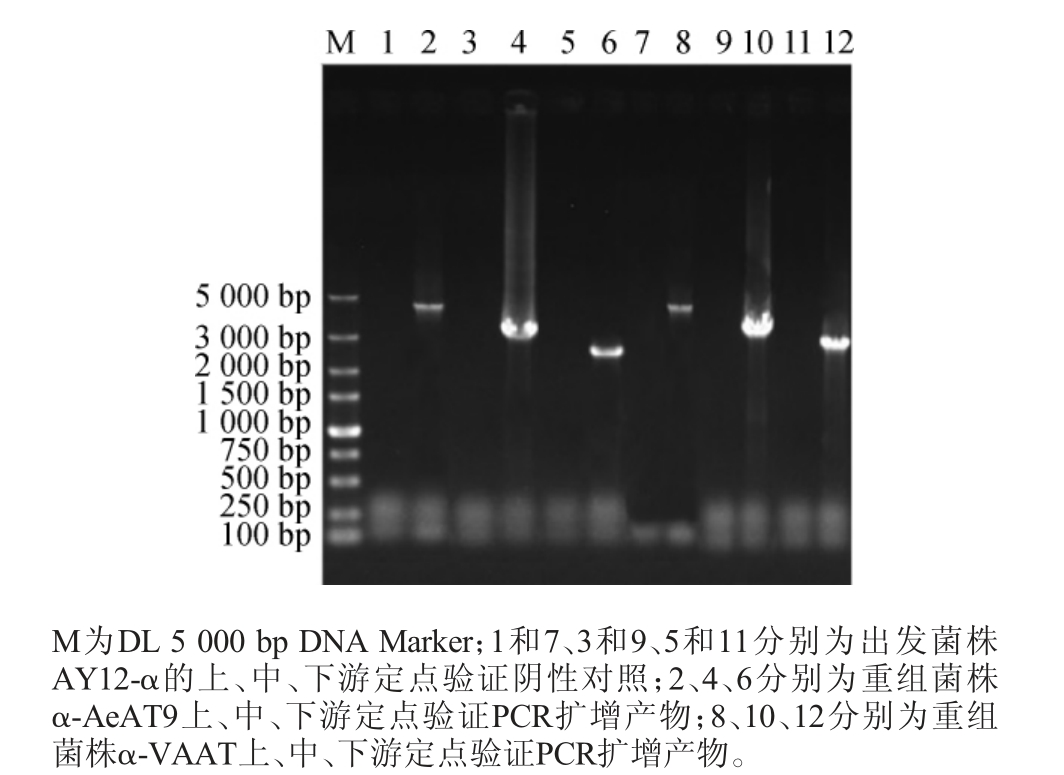
图4 重组菌株α-AeAT9和α-VAAT的PCR验证结果
Fig. 4 PCR verification results of recombinant strains α-AeAT9 and α-VAAT
由图4可知,分别以提取的α-AeAT9和α-VAAT转化子基因组为模板进行PCR扩增,采用上游引物D1-U/DA-D、D1-U/DV-D PCR扩增得到的产物碱基长度均在3 700 bp左右;采用中游引物DA-U/D2-D、DV-U/D2-D PCR扩增得到的产物碱基长度均在3 200 bp左右;采用下游引物D3-U/D3-D PCR扩增得到的产物碱基长度均在2 700 bp左右;上述条带大小均与理论预期一致,且出发菌株AY12-α的阴性对照均无条带。说明重组盒GA-PGK1P-AeAT9-PGK1T-loxp-KanMXloxp-GB、GA-PGK1P-VAAT-PGK1T-loxp-KanMX-loxp-GB已分别成功导入到酿酒酵母AY12-α基因组中,并且重组位置正确,获得了正确的α-AeAT9和α-VAAT转化子。
2.2.2 转化子筛选标记KanMX的去除
通过1.3.1的方法去除α-AeAT9和α-VAAT转化子的筛选标记KanMX,分别以其基因组为模板进行PCR扩增验证,PCR扩增产物经0.8%的琼脂糖凝胶电泳检测,结果见图5。
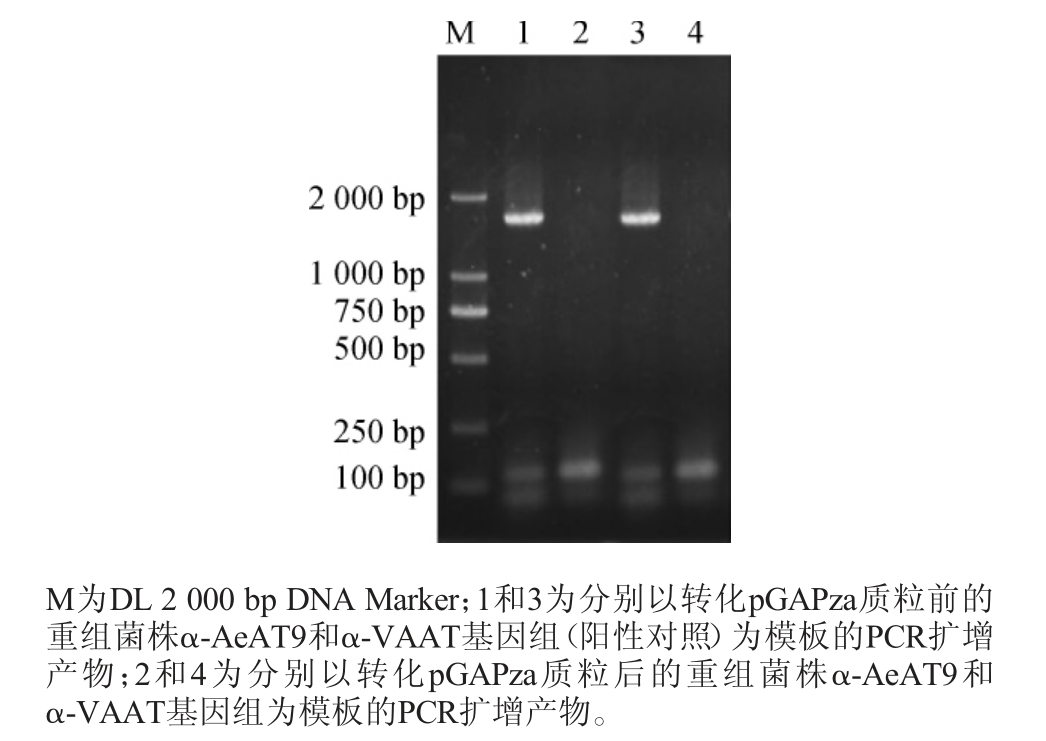
图5 重组菌株去除KanMX筛选标记PCR验证
Fig. 5 Verification of screening marker KanMX removal of recombinant strains by PCR
由图5可知,以转化pGAPza质粒前后的重组菌株基因组为模板,通过引物Kr-U/Kr-D获得PCR扩增产物,前者作为阳性对照均有1 600 bp左右的特异性条带,后者均无条带,该结果与理论预期相符,证明菌株α-AeAT9和α-VAAT成功去除KanMX筛选标记。
2.3 重组菌株的生长性能
亲本菌株AY12-α和重组菌株α-AeAT9、α-VAAT的生长曲线见图6。

图6 亲本菌株AY12-α和重组菌株α-AeAT9、α-VAAT生长性能的比较
Fig. 6 Comparison of growth characteristics of parent strain AY12-α and recombiant strains α-AeAT9 and α-VAAT
由图6可知,重组菌株α-AeAT9、α-VAAT的生长速率与出发菌株AY12-α保持一致,而且最终达到的最大生物量基本一致,说明AeAT9、VAAT基因的过表达对菌株的生长基本无影响。
2.4 重组菌株的基本发酵性能
以亲本菌株AY12-α作为对照组,对重组菌株α-AeAT9、α-VAAT进行白酒液态模拟发酵,整个发酵周期为4 d。发酵结束后对各菌株的基本发酵性能进行测定,结果见表3。
表3 亲本菌株AY12-α和重组菌株α-AeAT9、α-VAAT发酵性能的比较
Table 3 Comparison of fermentation characteristics of parent strain AY12-α and recombinant strains α-AeAT9 and α-VAAT
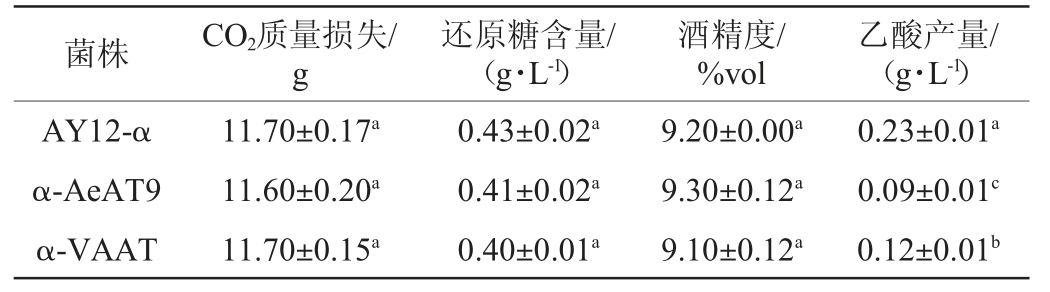
注:不同字母表示同列间差异显著(P<0.05)。下同。
菌株 CO2质量损失/g还原糖含量/(g·L-1)酒精度/%vol乙酸产量/(g·L-1)AY12-α α-AeAT9 α-VAAT 11.70±0.17a 11.60±0.20a 11.70±0.15a 0.43±0.02a 0.41±0.02a 0.40±0.01a 9.20±0.00a 9.30±0.12a 9.10±0.12a 0.23±0.01a 0.09±0.01c 0.12±0.01b
由表3可知,重组菌株α-AeAT9、α-VAAT和出发菌株AY12-α在相同条件下发酵结束后,CO2总质量损失、还原糖含量和酒精度无显著变化(P>0.05),表明本实验中的基因敲除和过表达的操作不会对菌株基本发酵性能产生不利影响。从乙酸的产量变化来看,重组菌株与亲本菌株相比,乙酸的积累量显著降低(P<0.05)。该结果表明醇酰基转移酶AeAT9、VAAT催化乙醇和乙酰辅酶A反应生成乙酸乙酯,致使更多的乙酸通过乙酰辅酶A合成酶转化为乙酰辅酶A,从而使得乙酸减少;同时,重组菌株α-AeAT9的乙酸积累量显著低于重组菌株α-VAAT(P<0.05),表明醇酰基转移酶AeAT9对于合成乙酸乙酯的催化效率高于VAAT。
表4 亲本菌株AY12-α和重组菌株α-AeAT9、α-VAAT高级醇及酯生成量的比较
Table 4 Comparison of higher alcohols and esters content between parent strainAY12-α and recombinant strains α-AeAT9 and α-VAAT mg/L

菌株 乙酸乙酯 乙酸异戊酯 正丙醇 异丁醇 异戊醇 苯乙醇AY12-α α-AeAT9 α-VAAT 14.30±0.20c 792.26±10.04a 204.19±5.83b 16.40±1.23c 40.25±0.08a 20.36±0.21b 24.20±0.59a 21.96±0.44b 24.21±0.27a 34.37±0.41a 20.41±0.42c 29.62±1.52b 155.32±2.64a 87.19±2.14c 106.32±2.63b 28.98±0.29a 23.21±0.33c 29.89±0.62b
2.5 重组菌株的醇酯生成量
重组菌株α-AeAT9、α-VAAT的高级醇和酯产量见表4。
由表4可知,重组菌株α-AeAT9和α-VAAT的乙酸乙酯生成量分别为(792.26±10.04)mg/L和(204.19±5.83)mg/L,分别为出发菌株AY12-α的55.40倍和14.28倍。结果表明醇酰基转移酶AeAT9、VAAT对于乙酸乙酯的合成有显著促进作用(P<0.05),且醇酰基转移酶AeAT9的作用效果显著优于VAAT(P<0.05)。另外重组菌株的乙酸异戊酯的生成量较出发菌株变化趋势与乙酸乙酯一致。值得注意的是,重组菌株的主要高级醇(异丁醇、异戊醇、正丙醇、苯乙醇)总含量分别为(152.77±2.14)mg/L和(190.04±2.63)mg/L,较出发菌株降低了37.10%和21.75%,其中异戊醇的生成量变化最为明显,可能是由于醇酰基转移酶AeAT9、VAAT催化异戊醇和乙酰辅酶A缩合形成乙酸异戊酯的结果[18-20]。
3 结论
在酿酒酵母菌株AY12-α中,分别引入来自绿色植物猕猴桃和草莓的醇酰基转移酶基因AeAT9、VAAT,成功构建了重组菌株α-AeAT9、α-VAAT。重组菌株α-AeAT9、α-VAAT的乙酸乙酯生成量分别为(792.26±10.04)mg/L和(204.19±5.83)mg/L,分别为亲本菌株的55.40倍和14.28倍;主要高级醇总含量分别为(152.77±2.14)mg/L和(190.04±2.63)mg/L,较亲本菌株分别降低37.10%和21.75%。本实验为提高酿酒酵母酯类合成及降低高级醇的研究提供了思路和参考;同时该研究所获得的高产乙酸乙酯的重组菌株在白酒生产中有一定的应用潜力,有利于提高白酒的风味和质量。
[1]LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[2]王文晶,朱会霞,李泽霞,等.白酒固态发酵酒醅中微生物研究概况[J].酿酒,2016,43(2):27-32.
[3]郑楠,郭庆焕,何亚辉,等.乙酰辅酶A 含量对酿酒酵母乙酸乙酯合成的影响[J].中国酿造,2018,37(5):150-156.
[4] CHEN Y F, LI F, GUO J, et al. Enhanced ethyl caproate production of Chinese liquor yeast by overexpressing EHT1 with deleted FAA1[J].J Ind Microbiol Biotechn,2014,41(3):563-572.
[5] PARK Y C, SHAFFER C E H, BENNETT G N. Microbial formation of esters[J].Appl Microbiol Biot,2009,85(1):13-25.
[6]VERSTREPEN K J,VAN LAERE S D M,VANDERHAEGEN B M P,et al. Expression levels of the yeast alcohol acetyltransferase genes ATF1,Lg-ATF1,and ATF2 control the formation of a broad range of volatile esters[J].Appl Environ Microbiol,2003,69(9):5228-5237.
[7]MASON A B,DUFOUR J.Alcohol acetyltransferases and the significance of ester synthesis in yeast[J].Yeast,2002,16(14):1287-1298.
[8] LILLY M, BAUER F F, LAMBRECHTS M G, et al. The effect of increased yeast alcohol acetyltransferase and esterase activity on the flavour profiles of wine and distillates[J].Yeast,2006,23(9):641-659.
[9] LILLY M, LAMBRECHTS M G, PRETORIUS I S. Effect of increased yeast alcohol acetyltransferase activity on flavor profiles of wine and distillates[J].Appl Environ Microbiol,2000,66(2):744-753.
[10]SAERENS S M,DELVAUX F R,VERSTREPEN K J,et al.Production and biological function of volatile esters in Saccharomyces cerevisiae[J].Microb Biotech,2010,3(2):165-177.
[11]SAERENS S M G.The Saccharomyces cerevisiae EHT1 and EEB1 genes encode novel enzymes with medium-chain fatty acid ethyl ester synthesis and hydrolysis capacity[J].J Biol Chem,2006,281(7):4446-4456.
[12]石钰,陈叶福,肖冬光.LEU1 基因缺失对酿酒酵母高级醇生成量的影响[J].酿酒科技,2015(2):12-16.
[13]邹凌波.酶法酿造米酒新技术的研究[D].无锡:江南大学,2019.
[14]葛峻伶,郭莹,刘小二,等.一次敲除BAT2 同时过表达Lg-ATF1 对啤酒酵母产醇酯的影响[J].现代食品科技,2019,35(6):171-176,272.
[15]苟静瑜,贾智勇,闫宗科,等.降低白酒中高级醇含量的研究进展[J].酿酒,2016,43(4):25-29.
[16]孙金旭.糖化酶用量对酱香型白酒杂油醇的影响研究[J].现代食品科技,2013,29(1):73-76.
[17]罗惠波,苟云淩,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
[18] GÜNTHER C S, CHERVIN C, MARSH K B, et al. Characterisation of two alcohol acyltransferases from kiwifruit(Actinidia spp.)reveals distinct substrate preferences[J].Phytochemistry,2011,51(72):700-710.
[19] BEEKWILDER J, ALVAREZ-HUERTA M, NEEF E, et al. Functional characterization of enzymes forming volatile esters from strawberry and banana[J].Plant Physiol,2004,135(4):1865-1878.
[20] LAYTON D S, TRINH C T. Expanding the modular ester fermentative pathways for combinatorial biosynthesis of esters from volatile organic acids[J].Biotechnol Bioeng,2016,113(8):1764-1776.
[21]刘港,李洁,任津莹,等.产乳酸乙酯酿酒酵母菌株的构建[J].中国酿造,2018,37(7):72-77.
[22]CUI D Y,ZHANG C Y,YU Z,et al.PGK1 promoter library for the regulation of acetate ester production in Saccharomyces cerevisiae during Chinese Baijiu fermentation[J].J Agr Food Chem,2018,66(28):7417-7427.
[23] GIETZ R D, WOODS R A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method[J].Method Enzymol,2002,350:87-96.
[24]MEXIS S F,BADEKA A V,RIGANAKOS K A,et al.Effect of packaging and storage conditions on quality of shelled walnuts[J]. Food Control,2009,20(8):743-751.
[25]张华东,韩经,魏晓庆,等.植物乳杆菌对高产酯酿酒酵母酒精发酵及酯醇代谢的影响[J].中国酿造,2019,38(11):85-89.