己酸是浓香型、酱香型等多种中国白酒的关键风味物质,在白酒中起着呈香、助香、延长酒体醇甜感及缓冲平衡作用[1-2]。其与酒曲发酵产生的酒精发生酯化反应,生成浓香型白酒的所特有的主体香风味成分-己酸乙酯,在浓香型白酒生产中,其优级原酒中己酸乙酯要到达浓香型白酒国家标准一般需要10~50年以上窖池,其窖泥中驯化成熟的己酸菌丰度和产酸能力才能满足生产需要[3-5],因此选育高产己酸菌株,用于制备窖泥或灌窖等生产应用,成为浓香型白酒企业提高浓香型白酒典型风味特征及质量的重要保障[6-9]。
微生物转录调节因子SigA和SigB基因表达产物分别为σ70和σB,均属于转录启始因子家族,其中σ70为管家调节因子,调控大多数基因的转录合成[10-13];σB为应激转录启动因子,启动参与热、酸、乙醇、盐和氧化应激性相关基因的转录[14-15]。
细菌同源重组定义是指发生在姐妹染色单体之间或同一染色体上含有同源序列的脱氧核糖核酸(deoxyribonucleic acid,DNA)分子之间或分子之内的重新组合,由此发展起来的同源重组技术是将待插入位点基因两侧的同源序列克隆质粒中,并将目的基因插入两段同源臂之间,质粒通过同源重组整合至细菌基因组从而获得稳定表达重组菌株的技术[16-20]。
本研究拟采用同源重组技术,同时将SigA和SigB基因转入L.fusiformis菌株基因组的α-淀粉酶和蔗糖磷酸化酶基因位点,通过在浓香型白酒发酵模拟环境筛选,选育具有高抗逆性稳定性状的高产己酸菌。
1 材料与方法
1.1 材料与试剂
1.1.1 引物采用美国国家生物信息中心(national center for biotechnologyinformation,NCBI)提供的在线引物设计工具(http://primer3.ut.ee/)分别对表达盒3和表达盒4设计引物,结果见表1。将表1设计的引物送上海生工生物工程有限公司合成。
表1 纺锤形赖氨酸芽孢杆菌表达盒及整合质粒引物
Table 1 Expression box and designed primers of integrated plasmids of Lysinibacillus fusiformis

SigA表达盒引物 模板、扩增长度 SigB表达盒引物 模板、扩增长度Left CCCAAGCTTGGGGtcacaatgcgc(bp)Right CGCGGATCCGCGataaaacgaaag(bp)L.fusiformis Amylase 引物Left ATCACTTTTACTAGCTACTACATTCGTAAG(bp)Right GAACTTTTCCTCGTTTAATGATGATTACAA(bp)SigA表达盒/1 417 pb SigB表达盒/1 073 bp模板、扩增长度pBE2RL.F-AmyE-MCS/504 Left CCCAAGCTTGGGGtcacaatgcgc(bp)Right CGCGGATCCGCGataaaacgaaag(bp)L.fusiformis alpha-amlyase 引物Left GCCTTATGAGTTCACAATAGTAGATAATGA(bp)Right CCTGACGTCAATAATTTCTCGAATATTAAT(bp)模板、扩增长度pBE2RL.F-sugar-phosphateisomerase-MCS/520
1.1.2 菌株与质粒
纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis):本研究所分离并保存;感受态大肠杆菌BL21:由西南医科大学万海粟博士惠赠;pBE2R:武汉淼灵生物科技有限公司。
1.1.3 试剂
酵母浸粉、蛋白胨、葡萄糖、无水乙醇、醋酸钠、氯化钠:成都科龙试剂厂;T4 DNA连接酶、限制性核酸内切酶EcoRI、HindIII、AatIII、NheI、AflIII、BamHI:美国ThermosFisher Scientific公司;DNA Ligation Kit Ver.2.1、Bacteria Genomic DNA Extraction Kit Ver.3.0:大连TaKaRa公司;细菌基因组DNA提取试剂盒、小量质粒抽提试剂盒、普通琼脂糖凝胶回收试剂盒(DP209)、DNA纯化试剂盒、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)、DNA Marker:天根生化有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物:由上海生工生物工程有限公司合成;卡那霉素(分析纯):湖北信康医药化工有限公司;氨苄青霉素(分析纯):杭州百思生物技术有限公司。
1.1.4 培养基与溶液
LB培养基:胰蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,蒸馏水1 000 mL,调pH 7.0±0.2,固体培养基加入15 g琼脂,121 ℃灭菌30 min。
改良麦氏培养基:葡萄糖1.0 g,KCl 1.8 g,酵母膏4 g,醋酸钠15 g,固体培养基加入琼脂15 g,蒸馏水1 000 mL,pH自然,121 ℃灭菌30 min,使用前加入20 mL无水乙醇。
乙酸钠培养基:葡萄糖1.0 g,KCl 1.8 g,酵母膏2.5 g,醋酸钠8.2 g,固体培养基加入琼脂15 g,蒸馏水1 000 mL,pH自然,121 ℃灭菌30 min,使用前加入10 mL无水乙醇。
B2培养基:水解酪蛋白10 g,酵母粉25 g,葡萄糖5 g,NaCl 5 g,K2HPO4 1 g,加900 mL去离子水,调pH值为7.5,定容至1 L,121 ℃灭菌30 min。
4×PAB培养基[21]:牛肉膏6 g,酵母膏6 g,蛋白胨20 g,葡萄糖4 g,NaCl 14 g,K2HPO4 14.72 g,KH2PO4 5.28 g,加水定容至1 000 mL,121 ℃灭菌30 min。
2×SMM溶液:4.6 g/L马来酸,8.1 g/L MgCl2·6H2O,1 mol/L蔗糖。用NaOH调pH至6.5,121 ℃灭菌30 min。而后加入2 mol/L蔗糖至终浓度为1 mol/L。
菌体保护液SMPP:20 g/L 牛血清蛋白,0.1 mol/L蔗糖,1×PAB培养基,1×SMM溶液。其中,牛血清蛋白、蔗糖需单独灭菌后再加入。
1.2 仪器与设备
BSD-YF3600全温培养摇床:上海博迅医疗生物仪器股份有限公司;TGL-16M台式高速冷冻离心机:金坛市良友仪器有限公司;WD-9413A型凝胶成像分析系统、DYY-8C电泳仪:北京市六一仪器厂;Smart Spec Plus核酸蛋白分析仪:美国伯乐公司;GT9611梯度PCR仪:杭州艾普仪器设备股份有限公司;GC-2014岛津气相色谱仪:日本岛津公司;YQX-T型厌氧培养箱:苏州市莱顿科学仪器有限公司;Scientz-2C基因导入仪:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 同源定点整合载体构建
(1)同源定点整合载体的设计
以产己酸菌L.fusiformis菌株α-淀粉酶(alpha-amlyase,NZ_CP010820)和蔗糖磷酸化酶基因(sugar phosphate iso merase,NZ_CP010820)上下游同源序列250 bp,分别为5'端和3'端,在其间依次插入多酶切位点(MCS,TTGCCTCGAGCTCGGTACCCGGGGATCCTCTAGAGTCGACCTGCAGGCATGCAAG)及终止序列(Terminator,TGATTAATTAATTCAGAACGCTCGGTTTCGGCCGGGCGTTTTTTTTGCA),结果如图1所示。
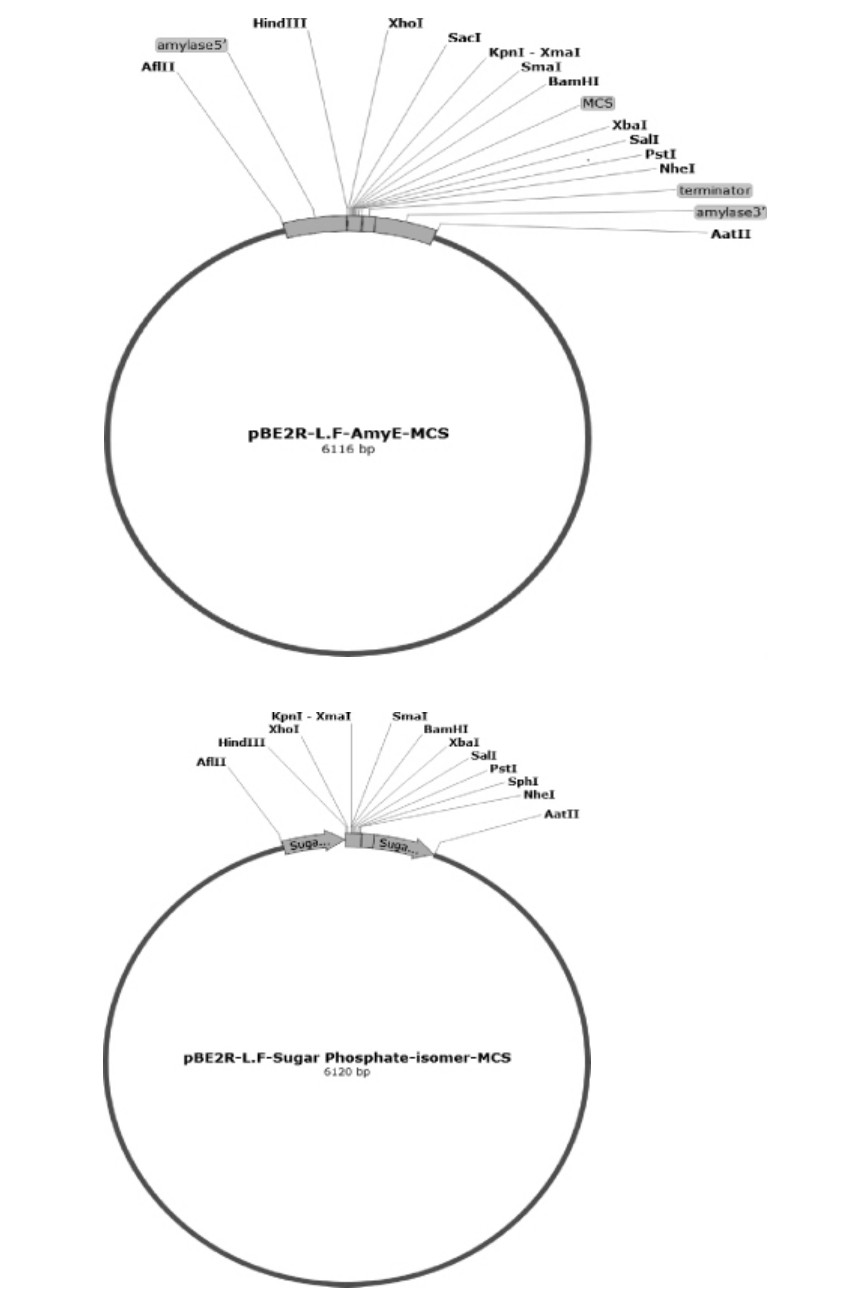
图1 纺锤形赖氨酸芽孢杆菌α-淀粉酶和蔗糖磷酸化酶基因同源整合载体设计
Fig. 1 Design of homologous integration vectors for α-amylase and sucrose phosphatase genes from Lysinibacillus fusiformis
(2)同源定点整合载体pBE2R-AmyE-MCS和pBE2Rsugar phosphate isomer-MCS的筛选
分别按照图1设计各合成L.fusiformis 菌株基因组的α-淀粉酶和蔗糖磷酸化酶基因上下游同源序列250 bp、MCS、终止子及酶切位点序列,送至上海生工生物工程有限公司合成,将合成序列经AflII和AatII双酶切后,经DNA Ligation KitVer.2.1中的连接酶连接至同样双酶切的pBE2R片段上,获得同源整合质粒pBE2R-AmyE-MCS和pBE2Rsugar phosphate isomer-MCS,分别转化感受态大肠杆菌BL21,将转化后菌液涂布于含100 μg/mL氨苄的LB的固体培养基上,倒置于37 ℃恒温培养箱中培养过夜。
分别各随机挑取10个转化菌单克隆进行菌落PCR鉴定,挑阳性克隆培养5 mL,取1 mL采用天根质粒小提试剂盒提取质粒,进行flII和AatII双酶切鉴定,取酶切鉴定正确菌落进行后续试验。
1.3.2 SigA/SigB基因同源定点整合载体的构建
(1)表达盒的设计
SigA表达盒的设计:上游酶切位点(HindIII)+杂交启动子+GGA+SD(GAGAGG)+AAAC+SigA+终止子+下游酶切位点(BamHI),杂交启动子参考YANG M等系列设计[12]。
SigB表达盒的设计:上游酶切位点(HindIII)+杂交启动子+GGA+SD(GAGAGG)+AAAC+SigB+终止子+下游酶切位点(BamHI)。
(2)pBE2R-AmyE-MCS-SigA 和pBE2R-sugar isomer-MCS-SigB质粒构建
将1.3.2 项下设计的表达盒序列送至上海生工生物工程有限公司进行合成。将上述合成序列用HindIII和BamIII进行双酶切,经DNA Ligation Kit Ver.2.1中的连接酶连接至同样双酶切的pBE2R-L.F-AmyE-MCS和pBE2R-L.F-sugar isomer-MCS片段上,获得同源整合载体pBE2R-AmyE-MCSSigA和pBE2R-sugar isomer-MCS-SigB,转化感受态大肠杆菌BL21,将转化后菌液涂布于含100 μg/mL氨苄的LB的固体培养基上,倒置于37 ℃恒温培养箱中培养过夜。
分别各随机挑取10个转化菌单克隆进行菌落PCR鉴定,挑阳性克隆培养5 mL,取1 mL采用天根质粒小提试剂盒提取质粒,进行HindIII和BamIII进行双酶切鉴定,取酶切鉴定正确菌落进行后续试验。
1.3.3 L.fusiformis SigA和SigB同源单整合菌株的建立
L.fusiformis感受态菌株的建立、pBE2R-AmyE-MCSSigA和pBE2R-sugar isomer-MCS-SigB对L. fusiformis的电转化参考薛正楷等的方法进行[11];采用细菌基因组DNA提取试剂盒提取整合菌株总基因组DNA,采用表1引物进行PCR鉴定。
(1)整合型L.fusiformis-SigA菌株的建立
冰上融化L. fusiformis感受态细胞,然后再加入1 μg pBE2R-sugar isomer-MCS-SigA至50 μL感受态细胞中,冰浴5 min,将混合液加入预冷的2 mm电击杯中,冰浴2 min后以电压2 000 V,电容25 μF,电阻200 Ω,时间2.8 ms进行电击,电击完毕取出杯子并立即加入500 μL SMMP溶液,洗脱感受态细胞,洗脱液转移至1.5 mL离心管中,37 ℃、250 r/min,复苏1h。取200μL转化液涂至含卡那霉素含量50μg/mL,乙醇含量4%的乙酸钠培养基平板(pH 4),36 ℃培养38 h。
随机挑取乙酸钠平板单菌落进行菌落PCR鉴定,挑取PCR鉴定正确的克隆至5 mL,乙醇含量6%的改良麦氏培养基(pH 4)中,取15 d发酵液1 mL,12 000 r/min离心10 min,取490 μL上清加入10 μL内标物质(2-乙基丁酸),振荡混匀,进行气相色谱检测,检测条件参考薛正楷等[7]的方法进行;选取产己酸最高菌株进行后续试验。
(2)整合型L.fusiformis-SigB菌株的建立
参考薛正楷等[11]的方法进行构建L.fusiformis-SigB菌株。
1.3.4 双整合型L.fusiformis-SigA-SigB菌株的建立与筛选
取己酸产量最高的L. fusiformis-SigA和L. fusiformis-SigB制备感受态细胞;按1.3.3项下方法进行电转化和L.fusiformis-SigA-SigB菌株的筛选,选取产己酸最高菌株进行后续试验。
1.3.5 双整合型L.fusiformis-SigA-SigB菌株关键性状稳定验证
取3只改良乙酸钠培养基平板(pH=4,乙醇含量6%),挑1.3.4项下筛选成功菌株进行划线后,置于0.08 MPa、34 ℃真空培养箱中静置培养至长出菌落后,挑取长出的菌落连续划线培养32代后,观察比较第32代与第1代菌落形态差异。
取6支试管,在传代32代和第1代菌落的改良乙酸钠培养基上随机挑取3个单克隆,接种至5 mL含50 μg/mL改良乙酸钠(pH=4,乙醇含量6%)培养液中,90 ℃水浴5 min,置于0.07 MPa、36 ℃真空培养箱中静置培养15 d,进行气相色谱分析[4]。
挑取稳定性鉴定合乎要求的菌落至5 mL麦氏培养基中,置于0.07 MPa、36 ℃真空培养箱中静置培养6 d,取3 mL菌液送至上海生工生物进行测序鉴定。
1.3.6 数据处理与分析
数据处理与分析采用Excel 2019、SPSS 22.0软件包和Sigma plot进行。
2 结果与分析
2.1 pBE2R-AmyE-MCS整合质粒鉴定
随机挑取1.3.1项下转化子克隆,进行菌落PCR,结果见图2A;将上述5个单克隆扩增菌液1mL提取质粒,进行AfIII/AatII 双酶切鉴定,结果见图2B。
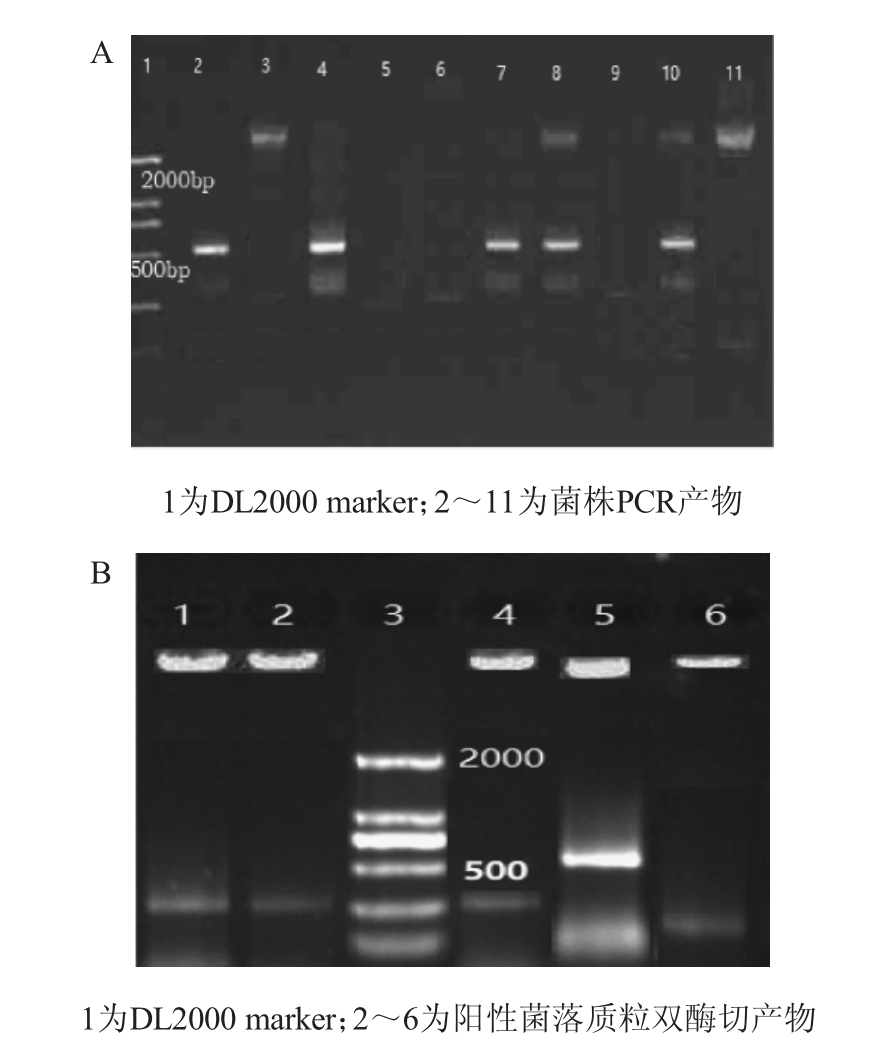
图2 Pbe2R-AmyE-MCS菌落PCR鉴定(A)及阳性菌落质粒双酶切鉴定(B)
Fig. 2 Identification of Pbe2R-AmyE-MCS integrated plasmids by PCR (A) and double-enzyme digestion of plasmids for positive colony (B)
由图2A可知,10个阳性单克隆中有5个克隆PCR片段大小在500 bp左右,符合预期大小。由图2B可知,5个单克隆质粒中,其中泳道3双酶切片段符合预期大小(小段600 bp左右),初步表明pBE2R-AmyE-MCS克隆成功,将泳道3质粒对应菌株命名为BL-pBE2R-AmyE-MCS3。
2.2 pBE2R-Sugar phosphate isomerase-MCS整合质粒鉴定
随机从1.3.1项下青霉素平板上随机挑取10个阳性单克隆菌落,进行菌落PCR,结果见图3A;进一步扩增4个单克隆菌落菌液5 mL,取1 mL提取质粒进行AfIII/AatII 双酶切鉴定双酶切鉴定,结果见图3B。
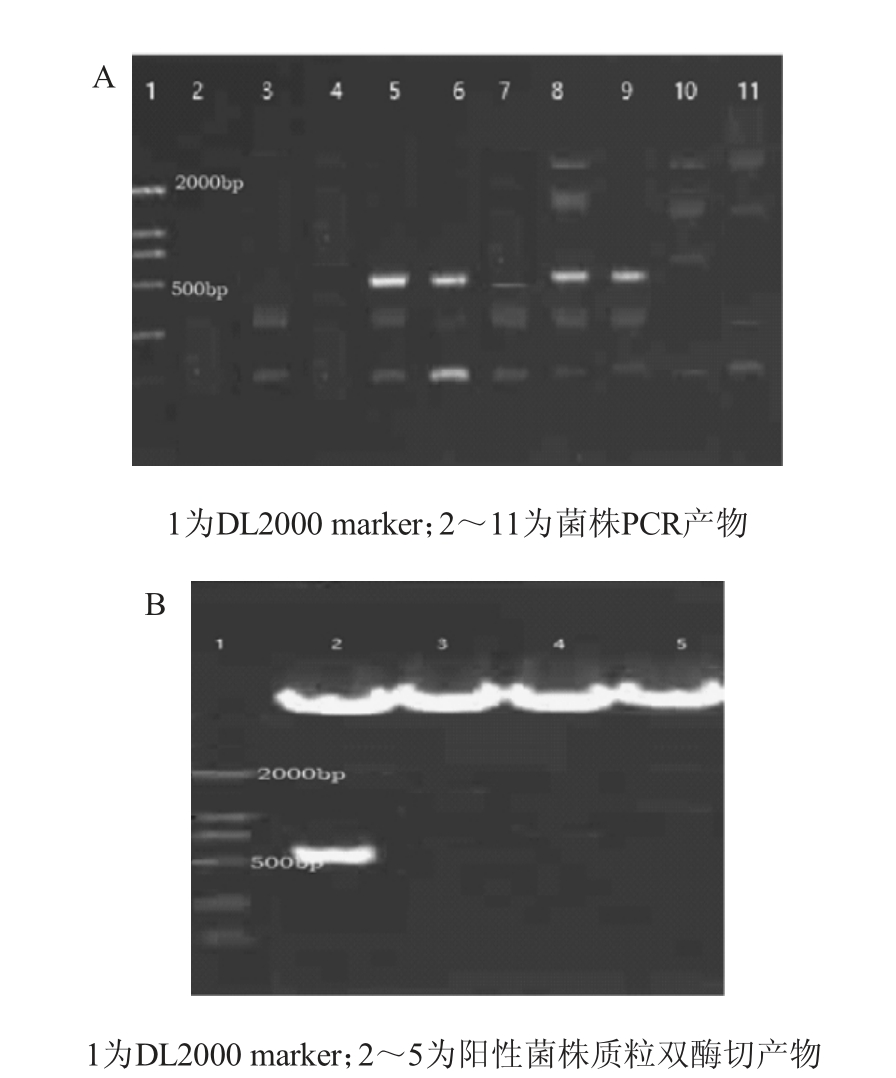
图3 pBE2R-Sugar phosphate isomerase-MCS整合质粒PCR鉴定(A)及阳性菌落质粒双酶切鉴定(B)
Fig. 3 Identification of pBE2R-Sugar phosphate isomerase-MCS integrated plasmids by PCR (A) and double restrictionenzyme digestion of plasmids for positive colony (B)
由图3A可知,10个单克隆菌落中,有4个克隆PCR扩增片段大小在500 bp左右符合预期。由图3B可知,4个菌落PCR阳性克隆中,只有1个克隆的pBE2R-Sugar phosphate isomerase-MCS质粒被AfIII/AatII切开,且片段大小约600 bp,符合预期,初步表明pBE2R-Sugar phosphate isomerase-MCS构建成功,将泳道1对应菌株命名为BL-pBE2R-Sugar phosphate isomerase-MCS1。
2.3 pBE2R-AmyE-SigA整合型表达载体的构建
将合成的SigA表达盒经HindIII/BamHIII双酶切纯化产物,经连接至经同样双酶切的pBE2R-AmyE-MCS整合型穿梭质粒,转染BL21进行抗性筛选,随机挑选10个阳性菌落进行菌落PCR,结果见图4A;进一步培养2个单克隆菌株菌液5 mL,提取质粒进行HindIII/BamHI双酶切鉴定,结果见图4B。
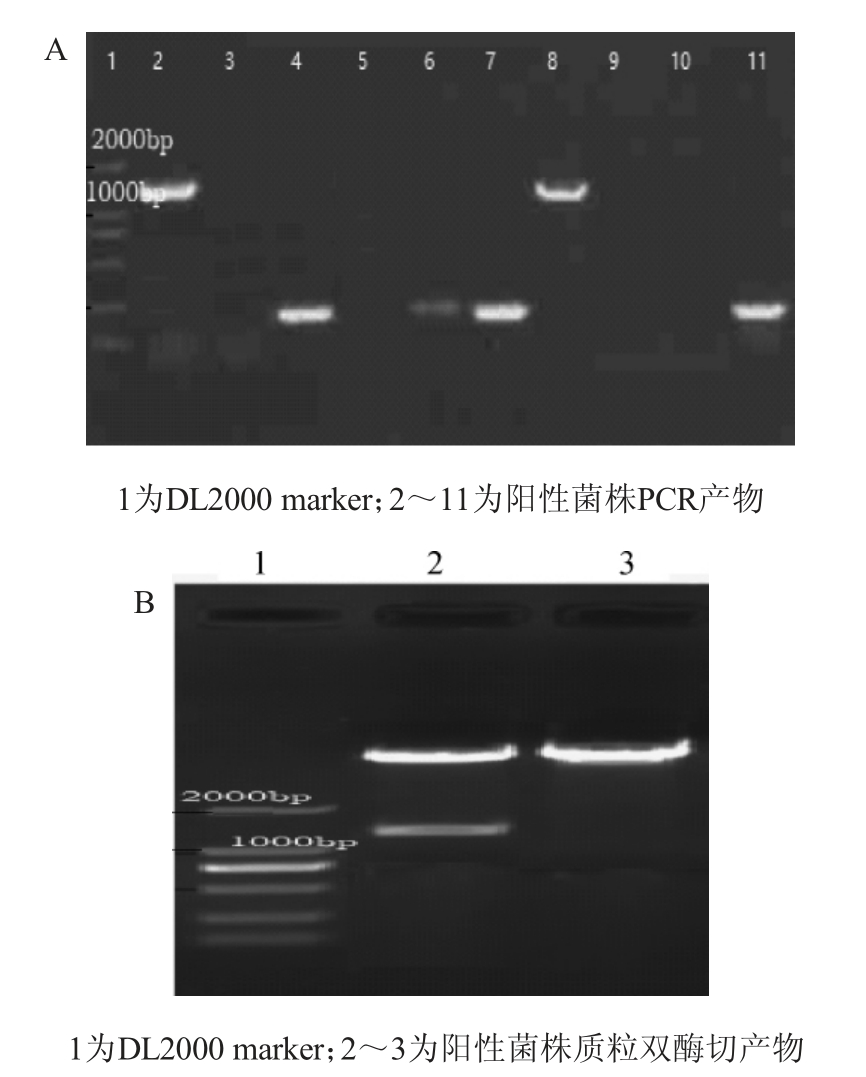
图4 pBE2R-AmyE-SigA整合质粒鉴定PCR鉴定(A)及阳性菌落质粒双酶切鉴定(B)
Fig .4 Identification of pBE2R-AmyE-SigA integrated plasmids by PCR (A) and double restriction-enzyme digestion of plasmids for positive colony (B)
由图4A可知,2、8泳道PCR产物DNA片段约为1 400 bp左右,符合目的片段大小,因此,初步筛选出菌株2(A1)和菌株8(A7)将进行进一步筛选。由图4B可知,A1菌株质粒经酶切的片段大小在1 400 bp左右,符合实验预期,初步表明pBE2R-AmyE-SigA整合型表达载体构建成功。
2.4 pBE2R-Sugar phosphate isomerase-SigB整合型表达载体的构建
将合成的SigB表达盒经HindIII/BamHIII双酶切连接至经同样双酶切的pBE2R-sugar phosphatase-MCS整合型穿梭质粒,转染BL进行抗性筛选,随机挑选10个阳性菌落进行菌落PCR,结果见图5A;挑7、8泳道阳性克隆培养5 mL菌液,提取质粒进行双酶切鉴定,结果见图5B。
由图5A可知,10个阳性克隆中,有2个克隆(B7、B8)PCR产物大小1 000 bp左右,符合预期;由图5B可知,2个克隆质粒经双酶切的片段大小在1 000 bp左右,符合实验预期,初步表明pBE2R-sugar phosphate-SigB整合型表达载体构建成功。
2.5 pBE2R-AmyE-SigA和pBE2R-Sugarphosphateisomerase-SigB整合表达L.fusiformis菌株的建立
挑取1.3.3项下菌株A1、B7、B8单克隆至5 mLLB培养基,培养至菌液吸光度值为1.5时,提取质粒,置于4 ℃备用。按1.3.3项下方法分别对pBE2R-AmyE-SigA、pBE2R-Sugar phosphate isomerase-SigB质粒对L.fusifromis感受态菌株的转化和转化菌株的筛选,结果见图6。
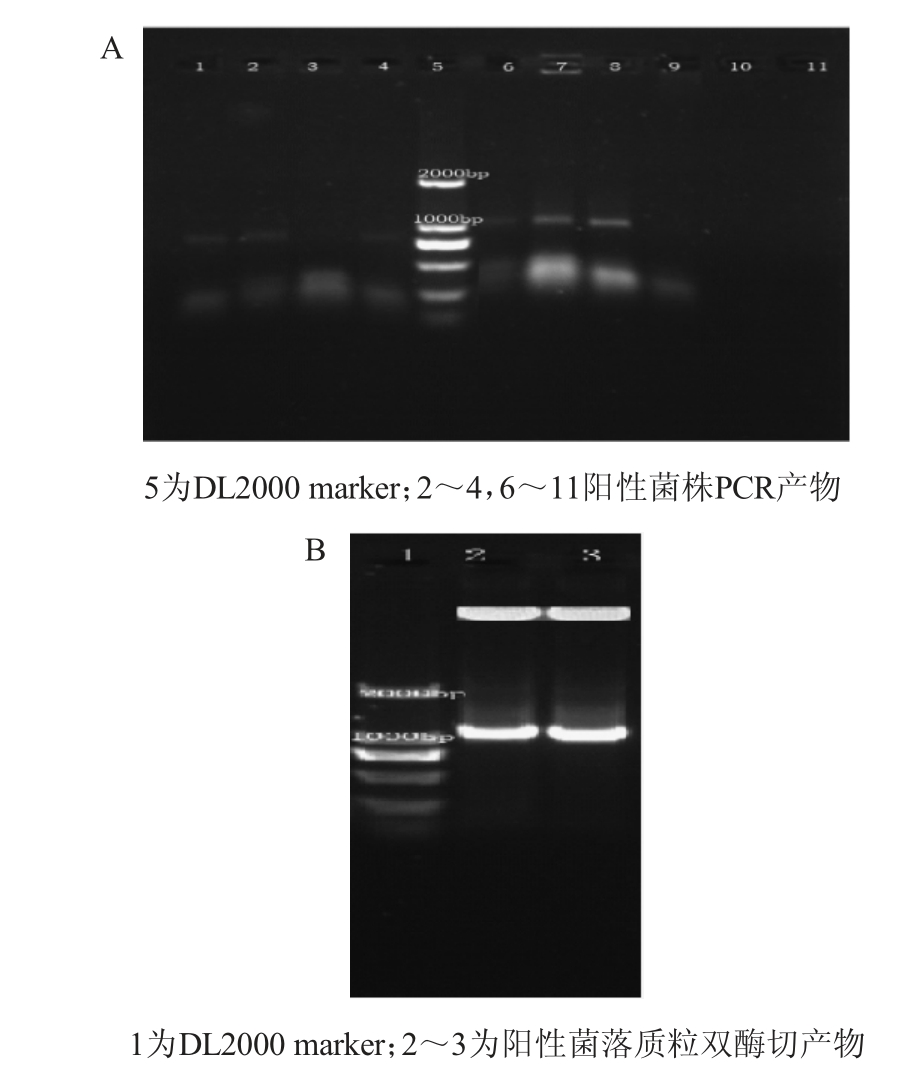
图5 pBE2R -Sugar phosphate-SigB整合质粒PCR鉴定(A)及阳性菌落质粒双酶切鉴定(B)
Fig. 5 Identification of pBE2R-Sugar phosphate-SigB integrated plasmids by PCR (A) and double-enzyme digestion of plasmids for positive colony (B)
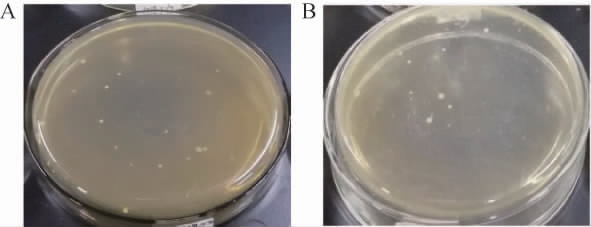
图6 pBE2R-AmyE-SigA(A)及pBE2R-Sugar phosphate isomerase-SigB(B)转化菌株
Fig. 6 Transformation strain of pBE2R-AmyE-SigA (A) and pBE2R-Sugar phosphate isomerase-SigB (B)
由图6可知,两种单整合转化方式在筛选平板上均有菌株生长,分别挑取图6阳性克隆各10个,提取细菌基因组总DNA进行PCR鉴定,结果见图7。
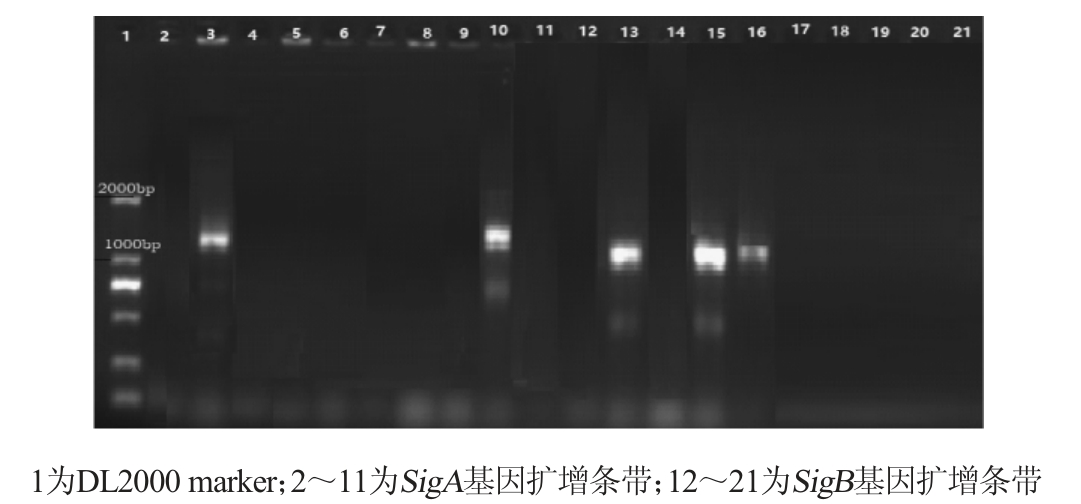
图7 pBE2R-AmyE-SigA和pBE2R-Sugar phosphate-SigB整合质粒阳性菌株菌落PCR鉴定
Fig. 7 Identification of integrated plasmids pBE2R-AmyE-SigA and pBE2R-Sugar phosphate-SigB positive strains by colony PCR
由图7可知,分别有2和3个克隆扩增得到预期大小的SigA基因(1 400 bp左右)和SigB(1 000 bp左右)基因片段,将获得预期大小SigA和SigB片段的克隆分别命名为pBE2RAmyE-SigA1、pBE2R-AmyE-SigA2、pBE2R-Sugar phosphate isomerase-SigB1、pBE2R-Sugar phosphate isomerase-SigB2和pBE2R-Sugar phosphate isomerase-SigB3菌株(分别简称为SigA1、SigA2、SigB1、SigB2、SigB3)。
挑取单整合菌株至5 mL乙酸钠培养基中,pH4、乙醇含量6%、36 ℃、0.07 MPa条件下培养15 d,取上清,进行气相色谱分析,平行测定3次,测得的己酸含量结果如表2。
表2 单整合菌株的产己酸鉴定
Table 2 Identification of the caproic acid production in single integrated strains
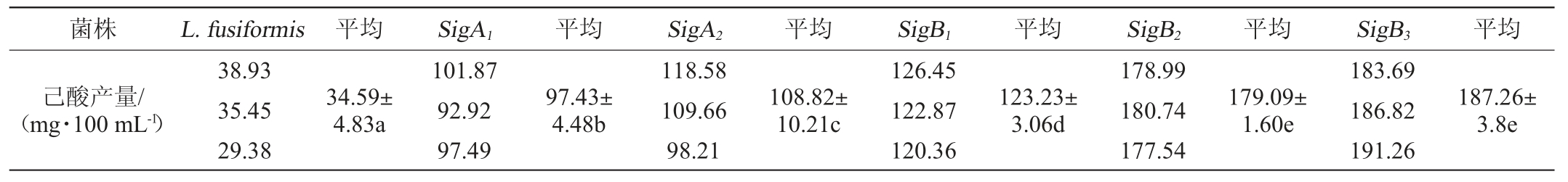
注:同行数据中的不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。
菌株 L.fusiformis 平均 SigA1 平均 SigA2 平均 SigB1 平均 SigB2 平均 SigB3 平均己酸产量/(mg·100 mL-1)38.93 35.45 29.38 34.59±4.83a 101.87 92.92 97.49 97.43±4.48b 118.58 109.66 98.21 108.82±10.21c 126.45 122.87 120.36 123.23±3.06d 178.99 180.74 177.54 179.09±1.60e 183.69 186.82 191.26 187.26±3.8e
采用SPSS 22.0对表2数据进行分析,结果显示,整合组所有菌株己酸产量均极显著高于对照组(P<0.01),表明抗性基因转录调节实现了其功能;SigA1和SigA2之间,差异显著(P=0.024<0.05),SigA1比SigA2显著低;SigB1显著低于SigB2、SigB3(P<0.01),但SigB2与SigB3之间差异不显著(P=0.088>0.05),SigB3高于SigB2。基于此,本研究选择SigA2、SigB3整合组菌株进行后续试验。
2.6 pBE2R-AmyE-SigA和pBE2R-Sugar phosphate isomerase-SigB双整合型表达菌株的建立
挑取高产SigA2、SigB1菌株制备感受态,按1.3.4项下方法分别进行pBE2R-AmyE-SigA、pBE2R-Sugar phosphate isomerase-SigB质粒对SigA2、SigB3整合组菌株感受态菌株的转化,结果见图8。
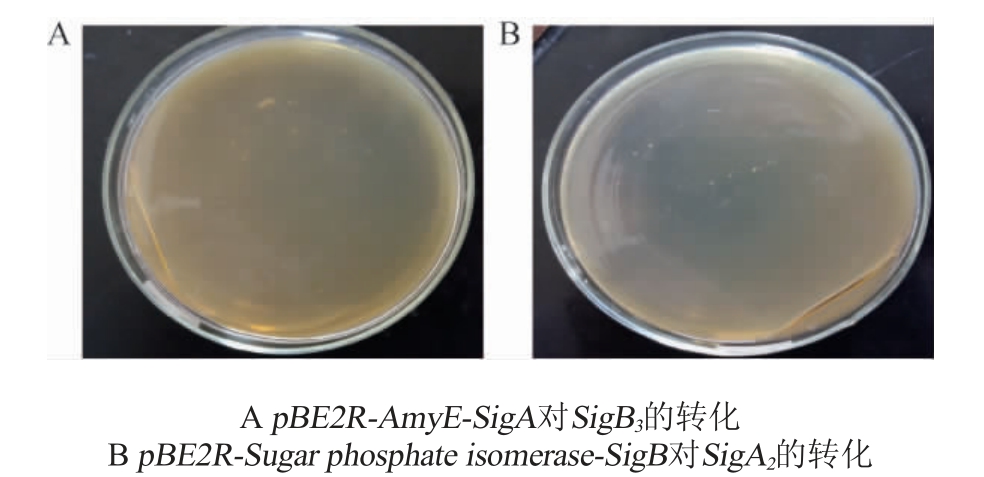
图8 双整合转化菌株
Fig. 8 Double-integrated transformation strain
由图8可知,两种双整合转化方式在筛选平板上均有菌株生长,分别挑取pBE2R-AmyE-SigA对SigB3的转化菌株和pBE2R-Sugar phosphate isomerase-SigB 对SigA2的转化菌株各10株,对表达盒SigA或表达盒SigB采用表1中表达盒引物进行菌落PCR鉴定,结果见图9。
由图9A和9B可知,各有1个克隆PCR产物中同时获得了预期大小基因片段(SigA为1 400 bp左右;Sig B为1 000 bp),该结果初步表明,本实验成功构建了2株SigA和SigB双整合表达盒菌株,分别命名为SigA-SigB7和SigA-SigB4。
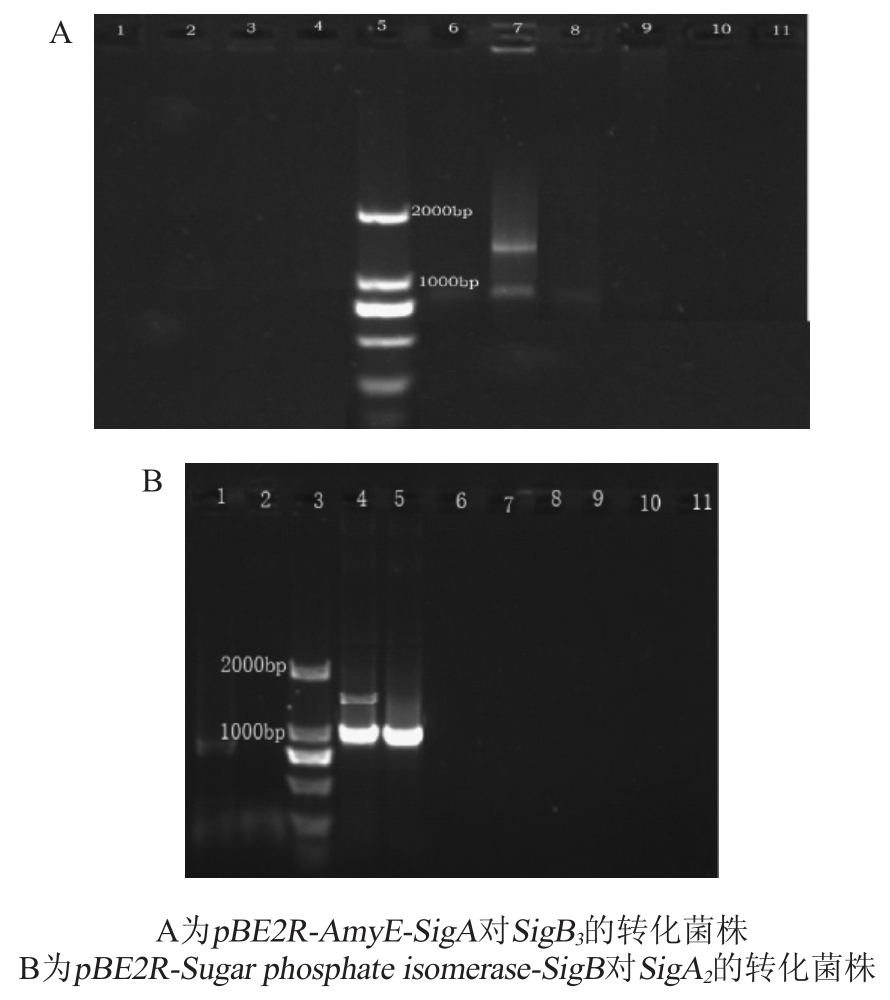
图9 SigA和SigB双整合转化菌株PCR鉴定
Fig. 9 Identification of SigA and SigB double-integrated transformed strains by PCR
分别挑取2个双整合菌株至5 mL乙酸钠培养基中,pH 4、乙醇含量6%、36 ℃、0.07 MPa条件下培养15 d,每组3个重复,取上清,进行气相色谱测定,结果见表3。
采用SPSS22.0对表3数据进行分析,结果显示,所有双重组菌株己酸产量均显著高于出发菌L.fusiformis(P<0.01),单重组菌极显著低于双重组菌株(P<0.01);单重组菌间SigA2极其显著低于SigB3(P <0.01),双重组菌株间SigASigB7极显著低于SigA-SigB4(P<0.01),在pH 4、乙醇体积分数6%条件下,双整合重组菌SigA-SigB4比单重组菌SigB3己酸产量提高了1.17倍,比非重组出发株L.fusiformis提高了8.97倍。
表3 双整合菌株的抗胁迫筛选
Table 3 Screening of double-integrated strains for stress resistance
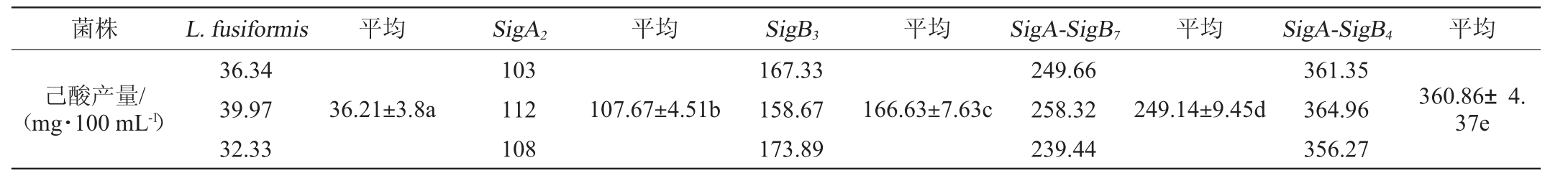
注:同行数据中的不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。
菌株 L.fusiformis 平均 SigA2 平均 SigB3 平均 SigA-SigB7 平均 SigA-SigB4 平均己酸产量/(mg·100 mL-1)36.34 39.97 32.33 36.21±3.8a 103 112 108 107.67±4.51b 167.33 158.67 173.89 166.63±7.63c 249.66 258.32 239.44 249.14±9.45d 361.35 364.96 356.27 360.86±4.37e
2.7 双重组菌株的稳定性鉴定
挑取SigA-SigB4单菌落,按1.3.5项下方法进行稳定性鉴定,具体形态结果见图10,产己酸性能结果见表4。
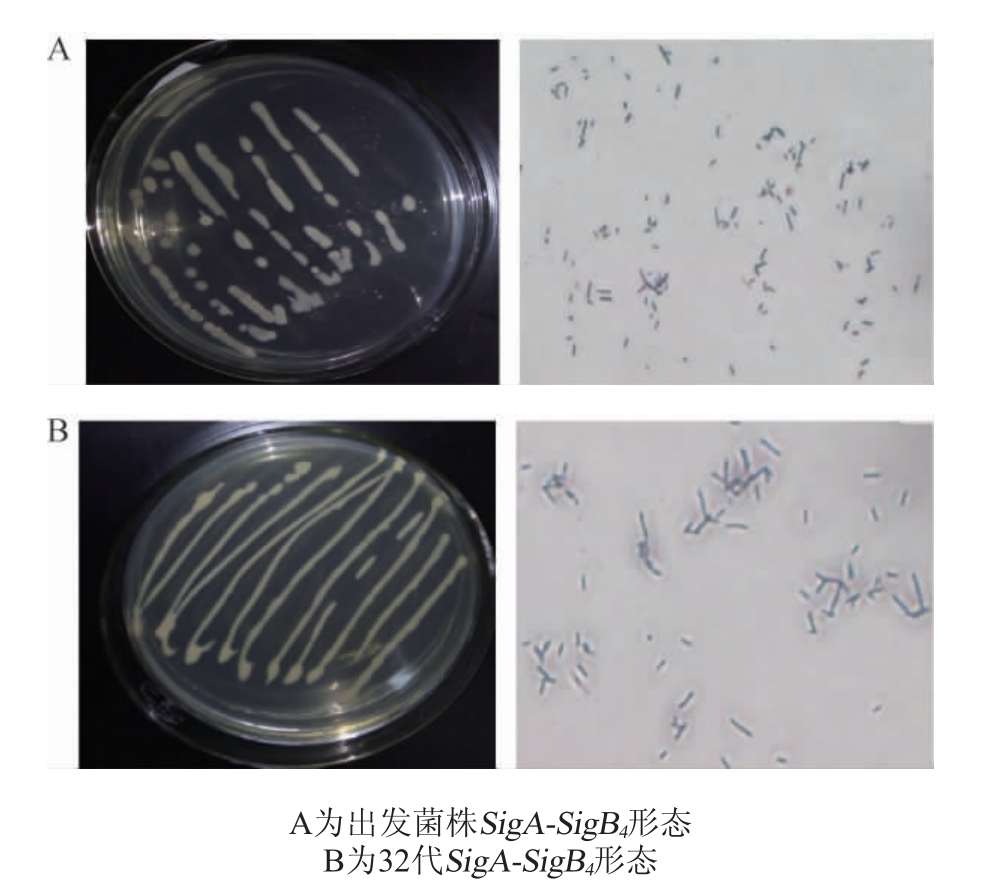
图10 双重组菌株SigA-SigB4形态稳定性试验
Fig. 10 Stability tests of double-integrated strain SigA-SigB4 in morphology
表4 双重组菌株SigA-SigB4产己酸稳定性试验
Table 4 Stability tests of double-integrated strain SigA-SigB4 in caproic acid-production

双重组己酸菌 出发菌株SigA-SigB4 平均 32代SigA-SigB4 平均己酸产量/(mg·100 mL-1)368.46 382.87 380.52 377.28±7.73 388.68 387.32 375.91 383.97±7.01
对表4中己酸产量采用SPSS软件包中成对数据进行T检验,结果显示,出发菌SigA-SigB4传代32代后,其产己酸效能无显著差异(P>0.05)。取0.5 mL 30代15 d培养SigASigB4菌液,送上海生工生物工程有限公司进行测序鉴定,采用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)在线多重序列比对工具,将设计序列与测序结果进行比对,比对结果见图11。
由图11A可知,对SigA-SigB4菌株中SigA表达盒进行测序,发现与设计序列SigA相比,SigA-SigB4菌株中SigA表达盒中有3个碱基发生了改变,即298(C→G)、711(A→T)、1007(T→A);从图11B可知,SigA-SigB4菌株中SigB表达盒发生了2个碱基突变:179(A→T)和462(C→G)。

图11 表达盒设计与SigA-SigB4菌株测序DNA序列比对
Fig. 11 Alignment of designed DNA sequences in expression box and sequencing in double-integrated strain SigA-SigB4

图12 表达盒设计与SigA-SigB4菌株测序氨基酸序列比对
Fig. 12 Alignment of designed amino acid sequence in expression box and sequencing in double-integrated strain SigA-SigB4
采用NCBI基因序列翻译工具orffinder(https://www.ncbi.nlm.nih.gov/orffinder/),将设计和测序表达盒DNA序列,翻译成氨基酸序列进行比较,结果见图12。
由图12A可知,SigA-SigB4菌株中SigA表达盒表达的σ70与设计序列相比,发现在有2个突变,23位的F(苯丙氨酸)→L(亮氨酸),162位M(蛋氨酸)→L(亮氨酸);由图12B可知,SigA-SigB4菌株中SigB表达盒表达的σB与设计序列相比无突变。
3 结论
本试验构建了用于L.fusiformis菌株α-淀粉酶和蔗糖磷酸化酶的定点整合质粒pBE2R-AmyE-MCS和pBE2R-sugar isome-MCS,并利用其在L.fusiformis α-淀粉酶基因、蔗糖磷酸化酶基因基因位点定点敲入了抗性调节基因SigA和SigB及其启动子序列,构建了双元整合菌株SigA-SigB2,该菌株在pH4和乙醇含量6%时,其己酸产量达到360.86 mg/100 mL,是单整合菌株SigB3的1.17倍,非重组出发菌株的8.97倍,且经过32代传代后,其高效产己酸效能无显著变化;因此,本试验成功选育了满足生产需要的高抗性高效发酵的稳定型己酸菌。
[1]彭兵,祝熙,李忠奎,等.窖泥高产己酸菌分离鉴定及培养条件优化的研究[J].中国酿造,2016,35(5):43-46.
[2]姚万春,唐玉明,任道群.浓香型白酒窖泥关键功能菌的优化培养[J].酿酒,2010,37(6):18-21.
[3]YAN S,DONG D.Improvement of caproic acid production in a Clostridium kluyveri H068 and methanogen 166 co-culture fermentation system[J].AMB Express,2018,8(1):1-13.
[4]ZOU W,ZHAO C Q,LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:a review[J].Front Microbiol,2018,9:671-675.
[5] HU X, DU H, XU Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[6]赵晨婕,刘念,王超凯,等.窖泥高产己酸菌的分离筛选及发酵性能测试[J].中国酿造,2020,39(1):114-118.
[7]薛正楷,薛原.一株窖泥己酸菌株的多相鉴定及产酸研究[J].酿酒科技,2016(6):65-71.
[8]胡智慧,谌柄旭,任雪,等.白酒生产用己酸菌发酵液发酵条件及培养基组成的优化[J].中国酿造,2018,37(4):16-22.
[9]徐军.人工老窖泥培养中功能菌发酵液的制备[J].酿酒科技,2011(10):61-62.
[10]WANG Z W,CUMMING B M,MAO C Y,et al.RbpA and σB association regulates polyphosphate levels to modulate mycobacterial isoniazidtolerance[J].Mol Microbiol,2018,108(6):627-640.
[11]薛正楷,杨根庆,张宿义,等.一株耐高乙醇和低pH 己酸产生菌Lysinibacillus fusiformis-pBE3-ep-SigB 的构建[J]. 中国酿造,2018,37(5):162-168.
[12]薛正楷,薛原,杨根庆,等.产己酸菌Lysinibacillus fusiformis SigA 基因的克隆、表达及生物信息学分析[J]. 中国酿造,2017,36(8):120-124.
[13] NARAYANAN A, VAGO F S, LI K, et al. Cryo-EM structure of Escherichia coli σ70 RNA polymerase and promoter DNA complex revealed a role of σ non-conserved region during the open complex formation[J].J Biol Chem,2018,293(19):7367-7375.
[14]SIHTO H,STEPHAN R,ENGL C,et al.Effect of food-related stress conditions and loss of agr and sigB on seb promoter activity in S.aureus[J].Food Microbiol,2017,65(65):205-212.
[15]SIHTO H,SUSILO Y B,TASARA T,et al.Effect of sodium nitrite and regulatory mutations Δagr, ΔsarA, and ΔsigB on the mRNA and protein levels of staphylococcal enterotoxin D[J]. Food Control, 2016, 65(65):37-45.
[16]季晓飞,赵慧琳,张莹,等.基因敲除质粒载体的构建及其在幽门螺杆菌基因敲除中的应用[J].中国病原生物学杂志,2016(12):16-19,23.
[17] DALESSANDRO G, FAGAGNA F D. Transcription and DNA damage:Holding hands or crossing swords?[J].J Mol Biol,2017,429(21):3215-3229.
[18] NORA L C, WESTMANN C A, GUAZZARONI M, et al. Recent advances in plasmid-based tools for establishing novel microbial chassis[J].Biotechnol Adv,2019,37(8):33-40.
[19]REH W A,NAIRN R S,LOWERY M P,et al.The homologous recombination protein RAD51D protects the genome from large deletions[J].Nucl Acid Res,2017,45(4):1835-1847.
[20]YANG M,ZHANG W,JI S,et al.Generation of an artificial double promoter for protein expression in Bacillus subtilis through a promoter trap system[J].Plos One,2013,8(2):e56321-52328.
[21]温赛,杨建国.地衣芽孢杆菌原生质体电转化方法的研究[J].中国生物工程杂志,2015(7):82-88.