四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪,属生物碱类,是一种含氮杂环化合物,广泛存在于食品原料、咖啡以及乳制品中,具有烘烤香气、甜香,是中国白酒中的重要香气化合物之一[1]。除了作为食品风味添加剂提升香气外,四甲基吡嗪还是中药川芎的重要活性成分,可用于对疾病的预防[2]。近年来,我国许多白酒企业为提高白酒中四甲基吡嗪含量,开展了如何利用微生物发酵酒曲以及优化条件的研究[3-6],并已成为研究白酒对人体健康作用的重要部分[7]。
徐岩等[8]研究验证了中国白酒发酵过程中TTMP的产生主要来源于微生物的代谢反应,而非美拉德反应。比如芽孢杆菌可利用底物合成四甲基吡嗪的前体3-羟基丁酮(又称乙偶姻),3-羟基丁酮进一步与氨反应生成四甲基吡嗪。陈梦圆等[9]通过固态发酵法从高温大曲中筛选得到2株高产四甲基吡嗪菌株,分别为地衣芽孢杆菌(Bacillus licheniformis)和暹罗芽孢杆菌(Bacillus siamensis),发酵10 d后产量最高可达(150.92±0.783)mg/L。王晓丹等[10]对产四甲基吡嗪地衣芽孢杆菌(Bacillus licheniformis)进行了研究,结果表明,将筛选得到菌株按最佳添加量5%添加到窖池中层的糟醅中,发酵后的酒醅四甲基吡嗪含量达6.81 μg/g,是对照组的3.03倍。ZHU B F等[11]对从高温大曲分离得到的利用乙偶姻产四甲基吡嗪的厌氧芽孢杆菌(Bacillus sp.)进行了研究,经鉴定为枯草芽孢杆菌(Bacillus subtilis)。并对该菌产四甲基吡嗪的发酵条件进行了优化,得到的TTMP产量>4.08 g/L,为目前最高的报道,同时研究发现高浓度的磷酸氢二铵有利于四甲基吡嗪的产生。
我国酱香型、芝麻香型、浓香型白酒中四甲基吡嗪含量比较高[12-14],目前大多集中在对酱香型和浓香型白酒中TTMP的研究。本研究通过从高温酒曲中分离纯化菌株,采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪筛选出高产TTMP的菌株,通过观察其菌落形态和细胞形态,结合利用16S rRNA鉴定,对高产TTMP的菌株进行菌种鉴定及挥发性成分分析。旨在增加白酒的风味及保健功能,为高产菌株在浓香型白酒中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲:舍得酒业股份有限公司。
1.1.2 化学试剂
四甲基吡嗪标品(纯度98%):上海源叶生物科技有限公司;二氯甲烷(色谱级):天津市大茂化学试剂厂;其他试剂均为国产分析纯。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂20 g/L,pH 7.0~7.2,121 ℃灭菌30 min。
液体培养基:酵母膏5 g/L,蛋白胨10 g/L,氯化钠10 g/L,pH 7.0~7.2,121 ℃灭菌20 min。
富集培养基:酵母膏3 g/L,蛋白胨10 g/L,淀粉3 g/L,MgSO4·7H2O 0.01 g/L,KH2PO4 0.2 g/L,Na2HPO4 2 g/L,pH 7.8,121 ℃灭菌20 min。
发酵培养基:葡萄糖50g/L,酵母粉10 g/L,蛋白胨30g/L,磷酸氢二铵30 g/L,pH 7.0,121 ℃灭菌20 min,葡萄糖单独灭菌,115 ℃灭菌20 min。
V-P培养基:6%α-奈酚酒精溶液为甲液,40%氢氧化钾为乙液。
1.2 仪器与设备
GR85DA型蒸汽灭菌锅:济南来宝医疗器械有限公司;SHP-25型恒温培养箱:上海森信实验仪器有限公司;Mixer 4k型微型漩涡混合仪:生工生物工程(上海)股份有限公司;RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂;PX2型聚合酶链式反应(polymerase chain reaction,PCR)仪:上海赛默生物科技有限公司;DYCP-31脱氧核糖核酸(deoxyribonucleic acid,DNA)电泳槽、DYY5稳压电泳仪:北京六一仪器厂;FR980凝胶成像仪:上海复日科技仪器有限公司;7890A自动进样气相色谱质谱联用仪:安捷伦科技(中国)有限公司;ZQWY-200S型三层组合式全温振荡培养箱:上海知楚仪器有限公司;BSA2202S型电子天平:北京赛多利斯仪器有限公司。
1.3 方法
1.3.1 产四甲基吡嗪菌株的分离纯化
在无菌环境下,称取10.00 g酒曲样品加入到100 mL无菌水,37 ℃、200 r/min振荡30 min。85 ℃水浴加热30 min,取上清液5.00 mL加入95 mL的富集培养基中,37 ℃、200 r/min振荡富集处理24 h。将培养好的富集液进行稀释,配成10-2、10-3、10-4、10-5、10-6、10-7梯度的菌悬液。吸取10-3、10-4、10-5、10-6、10-7梯度菌悬液各50 μL进行涂布培养,37 ℃倒置培养24 h。挑取平板上不同形态的菌株,将获得的单菌落进行平板划线处理,多次纯化。将纯化好的单菌落进行细菌染色处理,观察菌落形态以及细菌的形态,去掉重复的细菌,-80 ℃保存菌种。
1.3.2 菌株液态发酵实验
由文献[15]可知,四甲基吡嗪发酵体系的前体物质为乙偶姻,在碱性条件下,乙偶姻被氧化为2,3-丁二酮,2,3-丁二酮与肌酸产生粉红色的复合物。借助V-P实验[15]进行乙偶姻含量高低初步检测,实现对产四甲基吡嗪菌株的初筛。
将纯化的菌种分别接入含5 mL的液体培养基的试管内,37 ℃、200 r/min培养15~18 h。4%接种量于发酵培养基内,37 ℃、200 r/min培养36 h。取1 mL加入V-P培养基的试管内振荡混匀,放置5 min,观察颜色变化。如果颜色不深可再培养一段时间。选取阳性反应的菌株进行高产四甲基吡嗪菌株的复筛。
将经过初筛的菌株继续培养,47 ℃、200 r/min培养24 h,随后升至60 ℃,200 r/min培养12 h[16]。然后取10 mL发酵液,用10 mL的二氯甲烷萃取。步骤为:将蒸馏液加入10 mL的二氯甲烷,超声20 min混合均匀,倒入分液漏斗中,排出气体,静置30 min,可明显看到分层,将下层液体从下方流出,上层液体从上方倒出,再将下方倒出的液体加入10 mL的二氯甲烷进行萃取,重复上述步骤3次,则得到30 mL萃取液,浓缩至1 mL,用气相色谱-质谱联用仪测定其TTMP的含量。
1.3.3 高产四甲基吡嗪菌株的鉴定
菌株形态鉴定:将筛选出TTMP产量高的菌株在平板上活化,再以点接法接种到牛肉膏蛋白胨琼脂培养基上,37 ℃条件下培养48 h后观察其在培养基上颜色、大小、质地、边缘整齐性、表面光滑性等菌落形态特征。将保存菌株接种到液体培养基中,在37 ℃、200 r/min条件下培养24 h。将活化后的菌株制片,染色后显微镜观察其菌体形态。
菌株分子生物学鉴定:根据细菌DNA提取试剂盒说明书,采用细菌16S rDNA通用27F(5'-AGAGTTTGATCCGGCTCAG-3'),1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,在25.0 μL聚合酶链式反应(PCR)体系中,上、下游引物1492R和27F各1.0 μL,Taq Master Mix 12.5 μL,细菌DNA 0.5 μL,双蒸水(ddH2O)10.0 μL。PCR扩增条件为初始变性94 ℃、15 min;然后变性94 ℃、0.5 min,退火55 ℃、0.5min,复性72℃、1.5 min,30个循环,最后延伸72 ℃、10 min,反应结束后4 ℃保存。取5 μl细菌DNA溶液加1 μL Loading buffer于1%琼脂糖凝胶120 V电泳25~30 min。
测序由上海生物工程有限公司完成,采用16S rRNA鉴定方法对菌株进行分子生物学鉴定。所得测序结果输入美国国家生物信息技术中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,用邻接(neighbor-joining,NJ)法构建目标菌株的系统发育树。
1.3.4 四甲基吡嗪含量的测定[17-19]
四甲基吡嗪含量测定采用气相色谱-质谱联用(GCMS)法。
四甲基吡嗪标准曲线的绘制:准确称取0.05 g(精确到0.000 1 g)的四甲基吡嗪,溶于100 mL的色谱级二氯甲烷,定容至刻度线,配制成500 mg/L的四甲基吡嗪标样母液。移液管依次移取1 mL、2 mL、3 mL、4 mL、5 mL、6 mL、8 mL 500 mg/L的四甲基吡嗪标样溶液于10 mL容量瓶中,定容至刻度线,即配制成50 mg/L、100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L、400 mg/L四甲基吡嗪系列标准溶液。四甲基吡嗪系列标准溶液在选定的色谱条件下测定,以四甲基吡嗪质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制TTMP标准曲线。
气相色谱条件:弹性石英毛细管色谱柱(30 m×0.25 mm×1 μm),柱温40 ℃(保持1 min),以10 ℃/min升温至150 ℃,再以10 ℃/min升温至210 ℃保持10 min,再以20 ℃/min升温至230 ℃保持4 min,运行时间52 min;汽化室温度250 ℃;载气为高纯氦气(He)(纯度99.999%);柱前压7.334 psi,载气流速1 mL/min;分流进样,分流比为20∶1。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230 ℃,接口温度250 ℃,四级杆温度150 ℃,溶剂延迟时间8 min,全扫描。
定性定量方法:采用选择离子扫描模式对四甲基吡嗪的4个特征离子进行扫描。GC-MS联用仪得出其峰面积,根据峰面积与含量成正比的关系,通过已建立的浓度-四甲基吡嗪峰面积标准曲线回归方程,计算筛选菌株产四甲基吡嗪含量。
2 结果与分析
2.1 四甲基吡嗪标准曲线的绘制
应用GC-MS法测定四甲基吡嗪,以四甲基吡嗪质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制四甲基吡嗪标准曲线见图1。由图1可知,四甲基吡嗪保留时间为14.467min,标准曲线线性方程为y=6E+07x,相关系数为R2=0.9899,表明二者线性关系良好。
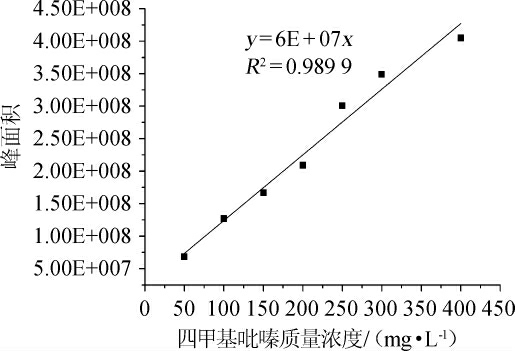
图1 四甲基吡嗪标准曲线
Fig. 1 Standard curve of tetramethylpyrazine
2.2 高产四甲基吡嗪菌株的筛选
采用平板稀释涂布法,从大曲样品中分离到具有不同特性菌株,接种到牛肉膏蛋白胨培养基中进行活化。通过V-P培养基筛选,将3-羟基丁酮含量作为重要筛选指标,筛选出10株呈阳性反应且颜色较深菌株。将筛选的10株分别接种于发酵培养基中进行发酵培养,经过72 h发酵,检测各菌株的TTMP产生能力,结果见图2。由图2可知,菌株A7、A18四甲基吡嗪产量较高,分别为350.98 mg/L、163.49 mg/L,将两株高产菌株用于进一步的分析。
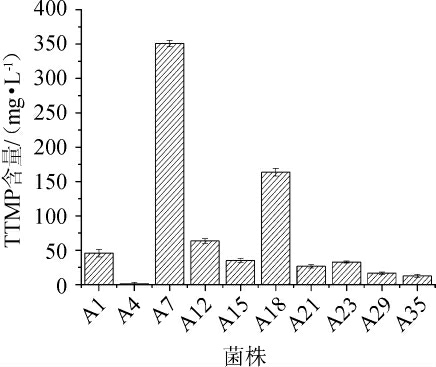
图2 不同菌株产四甲基吡嗪含量的测定结果
Fig. 2 Determination results of tetramethylpyrazine contents produced by different strains
2.3 高产四甲基吡嗪菌株的鉴定
2.3.1 菌株的形态学观察
对筛选出的菌株A7、A18接种于牛肉膏蛋白胨固体培养基上,观察其菌落形态特征,结果见图3。由图3可知,菌株A7菌落呈白色圆形,呈凝胶状,边缘整齐,表面呈突起的圆形,有黏性,湿润。经染色后,细胞形态为短杆状;菌株A18菌落为白色圆形,边缘整齐,中间厚边缘薄,表面粗糙干燥,附着力强。经染色后,细胞形态同为短杆状。
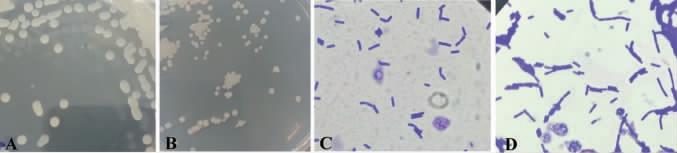
图3 菌株A7、A18的菌落形态(A、B)及细胞形态(C、D)
Fig. 3 Colony (A, B) and cell (C, D) morphology of strains A7 and A18
2.3.2 菌株的分子生物学鉴定
采用通用引物27F和1492R,利用PCR扩增获得高产菌株A7和A18的16S rDNA序列,并交由上海生工有限公司进行序列测定。将测得核苷酸序列通过NCBI-BLAST程序在GenBank数据库中进行比对,选取相关菌种的同源性高的序列。采用MEGA-X软件进行序列比对,NJ法多序列连配分析后构建系统发育树,结果见图4。由图4A可知,菌株A7与多株芽孢杆菌同源性为99%,与模式菌株甲基营养型芽孢杆菌(Bacillus methylotrophicus)RY1处于同一分支,结合菌落形态分析,可鉴定菌株A7为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。由图4B可知,菌株A18与多株芽孢杆菌同源性为99%,与模式菌株蛋白水解芽孢杆菌(Bacillus proteolyticus)CBD 119处于同一分支,结合菌落形态分析,可鉴定菌株A18为蛋白水解芽孢杆菌(Bacillus proteolyticus)。
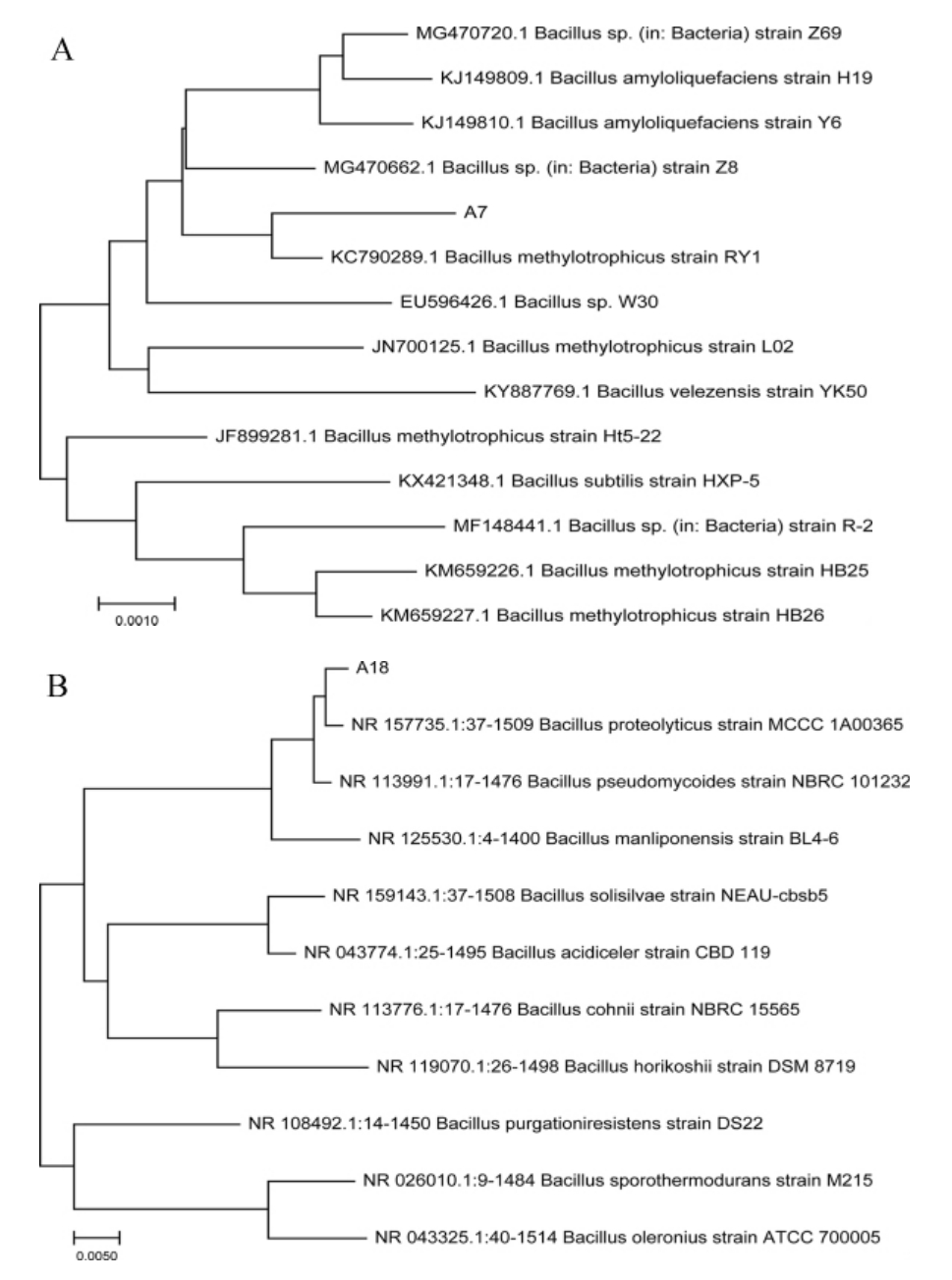
图4 基于16S rDNA序列分析菌株A7(A)及菌株A18(B)的系统发育树
Fig. 4 Phylogenetic tree of strains A7 (A) and A18 (B) based on 16S rDNA gene sequences analysis
2.4 菌株A7代谢产物的GC-MS分析
对菌株A7进行了模拟液态发酵实验,发酵72 h后,到达TTMP的最大积累量,同时对发酵成分进行分析。发酵液取10 mL,以5 000 r/min离心10 min以除去菌体,取上清液与二氯甲烷等体积混合后进行蒸馏,收集馏分,对馏分进行GC-MS分析,对其发酵产物的挥发性香味成分进行了测定,其GC-MS检测总离子流色谱图见图5,各成分含量检测结果见表1。
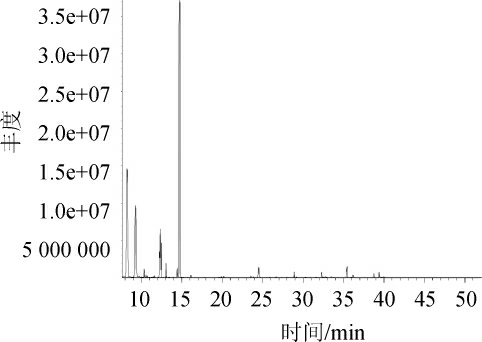
图5 菌株A7发酵产物挥发性成分GC-MS分析总离子流色谱图
Fig. 5 Total ion chromatogram of volatile components in fermentation products of strain A7 analysis by GC-MS
表1 菌株A7发酵产物挥发性成分GC-MS分析结果
Table 1 Results of volatile components contents in fermentation products of strain A7 analysis by GC-MS
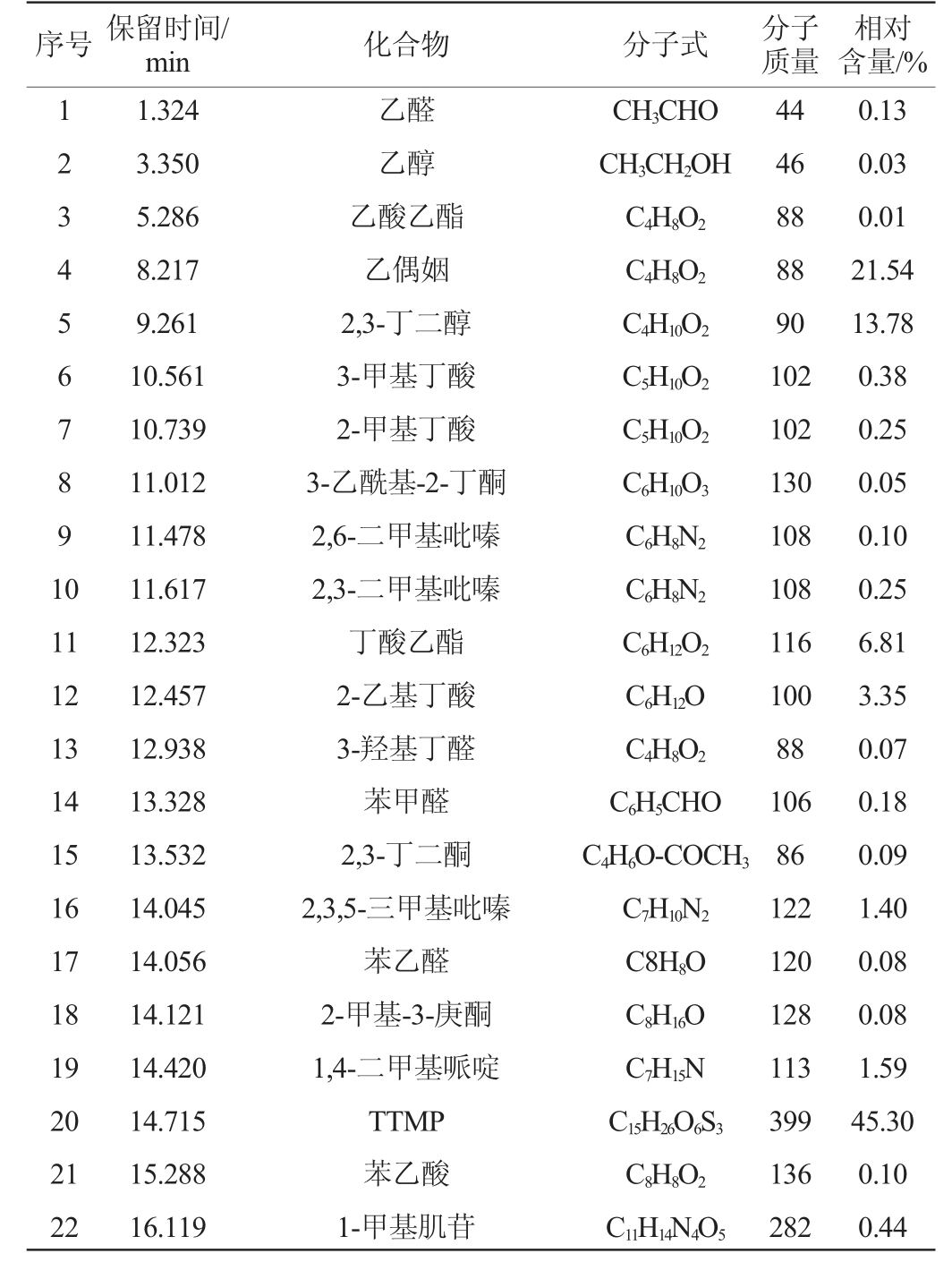
序号 保留时间/min 化合物 分子式 分子质量相对含量/%1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 1.324 3.350 5.286 8.217 9.261 10.561 10.739 11.012 11.478 11.617 12.323 12.457 12.938 13.328 13.532 14.045 14.056 14.121 14.420 14.715 15.288 16.119乙醛乙醇乙酸乙酯乙偶姻2,3-丁二醇3-甲基丁酸2-甲基丁酸3-乙酰基-2-丁酮2,6-二甲基吡嗪2,3-二甲基吡嗪丁酸乙酯2-乙基丁酸3-羟基丁醛苯甲醛2,3-丁二酮2,3,5-三甲基吡嗪苯乙醛2-甲基-3-庚酮1,4-二甲基哌啶TTMP苯乙酸1-甲基肌苷CH3CHO CH3CH2OH C4H8O2 C4H8O2 C4H10O2 C5H10O2 C5H10O2 C6H10O3 C6H8N2 C6H8N2 C6H12O2 C6H12O C4H8O2 C6H5CHO C4H6O-COCH3 C7H10N2 C8H8O C8H16O C7H15N C15H26O6S3 C8H8O2 C11H14N4O5 44 46 88 88 90 102 102 130 108 108 116 100 88 106 86 122 120 128 113 399 136 282 0.13 0.03 0.01 21.54 13.78 0.38 0.25 0.05 0.10 0.25 6.81 3.35 0.07 0.18 0.09 1.40 0.08 0.08 1.59 45.30 0.10 0.44
续表
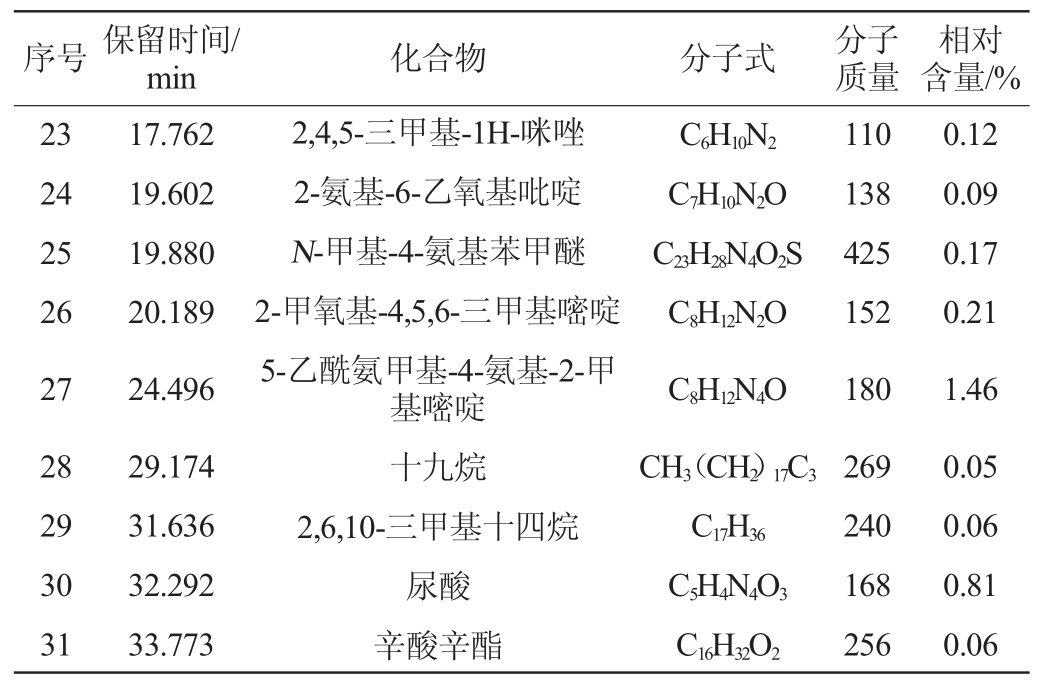
序号 保留时间/min 化合物 分子式 分子质量相对含量/%23 24 25 26 27 28 29 30 31 17.762 19.602 19.880 20.189 24.496 29.174 31.636 32.292 33.773 2,4,5-三甲基-1H-咪唑2-氨基-6-乙氧基吡啶N-甲基-4-氨基苯甲醚2-甲氧基-4,5,6-三甲基嘧啶5-乙酰氨甲基-4-氨基-2-甲基嘧啶十九烷2,6,10-三甲基十四烷尿酸辛酸辛酯C6H10N2 C7H10N2O C23H28N4O2S C8H12N2O C8H12N4O CH3(CH2)17C3 C17H36 C5H4N4O3 C16H32O2 110 138 425 152 180 269 240 168 256 0.12 0.09 0.17 0.21 1.46 0.05 0.06 0.81 0.06
由图5和表1可知,在菌株A7发酵产物中,吡嗪类化合物相对含量最高,达到了47.05%,其中以四甲基吡嗪为主,相对含量为45.30%。其次是酮类化合物,相对含量为21.76%,其中以3-羟基-2-丁酮(乙偶姻)为主,相对含量为21.54%。醇类化合物相对含量为13.81%,以2,3-丁二醇为主,相对含量为13.79%。酸类物质相对含量为4.08%,醛类物质相对含量为0.46%,酯类物质相对含量为6.85%,还有一些其他的烷烃类和杂环类和未测定出的化合物,总相对含量为4.30%。
3 结论
通过稀释涂布法,从大曲中分离得到的细菌中有10株菌株具有产四甲基吡嗪的能力。通过模拟液态发酵工艺,梯度升温发酵,获得2株液态发酵高产四甲基吡嗪菌株A7和A18,其四甲基吡嗪的含量分别为350.98 mg/L、163.49 mg/L。结合菌株形态学观察和分子生物学方法,菌株A7被鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus),菌株A18被鉴定为蛋白水解芽孢杆菌(Bacillus proteolyticus)。菌株A7液态发酵产物中的挥发性成分GC-MS检测结果表明,其液态发酵产物中吡嗪类物质含量较高(40.05%)。结合液态发酵产物感官评价,其发酵产物香气浓郁,这与白酒中风味的特征性成分以吡嗪类等物质为主的说法相符。液态发酵过程相对于固态发酵来说时间短、效率高,适用于实验室进行小规模筛选高产四甲基吡嗪的菌株。在不同香型白酒中,四甲基吡嗪的含量有所差异,据此可对白酒生产工艺进行改进,提高该组分在白酒中的含量,改善白酒品质[20]。
[1] FAN W L, XU Y, ZHANG Y H. Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[2]胡国芬,王建平.川芎嗪的药理作用及临床应用进展[J].中国药物与临床,2006,6(10):773-774.
[3]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[4]王晓丹,王婧,朱国军,等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造,2017,36(1):55-60.
[5]李晓欢,葛向阳,汤有宏,等.古井桃花曲中高产四甲基吡嗪功能微生物筛选及其发酵条件优化[J].酿酒,2016,43(3):52-56.
[6]赵德义,汤丹丹,曹建全,等.产四甲基吡嗪微生物菌株的选育[J].中国酿造,2015.34(3):102-106.
[7]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[8]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[9]陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[10]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[11] ZHU B F, XU Y, FAN W L. High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].J Ind Microbiol Biot,2010,37(2):179-186.
[12]李晓霞.汾酒大曲中高产四甲基吡嗪菌株的筛选及其在酿酒中的应用研究[D].临汾:山西师范大学,2016.
[13]李宝霞.芝麻香型白酒中功能成分四甲基吡嗪研究[D].济南:齐鲁工业大学,2015.
[14]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[15]WESTERFIELD W W.A colorimetric determination of blood acetoin[J].J Biol Chem,1945,161(2):495-502.
[16]丁雪梅.酒曲中高产四甲基吡嗪菌株的选育及发酵优化[D].天津:天津科技大学,2015.
[17]王双.利用全二维气质联用仪对剑南春白酒中吡嗪类生理活性物质的研究[J].酿酒,2016,43(5):49-50.
[18]张艳红,范文来,徐岩,等.顶空固相微萃取与气相色谱-火焰热离子检测器联用测定白酒中吡嗪类化合物[J].分析试验室,2008,27(6):39-41.
[19]王莉,吴建霞,雷良波.气相色谱-质谱-离子扫描联用法快速检测白酒中4 种吡嗪类化合物[J].中国酿造,2009,29(3):148-150.
[20]张文学,岳元媛,向文良,等.浓香型白酒酒醅中化学物质的变化及其规律性[J].四川大学学报(工程科学版),2005,37(4):44-48.