食用酵素是指以动物、植物和食用菌等为原料,经微生物发酵制得的含有特定生物活性成分的可食用的酵素产品[1],由于其具有良好的口感和多种健康功能而深受消费者的喜爱[2-3]。
海棠酵素作为人们喜爱的水果类酵素,含有多糖、有机酸、短链脂肪酸、氨基酸、生物活性肽、生物酶、多酚、黄酮等生物活性物质[4-5],赋予酵素多种功能,具有生津止渴、健脾止泻的作用,治疗消化不良、食积腹胀、增强对疾病的抵抗力等功能,目前对海棠酵素的研究主要在发酵条件和生产工艺的优化方面;杨志鹏等[6]报道了以海棠果果汁为主要原料,通过鼠李糖乳杆菌(Lactobacillus rhamnosus)217-3发酵,研究了海棠酵素的发酵条件;刘维兵等[7]报道了葡萄海棠果酵素发酵工艺的优化及体外抑菌与抗氧化活性。酵素的生产是一个及其复杂的发酵过程,特别是其中参与发酵的微生物的种类及其在发酵过程中的变化,对酵素的生产起着关键作用。邸鹏月等[8]采用宏基因组技术分析桑葚酵素发酵前、中、后期微生物的丰度及多样性发现,桑葚酵素发酵过程中细菌较真菌丰富,其优势菌是乳杆菌属;马蓉等[9]报道了黑果枸杞酵素发酵过程中理化成分变化及微生物类型分析,获得了1种酵母菌,为库德里阿兹威毕赤氏酵母菌(Pichia kudriavzevii),1种曲霉菌,为短青霉菌(Penicillium brevicompactum),2种乳酸菌,为乳酸片球菌(Pediococcus acidilactici)、植物乳杆菌(Lactobacillus plantarum),为黑果枸杞酵素接种发酵提供特定菌种,并能够调控黑果枸杞酵素发酵过程中的理化成分变化及微生物生长规律;赵菲等[10]采用高通量测序技术研究鱼腥草酵素对小鼠肠道菌群的影响。
酵素作为一款新型的发酵食品,众多酵素产品的功能特性、发酵过程的控制尚不清楚。目前,对其发酵理论研究、生产工艺研究和功能作用机制的研究也较少。一方面,由于目前多数酵素产品采用自然发酵,其生产工艺和发酵菌种容易受到环境条件的影响,导致产品的品质和质量不稳定,因此对酵素发酵过程中微生物菌相的分析及对发酵微生物的了解就显得非常重要。目前,关于海棠酵素中微生物菌相的研究还尚未相关报道,本研究采用高通量测序技术,对海棠酵素发酵过程中的微生物菌相构成进行分析;同时采用传统微生物培养法分离、纯化海棠酵素发酵的优势微生物菌种,了解其发酵过程优势微生物,并获得纯培养物,为海棠酵素的接种发酵提供理论基础和菌种资源;最后,通过小鼠动物实验,研究海棠酵素对小鼠肠道菌群的影响,为揭示海棠酵素的益生功能奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
海棠酵素:山东博华高效生态农业科技有限公司。
1.1.2 试剂革兰氏染色试剂盒:南京建成生物有限公司;无水乙醇(分析纯):天津市化学试剂一厂。
1.1.3 培养基
溴甲酚绿(bromocresol green,BCG)牛乳培养基:天津市江天化工技术有限公司;溴甲酚紫显色培养基:天津市博迪化工有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:天津市江天化工技术有限公司。
1.2 仪器与设备
HVA-85型全自动高压蒸汽灭菌器:天津福宝德科技发展有限公司;Multiskan GO型酶标仪:美国Thermo公司;YS100生物显微镜:日本NIKON公司;HFsafe 900型超净工作台:上海力申科学仪器有限公司。
1.3 实验方法
1.3.1 海棠酵素活菌数分析及菌株分离
将海棠酵素摇晃均匀,吸取500 μL到装有4.5 mL无菌生理盐水的试管中,按10倍系列梯度稀释至10-6,分别取稀释度为10-3、10-4、10-5的稀释液100 μL分别涂布于BCG牛乳培养基(用于乳酸菌的分离)、YPD培养基(用于酵母菌的分离)、溴甲酚紫显色培养基(用于醋酸菌的分离)中,作3次平行试验[11]。将BCG牛乳培养基置于37 ℃条件下培养1~2 d,将YPD培养基置于30 ℃条件下培养2~3 d,将溴甲酚紫显色培养基置于28 ℃条件下培养2~3 d,观察菌落形态并计数。挑选单个菌落进行显微镜观察,同时记录菌体的形态特征。将纯化后的菌株采用甘油-80 ℃保藏并编号。
1.3.2 分离菌株的分子生物学鉴定
参照文献[11],采用细菌16S rDNA通用引物对细菌的16S rDNA序列进行PCR扩增。参照文献[11],采用真菌18S rDNA对真菌的18S rDNA序列进行PCR扩增。通过2%琼脂糖凝胶电泳对PCR扩增产物进行分析,将PCR扩增产物纯化后委托苏州GENEWIZ公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST),选取同源性较高的模式菌株的16SrDNA或18SrDNA序列,采MEGA7.0.14软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 海棠酵素发酵过程中微生物菌相变化分析
当海棠酵素发酵至0 d、4 d、13 d、20 d、25 d、31 d时取样,委托苏州金唯智生物科技有限公司进行高通量测序,研究海棠酵素发酵过程中菌相变化情况。
海棠酵素的操作分类单元(operational taxonomic unit,OTU)种类分析:OTU数量可以代表物种的丰度[12],将分析得到的序列按照相似性进行归类,将序列相似度>97%的序列定义为一个OTU[13]。
海棠酵素细菌和真菌菌群结构分析:通过R语言统计和分析作图,可得各样本在不同分类水平下含量较高的前30种微生物菌相的相对丰度图,展示海棠酵素微生物群落组成的种类和相对含量[14]。
海棠酵素菌相的a多样性分析:主要包括超1(Chao1)指数、ACE指数、香农(Shannon)指数、辛普森(Simpson)指数和Coverage指数,其中Chao1指数和ACE指数为菌群丰度指数;Shannon指数和Simpson指数为菌群多样性指数[15-16];Coverage指数代表样本的测序深度,是指各样本文库的覆盖率,其数值越高则样本中序列没有被测出的概率越低[17-18]。
1.3.4 海棠酵素改善小鼠肠道菌群功能探究
小鼠粪便的收集:选取6周龄雄性昆明小鼠16只,随机分为空白组和实验组,每组8只。空白组小鼠灌胃0.86%生理盐水,实验组小鼠灌胃海棠酵素原液,每天灌胃一次,灌胃0.4 mL,连续灌胃28 d。取空白组灌胃28 d后和实验组小鼠灌胃0 d和28 d后的3组小鼠粪便,依次命名为K组(空白组)、G组(灌胃前组)、S组(实验组)委托谷禾健康生物科技公司进行小鼠肠道菌群分析。
采用俞赟霞等[19]的方法,对3组小鼠粪便进行高通量测序,分析不同分类水平上微生物组成差异及变化情况和微生物多样性,研究海棠酵素改善小鼠肠道菌群的能力。
2 结果与分析
2.1 海棠酵素中微生物组成及含量分析
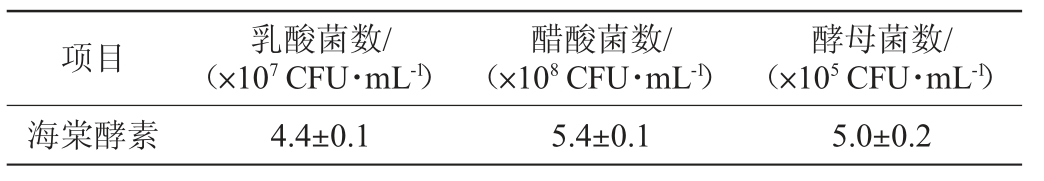
海棠酵素中活菌统计结果见表1。由表1可知,海棠酵素中乳酸菌、醋酸菌、酵母菌含量分别为(4.4±0.1)×107CFU/mL、(5.4±0.1)×108 CFU/mL和(5.0±0.2)×105 CFU/mL。
表1 海棠酵素中微生物含量
Table 1 Microbial content in Malus spectabilis Jiaosu
?
2.2 海棠酵素中微生物的分离及鉴定
通过传统分离培养法从海棠酵素产品中共分离纯化出9株菌株,其编号及形态见表2,系统发育树见图1。
表2 海棠酵素中分离菌株的菌落及细胞形态
Table 2 Colony and cell morphology of strains isolated from Malus spectabilis Jiaosu

菌株编号 菌落形态 细胞形态1498 1500 1502 1524 1526 1528 1504粗短杆,单独存在或成对存在细长杆,单独存在短杆,单独存在或三四个连在一起细长杆,单独存在或连在一起梭形梭形椭圆形,单独存在1703椭圆形,单独存在1705圆形,光滑,中心凸起,乳白色圆形,光滑,中心凸起,乳白色圆形,光滑,中心凸起,乳白色圆形,光滑,中心凸起,乳白色圆形,光滑,中心凸起,黄色圆形,光滑,中心凸起,黄色大且厚呈圆柱状,粉红色,表面光滑湿润,粘稠大且厚呈圆柱状,白色,表面光滑,湿润,粘稠大且厚呈圆柱状,白色,表面光滑,湿润,粘稠椭圆形,单独存在
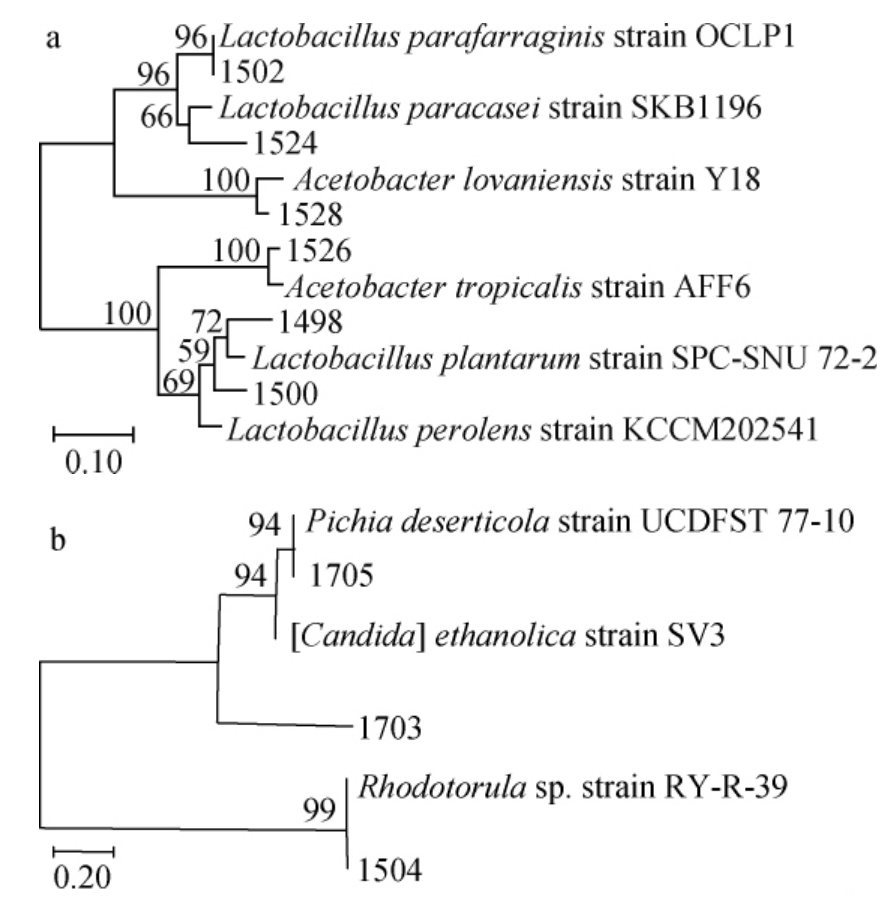
图1 分离细菌(a)及真菌(b)的系统发育树
Fig. 1 Phylogenetic tree of isolated bacteria (a) and fungi (b)
由表2及图1可知,分离得到的9株菌株中包括4株乳酸菌、2株醋杆菌、3株酵母菌,通过与NCBI网站上的数据库比对,发现细菌的菌种分类归属如下:菌株1498、1500与模式菌株Lactobacillus plantarum strain SPC-SNU 72-2遗传距离较近,聚于一支,因此,将菌株1498、1500归属为植物乳杆菌(Lactobacillus plantarum);菌株1502与模式菌株Lactobacillus parafarraginis strain OCLP1遗传距离较近,聚于一支,因此,将菌株1502归属为类谷糠乳杆菌(Lactobacillus parafarraginis);菌株1524与模式菌株Lactobacillus paracasei strain SKB1196遗传距离较近,聚于一支,因此,将菌株1524归属为副干酪乳杆菌(Lactobacillus paracasei);菌株1526与模式菌株Acetobacter tropicalis strain AFF6遗传距离较近,聚于一支,因此,将菌株1526归属为热带醋杆菌(Acetobacter tropicalis);菌株1528与模式菌株Acetobacter lovaniensis strain Y18遗传距离较近,聚于一支,因此,将菌株1528归属为罗旺醋酸杆菌(Acetobacter lovaniensis)。所分离出的真菌的分类进化为:菌株1504与模式菌株Rhodotorula sp. strain RY-R-39遗传距离较近,聚于一支,因此,将菌株1504归属为粘红酵母属(Rhodotorula);菌株1703与模式菌株Candida ethanolica strain SV3遗传距离较近,聚于一支,因此,将菌株1703归属为乙醇假丝酵母(Candida ethanolica);菌株1705与模式菌株Pichia deserticola strain UCDFST 77-10遗传距离较近,聚于一支,因此,将菌株1705归属为Pichia deserticola。
2.3 海棠酵素微生物菌相分析
2.3.1 海棠酵素发酵过程中微生物菌相丰富度分析
海棠酵素发酵过程中(0~31 d)微生物菌相丰富度分析结果见表3。由表3可知,细菌OTU数在发酵0~4 d由4种增加为29种,发酵4~31 d由29种逐渐减少为3种;真菌OTU数在发酵过程中(0~31 d)逐渐减少,由0 d的8种减少为到31 d的2种。这可能是因为海棠酵素发酵后期,营养物质匮乏导致微生物间进行竞争,微生物种类减少。海棠酵素在发酵31 d时的细菌丰富度高于真菌,与海棠酵素活菌计数结果相一致。
表3 海棠酵素发酵过程中微生物丰富度变化
Table 3 Changes of microbial richness during Malus spectabilis Jiaosu fermentation
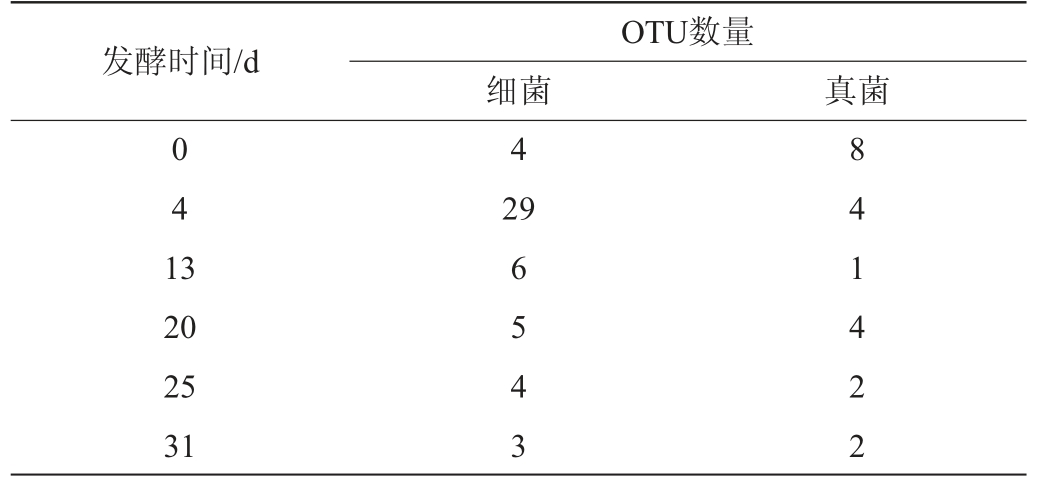
发酵时间/d OTU数量细菌 真菌0 4 1 3 4 29 20 25 31 6 5 4 3 8 4 1 4 2 2
2.3.2 海棠酵素发酵过程中微生物组成分析
海棠酵素发酵过程中(0~31 d)细菌菌群的组成见图2。由图2可知,在门水平上,海棠酵素发酵各个时间段95%以上为厚壁菌门(Firmicutes);在纲水平上,海棠酵素在发酵过程中主要为芽孢杆菌纲(Bacillibacteria),在发酵第4天时还出现了梭菌纲(Clostridia)和拟杆菌纲(Bacteroidia);在目水平上,发酵过程中主要为乳杆菌目(Lactobacillales),在发酵第4天时还出现了梭菌目(Clostridiales)、醋酸杆菌目(Acetobacterales)和假单胞菌目(Pseudomonadales);在科水平上,海棠酵素发酵0~4 d,主要为乳酸菌科(Lactobacillaceae)、明串珠菌科(Leuconostocaceae)、链球菌科(Streptococcaceae)和消化链球菌科(Peptostreptococcaceae),发酵13~31 d主要为乳酸菌科(Lactobacillaceae)、明串珠菌科(Leuconostocaceae);在属水平上,海棠酵素发酵0~4 d主要为乳杆菌属(Lactorbacillus)、酒球菌属(Oenococcus)、消化链球菌属(Peptostreptococcus)、魏斯氏菌属(Weissella)和醋杆菌属(Acetobater),发酵13~31 d主要为乳杆菌属(Lactorbacillus)、酒球菌属(Oenococcus)。乳杆菌属是有益于宿主健康的微生物,能发酵糖类产生乳酸,能维护人体健康和调节免疫功能[20],酒球菌属被广泛应用于酿酒生产中,降低酒的酸度[21]。对海棠酵素进行传统微生物法分离鉴定时也鉴定出海棠酵素含有乳杆菌属中的植物乳杆菌和副干酪乳杆菌以及醋杆菌属中的热带醋杆菌和罗旺醋酸杆菌,与16S rDNA高通量测序结果相符,说明海棠酵素发酵过程中优势细菌主要是乳杆菌属和醋杆菌属。

图2 基于门(a)、纲(b)、目(c)、科(d)及属(e)水平海棠酵素发酵过程中细菌的相对丰度
Fig. 2 Relative abundance of bacteria during Malus spectabilis Jiaosu fermentation based on phylum (a), class (b), order (c), family (d) and genus (e) levels
海棠酵素发酵过程中(0~31 d)真菌菌群的组成见图3。由图3可知,在门水平上,海棠酵素发酵0 d时包含子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota),在发酵4 d后主要为子囊菌门;在纲水平上,海棠酵素发酵0 d时含有酵母纲(Saccharomycetes)和虫囊菌纲(Eurotiomycetes),发酵4 d后主要为酵母纲(Saccharomycetes);在目水平上,海棠酵素发酵0 d时,包含酵母目(Saccharomycetes)、毛霉目(Mucorales)和散囊菌目(Eurotiales),在发酵4 d后海棠酵素主要含有酵母目(Saccha romycetes);在科水平上,海棠酵素发酵0 d时,包含酵母科(Saccharomycetaceae)、毕赤酵母科(Pichiaceae)和毛霉科(Mucoraceae),在发酵4 d后主要为酵母科(Saccharomycetaceae);在属水平上,海棠酵素在发酵0 d时,主要为酵母属(Saccharomyces)、假丝酵母属(Candida)、毕赤酵母属(Pichia)、有孢圆酵母属(Torulaspora)和毛霉菌属(Mucor),在发酵4 d后主要为酵母属(Saccharomyces)和假丝酵母属(Candida)。酵母菌具有很高的营养价值,含有较多的蛋白质,B族维生素、核酸和矿物质,同时也能产生一些功能活性物质[22]。对海棠酵素进行传统微生物法分离鉴定时也鉴定出海棠酵素含有红酵母属的粘红酵母、假丝酵母属的假丝酵母和毕赤酵母属的毕赤酵母,与2.2中5.8 ITS高通量测序结果相符。结果也表明,海棠酵素发酵过程中的优势真菌主要是酵母菌属和假丝酵母菌属。

图3 基于门(a)、纲(b)、目(c)、科(d)及属(e)水平海棠酵素发酵过程中真菌的相对丰度
Fig. 3 Relative abundance of fungi during Malus spectabilis Jiaosu fermentation based on phylum (a), class (b), order (c), family (d) and genus (e) levels
2.3.3 海棠酵素发酵过程中微生物菌相a多样性分析
海棠酵素发酵过程中微生物a多样性分析结果见表4。由表4可知,海棠酵素中细菌的ACE指数和Chao1指数均高于真菌,表明海棠酵素中细菌丰富度大于真菌;真菌的Shannon指数和Simpson指数均高于细菌,表明真菌菌群多样性大于细菌菌群。海棠酵素样品中细菌及真菌的Coverage指数均为1,说明样本中物种被检测概率较高,测序的结果能够真实的反应样品物种丰度和多样性。
表4 海棠酵素发酵过程中细菌和真菌的α多样性分析
Table 4 Analysis of Alpha diversity of bacteria and fungi during Malus spectabilis Jiaosu fermentation
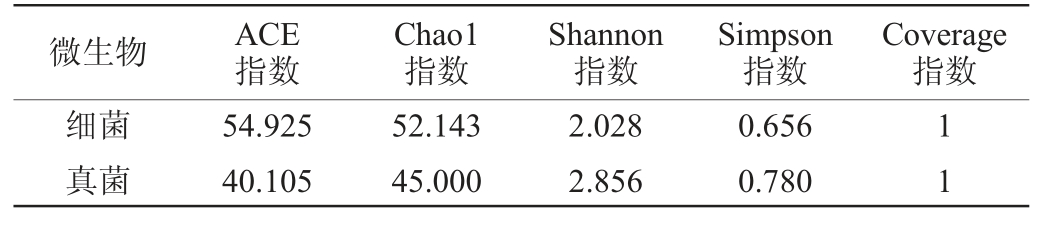
微生物 ACE指数Coverage指数细菌真菌Chao1指数Shannon指数Simpson指数54.925 40.105 52.143 45.000 2.028 2.856 0.656 0.780 11
2.4 海棠酵素改善小鼠肠道菌群功能
2.4.1 小鼠粪便细菌微生物丰富度分析
对空白组、灌胃前组和实验组3组小鼠粪便样品的微生物菌相构成进行比较并绘制韦恩(Venn)图见图4。由图4可知,3组小鼠粪便的总OTU数量和特有OTU数量均为S组>G组>K组,总OTU数量分别为1 235、977和834,特有OTU数量分别为461、200和97。结果表明,实验组的小鼠粪便中细菌物种丰度高于灌胃前组和空白组。
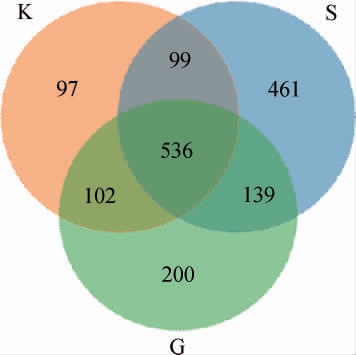
图4 小鼠粪便样品中操作分类单元(OTU)的Venn图
Fig. 4 Venn diagram of operational taxonmic unit in fecal samples of mice
2.4.2 小鼠粪便细菌微生物组成
基于科、属水平,空白组、灌胃前组和实验组3组小鼠粪便细菌微生物组成见图5。
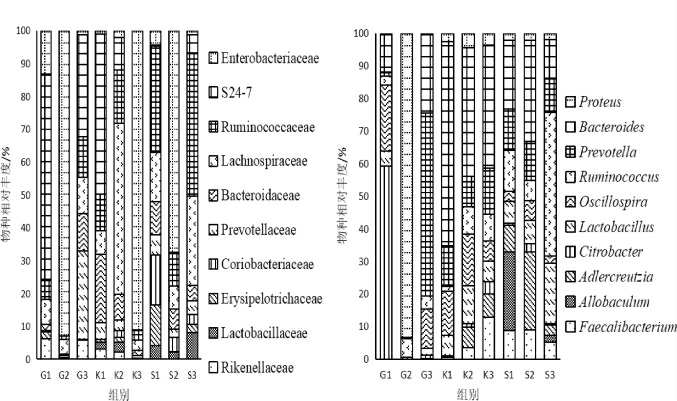
图5 基于科(a)、属(b)水平小鼠肠道细菌物种的相对丰度
Fig. 5 Relative abundance of bacteria in intestinal flora of mice based on family (a) and genus (b) levels
由图5可知,实验组小鼠的粪便在科、属2个水平上的物种丰富度均要高于空白组。在科水平上,灌胃海棠酵素后实验组小鼠粪便中增加了丹毒丝菌科(Erysipelothrix)、乳杆菌科(Lactobacillaceae)和红蝽杆菌科(Coriobacteriales)。在属水平上,增加了乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus),减少了枸橼酸杆菌(Citrobacter)。乳酸杆菌为常见益生菌,对人类肠道健康具有促进作用。
2.4.3 小鼠粪便细菌微生物多样性分析
通过a多样性分析,3组小鼠粪便样品的微生物多样性结果见图6。由图6可知,空白组、灌胃前组和实验组的Shannon指数差别不大,表明三组小鼠的微生物多样性差异较小。实验组Chao1指数高于灌胃前组和空白组,表明实验组小鼠与灌胃前组、空白组相比微生物的丰富度更高。
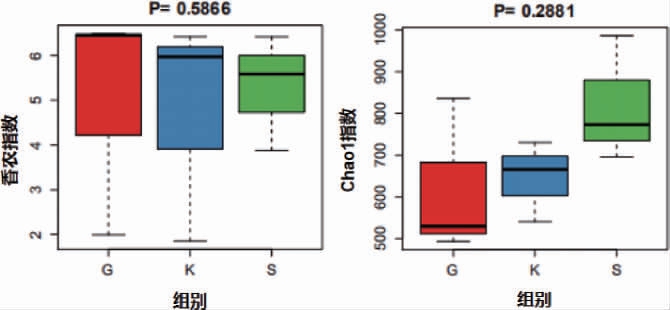
图6 小鼠粪便样品微生物α多样性分析结果
Fig. 6 Results of alpha diversity analysis of microorganism in fecal samples of mice
3 结论
首次对传统自然发酵法制备的海棠酵素进行微生物菌相分析及功能研究。海棠酵素主要由乳酸菌[(4.4±0.1)×107 CFU/mL]、醋酸菌[(5.4±0.1×108)CFU/mL]和酵母菌[(5.0±0.2)×105 CFU/mL]组成,经传统微生物培养法分离鉴定得到9株优势菌株,其中4株乳酸菌、2株醋酸菌和3株酵母菌。经高通量测序分析可知,海棠酵素在发酵过程中,发酵0~4 d,细菌主要为乳杆菌属(Lactobacillus)、酒球菌属(Oenococcus)、消化链球菌属(Peptostreptococcaceae)、魏斯氏菌属(Weissella),发酵13~31 d,主要为乳杆菌属、酒球菌属;发酵0~31 d,真菌主要为酵母属(Saccharomyces)和假丝酵母属(Candida)。经a多样性分析可知,海棠酵素细菌丰富度较高,真菌多样性较高。动物实验结果表明,连续灌胃小鼠0.4 mL海棠酵素28 d后,与空白组和灌胃前组小鼠粪便相比,实验组小鼠粪便增加了乳杆菌属和瘤胃球菌属,减少了枸橼酸杆菌属,具有改善小鼠肠道菌群的能力。
[1]中国生物发酵产业协会.T/CBFIA08001—2016 酵素产品分类导则[S].北京:中国标准出版社,2016.
[2]刘加友,王振斌.微生物酵素食品研究进展[J].食品与发酵工业,2016,42(1):273-276.
[3]白浩,文佳嘉,费爽雯.酵素的功能与综合应用研究进展[J].食品工业,2017,2(6):270-274.
[4]敖梅英,王鑫,范友隆.食用型酵素产品的研究进展[J].安徽农业科学,2016,44(30):64-66,145.
[5]蒋增良.天然微生物酵素发酵机理、代谢过程及生物活性研究[D].杭州:浙江理工大学,2013.
[6]杨志鹏,王婷,袁峰,等.海棠果酵素产品开发及其生物活性研究[J].中国调味品,2018,43(1):48-51,83.
[7]刘维兵,王舸楠,王犁烨,等.葡萄海棠果酵素发酵工艺优化及体外抑菌与抗氧化活性的研究[J].食品工业科技,2019,40(16):118-125.
[8]邸鹏月,彭宇,李晨,等.基于宏基因组分析桑葚酵素的微生物多样性[J].中国食品学报,2020,20(5):251-257.
[9]马蓉,高庆超,常应九,等.黑果枸杞酵素发酵过程中理化成分变化及微生物类型分析[J].食品科技,2019,44(9):30-37.
[10]赵菲,刘孝余,宫芳婧,等.高通量测序技术研究鱼腥草酵素对小鼠肠道菌群的影响[J].安徽农业科学,2018,46(32):156-159,172.
[11]王海英.番木瓜酵素的研究与制备[D].天津:天津科技大学,2016.
[12]闫丽,董振,刘伟杰.温敏型淀粉酶产生菌的分离、分子生物学鉴定及特性研究[J].文物保护与考古科学,2019,31(6):6-11.
[13]凌空,周明,陆路,等.果蔬酵素不同发酵周期中微生物的分离鉴定[J].中国食品添加剂,2018(7):71-77.
[14]魏东东,常曼曼,阴芳冉,等.红树莓酵素发酵过程中优势菌株的分离鉴定[J].河北农业大学学报,2016,39(6):52-56.
[15] RUSU O R, OBADA M D. The identification of the Campylobacter jejunus strain on poultry carcasses using microbiological and molecular biology methods[J].J Biotechnol,2019,305:Doi:10.1016/j.jbiotec.2019.05.211.
[16]ALIDJINOU E K,COULON P,HALLAERT C,et al.Routine drug resistance testing in HIV-1 proviral DNA,using an automated next-generation sequencing assay[J].J Clin Virol,2019,121:104207.
[17]ZHOU J,LIH S,CHEN X L,et al.Cometabolic degradation of low-strength coking wastewater and the bacterial community revealed by high-throughput sequencing[J].Bioresource Technol,2017,245(PtA):379-385.
[18]张永杰,崔宁波,张丽珍,等.基于DNA 高通量测序分析生料酿醋过程中的真菌多样性[J/OL].微生物学报,https://doi.org/10.13343/j.cnki.wsxb.20190378.
[19]俞赟霞,王刚,赵建新,等.乳酸菌细菌素对小鼠肠道菌群结构及代谢产物的影响[J].食品与发酵工业,2018,44(7):20-28.
[20] Riva A,Borgo F,Lassandro C,et al. Pediatric obesity is associated with an altered gut microbiota and discordant shifts in Firmicutes populations[J].Environ Microbiol,2017,19(1):95-105.
[21]宋月,李娜,岳莹雪,等.膳食中的主要成分对肠道微生物组成及代谢影响的研究进展[J].食品工业科技,2019,40(18):354-360.
[22]何翠婵,熊犍,叶君,等.酒酒球菌在青梅汁中的生长及苹果酸乳酸发酵特性的研究[J].食品工业科技,2014,35(6):177-180.