浏阳豆豉以黑豆为原料,经过浸泡、蒸煮、自然接种、洗曲、堆积发酵、晒干后成为药食同源产品。浏阳豆豉是曲霉型发酵豆豉,制曲期间主要微生物属以曲霉、根霉为主,而后发酵期则有大量酵母菌参与[1]。豆豉不仅具有良好的风味,还具有抗氧化、溶血栓、降血糖等营养价值[2-5],大豆在发酵过程中会产生新的活性物质,如活性肽、不饱和脂肪酸、大豆异黄酮等[6-7],这些活性物质以及良好风味的形成均与微生物产酶密切相关。豆豉发酵过程中,在微生物产蛋白酶的作用下将大分子蛋白水解成小分子多肽和氨基酸以及各种香气成分前提物质,因此微生物产蛋白酶活性与豆豉中蛋白质的水解程度密切相关。同时,微生物产生的纤维素酶通过分解纤维素使蛋白质裸露出来,从而提高大豆蛋白的消化率[8-9],加速了蛋白质的降解及各类气味物质的生成以赋予豆豉独特的风味。此外脂肪酶也是豆豉发酵过程中重要的水解酶,可催化大豆中的油脂,生成甘油、脂肪酸和甘油单酯或者二酯,有助于豆豉独特风味的形成[10]。
为了获得高产酶活菌株,学者们在微生物菌种分离方面做了大量的研究,如任璐等[11]从永川豆豉和三台豆豉中分离到2株毛霉YC-1和ST-1,其产蛋白酶活分别为176.891 U/mL和51.201 U/mL,产纤维素总体酶活分别为107.645 U/mL和66.762 U/mL。郭聪等[12]通过从热带海水养殖系统中筛选得2株地衣芽孢杆菌LD-1205和DF-1307,其以橄榄油为唯一碳源培养60 h后,纤维素酶活力分别达到56.3 U/mL、60.7 U/mL。邓维琴等[13]从发酵成曲的郫县豆瓣酱筛选得到2株具有高产蛋白酶能力的菌株PCSM001和PCSM002,其在麸皮中培养3 d蛋白酶酶活分别为1 450.25 U/g、1 703.25 U/g。CHANCHAROONPONG C等[14]以60%大豆含量的曲司为底物对米曲霉(Aspergillus oryzae)S产酶进行了研究,结果表明在48 h时蛋白酶活性达到最高为84.38 U/g(干质量)。徐伟芳等[15]从含油脂的土壤中得到一株甲基营养型芽孢杆菌(Bacillus methylotrophicus)SLB-1,该菌在30 ℃、pH 7.0条件下的脂肪酶酶活为21.22 U/mL。YIN H C等[16]研究发现,枯草芽孢杆菌(Bacillus subtilis)在以豆粕作为固态发酵可产生羧肽酶。
为了筛选浏阳豆豉的关键微生物,并评估其在浏阳豆豉发酵过程中的作用,本研究从浏阳豆豉中分离高产酶活菌株,对其进行形态学观察及分子生物学鉴定,并对其蛋白酶、纤维素酶和脂肪酶的酶活力进行测定,旨在获得新的发酵菌株,为后续豆豉的工业化生产提供理论指导与实践基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
麸皮:湖南农业大学东之源超市;豆豉曲醅:浏阳某豆豉厂。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、福林试剂、碳酸钠、三氯乙酸、磷酸盐、酪蛋白、酪氨酸、盐酸(均为分析纯):国药集团化学试剂有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒Solarbio D2300:北京索莱宝科技有限公司。
1.1.3 培养基
孟加拉红琼脂培养基、马铃薯葡萄糖琼脂(potatodextrose agar,PDA)培养基、查氏琼脂(Czapek agar,CA)培养基、麦芽汁琼脂培养基、酵母浸出粉胨葡萄糖琼脂培养基:北京陆桥生物技术有限公司。
1.2 仪器与设备
CX41RF光学显微镜:日本Olumpus公司;Thermo Scientific Multiskan FC全波长酶标仪:赛默飞世尔科技(中国)有限公司;LDZX-50KBS立式高压灭菌锅:上海申安医疗器械有限公司;SW-CJ系列净化工作台:上海新苗医疗器械制造有限公司;DHP120恒温培养箱:上海实验仪器厂有限公司、TP-620A电子天平:湘仪天平仪器设备有限公司;HHS-11-6数显6孔电热恒温水浴锅:常州杰博森仪器有限公司、HY45恒温摇床:深圳汇成科技有限公司;Verity 96well聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYY-6C电泳仪:北京六一仪器厂;FR-980A凝胶成像仪:上海复日科技有限公司。
1.3 方法
1.3.1 浏阳豆豉加工工艺流程
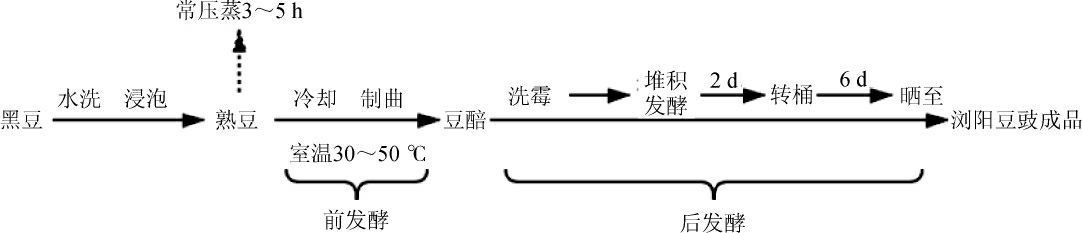
1.3.2 优势霉菌的筛选及分离纯化
采集制曲阶段第3、5、7、9、14天的豆豉各25 g分别定容于225 mL生理盐水中,摇床振荡30 min,采用稀释涂布平板法做4个稀释梯度即10-2、10-3、10-4、10-5,各取菌悬液200 μL分别涂布至孟加拉红培养基、麦芽汁琼脂培养基、查氏培养基、酵母浸出粉胨葡萄糖培养基、PDA培养基上,在28 ℃条件下静置培养,每隔24 h观察1次,3~5 d后根据菌落形态和孢子颜色分离平板上生长的所有菌种,在筛选出优势霉菌的同时优化培养基,在平板上重复点接3次以上,直至得到单个菌落。
1.3.3 菌液的制备
将纯化好的霉菌接入麸皮中扩大培养,28 ℃培养72 h,取5 g研细,加pH为7.2的磷酸缓冲溶液至100 mL,在40 ℃水浴下间断的搅拌1 h,过滤得到菌液。
1.3.4 分离菌株的鉴定
(1)形态观察
菌落特征观察:将霉菌接入PDA培养基中观察其菌落特征,包括形状、大小、表面结构、松紧度、孢子颜色以及是否产生色素等。
菌丝形态观察:于洁净载波片上,滴一滴乳酸石炭酸棉蓝染色液,可用接种环挑取菌落边缘的少量孢子放入棉蓝染色液中,盖上波片观察菌株细胞形态。
(2)菌株分子生物学鉴定
DNA提取:对霉菌进行ITS rDNA鉴定,上游引物:5'-TCCG TAGG TGAA CCTG CGG-3';下游引物:5'-TCCT CCGC TTAT TGAT ATGC-3'。
PCR扩增体系:PCRMix缓冲溶液5μL,两端引物浓度均为10 μmol/L,模版DNA 1 μL,再加入20 μL双蒸水(ddH2O)。PCR扩增条件为98 ℃预变性2 min;98 ℃变性1 s,54 ℃退火10 s,72 ℃延伸10 s,35个循环;72 ℃延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,送杭州联川生物有限公司测序部测序。
(3)系统发育树的构建
利用美国国家生物技术信息中心(national center of biotechnology information,NCBI)中基本局部比对搜索工具(basic local alignment search tool,BLAST)对DNA序列进行对比分析,构建系统发育树。自GenBank下载的菌株如下:Aspergillussp.(MH836320.1)、Aspergillustamarii(MN339986.1)、Aspergillus toxicarius(MH865314.1)、Aspergillus nomius(MG575481.1)、Aspergillus flavofurcatus(MK120607.1)等。用Mega软件以Maximum Likehood法绘制系统发育树,以Bootstrap对系统发育树进行检验1 000次重复。
1.3.3 蛋白酶活性
蛋白酶活性的测定采用分光光度法[17]。酪氨酸标准曲线的绘制:配制质量浓度分别为0、20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL系列酪氨酸溶液。分别取1 mL系列酪氨酸溶液至10 mL试管中,依次加入0.4 mol NaCO3 5 mL、1∶2稀释好的福林试剂1 mL,40 ℃水浴中保温显色20 min,以空白管调零点,于波长660 nm条件下测定吸光度值(OD660nm值)。以酪氨酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制酪氨酸标准曲线。按照酪氨酸标准曲线回归方程计算样品中蛋白酶的活性,其计算公式如下:
式中:A为3次平行试验平均吸光度值;W为样品水分百分含量,%;N为稀释倍数;4为反应试剂总体积,mL;10为反应时间,min。
蛋白酶酶活定义:1 g固体酶粉(或1 mL液体酶),在40 ℃(酸性pH=3.0;中性pH=7.5;碱性pH=10.5)条件下,每分钟水解酪素产生1 μg酪氨酸为一个酶活单位(U/mL)。
1.3.4 纤维素酶活性
纤维素酶活性测定采用DNS法[18]。
葡萄糖标准曲线绘制:取5支试管分别加0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL的0.1 mg/mL葡萄糖标准溶液于试管中,用蒸馏水分别补充至2.0 mL,加1.5 mL DNS,以空白试剂调零,在波长540 nm处测定吸光度值。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线。按照葡萄糖标准曲线回归方程计算样品中纤维素酶的活性。
纤维素酶酶活定义:在30 ℃、pH值为5.5条件下,每分钟从质量浓度为4 mg/mL的羧甲基纤维素溶液中降解释放1 μmol还原糖需要的酶量为一个酶活单位(U/mL)。
1.3.5 脂肪酶活性
油酸标准曲线的绘制:配制一系列不同浓度的油酸溶液,分别取1 200 μL于1.5 mL离心管中,加入300 μL显色剂(5%的醋酸酮溶液用吡啶调至pH=6.1),摇匀后离心,取上层有机相,在波长710nm处测定吸光度值。首先将0.0667mol/L磷酸盐缓冲溶液和橄榄油放入水浴恒温磁力搅拌器37 ℃中预热30 min。测试管中加入125 μL酶溶液,750 μL磷酸盐缓冲溶液和250 μL的橄榄油,37 ℃条件下反应10 min后立即加入2 000 μL甲苯,标准管中由375 μL的蒸馏水代替橄榄油与酶溶液。37 ℃振荡反应10 min后,8 000×g、25 ℃条件下离心10 min,取上层清液,空白管与测定管分别加入1 200 μL对应上清液和300 μL显色剂。用分光光度计在波长710 nm处测其吸光度值。

脂肪酶酶活性定义:37 ℃条件下,每克组织每分钟水解橄榄油生成1 μmol 脂肪酸为一个酶活单位(U/mL)。
2 结果与分析
2.1 菌株的分离纯化与鉴定
2.1.1 分离菌株形态观察
取浏阳豆豉发酵过程中制曲阶段的第3、5、7、9、14天的豆豉,采用稀释涂布平板法,分别涂布至孟加拉红培养基、麦芽汁琼脂培养基、查氏培养基、酵母浸出粉胨葡萄糖培养基、PDA培养基上,对分离菌株进行形态学观察,结果见图1。由图1可知,分离得到3株菌,分别编号为621、000、5132。
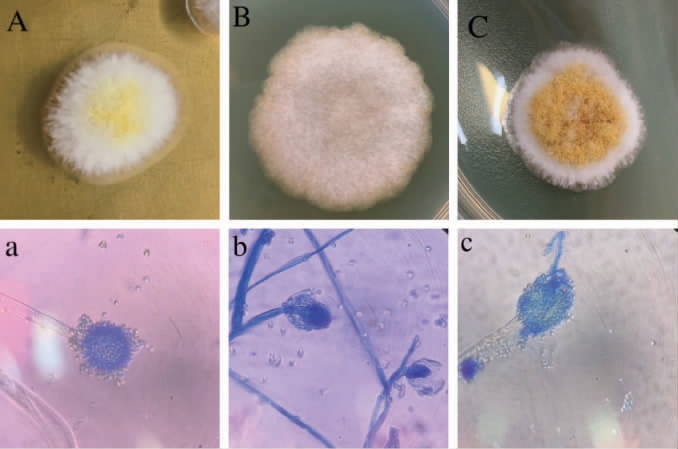
图1 菌株621、000、5132的菌落(A、B、C)及细胞(a、b、c)形态
Fig. 1 Colony (A、B、C) and cell (a、b、c) morphology of strain 621, 000 and 5132
由图1A可知,菌株621在麦芽汁琼脂培养基上于28 ℃培养3 d后,菌落质地蓬松呈絮状且菌丝体发达,菌落较厚且边缘呈白色,成熟后中间的孢子呈黄色,不透光呈不规则的边缘,菌落直径为1.5~2.0 cm。由图1a可知,621经棉兰染色后的分生孢子梗且具有顶端膨大呈球状的顶囊,以及浅黄色的孢子,根据《真菌鉴定手册》及其他文献,可鉴定该菌为半知菌丛梗孢科曲霉属。由图1B可知,菌株000在CA培养基上经28 ℃培养3 d后,菌落直径为4.0~4.5 cm且后期可长满整个平板,14~36 h时呈不透光的灰白色棉絮状,边缘不规则,表面有一些细小的菌丝但不丰富,用接种环按压时有少许液体渗出,成熟后灰黑色孢子大量形成。由图1b可知,菌株000无小梗结构,可看见闭囊壳以及子囊孢子。由图1C可知,菌株5132在酵母浸出粉胨葡萄糖培养基上28 ℃培养3 d后,质地蓬松且较厚,边缘呈白色,成熟后整个菌落变为深褐色,不透光呈不规则的边缘,菌落直径为1.5~2.0 cm。由图1c可知,膨大的顶囊以及一轮小梗、二轮小梗等结构。
2.1.2 分离菌株的分子生物学鉴定
利用ITS通用引物ITS1和ITS4进行PCR扩增结果见图2。由图2可知,从PCR样品扩增条带可以看出,大约位于750 bp位置附近出现亮带,说明ITS序列扩增成功。
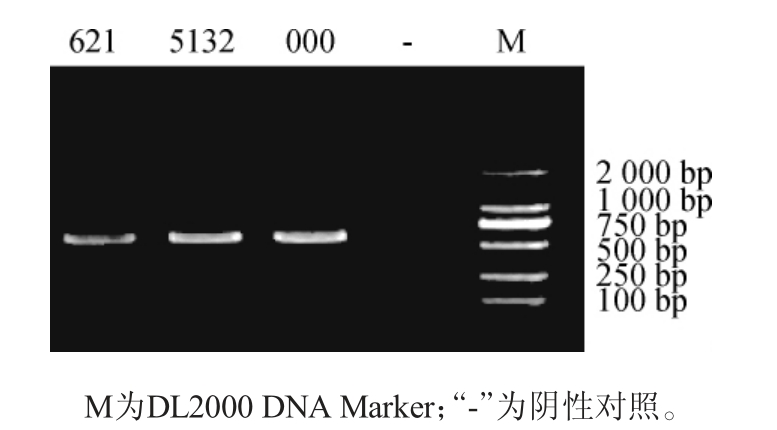
图2 分离菌株18S rRNA基因PCR扩增产物琼脂糖凝胶电泳图
Fig. 2 Agarose gel electrophoretogram of PCR amplification products of 18S rRNA gene of isolated strains
将分离得到的3株菌进行18S rRNA基因序列分析,通过将000、621、5132三株菌的序列输入NCBI中,利用的BLAST功能将同源性相近的其他几个序列进行同源性比对,并采用MEGA8.0软件进行序列对比和系统进化树的构建,结果见图3。由图3可知,菌株000与溜曲霉菌JQ257030.1的相似度为100%,菌株621与溜曲霉菌MH345889.1相似度为100%,菌株5132与溜曲霉菌MH244392.1的相似度为99%。因此,菌株000、621、5132均被鉴定为溜曲霉菌(Aspergillus tamarri)。
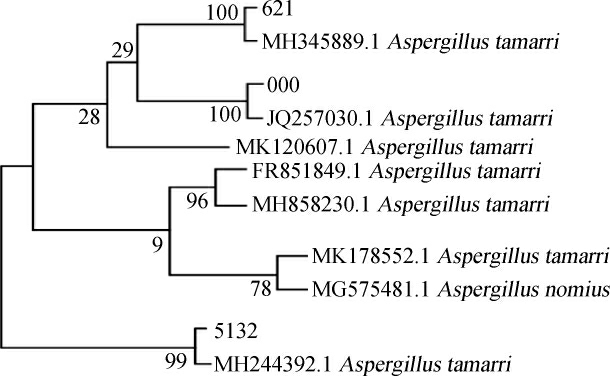
图3 分离菌株基于18S rRNA基因序列系统进化树
Fig. 3 Phylogenetic tree of isolated strains based on 18S rRNA gene sequences
2.2 三株菌蛋白酶、纤维素酶及脂肪酶活力测定
以酪氨酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标;以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标;以油酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,分别绘制酪氨酸、葡萄糖及油酸标准曲线。得到酪氨酸标准曲线回归方程y=0.002 9x+0.044 9,相关系数R2为0.999 2;葡萄糖标准曲线回归方程y=0.024 1x+0.008 8,相关系数R2为0.998 9。油酸标准曲线回归方程y=0.135 1x+0.023 8,相关系数R2为0.996 1,分别按照标准曲线回归方程及计算公式计算蛋白酶、纤维素酶及脂肪酶酶活,结果见表1。
表1 三株溜曲霉的酶活比较
Table 1 Comparison of enzyme activities of 3 strains of Aspergillus tamarii
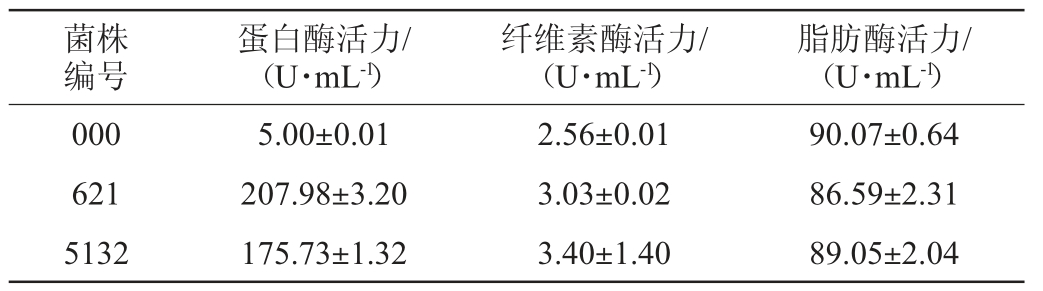
菌株编号蛋白酶活力/(U·mL-1)纤维素酶活力/(U·mL-1)脂肪酶活力/(U·mL-1)000 621 5132 5.00±0.01 207.98±3.20 175.73±1.32 2.56±0.01 3.03±0.02 3.40±1.40 90.07±0.64 86.59±2.31 89.05±2.04
在以蛋白质为主要成分的大豆制品中,蛋白酶能催化蛋白质水解生成多肽及小分子氨基酸以及各种香气成分[19-21],其活性高低也反映了豆豉中蛋白质水解的速度,决定了豆豉发酵成熟的周期。因此,蛋白酶活性是评价豆豉发酵过程中的一项重要指标。由表1可知,菌株0000、621和5132的蛋白酶活力分别为(5.00±0.01)U/mL、(207.98±3.20)U/mL、(175.73±1.32)U/mL,菌株0000蛋白酶活力明显低于其余两者且很弱,其中最高的菌株621的酶活力与任璐等[11]从永川豆豉与三台豆豉中分离得到的2株总状毛霉中最高蛋白酶活力176.891 U/mL相比要高31.09 U/mL。
纤维素酶活力高低在豆豉发酵的过程中决定着大豆纤维的降解速度,大豆纤维素的降解会降低豆豉的硬度、弹性以及咀嚼度等质构指标[22],不仅有利于后续发酵还使豆豉具有入口化渣的口感。根据表1可知,菌株000、621、5132的纤维素酶活力差距较小,其中以菌株5132的纤维素酶活力最高为(3.40±1.40)U/mL,与彭昀等[23]从庆阳豆豉中分离得到的菌株的纤维素酶活力(最高的可达到6.015 U/mL)相比较低,张洪勋[24]在1992年首次提出了一株产果胶酶的溜曲霉827,此菌也具有产纤维素酶和半纤维素酶的能力。
大豆作为油料,脂肪含量较高,管泳宇等[25]对曲霉型豆豉发酵过程研究中发现豆豉脂肪含量最高可达到27.31 g/100 g,脂肪酶在豆豉发酵过程中也起着很大的作用,由于脂肪降解产物中的C5~C11不饱和脂肪酸是豆豉中挥发性风味物质的主要成分之一[26],因比脂肪酶活性与豆豉风味的形成密切相关。由表1可知,菌株000、621、5132的脂肪酶活力差距不大,以菌株000脂肪酶活力为(90.07±0.64)U/mL最高,与廖焰焰等[27]从南昌稻香元曲霉型豆豉中分离出1株脂肪酶活力为30 U/mL的米曲霉相比高60.7 U/mL。
综上,在浏阳豆豉所分离的3株菌中,菌株621蛋白酶酶活力最强为(207.98±3.20)U/mL,可考虑用作豆豉、腐乳、豆渣等或者高蛋白饲料发酵用菌[28-29]。菌株5132纤维素酶活力最高为(3.40±1.40)U/mL,由于纤维素酶可以分解包裹蛋白质的纤维素,因此可以考虑作为作物类快速发酵用菌[30]。3株菌脂肪酶活力平均值为88.78 U/mL,其中以菌株000最高为(90.07±0.64)U/mL,可以进一步探索是否可作为蛋奶制品等高脂肪食品的发酵用菌。
3 结论
本研究从传统发酵的浏阳豆豉中分离出3株菌,对其进行ITS rDNA基因序列分析,经测序、序列提交到GenBank数据库利用BLAST工具进行序列比对后,结果表明,菌株000、5132、621分别为溜曲霉(Aspergillus tamarri)JQ257030.1,溜曲霉(Aspergillustamari)MH244392.1及溜曲霉(Aspergillus tamari)MH345889.1。菌株000、621、5132均具有不同程度的产蛋白酶、纤维素酶及脂肪酶活力。其中菌株621蛋白酶酶活力最高为(207.98±3.20)U/mL,菌株5132产纤维素酶活力最高为(3.40±1.40)U/mL,菌株000产脂肪酶活力最高为(90.07±0.64)U/mL。本研究从浏阳豆豉中分离纯化出3株优势溜曲霉菌,并对其产酶能力进行评价,为传统豆豉工业化生产菌种的选育以及对菌株的开发利用提供了科学理论依据。
[1]石聪,李世瑞,李跑,等.基于高通量测序浏阳豆豉不同发酵阶段微生物多样性分析[J].食品与发酵工业,2018,44(2):27-39.
[2] WEI W, LIU Q, TAN Y, et al. Oxidative stress, diabetes, and diabetic complications[J].Hemoglobin,2009,33(5):8-9.
[3] AMAROWICZ R, SHAHIDI F. Antioxidant activity of broad bean seed extract and its phenolic composition[J].J Funct Foods,2017,38:656-662.
[4]JAYACHANDRAN M,XU B J.An insight into the health benefits of fermented soy products[J].Food Chem,2019,721(15):271-280.
[5] XU L, DU B, XU B J. A systematic, comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China[J].Food Chem,2015,174(1):202-213.
[6]LEE M J,CHUNG I M,KIM H,et al.High resolution LC-ESI-TOF-mass spectrometry method for fast separation, identification, and quantification of 12 isoflavones in soybeans and soybean products[J].Food Chem,2015,176(6):254-262.
[7] BROUNS F. Soya isoflavones: a new and promising ingredient for the health foods sector[J].Food Res Int,2002,35(2):187-193.
[8]高蕾蕾,李迎秋.纤维素酶及其在食品行业中的应用[J].食品工业,2017,38(2):271-274.
[9]SUN W C,CHENG C H,LEE W C.Protein expression and enzymatic activity of cellulases produced by Trichoderma reesei Rut C-30 on rice straw[J].Process Biochem,2008,43(10):1083-1087.
[10] RIGO E, NINOW J L, LUCCIO M D, et al. Lipase production by solid fermentation of soybean meal with different supplements[J].LWT-Food Sci Technol,2010,43(7):211-252.
[11]任璐,刘思雨,钟燕,等.毛霉型豆豉发酵菌株分离鉴定与酶活分析[J].中国调味品,2018,43(1):30-34.
[12]郭聪,吴海武,郭伟良,等.适应海南热带海洋环境产脂肪酶菌株的筛选及产酶条件研究[J].海洋通报,2016,35(4):427-435.
[13]邓维琴,陈功,张其圣,等.传统郫县豆瓣酱中高产蛋白酶曲霉的筛选及应用[J].微生物学通报,2019,46(9):2272-2281.
[14] CHANCHAROONPONG C, HSIEHP C, SHEU S C. Effect of different combinations of soybean and wheat bran on enzyme production from Aspergillus oryzae S[J].APCBEE Procedia,2012,2:68-72.
[15]徐伟芳,黄涛杨,周敏,等.一株脂肪酶产生菌的筛选鉴定及其酶学性质研究[J].西南大学学报(自然科学版),2017,39(5):62-69.
[16] YIN H C,JIA F, HUANG J. The variation of two extracellular enzymes and soybean meal bitterness during solid-state fermentation of Bacillus subtilis[J].Grain Oil Sci Technol,2019,2(2):39-43.
[17]全国信息与文献标准化技术委员会.SB/T 10317—1999 蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[18]全国信息与文献标准化技术委员会.NY/T 912—2004 饲料添加剂纤维素酶活力的测定分光光度法[S].北京:中国标准出版社,2004.
[19] GUO J, HEZ Y, WU S F, et al. Effects of concentration of flavor compounds on interaction between soy protein isolate and flavor compounds[J].Food Hydrocolloid,2020,1(1):100-110.
[20] SMITH T J, CAMPBELL R E, JO Y, et al. Flavor and stability of milk proteins[J].J Dairy Sci,2016,99(6):20-31.
[21]TROISE A D,WILTAFSKY M,FOGLIANO V,et al.The quantification of free Amadori compounds and amino acids allows to model the bound Maillard reaction products formation in soybean products[J].Food Chem,2018,247:29-38.
[22]索化夷,赵欣,骞宇,等.永川豆豉发酵过程中质构色泽形成规律[J].食品与发酵工业,2016,42(7):80-85.
[23]彭昀,杨富民,康红霞,等.庆阳豆豉优势菌株的分离鉴定[J].食品与发酵工业,2013,39(4):58-63.
[24]张洪勋.溜曲霉827 果胶酶研究[D].北京:中国科学院研究生院,1992.
[25]管泳宇,于海,葛庆丰,等.曲霉型豆豉后发酵过程的初步研究[J].食品与生物技术学报,2013,32(2):212-218.
[26]谢建春,孙宝国,郑福平,等.以葵花油为原料酶法制备香味料[J].精细化工,2008(1):68-71.
[27]廖焰焰,张菊,李翔,等.传统曲霉型豆豉中高产脂肪酶的米曲霉筛选及鉴定[J].江西师范大学学报(自然科学版),2018,42(5):494-499.
[28]SUN F D,HU Y Y,YIN X Y,et al.Production,purification and biochemical characterization of the microbial protease produced by Lactobacillus fermentum R6 isolated from Harbin dry sausages[J]. Process Biochem,2019,29(10):37-45.
[29]SUN T,XIAO W J,JIANG C F,et al.Producing amino acid fertilizer by hydrolysis of the fermented mash of food waste with the synergy of three proteases expressed by engineered Candida utilis[J].Bioresource Technol Rep,2019,1(7):100-268.
[30]李永博,暴金磊,万敏,等.酒醅中高产纤维素酶菌株的筛选及其酶学性质[J].食品工业科技,2017,38(24):109-113.