丹参(Salvia miltiorrhiza)主产于四川、山西、河北、江苏、安徽等地,其根部含有脂溶性和水溶性两大类化学物质,其中水溶性是以丹参素为基本结构的酚酸类化合物,多数命名为丹酚酸;脂溶性为丹参酮类,主要是丹参酮Ⅰ、丹参酮ⅡA、丹参酮ⅡB等[1]。丹参的药用价值很高,在临床上主要是活化瘀血,常用于心脑血管疾病、糖尿病、肾病、小儿肺炎等疾病[2-5];丹参也与其他中药配伍应用于多种疾病的治疗与保健康复,如肝损伤[6]、黄褐斑[7]、体疲劳[8]、失眠[9]、痤疮[10]和骨质疏松[11]等。
谢兴亮等[12]采用正交设计试验,研究丹参酒制的炮制工艺条件。STRYJEWSKI M E等[13]以丹参酮ⅡA含量为关键指标,对酒丹参的加酒量、加热温度和时间三个影响炮制结果的因素进行正交试验,筛选出了酒丹参的最佳炮制条件:加酒量5%、加热温度60 ℃、加热时间10 min。宋平顺等[14]利用正交试验以丹参中的丹酚酸B为指标得到最佳提取工艺:10%的黄酒、加20%的酒量、80 ℃炒制4 min。
目前丹参的主要用于茶饮、食疗和医疗,但丹参用于酿酒行业生产丹参保健酒还鲜有报道。本实验以鲜丹参为原料,不仅可以利用丹参中丰富的营养物质及有效成分,提高丹参的经济价值,而且还可以开发风味独特的保健饮品,实现丹参的多样化产业的发展,对我国丹森产业链的发展具有重要意义。该实验利用丹参与赤砂糖为原料,以总黄酮含量、总酚酸含量为主要指标,同时以酒精含量作为辅助考察指标,确定丹参保健酒的最佳工艺条件。
1 材料与方法
1.1 材料与试剂
赤砂糖:南宁糖业股份有限公司;丹参:江苏瑞禾生物科技有限公司;超级酿酒高活性干酵母:安琪酵母股份有限公司;氢氧化钠、酒石酸钾钠、3,5-二硝基水杨酸、亚硫酸氢钠、磷酸、葡萄糖、亚硝酸钠、没食子酸、芦丁、硝酸铝、十二烷基硫酸钠、铁氰化钾(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
TW12恒温水浴锅:优莱博技术(北京)有限公司;SN510C全自动高压灭菌锅:重庆雅玛拓科技有限公司;UVmini-1240紫外-可见光分光光度计:日本岛津公司;JJ-2组织捣碎机:金坛市城东新瑞仪器厂;LRH-250A生化培养箱:韶关市医疗器械有限公司;雷磁PHS-3CpH计:上海楚柏实验室设备有限公司;PL-303电子分析天平:梅特勒-托利多仪器(上海)有限公司;酒精计:余姚仪表二厂有限责任公司。
1.3 试验方法
1.3.1 丹参保健酒酿造工艺流程及操作要点
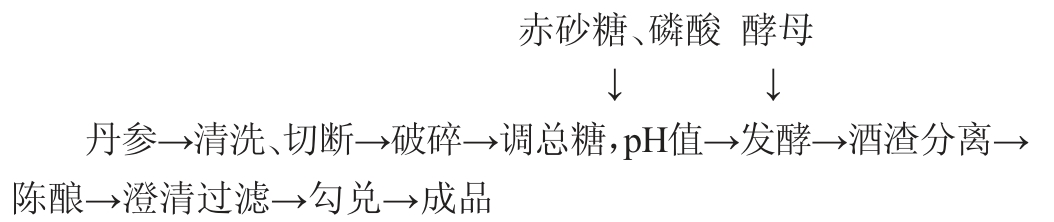
操作要点:将丹参清洗破碎,按照一定的添加量加入到调好的发酵糖液中,放入组织捣碎机打碎,把丹参与发酵糖液的混合物分装到容量为250 mL的三角瓶中,装液量为150 mL,用磷酸调pH值后灭菌,接种一定量的干酵母并在一定温度的恒温培养箱中静置发酵6 d[15],发酵结束后,先后用300目、500目的尼龙纱布粗过滤后做澄清处理,得到丹参保健酒。
1.3.2 丹参保健酒发酵条件优化单因素试验
在控制其他变量不变的情况下,分别考察丹参添加量(0、5%、10%、15%、20%)、酵母接种量(0.010%、0.015%、0.020%、0.025%、0.030%)、发酵温度(16 ℃、20 ℃、24 ℃、28 ℃、32 ℃)、发酵初始pH值(3.0、3.5、4.0、4.5、5.0)、发酵初始总糖(200 g/L、225 g/L、250 g/L、275 g/L、300 g/L)对丹参保健酒酒精含量、总黄酮含量以及总多酚酸含量变化的影响,并确定最佳的工艺参数。
1.3.3 丹参保健酒发酵条件正交试验优化
在单因素试验的基础上,以初始糖含量(A)、发酵pH(B)、发酵温度(C)为正交试验的影响因素,每因素选择3水平,以总黄酮含量和酒精度为评价指标,采用L9(33)正交设计确定丹参保健酒的最佳发酵条件参数,正交试验因素与水平见表1。
表1 丹参保健酒发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization of Saliva miltiorrhiza health wine

1.3.4 总糖含量的测定
采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测还原糖[16]。得到葡萄糖的标准曲线为:y=0.347 5x-0.028 5(R2=0.999 4),表明二者线性关系良好。
1.3.5 酒精度的测定
采用蒸馏法测定发酵液酒精度[17-18]。
1.3.6 总酚酸含量的测定
参考陈丽珍等[19]的方法并稍作修改。以没食子酸作为标准品绘制标准曲线:精确制22.4 μg/mL没食子酸标准溶液。分别吸取0.25 mL、0.5 mL、0.75 mL、1.00 mL、1.25 mL、1.5 mL置于25 mL的具塞比色管中,用无水乙醇定容至5 mL,加入2 mL的0.3%十二烷基硫酸钠溶液、0.6%三氯化铁-0.9%铁氰化钾(1∶1)混合溶液1 mL混匀,放置于暗处反应5 min,最后用0.1 mol/mL HCl定容至刻度,混匀,在暗处放置20 min。以显色剂为空白,在720 nm波长处测定吸光度值。测定酒样中的总酚酸含量时,需先将醪液进行4 000 r/min离心20 min,测定上清液中的含量测定。
最终得到标准曲线回归方程y=0.034 2x+0.046 7(R2=0.999 7),表明没食子酸含量在0.22~1.12 μg/mL范围内,线性关系良好。
1.3.7 总黄酮含量的测定
黄酮含量的测定方法参考文献[20-21],并稍有改动。根据弱碱环境下,黄酮类分子中的酚羟基与铝盐生成络合物显红橙色在510 nm处有最大吸光度的原理。准确称量烘干至恒质量的芦丁标准品10.5 mg用医用乙醇定容至100 mL。精确吸取不同体积(0、1.0、2.0、3.0、4.0、5.0、6.0 mL)此溶液于25 mL试管中,用医用乙醇补足至10 mL,加入5%亚硝酸钠溶液0.8 mL,摇匀,静置6 min,加入10%硝酸铝溶液0.8 mL,摇匀,静置6 min,再加4%氢氧化钠溶液10 mL,定容摇匀,静置15 min,测定吸光度值(OD510nm值)。将样品稀释1倍,按照上述方法测定总黄酮含量。得到芦丁的标准曲线回归方程为:y=0.484 5x-0.023(R2=0.999 5),表明芦丁含量在4.2~21.0 μg/mL范围内,线性关系良好。
2 结果与分析
2.1 丹参保健酒发酵条件优化单因素试验
2.1.1 不同丹参添加量对丹参保健酒酒精度、总黄酮及总酚酸含量的影响
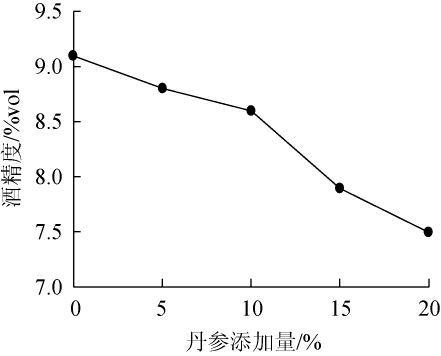
图1 丹参添加量对丹参保健酒酒精度的影响
Fig.1 Effect of Saliva miltiorrhiza addition on the alcohol content of Saliva miltiorrhiza health wine
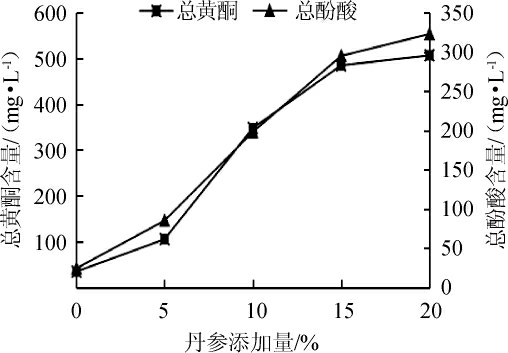
图2 丹参添加量对总黄酮和总酚酸含量的影响
Fig.2 Effect of Saliva miltiorrhiza addition on the total flavonoids and total phenolic acids contents
由图1可知,丹参保健酒酒精度随丹参添加量的增多逐渐下降的趋势,且下降的幅度越来越大,结合图2总黄酮与总酚酸含量的与丹参含量的关系,选取丹参添加量为10%。此时酒精含量达8.6%vol,总黄酮与总多酚酸含量分别为348 mg/L、198 mg/L。
2.1.2 不同酵母接种量对丹参保健酒酒精度、总黄酮及总酚酸含量的影响

图3 酵母接种量对丹参保健酒酒精度的影响
Fig.3 Effect of yeast inoculum on the alcohol content of Saliva miltiorrhiza health wine
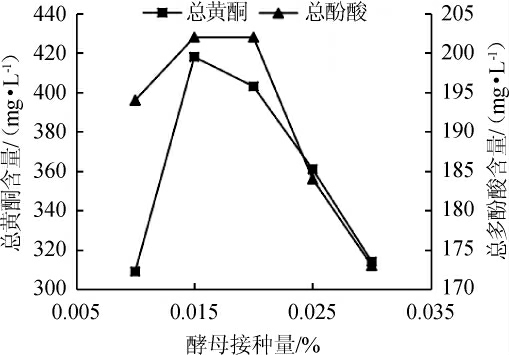
图4 酵母接种量对总黄酮和总酚酸含量的影响
Fig.4 Effect of yeast inoculum on the total flavonoids and total phenolic acids contents
丹参保健酒在发酵过程中,酵母菌种添加量的多少直接影响到酵母的倍增时间。由图3、图4可以看出,随着酵母接种量的不断增大,丹参保健酒的酒精含量与总黄酮、总酚酸含量都呈现先升后降的趋势。当酵母接种量为0.01%时,发酵启动慢,产生的酒精量少,所以溶解在酒中的黄酮量也少;接种量为0.03%时,酵母基数大,新增酵母细胞数量少,容易老化,酒精产量低,酒中的总黄酮含量也较低。与陈玲在研究枸杞果酒发酵过程中,酵母接种量对酒中黄酮含量的影响的结论相一致[22]。当酵母接种量为0.015%时,发酵较快,酒精产量也较高,总黄酮含量也达到了最大值。而总酚酸与总黄酮呈现相同的趋势,可能与黄酮酚酸极性相似有关。因此,选择酵母接种量0.015%为宜,此时的总黄酮和总酚酸的含量分别是418 mg/L、202 mg/L。
2.1.3 不同初初糖度对丹参保健酒酒精度、总黄酮及总酚酸含量的影响
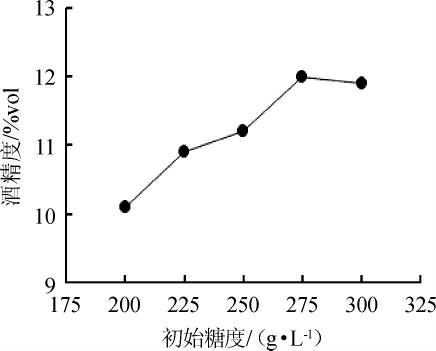
图5 初始糖度对丹参保健酒酒精度的影响
Fig.5 Effect of initial sugar content on the alcohol content of Saliva miltiorrhiza health wine
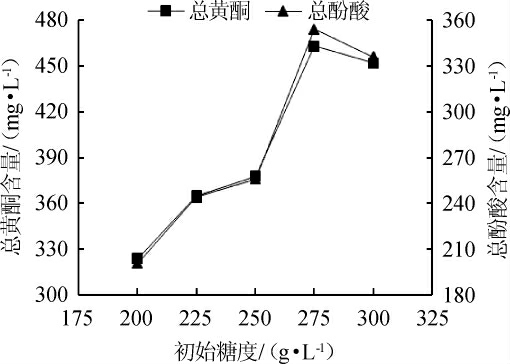
图6 初始糖度对总黄酮和总酚酸含量的影响
Fig.6 Effect of initial sugar content on the total flavonoids and total phenolic acids contents
由于丹参含糖量较低,发酵需要添加一定量的蔗糖才能达到所需酒度,含糖量越高,发酵产酒精越高,而过高的糖浓度与酒精含量都会导致发酵液的渗透压增大,不利于酵母细胞的生长繁殖。由图5、6可知,不同的糖度对酒精度与活性物质的含量影响较大。当初始总糖为200 g/L时,糖度较低,酵母的生长得不到足够碳源而导致酒精度低,发酵醪液中的活性物质含量也低;随着总糖的增加,酒精度与黄酮、酚酸含量虽然一直在增加但幅度有所降低。当初初糖度达到300 g/L时,酵母的生长和代谢受到抑制,造成糖的利用率低。因此,发酵过程中调整初始糖度为275 g/L为宜。
2.1.4 发酵液pH值对丹参保健酒酒精度、总黄酮及总酚酸含量的影响
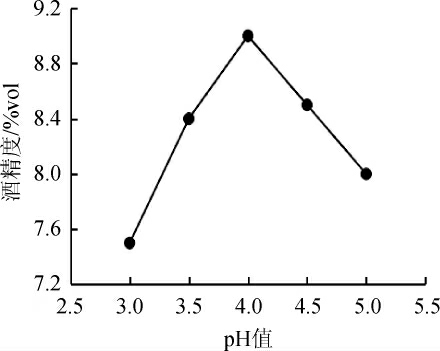
图7 发酵液pH值对丹参保健酒酒精度的影响
Fig.7 Effect of fermentation liquid pH on the alcohol content of Saliva miltiorrhiza health wine
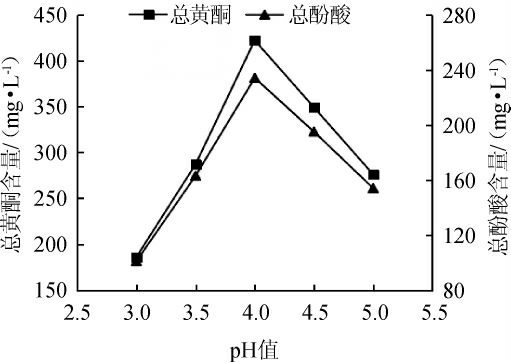
图8 发酵液pH值对总黄酮和总酚酸含量的影响
Fig.8 Effect of fermentation liquid pH on the total flavonoids and total phenolic acids contents
由图7、8可知,当发酵液pH值为3~5时,酒精含量与总黄酮、总酚酸含量表现出相同的趋势,即先上升后下降。当pH值为3时,酵母菌的生长和代谢受到抑制,酒精产量较低,不利用黄酮与酚酸的溶出;当pH值为4时,适合酵母菌的生长,在提高了酒精含量的同时也增加了黄酮和酚酸的含量;但pH值过高时,丹参酒发酵液易受杂菌污染,而导致酒精含量降低。李楠等[23]发现,在山楂果酒的发酵过程中,pH值对酒中总黄酮含量也表现出相同的影响规律。因此选择发酵液pH值4为宜。
2.1.5 发酵温度对丹参保健酒酒精度、总黄酮及总酚酸含量的影响
由图9、10可知,发酵温度在16~32 ℃范围内,丹参酒的酒精度与总黄酮和总酚酸含量都随着温度的升高而逐渐上升,发酵温度为28 ℃时,此时酵母适宜繁殖,酒精产量高有利于丹参保健酒中黄酮与酚酸的提取率,并保持稳定性[24]。当温度过低时,酵母生长和代谢速度缓慢,短期内酒精含量低,使丹参保健酒中的活性物质提取缓慢;温度过高发酵速度快,由于酵母衰老化加快,发酵提前终止,导致酒精度低同时影响黄酮和酚酸的溶出。因此,选择发酵温度为28 ℃。
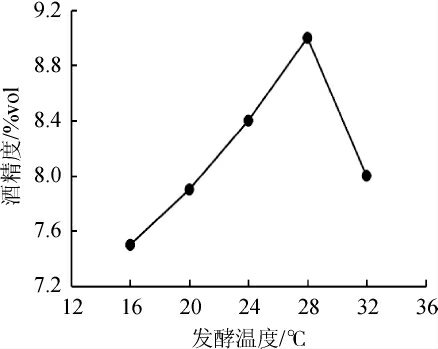
图9 发酵温度对丹参保健酒酒精度的影响
Fig.9 Effect of fermentation temperature on the alcohol content of Saliva miltiorrhiza health wine
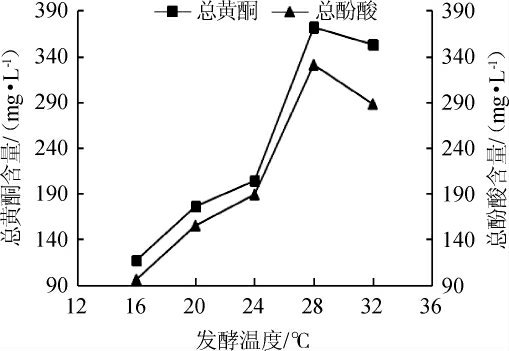
图10 发酵温度对总黄酮和总酚酸含量的影响
Fig.10 Effect of fermentation temperature on the total flavonoids and total phenolic acids contents
2.2 正交试验优化丹参保健酒的酿造工艺
在单因素试验的基础上,设计3因素3水平L9(33)正交试验,以总黄酮与酒精度作为考察指标,确定最佳发酵工艺条件。正交试验结果与分析见表2,方差分析见表3和表4。
由表2可知,3个因素对丹参保健酒总黄酮含量的影响结果排序为A>C>B,即初始糖度>发酵温度>发酵液pH值,从K值大小可知,以总黄酮为评价指标的最佳工艺组合为A2B2C2,即初始糖度为275 g/L、温度28 ℃、发酵液pH值为4;3个因素对丹参保健酒酒精度影响结果排序为A>C>B,与总黄酮含量影响一致,以酒精度为评价指标的的最佳工艺组合为A2B2C2,即发酵液初始糖度为275 g/L、温度28 ℃、发酵液pH值为4,与总黄酮含量影响一致。在此条件下进行验证试验,得到丹参保健酒酒精度为12.6%vol,总黄酮含量为506 mg/L、总酚酸含量为354 mg/L。
表2 发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization of Saliva miltiorrhiza health wine
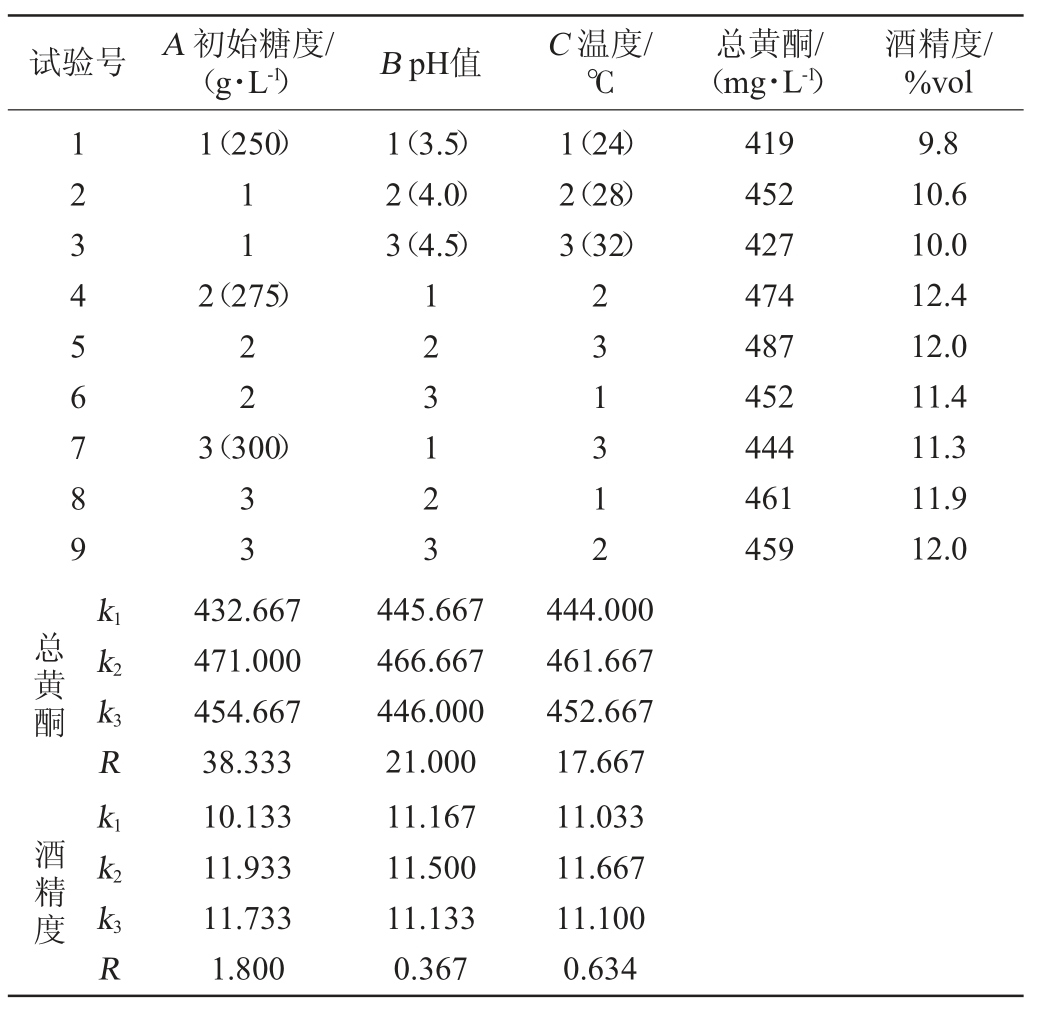
表3 基于总黄酮的正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments based on total flavonoids
注:“*”表示对结果影响显著(P<0.05)。下同。
表4 基于酒精度的正交试验结果方差分析
Table 4 Variance analysis of orthogonal experiments based on alcohol content
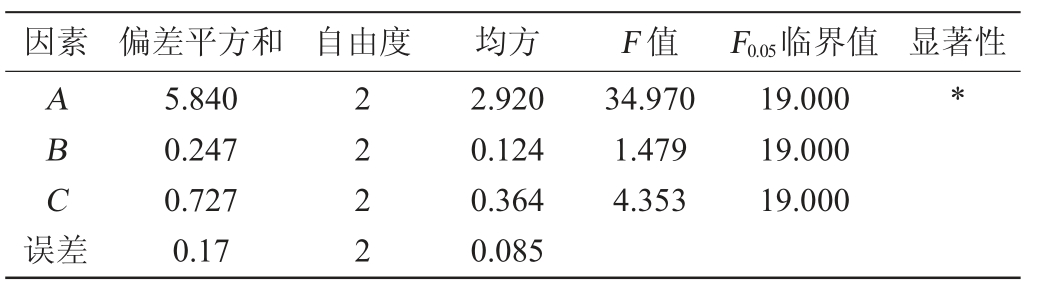
由表3和表4可知,在选定试验条件下,初总糖对丹参保健酒酒精度与总黄酮含量影响显著(P<0.05),而发酵温度和发酵液的pH值对丹参保健酒酒精度与总黄酮含量的影响均不显著(P>0.05)。
3 结论
本试验在单因素试验的基础上,以丹参保健酒中的总黄酮与总酚酸含量作为指标,进行3因素3水平进行正交试验,确定发酵的最佳条件为丹参添加量10%、酵母接种量为0.015%、发酵液初总糖为275 g/L、发酵温度28 ℃、发酵液pH值为4,在此优化条件下,此时的丹参保健酒酒精度为12.6%vol,总黄酮含量为506 mg/L、总酚酸含量为354 mg/L。
[1]吕亚青.丹参的化学成分及临床应用进展[J].中国药房,2007(12):947-948.
[2]张翠英,任伟光.丹参制剂与心脑血管、抗癌化学药联合用药的药动学研究进展[J].中国医院药学杂志,2017,37(18):1867-1872.
[3]王钦汶,戴新新,项想,等.丹酚酸和丹参酮干预糖尿病肾病的分子机制研究进展[J].药学学报,2019(8):1356-1363.
[4] STENVINKEL P.Chronic kidney disease:a public health priority and harbinger of premature cardiovascular disease[J].J Int Med,2010,268(5):456-467.
[5]王宇,胡敏,张跃辉,等.隐丹参酮对Akt2 基因缺失雌鼠生殖功能及其效应机制的影响[J].中国中西医结合杂志,2019,39(5):577-582.
[6]左军,唐明哲,韩淑丽,等.中医药治疗酒精性肝损伤的研究进展[J].中医药信息,2017,34(3):124-128.
[7]梁伟,李怀军,李洁.黄褐斑形成应用杭白菊、当归、丹参提取液抑制的机制研究[J].世界最新医学信息文摘,2016,16(A4):67.
[8]王歆君,雷鸣宇,杨巧丽,等.六味西红花口服液活血化瘀及抗疲劳作用的研究[J].中国民族民间医药,2017,26(19):21-23.
[9]尚丛珊,雷喆.酸枣仁-丹参茶饮对失眠症患者睡眠质量改善效果研究[J].现代食品,2018(4):50-51.
[10]裴悦,梁海莹,曾剑波,等.基于关联规则的痤疮中药面膜方用药规律研究[J].中国医药导报,2018,15(28):130-132.
[11]杨芳芳,高玉海,葸慧荣,等.丹参酮ⅡA 与白藜芦醇的复方药对青年大鼠峰值骨量的影响[J].中国医学科学院学报,2018,40(4):456-462.
[12]谢兴亮,薛棱芬,殷雅卓,等.基于指纹图谱及多指标成分定量的丹参提取工艺对比研究[J].成都医学院学报,2017,12(3):237-240.
[13] STRYJEWSKI M E,COREY G R.Methicillin-resistant Staphylococcus aureus:an evolving pathogen[J].Clin Infect Dis,2014,58(1):10-19.
[14]宋平顺,杨树声,马真金,等.酒制甘肃丹参的炮制工艺研究[J].中国中医药信息杂志,2010,17(5):49-51.
[15]胡军.柚子木瓜发酵酒工艺研究[J].酿酒,2019,46(5):107-109.
[16]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[11]彭秧锡.同时蒸馏萃取器及其使用方法[J].理化检验:化学分册,2004,40(5):296-296.
[18]李龙柱,张富新,贾润芳,等.海红果果酒发酵工艺研究[J].农产品加工·学刊(中),2013(1):16-19.
[19]陈丽珍,艾朝晖,蔡蓝洁,等.冰糖草中总酚酸的含量测定[J].中国民族民间医药,2015,24(10):10-12.
[20]吴清华,许英豪,李志西,等.玉米须枳椇醋的研制及抗氧化性研究[J].中国酿造,2011,30(8):91-93.
[21]JIA Z S,TANG M C,WU J M.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J].Food Chem,1999,64(4):555-559.
[22]陈玲,余昆,崔振华.枸杞果酒发酵过程中黄酮含量变化及其发酵条件优化[J].酿酒,2015,42(6):65-68.
[23]李楠,杨春杰,邓随胜,等.富含黄酮的山楂果酒发酵条件优化[J].中国酿造,2016,35(11):112-116.
[24]孔令明,李芳.枸杞中类黄酮化合物的提取研究[J].食品研究与开发,2008,29(8):45-48.