白酒是中华民族的瑰宝,发展历史悠久,酿造工艺精湛,风味众多且风格独特,有促进人际关系、放松身心、增强抵抗力[1]、促进机体新陈代谢和预防肝癌[2]的功效。研究表明,适量饮酒不但能够调节和帮助体内生理代谢,还能预防动脉粥样硬化、降低心血管疾病以及糖尿病的发生和死亡[3-6]。吴寿岭等[4]研究发现,适度饮酒不仅可以降低男性糖尿病心脑血管的发生,还可以减少脑梗死亡。石亚林等[7]测定了不同香型白酒的体外抗氧化能力,并对不同香型白酒的清除能力进行排序,研究推断酚类是引起白酒具有抗氧化活性的主要物质成分。刘银等[8]证实了适量饮酒能够调节人体对于酯类的分解。岳元媛等[9]讨论了白酒中的微量风味物质和金属元素等健康因子的研究近况。霍嘉颖等[10]阐述了白酒中健康因子的功效。由于白酒起源于中国,发展于中国,国外酒精饮料多以红酒、香槟、啤酒为主,有关白酒的研究还很匮乏。
随着社会发展和生活质量的提高,越来越多的消费者开始注重饮酒中和饮酒后的感受。目前,有关白酒醉酒上头的研究有很多,但是具体造成不适的物质成分、形成机理和调控手段还未明确。在众多影响醉酒程度的因素中,高级醇含量不合理是导致饮酒醉酒上头比较常见的原因之一。高级醇是含有三个以上碳原子的醇,包括异戊醇、异丁醇、正丙醇和活性戊醇等。虽然高级醇在人体内的氧化速率没有乙醇快[11],但它停留的时间比乙醇长,对人体的麻醉作用也比乙醇高出很多[12]。适量的醇类有益于白酒风味的形成,与酸类酯化后会形成高碳酸酯,使白酒更加芳香舒适;当白酒中的高级醇含量超过一定限度时,会使白酒的口感变得苦涩,从而影响白酒的感官质量,还会抑制神经中枢,出现头晕和头痛等症状,更严重的会导致神经系统充血。
血液中与醉酒程度和饮后“上头”相关的主要生物标志物是乙醇和乙醛。人体摄入酒精后,含有乙醇的血液流经肝脏后,其中的乙醇首先被乙醇脱氢酶(alcoholdehydrogenase,ADH)氧化为乙醛,该过程中会导致血液中乙醛的累积。乙醛再经乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)作用将自身中的两个氢原子脱掉,并转化为乙酸,最终乙酸经三羧酸循环代谢为二氧化碳和水[13]。此外,肝脏中的乙醇还能被CYP2E1酶分解代谢[14]。乙醛的代谢速率主要取决于人体内ALDH含量,其具有较大的个体差异[15],并与遗传因素密切相关[16]。这也就意味着只要ALDH的活性较强,就能较快分解乙醛,从而使体内的系统和组织较少受到酒精的影响,即使在饮用一定量的酒后,也不会产生较大反应。虽说在人体内都存在ADH并且在正常个体间含量相差不大,但是ALDH的含量则不尽相同[17]。因此,在体外模拟酒精在人体内的代谢过程,建立体外酶学模型是非常有研究意义的。
因此,本实验通过对几款市售浓香型白酒饮后动物行为学和酒精代谢生物标志物的研究,结合酒体成分分析影响饮后不适的高级醇类物质,再由体外酶学实验探究其对ALDH的影响。以期为提高白酒饮用舒适度,降低醉酒度,减少浓香型白酒中高级醇类物质带来的上头效应提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品和动物
实验选用八款不同浓香型白酒,根据酒精度数的高低分为:高度数组和低度数组。高度数组:酒样A(52%vol);酒样B(52%vol);酒样C(52%vol);酒样D(52%vol);对照组:酒样E(食用酒精52%vol)。低度数组:酒样F(42%vol);酒样G(42%vol);酒样H(40.6%vol);酒样I(41%vol);对照组:酒样J(食用酒精40.6%vol)。
昆明鼠:雄性,四月龄,平均体质量按照30 g/只计算,无特定病原体(specific pathogen free,SPF)级,实验前于清洁Ⅱ级环境进行一周适应性饲养。喂养环境为国家规定普通研究及试验环境(室内温度18~26 ℃,相对湿度50%~70%,光照150 lx,噪音<60 dB,室内用排风扇通风换气,保证室内氨浓度<14 mg/m3,所喂颗粒饲料达到国家试验动物营养需要标准,饮用水为符合城市卫生标准的普通自来水,自动饮水器供水),正常饲喂一周后开始实验。
1.1.2 化学试剂
乙醛脱氢酶(1.5 U/mg)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+):SIGMA(上海)贸易有限公司。
1.2 仪器与设备
旷场实验动物行为学跟踪系统(ANY-Maze系统):美国Stoelting公司;Clarus 580气相色谱(gas chromatograph,GC)仪(配备氢火焰离子化检测器(flame ionization detector,FID))、Clarus SQ 8气质联用仪:美国PerkinElmer公司;Scientific Forma 900超低温冰箱、Multiskan FC酶标仪:美国热电公司;DHG-9162电热恒温培养箱:上海一恒科技有限公司;ICS-3000型离子色谱仪(配有EluGen Cartridge 淋洗液自动发生器、电导检测器和Chrromeleon 6.80色谱工作站)、Ionpac AS11-HC型分离柱(250 mm×4 mm)、Ionpac AG11-HC型保护柱(50 mm×4 mm):美国Dionex公司;Multiskan FC型酶标仪:美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 灌胃剂量
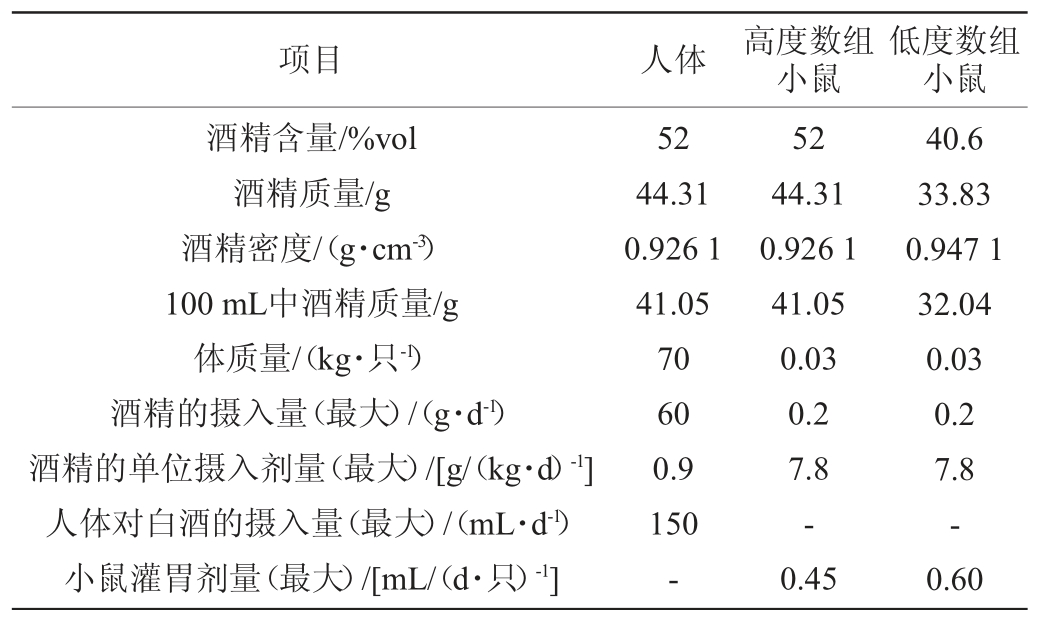
由于各酒样酒精度差异依据酒精密度与百分含量对照表(20 ℃),低度数组酒样的最低酒精度数为40.6%vol,将低度数组的酒样统一调为40.6%vol,高度数酒样酒精度为52%vol,进行密度折算,每只小鼠按照平均体质量30 g计,成年男性的标准体质量设为70 kg。依据《药理实验方法学》[18],按单位体质量的剂量计算,灌胃剂量及对应的人的饮酒量折算如表1所示。高度数组小鼠灌胃量为0.45 mL/只,低度数组小鼠灌胃量为0.60 mL/只。
表1 体质量30 g小鼠的灌胃剂量计算
Table 1 Calculation of intragastric dose in mice weighed 30 g
1.3.2 旷场实验方法
高度数组和低度数组共10个酒样,每个酒样随机灌胃20只小鼠,共计20个平行重复。然后,将每组小鼠依次在灌酒前0 h、灌酒后1 h、2 h、3 h、4 h、5 h、24 h置于动物精细行为学分析装置旷场中,采用高频摄像机和行为学分析软件Any-maze分别实时录制小鼠在上述7个时刻时自由运动120 s的行为轨迹,并同步自动分析获得行为参数。操作过程中保持安静,每只动物实验结束后及时清理粪便,使用体积分数为72%医用乙醇溶液擦拭干净,减少之前动物的气味,防止行为干扰。
1.3.3 动物血浆乙醇及乙醛含量测定
将50只小鼠随机分为10组,每组对应一个酒样,做5个平行。灌胃后,向离心管加入30 μL肝素钠(1 500 U/mg),分别于灌酒前0 h和灌酒后第2、5、24 小时,采用断尾取血采集小鼠血液标本0.3 mL,混匀后于离心机中3 500 r/min离心10 min取上清,即为血浆,所采集样品均于-80 ℃进行储存,待测。
参照使用气相色谱法对血浆中的乙醇、乙醛含量进行测定。配制乙醇、乙醛混合标准工作液,得出乙醛和乙醇的峰面积标准曲线,待测样品峰面积对照标准曲线回归方程计算乙醛和乙醇含量。
1.3.4 酒体成分检测方法
酯、醇、醛测定采用气相色谱法。色谱条件如下:载气为氮气(N2);流速1 mL/min;氢火焰离子检测器(FID)(280 ℃);氢气(H2)45 mL/min;空气450 mL/min;CP-Wax 57 CB毛细管柱(0.25 mm×0.20 μm×50 m)。进样器温度:240 ℃。采用内标法,内标物选用2%叔戊醇、2%乙酸正戊酯、2%2-乙基丁酸。采用10∶1分流比进样。
酯测定采用气质联用法。气相色谱条件:载气为高纯氦气(He)(纯度>99.999%),流速1 mL/min;柱温:起始温度35 ℃,恒温2 min,以4 ℃/min升温至230 ℃,恒温7 min;不分流进样;进样口温度240 ℃。质谱条件:电子电离(electronic ionization,EI)源,温度230 ℃;传输线温度240 ℃;电子能量70 eV;扫描范围:30~550 amu。
有机酸测定采用离子色谱法。色谱条件如下:Dionex IonPao AG11-HC分析柱(4 mm×250 mm);Dionex IonPao AG1I1-HC保护柱(4 mm×50 mm);淋洗液:超纯水;淋洗液流速1.1 mL/min;进样体积50 μL;色谱池温度35 ℃;柱温30 ℃;抑制器电流96 mA。
1.3.5 主成分分析法
主成分分析法(principal component analysis,PCA)是用降维的思想,将多个变量转化成为少数的几个综合的变量,称为主成分。这些主成分不仅可以反映原始变量的大部分信息内容,而且它们包含的信息彼此之间没有重复。
1.3.6 体外酶学实验方法
实验原理:乙醛与烟酰胺腺嘌呤二核苷酸(NAD+)(辅酶Ⅰ)在乙醛脱氢酶的作用下变成乙酸和NADH(还原型辅酶Ⅰ),NADH在波长340 nm下有吸收峰。
根据实验酒样中异戊醇和正丙醇质量浓度分别为58~272 mg/L和74~404 mg/L,配制质量浓度分别为19 mg/L、39 mg/L、78 mg/L、167 mg/L、312 mg/L的异戊醇,31 mg/L、62 mg/L、125 mg/L、250 mg/L、500 mg/L的正丙醇,并将其分别加入52%vol食用酒精+300 mg/L乙醛中。
200 μL反应体系:90 μL 0.1 mol/L 磷酸盐缓冲液(phosphate buffer solution,PBS),10 μL 0.4 mol/L二硫代苏糖醇(dithiothreitol,DTT),55 μL 4 mmol/L NAD+,30 μL 0.9 U/mL ALDH,15 μL 52%vol食用酒精+300 mg/L乙醛+高级醇。
操作步骤:将酶标仪提前预热30 min,乙醛脱氢酶液提前取出放置30 min,按照顺序依次向酶标孔板加样,然后将孔板于37 ℃保温箱孵育5 min后,在波长340 nm处测定吸光度值。以吸光度值为纵坐标,乙醛脱氢酶活力为横坐标,绘制乙醛脱氢酶标准曲线。
1.3.7 数据处理
实验结果采用Excel 2016、SPSS 23.0软件对数据进行分析,并使用Qrigin8.0作图。
2 结果与分析
2.1 旷场实验结果
旷场实验是用来检测小鼠在旷场中的自发活动和探索行为的经典动物学实验[19]。常用的旷场系统是一个圆形的箱子,顶部装有连接电脑的摄像头,通过软件记录分析小鼠在旷场中的行动轨迹,行动距离、移动时间、停滞时间等参数。行为参数比是灌胃后小鼠在旷场中运动120 s的行为参数/灌胃前小鼠在旷场中运动120 s的行为参数[20]。灌胃后,不同时刻小鼠在旷场中的行动距离见分别表2和表3。由行为参数计算行为参数比,可以减少小鼠自身原因造成的误差,结果如图1~3所示。
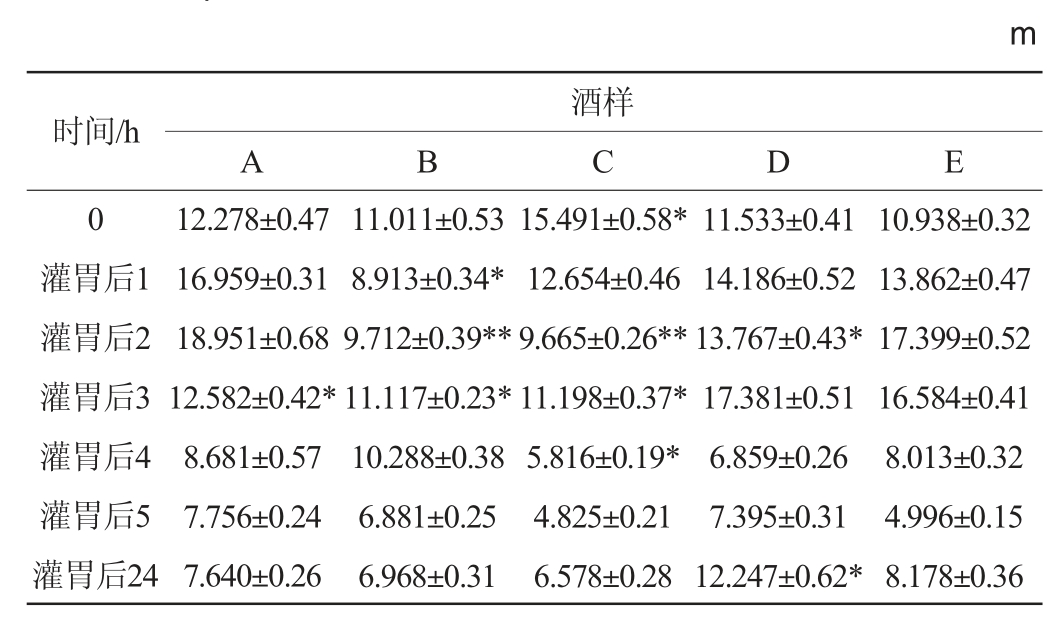
表2 高度数组小鼠在旷场中运动的行动距离
Table 2 Movement distance of mice with high alcohol dose in the open field
注:“*”表示与对照组相比差异显著(P<0.05);“**”表示与对照组相比差异极显著(P<0.01)。下同。
由表2可知,各组小鼠在灌胃后第4、5小时行动距离处于低谷,A组小鼠在灌胃后第3小时与对照组E差异显著(P<0.05);B组小鼠在灌胃后第1、3小时与对照组差异显著(P<0.05),在灌胃后第2小时与对照组差异极显著(P<0.01);C组小鼠在灌胃前0 h和灌胃后第3、4小时,行动距离与对照组差异显著(P<0.05),在灌胃后第2小时与对照组差异极显著(P<0.01);D组小鼠在灌胃后第2、24小时与对照组差异显著(P<0.05),在灌胃后第24小时恢复力最好。
由表3可知,除F组小鼠在灌胃后第1小时行动距离增加,其他组小鼠灌胃后行动距离都降低,行动能力减弱。其中,F组小鼠在灌胃后第1、2小时行动距离与对照组J差异显著(P<0.05);G组与对照组无显著性差异(P>0.05);H组小鼠行动距离在灌胃后第3、25小时与对照组有显著性差异(P<0.05);I组小鼠行动距离在灌胃后第3小时与对照组有显著性差异(P<0.05)。
表3 低度数组小鼠在旷场中运动的行动距离
Table 3 Movement distance of mice with low alcohol dose in the open field
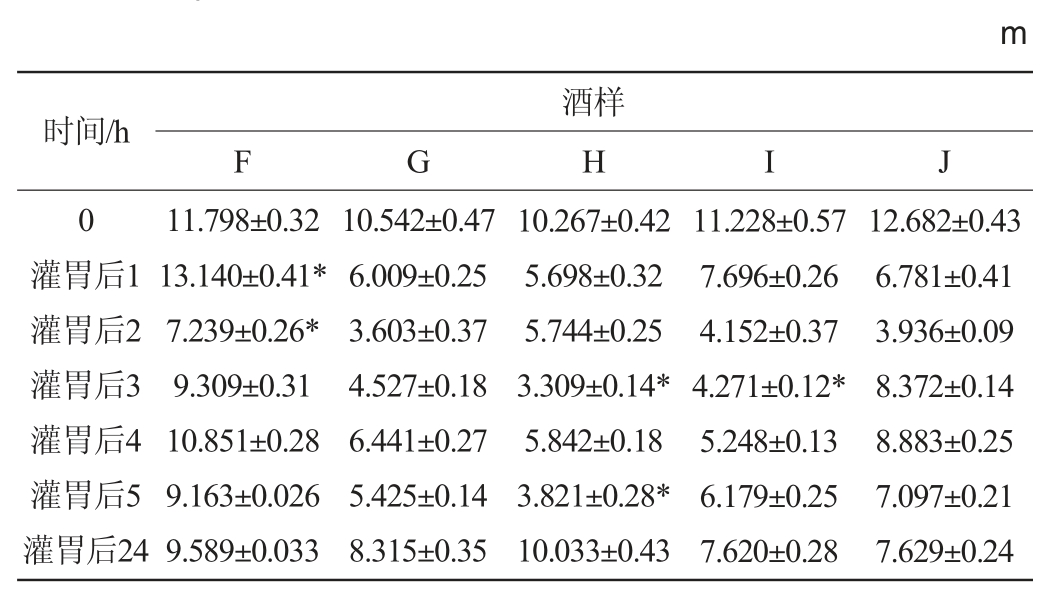
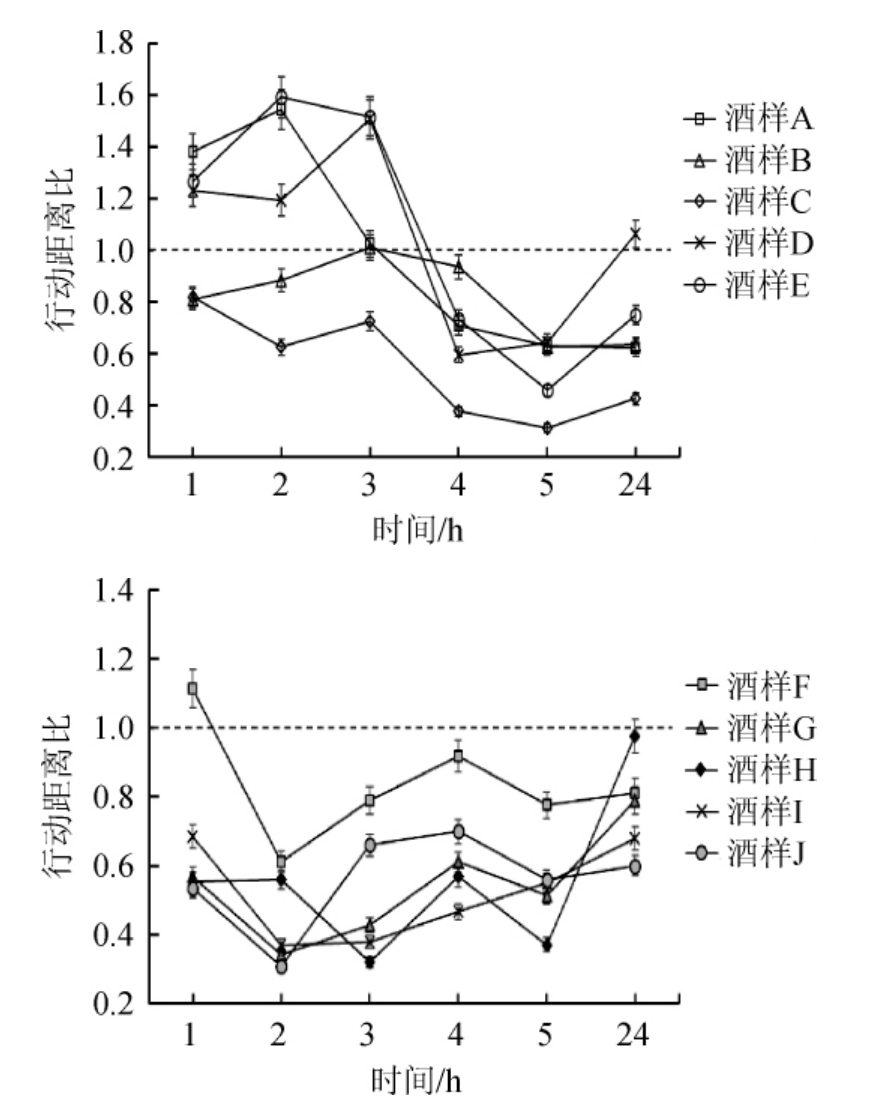
图1 不同时刻小鼠在旷场中运动的行动距离比
Fig.1 Ratio of movement distance of mice in the open field at different time
由图1~3可知,A组小鼠灌胃后3 h前行动距离比值>1,3 h后行动距离比值<1,停滞时间比值在2~8之间,有上升趋势但低于其他组,与对照食用酒精组E无显著性差异(P>0.05)。B组小鼠灌胃后5 h内的不同时间点的行动距离比与移动时间比值<1,停滞时间比值在10~14范围内,与对照组相比,酒样B组小鼠行动距离比、停滞时间比差异显著(P<0.05)。C组小鼠灌胃后行动距离比与移动时间比值也<1,停滞时间比值在7~14之间,与对照组差异极显著(P<0.01)。D组小鼠灌胃后行动距离比在3 h>1,然后开始下降,移动时间比值接近1,停滞时间比在2~7之间,与对照组E差异不显著(P>0.05)。
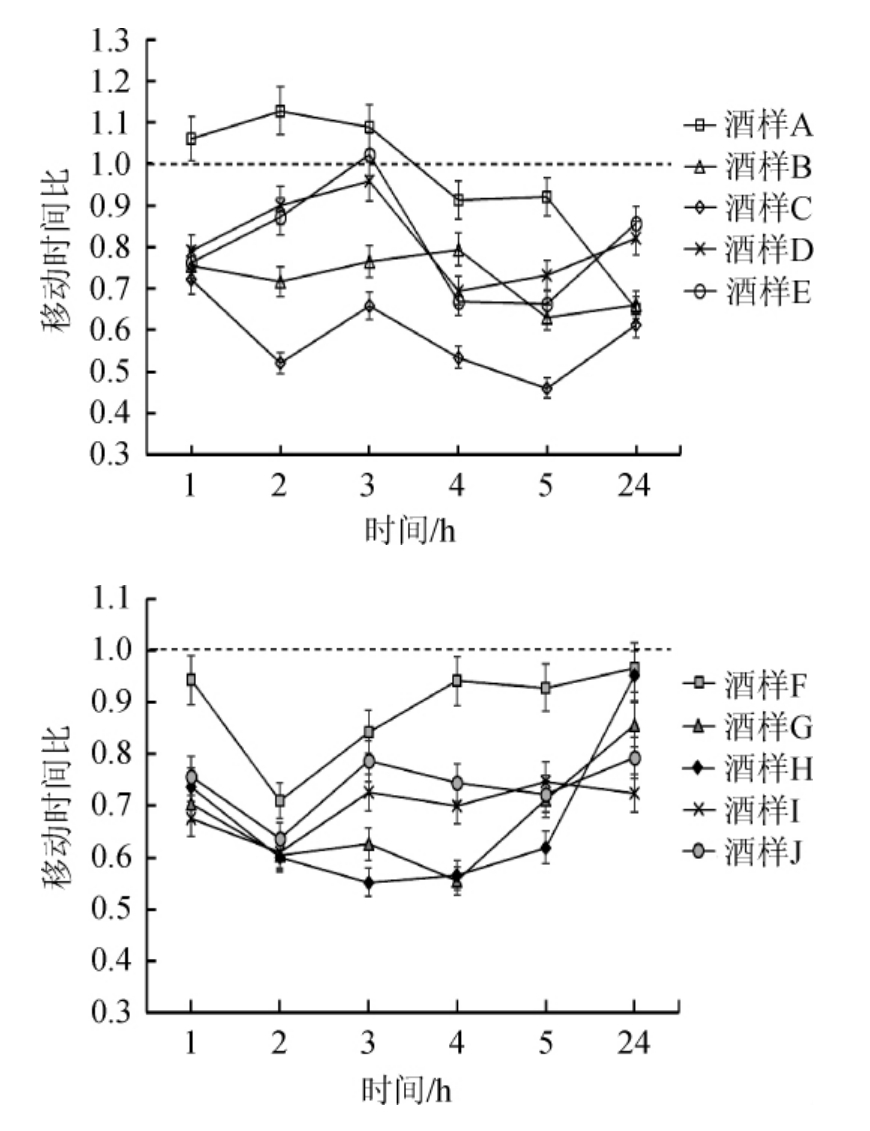
图2 不同时刻小鼠在旷场中运动的移动时间比
Fig.2 Ratio of moving time of mice in open field at different time
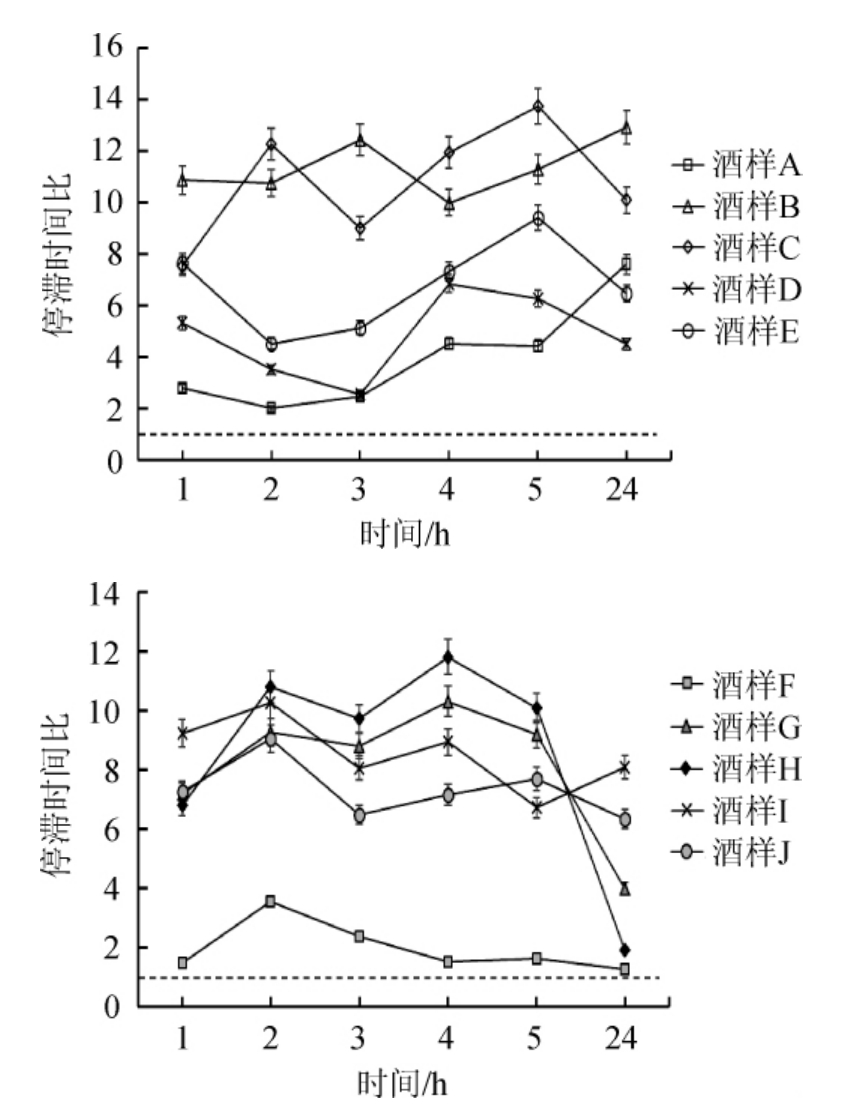
图3 不同时刻小鼠在旷场中运动的停滞时间比
Fig.3 Ratio of stagnation time of mice in open field at different time
F组小鼠饮酒后在1 h时行动距离比值>1,之后行动距离比值<1,移动时间比为0.7~1.0,停滞时间比为1~4,与对照食用酒精组J差异显著(P<0.05)。G组小鼠灌胃后不同时间点的行动距离比与移动时间比值均<1,整体比值较低,停滞时间比值在4~11范围内,与对照组相比,差异不显著(P>0.05)。H组小鼠灌胃后行动距离比与移动时间比值也<1,行动距离比值在3 h、5 h时处于低谷,停滞时间比值在2~12之间,与食用酒精组相比,H组小鼠移动时间比、停滞时间比差异显著(P<0.05)。I组小鼠灌胃后行动距离比值与G组相近,移动时间比值为0.6~0.8之间,停滞时间比在6~11范围内,与食用酒精组比差异不显著(P>0.05)。
旷场实验结果表明,A与B组小鼠饮酒后不同时间点行动距离比、移动时间比、停滞时间比与食用酒精组差异显著(P<0.05);C组小鼠灌胃后不同时间点行动距离比、移动时间比、停滞时间比,与对照食用酒精组相比,差异极显著(P<0.01);D组小鼠行为参数比与食用酒精组相近,差异不显著(P>0.05)。F与H组小鼠灌胃后行为参数比与食用酒精差异显著(P<0.05);G与I组小鼠行动距离比、移动时间比、停滞时间比,与食用酒精组相比,差异不显著(P>0.05)。综上,实验组与对照食用酒精组小鼠在灌胃后不同时刻都会引起行为参数变化,整体表现为行为抑制状态。其中,酒样B、C、H饮用后小鼠行动距离比和移动时间比值较低,停滞时间比值较高。
2.2 血浆中乙醇、乙醛含量测定结果
乙醇进入人体后随血液流经肝脏,首先被乙醇脱氢酶氧化为乙醛,该过程中会导致血液中乙醛的累积。乙醛再被乙醛脱氢酶转化为乙酸,最终乙酸将被代谢为二氧化碳和水。当血液中乙醇浓度超过一定限度时,血流量增加而代谢作用却下降。这就造成乙醇在脑中不能及时代谢排出,必然会引起头痛、头晕。根据旷场实验结果,灌胃后2 h与5 h行为参数差异较大,同时在饮后2 h左右血液乙醇累积含量最大,故本实验选择测定小鼠灌胃前0 h和灌胃后2 h、5 h、24 h血浆乙醇和乙醛含量,结果分别见表4和表5。
表4 高度数组小鼠血浆乙醇及乙醛含量测定结果
Table 4 Determination of ethanol and acetaldehyde in plasma of mice content in the high alcohol group
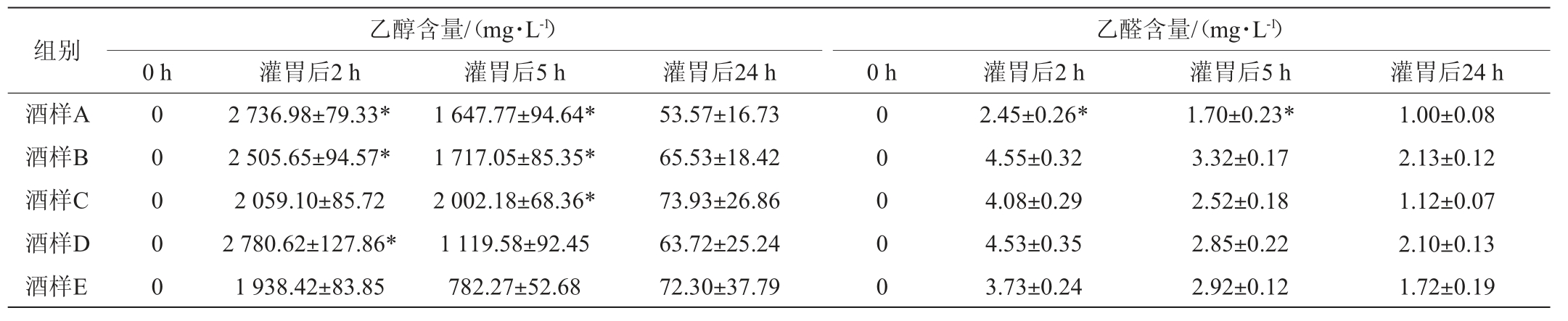
注:“*”表示与对照组相比差异显著(P<0.05)。
表5 低度数组小鼠血浆乙醇及乙醛含量测定结果
Table 5 Determination of ethanol and acetaldehyde content in plasma of mice in the low alcohol group
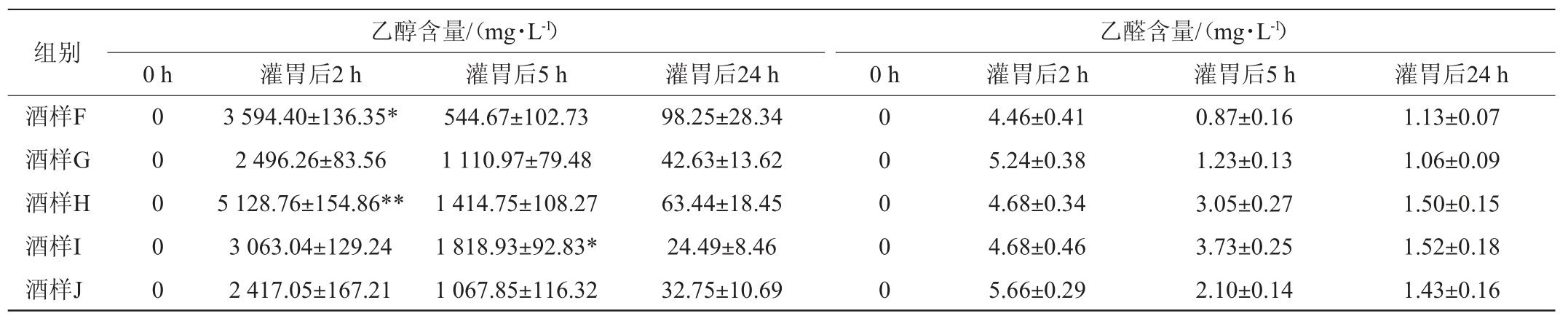
注:“*”表示与对照组相比差异显著(P<0.05);“**”表示与对照组相比差异极显著(P<0.01)。
由表4可知,小鼠灌胃后2 h,血浆中乙醇的积累程度由高到低分别是D、A、B、C、E(食用酒精);A、B、D组小鼠血浆乙醇含量与对照食用酒精组E差异显著(P<0.05);C组小鼠血浆乙醇含量与食用酒精差异不显著(P>0.05)。灌胃后5 h时,乙醇的积累程度由高到低分别是C、B、A、D、E,其中,C组小鼠血浆中乙醇累积量最高,在灌胃后2~5 h内,乙醇在体内转化率极低,A、B和C组乙醇含量与对照组差异显著(P<0.05);D组乙醇含量与对照组差异不显著(P>0.05)。灌胃后24 h,所有酒样的血浆乙醇浓度几乎接近于零,与食用酒精差异不显著(P>0.05)。灌胃后2 h,小鼠血浆乙醛含量为2~5 mg/L,由高到低分别是B、D、C、E(食用酒精)、A;5 h时,乙醛含量在1~4 mg/L范围内,由高到低分别是B、E、D、C、A;其中,B、C、D组小鼠血浆乙醛含量与对照组E无显著性差异(P>0.05);A组与食用酒精差异显著(P<0.05)。
由表5可知,灌胃后2 h时,小鼠血浆中的乙醇含量由高到低分别是H、F、I、G、J(食用酒精);灌胃后5 h时,乙醇含量由高到低分别是I、H、G、J、F;在灌胃后24 h时,所有酒样的血浆乙醇浓度几乎接近于零;其中,H 组与食用酒精组差异极显著(P<0.01),乙醇累积量最高;F组与食用酒精组差异显著(P<0.05);G、I组乙醇含量与食用酒精组差异不显著(P>0.05)。灌胃后2 h、5 h、24 h小鼠血浆乙醛含量逐渐降低,实验组与对照组食用酒精无显著性差异(P>0.05)。
通过对灌胃后小鼠血浆乙醇和乙醛的测量结果可得出,饮用不同的白酒后乙醇和乙醛在体内的代谢速率各有不同。其中,C组小鼠在灌胃后5 h时血浆中乙醇累积量最高,饮酒后2~5 h内,乙醇在体内转化为乙醛的速率极低,与对照组差异显著(P<0.05),H组小鼠在灌胃后2 h时乙醇累积量较其他组高,与对照组差异极显著(P<0.01),推测酒体中有其他微量物质成分影响乙醇在体内的代谢速率;小鼠血浆乙醛含量在1~6 mg/L范围内,随时间变化逐渐降低;除A组乙醛含量与对照组差异显著(P<0.05)外,其他实验组与对照组差异不显著(P>0.05)。
2.3 酒体成分PCA结果分析
采用气相色谱法对八款浓香型白酒主要的四种风味物质成分进行定量分析,结果见表6。由表6可知,共检测出19种酯类、13种高级醇、10种酸类、6种醛类。由于过量的高级醇饮后可造成头痛,降低饮用舒适度。王维刚等[21]通过对浓香型白酒中高级醇的研究,初步判定异戊醇为饮后不适的关键高级醇之一,所以本研究主要以高级醇为研究对象。
表6 八款市售浓香型白酒中醇类物质含量
Table 6 Content of alcohols in eight kinds of commercial strong-flavor Baijiu
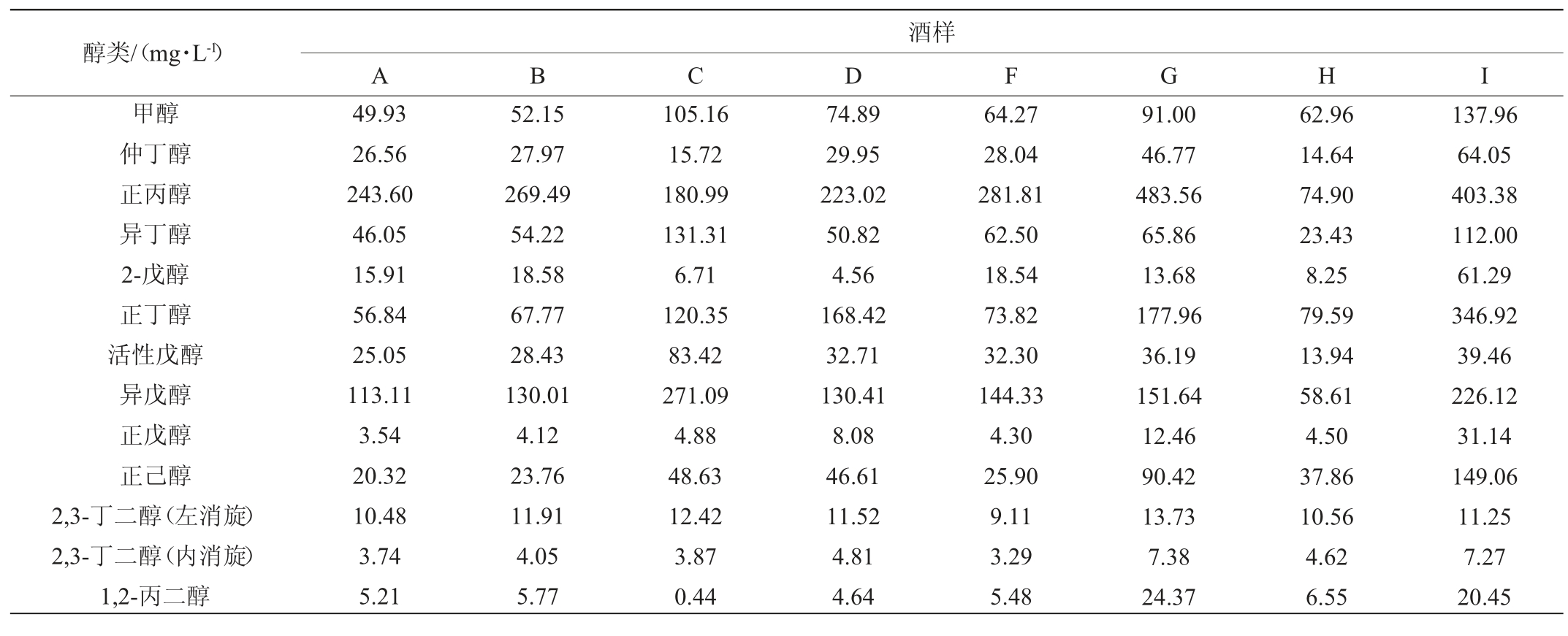
将八款浓香型白酒所检测出的醇类物质进行主成分分析,结果见图4。
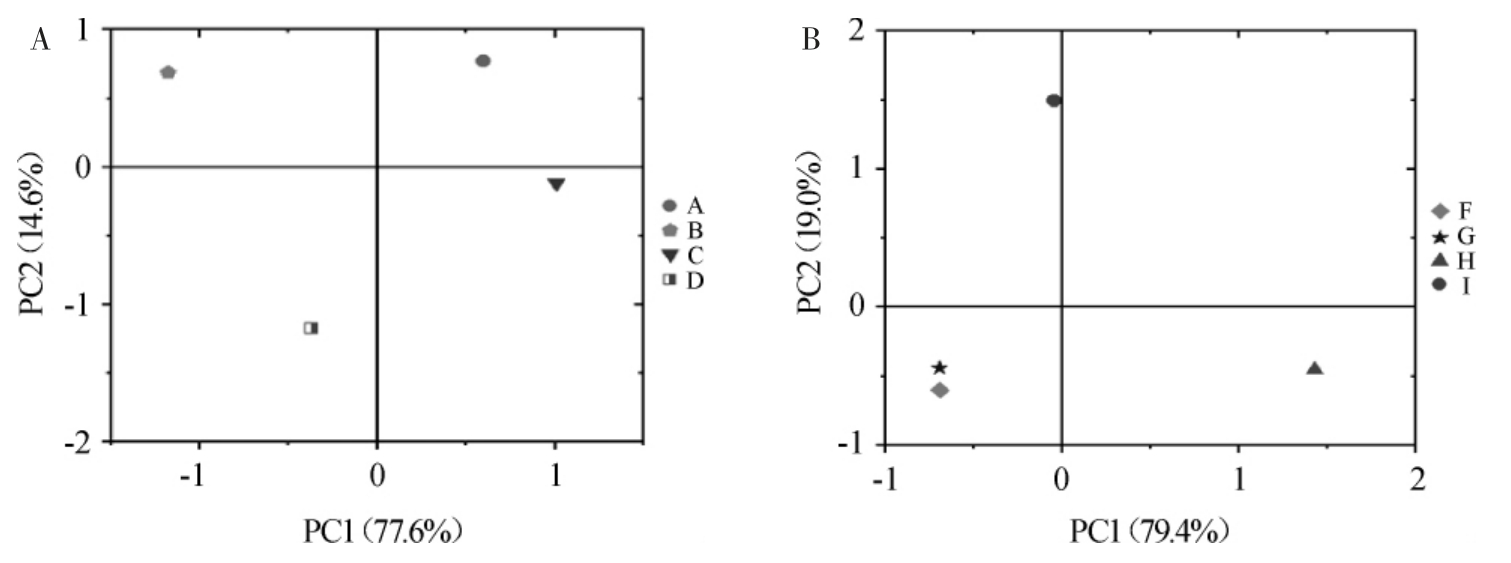
图4 低度数组(A)和高度数组(B)醇类物质主成分分析结果
Fig.4 Principal component analysis results of alcohols in low alcohol group (A) and high alcohol group (B)
由图4 可知,酒样A和B是以主成分2(PC2)所代表的正丙醇占主要作用;酒样D的两个主成分均不起作用;酒样C是以主成分1(PC1)所代表的甲醇、仲丁醇、异丁醇、正丁醇、异戊醇、正戊醇、正己醇起主要作用。酒样F和G的两个主成分均不起作用,酒样H是以PC1所代表的甲醇、异丁醇、活性戊醇、异戊醇起主要作用;酒样I中PC2所占权重最大,说明PC2所代表的正丁醇在其所含醇类物质中起到主要作用。
高级醇含量不合理是影响酒体醉酒程度的常见原因之一,高级醇含量过高,会抑制神经递质的表达,饮酒者次日醒来会出现头晕、头痛症状。结合旷场实验和小鼠血浆乙醇、乙醛研究结果表明,酒样B、C和H能够引起小鼠饮后较为强烈的不适感。由高级醇含量发现,而酒样C中的异丁醇、活性戊醇、异戊醇虽然在其所含醇类物质中起到主要作用,但含量较低,说明造成饮后不适的关键物质不是高级醇;酒样H中异戊醇含量最高,酒样B中正丙醇含量占所有酒样中最高,由此推断异戊醇和正丙醇含量过高对浓香型白酒醉酒程度有一定影响。
2.4 酒体成分对乙醛脱氢酶活性影响
以乙醛脱氢酶活力(x)为横坐标,吸光度值(y)为纵坐标,绘制乙醛脱氢酶标准曲线,得到乙醛脱氢酶标准曲线回归方程y=0.458 7x+0.057 7,相关系数R2=0.998 9,吸光度值随着酶浓度的升高而升高,确定乙醛脱氢酶浓度为0.9 U/mL合适。将52%vol食用酒精+300 mg/L乙醛中分别加入不同浓度的异戊醇、正丙醇,分别考察其对乙醛脱氢酶酶活的影响,结果分别见图5。
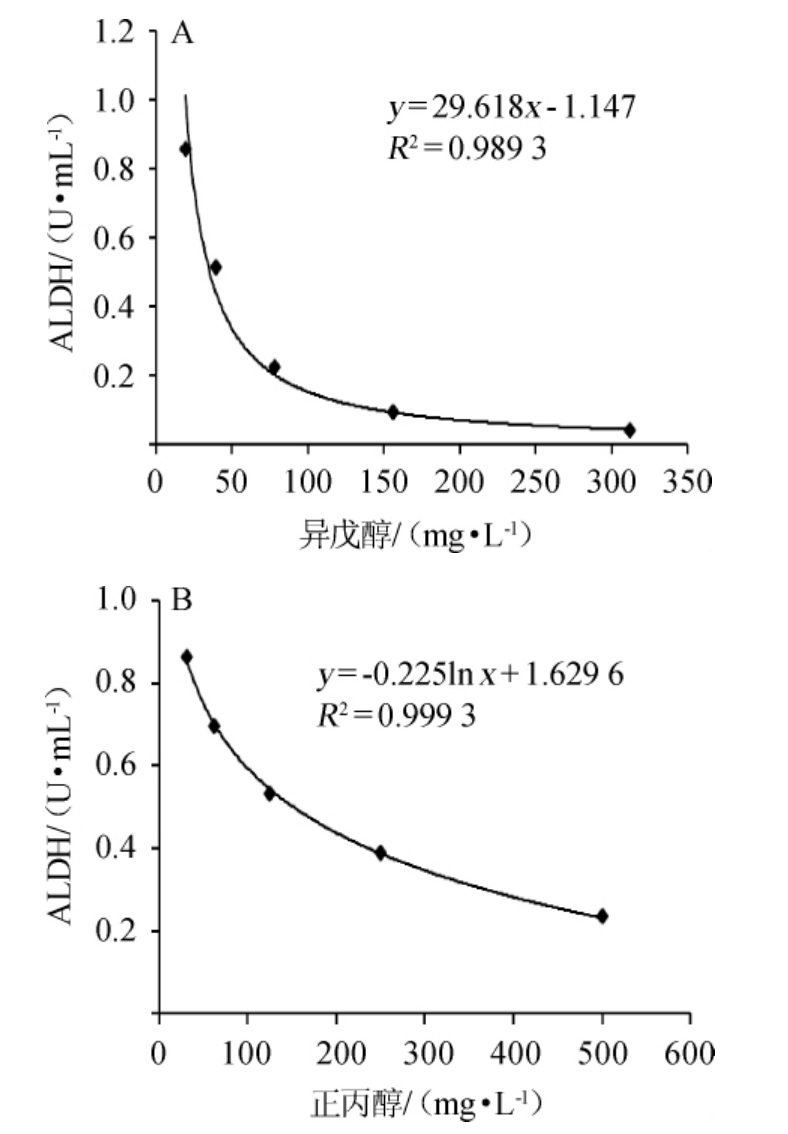
图5 不同浓度异戊醇(A)、正丙醇(B)对乙醛脱氢酶酶活的影响
Fig.5 Effects of different concentration of isoamyl alcohol (A) and n-propanol (B) on acetaldehyde dehydrogenase activity
由图5可知,异戊醇质量浓度为20~310 mg/L范围时,乙醛脱氢酶活力随着异戊醇浓度的升高而降低。正丙醇质量浓度在30~500 mg/L范围时,随着正丙醇质量浓度的升高,乙醛脱氢酶活力降低。
3 结论
通过对八款市售浓香型白酒产品醉酒程度进行研究,结果表明,异戊醇和正丙醇含量过高对浓香型白酒醉酒程度有一定影响。由体外酶学实验得到验证,在一定浓度范围内,随着异戊醇和正丙醇含量的增加,乙醛脱氢酶活性降低。由此推断,异戊醇、正丙醇含量过高会降低乙醛脱氢酶活力,使得乙醛在体内累积,从而影响浓香型白酒醉酒程度但是饮酒后,这些微量物质成分在人体内的代谢是一个非常复杂的过程,体外实验只是一个初步的筛选,还需体内或细胞实验加以验证。在理性饮酒的基础上,对中国白酒的不断探索和研究,为白酒产品品质提升提供科学支持,对于白酒行业的持续发展能力具有重大意义。
[1]张治刚,王永亮.白酒健康与健康白酒综述[J].中国酿造,2017,36(5):13-16.
[2] YI X,LONG L,YANG C,et al.Maotai ameliorates diethylnitrosamineinitiated hepatocellular carcinoma formation in mice[J].Plos One,2014,9(4):e93599.
[3]刘银,周玲旭,杨官荣,等.白酒对大鼠血脂及脂代谢关键酶影响的研究[J].现代预防医学,2017,44(22):4151-4155.
[4]吴寿岭,张倩,戚长春,等.饮酒对男性糖尿病人群心脑血管事件的影响[J].中华高血压杂志,2011,19(11):1065-1069.
[5]韦亚林,马依彤.饮酒与心力衰竭研究进展[J].心血管康复医学杂志,2010,19(6):651-653.
[6]WEINTRAUB W S.Alcohol consumption,diabetes,and coronary disease[J].Circulation,2000,102(5):489-490.
[7]石亚林,范文来,徐岩.白酒抗氧化性的初步研究[J].食品工业科技,2015,36(2):95-97.
[8]刘银,周玲旭,官荣,等.白酒对大鼠血脂及脂代谢关键酶影响的研究[J].现代预防医学,2017,44(22):4151-4155.
[9]岳元媛,张文学,向文良,等.中国白酒的功能性及组成成分[J].酿酒科技,2004(5):53-55.
[10]霍嘉颖,黄明泉,孙宝国,等.中国白酒中功能因子研究进展[J].酿酒科技,2017(9):17-23.
[11]张秋,范光森,李秀婷.我国白酒安全现状浅析[J].中国酿造,2016,35(11):15-20.
[12]产锦,方尚玲,蒋威,等.降低小曲酒中杂醇油含量的研究进展[J].酿酒,2012,39(6):32-35.
[13]高仕偲,陈朝银,赵声兰.解酒酵素的研究与开发[J].药物生物技术,2017(1):92-94.
[14]韩桂玲,杨海英.酒精的代谢与饮酒对人体的影响[J].山西医药杂志,2012,41(22):1150-1151.
[15]阎道博,哈利达·夏尔甫哈孜,冯涓,等.酒精及代谢性因素对慢性乙型肝炎患者肝纤维化的作用[J].世界华人消化杂志,2013(8):694-699.
[16]赵丽娟.酒精代谢相关基因多态性与酒依赖综合征的关联性研究[D].昆明:昆明医科大学,2013.
[17]张幼芳.乙醇脱氢酶在酒精代谢中的作用[J].中国法医学杂志,2013,28(5):391-393.
[18]魏伟.药理实验方法学[M].北京:人民卫生出版社,2010:182-197.
[19]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019(14):191-195.
[20]皇甫洁,王德良,刘蓉,等.一种评价酒类饮后兴奋程度的方法:中国,CN107908924A[P].2018-04-13.
[21]王维刚.旷场实验在小鼠行为分析中的应用[J].中国细胞生物学学报,2016,33(11):1191-1196.