微生物胞外多糖(exopolysaccharide,EPS)是微生物在生长代谢过程中产生并分泌到细胞壁外的天然大分子物质,具有重要的生物活性功能,广泛应用于食品和医药等领域[1-2]。研究表明,微生物EPS可作为食品稳定剂和增稠剂,增加食品黏度防止乳清沉淀[3],可作为益生元添加到保健食品中,调节肠道菌群平衡[4-5],可作为添加剂添加到药品中,达到提高机体免疫力、降低胆固醇、抗肿瘤和抗氧化的作用[6-7]。目前用于生产EPS的微生物主要为乳酸菌中的嗜热链球菌(Streptococcus thermophilus)[8-9]、植物乳杆菌(Lactobacillus plantarum)[10-11]、肠膜明串珠菌(Leuconostoc mesenteroides)[12]和魏斯氏菌属(Weissella sp.)[13-14]等。葡糖杆菌属(Gluconobacter sp.)作为一类具有产EPS能力的微生物,近些年来也逐渐受到人们的关注,但受其产量的制约,很难应用到大规模的工业化生产中。因此,对其产EPS条件的优化成为研究的热点[15-16]。
利用微生物发酵生产EPS,需要多种营养成分和环境因素共同作用,各种因素间的相互作用错综复杂,具有高度的非线性[17-18]。因此,在微生物发酵产EPS过程中,优化培养基成分和发酵条件对发酵水平的提高起着举足轻重的作用,而在寻求最佳发酵培养基和发酵条件的过程中,试验设计及统计优化发挥着重要作用[19]。目前针对培养基和发酵条件的优化主要采用单因素试验、正交试验设计和响应面法(response surface methodology,RSM)优化等方法[20]。RSM主要用于研究反应混合物中各组分所占比例与其产物生物学活性和含量之间的关系,确定最优试验条件[21],已经成为优化加工条件、降低开发成本和提高产品质量的一种有效方法,同时也成为一种快速优化培养基和发酵条件的方法,广泛地应用于生物、食品和化学等领域[22]。
本研究以分离自自然发酵草莓汁中的弗氏葡糖杆菌(Gluconobacter frateurii)PFY-8为试验菌株,以EPS含量为响应值,采用单因素试验和RSM方法优化培养基组成和培养条件,旨在进一步提高EPS的产量,为进一步利用G.frateurii PFY-8大量生产EPS提供依据,同时也为其EPS分离纯化、结构分析和功能研究提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株弗氏葡糖杆菌(Gluconobacter frateurii)PFY-8:分离自自然发酵的草莓汁中,甘油管保存于-80 ℃冰箱备用。
1.1.2 化学试剂
葡萄糖、蔗糖、半乳糖、木糖、D-阿拉伯糖、醋酸钠(CH3COONa)、硫酸锰(MnSO4)、硫酸钾(K2HPO4)、七水硫酸镁(MgSO4·7H2O)、柠檬酸铵、吐温-80、苯酚、硫酸、三氯乙酸(均为分析纯):天津市江天化工技术有限公司;牛肉浸膏、蛋白胨、酵母提取物(均为生化试剂):北京奥博星生物技术有限责任公司。
1.1.3 培养基
MRS培养基:葡萄糖20 g/L,牛肉浸粉10 g/L,酵母提取物5 g/L,蛋白胨10 g/L,CH3COONa 5 g/L,K2HPO4 2 g/L,MnSO40.25g/L,MgSO4·7H2O0.58g/L,柠檬酸铵2g/L,吐温-80 1 mL,蒸馏水1 L。121 ℃灭菌15 min。
1.2 仪器与设备
YXQ-LS-50G立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;BSC-1100-LⅡ-A2生物安全柜:北京东联哈尔仪器制造有限公司;HZQ-211C落地振荡器、DHP-9162电热恒温培养箱:上海一恒科学仪器有限公司;AL204电子天平、FE28pH计:梅特勒-托利多集团;22331Hamburg高速离心机、5804R台式高速大容量冷冻离心机:德国艾本德公司;V-5000可见分光光度计:上海元析仪器有限公司。
1.3 试验方法
1.3.1 菌株活化
取甘油保藏的G.frateurii PFY-8菌株20 μL接种于30 mL MRS培养基中,30 ℃、120 r/min培养48 h,再按2%(V/V)的接种量接种于MRS培养基,30 ℃、120 r/min培养24 h,活化3代后,用于后续试验。
1.3.2 EPS的提取
多糖的提取参照DU R P等[12]的方法。将活化后的G.frateurii PFY-8菌株以2%(V/V)接种量接种到MRS培养基中,30 ℃、120 r/min振荡培养48 h。4 ℃、11 000 r/min离心20 min去除菌体。加入上清液3倍体积分数95%的乙醇,4 ℃静置24 h,按上述条件离心收集沉淀,用适量去离子水溶解多糖沉淀,加入等体积的10%三氯乙酸,充分搅拌,4 ℃静置24h后离心。上清液中加入3倍体积分数95%的乙醇,4℃静置24 h,按上述条件离心,多糖沉淀溶于50 mL去离子水中,装入透析袋,4 ℃透析2 d,每8 h换一次水,获得粗胞外多糖(EPS)。
1.3.3 EPS含量的测定[23-24]
通过苯酚-硫酸法测定EPS的含量,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到葡萄糖标准曲线回归方程为:y=9.855x+0.009,相关系数R2=0.999。根据标准曲线回归方程计算菌株产EPS的含量。
1.3.4 培养基优化单因素试验
分别在MRS培养基中添加蔗糖、半乳糖、木糖、D-阿拉伯糖(20 g/L),考察不同碳源对EPS产量的影响;选取最有利于菌株产EPS的碳源,分别考察添加量为20 g/L、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L、140 g/L碳源时EPS的产生情况;向优化后的培养基中,分别加入不同添加量牛肉浸粉(0、5 g/L、10 g/L、15 g/L、20 g/L)、酵母提取物(0、2 g/L、4 g/L、6 g/L、8g/L、10 g/L)和蛋白胨(0、5 g/L、10 g/L、15 g/L、20 g/L),考察不同添加量有机氮源对EPS产量的影响;向优化后的培养基中,分别加入添加量为0、1.0g/L、2.0g/L、3.0g/L、4.0g/L、5.0 g/L的柠檬酸铵,考察不同添加量柠檬酸铵对EPS产量的影响。
1.3.5 培养条件优化单因素试验
分别选择培养温度(20 ℃、25 ℃、30 ℃、35 ℃)、转速(0、60 r/min、120 r/min、180 r/min、240 r/min)、接种量(1%、3%、5%、7%、9%)、培养时间(24 h、48 h、72 h、96 h、120 h)、初始pH值水平(3.5、4.5、5.5、6.5、7.5)条件下测定菌株产EPS的含量,确定其最佳培养条件。
1.3.6 Plackett-Burman(PB)试验设计
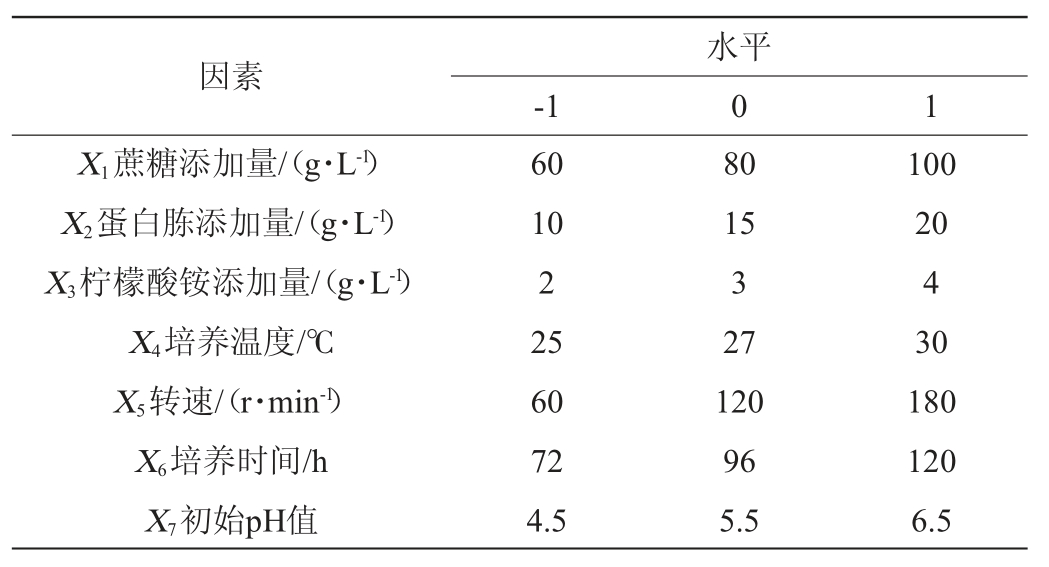
根据单因素试验结果,选择影响EPS产量的7个因素(蔗糖添加量、蛋白胨添加量、柠檬酸铵添加量、培养温度、转速、培养时间、初始pH值),以EPS产量(Y)为响应值,将每个因素分为高(+1)、低(-1)2个水平,共进行15组试验。PB试验设计因素与水平见表1。
表1 PB试验设计因素与水平
Table 1 Factors and levels of PB experiments design
1.3.7 响应面试验设计
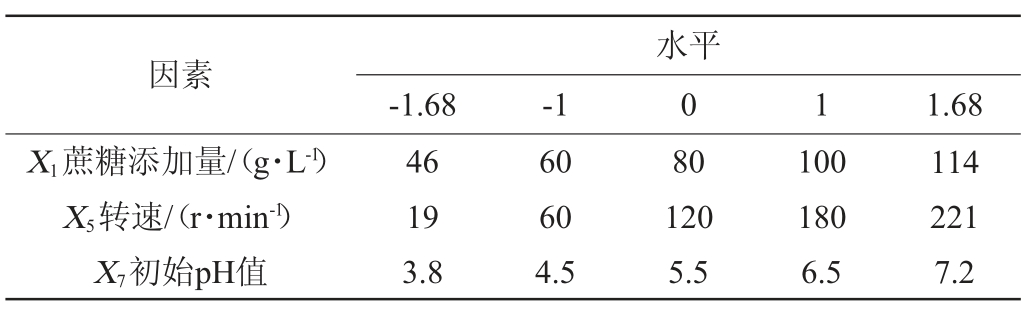
根据PB试验结果,以EPS产量(Y)为响应值,对影响因素蔗糖添加量(X1)、转速(X5)、初始pH值(X7),进行中心组合试验设计(central composite design,CCD),得到最优方案。CCD试验设计因素与水平见表2。
表2 中心组合试验设计因素与水平
Table 2 Factors and levels of central composite experiments design
1.3.8 数据统计分析
响应面试验设计使用Design Expert 8.0.6;统计分析使用SPSS 19.0;绘图使用Excel 2016。
2 结果与分析
2.1 培养基成分对菌株产EPS的影响
2.1.1 碳源种类对EPS产量的影响
EPS产量不仅受菌体自身遗传因素的影响,而且培养基组成(碳源、氮源)和培养条件也会对菌株EPS产量造成很大影响[25]。因此,可通过优化培养基成分来提高菌株产EPS的能力。由图1可知,G.frateuriiPFY-8可利用多种碳源合成EPS,其中蔗糖作为碳源时,EPS产量最高,为(12.90±0.41)g/L,其次是半乳糖(9.42±0.56)g/L、木糖(7.78±0.43)g/L、D-阿拉伯糖(5.92±0.43)g/L。因此,选择最佳碳源为蔗糖。
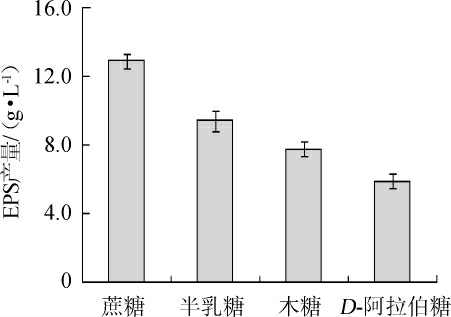
图1 不同碳源对菌株PFY-8胞外多糖产量的影响
Fig.1 Effect of different carbon sources on exopolysaccharide production of strain PFY-8
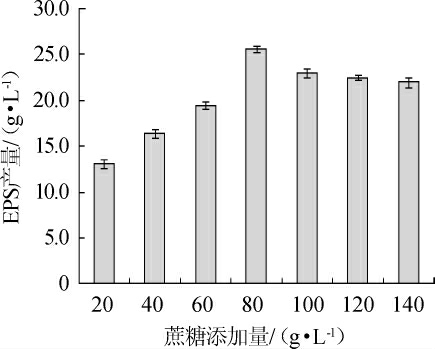
图2 蔗糖添加量对菌株PFY-8胞外多糖产量的影响
Fig.2 Effect of sucrose addition on exopolysaccharide production of strain PFY-8
2.1.2 蔗糖添加量对EPS产量的影响蔗糖添加量对EPS产量的影响见图2。由图2可知,随着蔗糖添加量的增加,EPS产量呈现先增加后减少的趋势,在蔗糖添加量为80 g/L时,G.frateurii PFY-8的EPS产量最高,为(25.60±0.34)g/L,是蔗糖添加量为20 g/L的1.95倍。说明在MRS培养基中加入一定添加量的蔗糖,可以大幅度提高EPS的产量。因此,选择最佳蔗糖添加量为80 g/L。
2.1.3 有机氮源添加量对EPS产量的影响
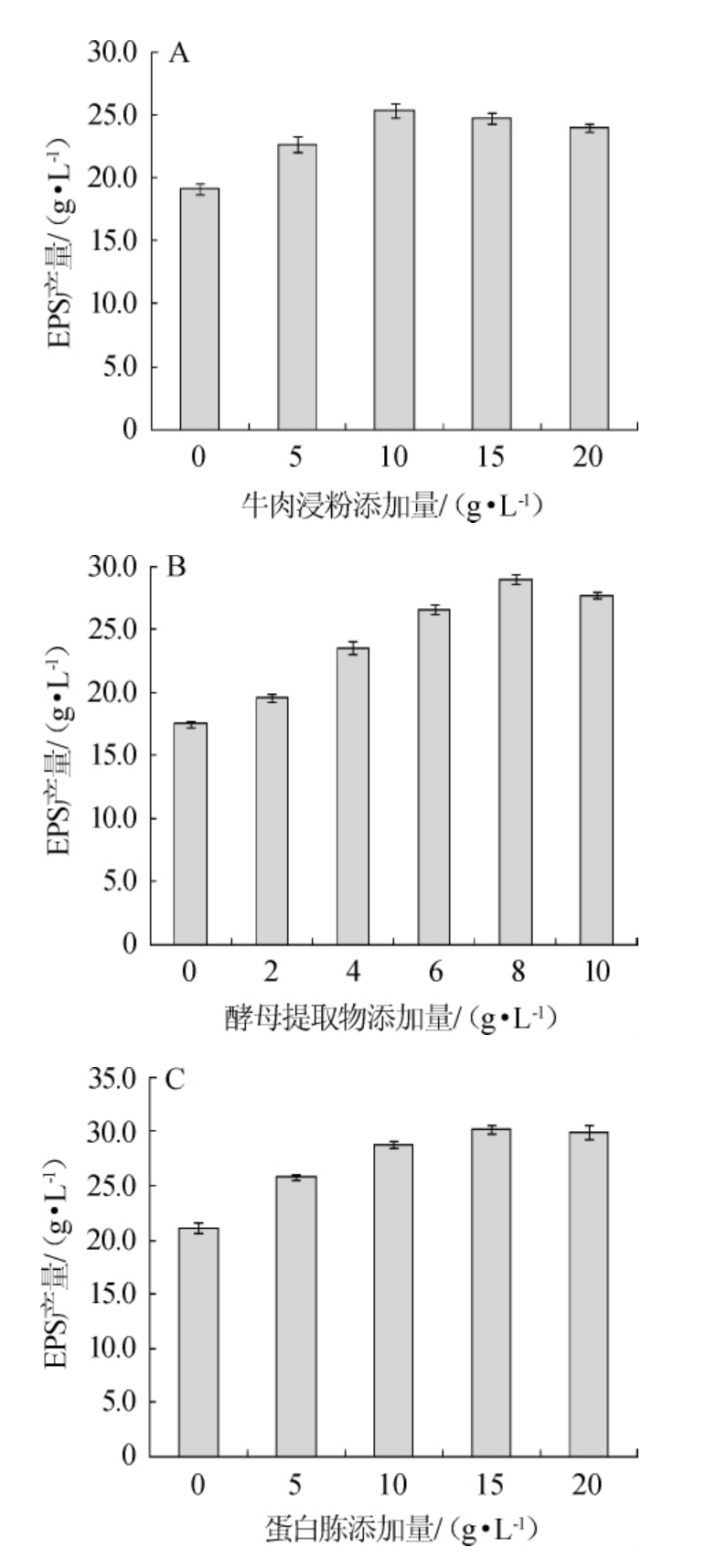
图3 牛肉浸粉(A)、酵母提取物(B)及蛋白胨(C)添加量对菌株PFY-8胞外多糖产量的影响
Fig.3 Effect of beef extract (A),yeast extract (B) and peptone (C)addition on exopolysaccharide production of strain PFY-8
由图3可知,随着氮源添加量的增加,EPS的产量均呈现先增加后减少的趋势,当牛肉浸膏、酵母提取物、蛋白胨添加量分别为10 g/L、8 g/L、15 g/L时,发酵液中EPS产量最高,分别为(25.40±0.56)g/L、(28.94±0.38)g/L、(30.19±0.45)g/L。因此,选择最佳牛肉浸膏、酵母提取物、蛋白胨添加量分别为10 g/L、8 g/L、15 g/L。
2.1.4 柠檬酸铵添加量对EPS产量的影响
柠檬酸铵添加量对EPS产量的影响结果见图4。由图4可知,随着柠檬酸铵添加量的增加,EPS的产量呈现先增加后减少的趋势,当柠檬酸铵添加量为3 g/L时,G.frateurii PFY-8的EPS产量最高,为(31.10±0.32)g/L。因此,选择最佳柠檬酸铵添加量为3 g/L。
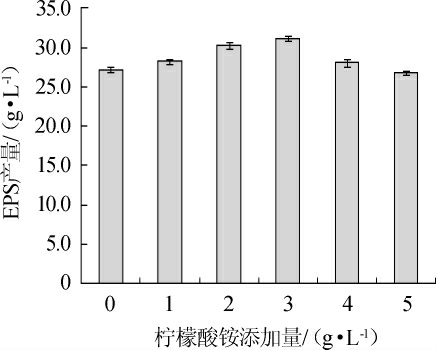
图4 柠檬酸铵添加量对菌株PFY-8胞外多糖产量的影响
Fig.4 Effect of ammonium citrate addition on exopolysaccharide production of strain PFY-8
2.2 发酵条件对菌株产EPS的影响
2.2.1 培养温度对EPS产量的影响
培养温度对菌株G.frateurii PFY-8产EPS影响结果见图5。由图5可知,随着培养温度的升高,EPS的产量呈现先升后降趋势,当培养温度为25 ℃时,EPS产量最高,为(32.06±0.66)g/L。可能是因为过高的培养温度不仅影响菌株生长,还会降低合成EPS酶的活性,从而降低菌株生产EPS的量。因此,选择最佳培养温度为25 ℃。
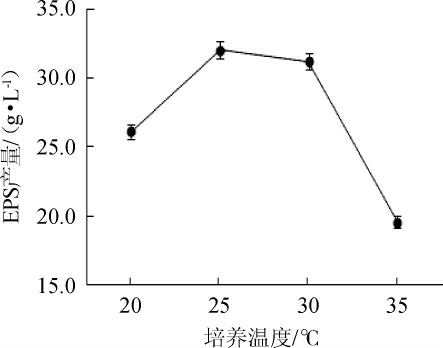
图5 培养温度对菌株PFY-8胞外多糖产量的影响
Fig.5 Effect of culture temperature on exopolysaccharide production of strain PFY-8
2.2.2 转速对EPS产量的影响
转速主要影响培养基的溶氧量,菌株G.frateurii PFY-8为严格好氧菌[26],因此,研究发酵过程中转速对EPS合成的影响极为重要。转速对菌株G.frateurii PFY-8产EPS影响结果见图6。由图6可知,在一定范围内随着转速的增加,EPS含量增加,当摇床转速为120 r/min时,EPS的含量最高,为(31.15±0.47)g/L。当摇床转数较低时,单位时间内培养液的溶氧量较低,菌体的生长速度和EPS生成速率下降,随着摇床转速的不断增加,菌体生长速度和EPS合成速度增加。但当转速超过一定范围时,由于剪切力过大,破坏菌体结构,使菌体过早衰亡,反而降低EPS产量[27]。因此,选择最佳摇床转速为120 r/min。
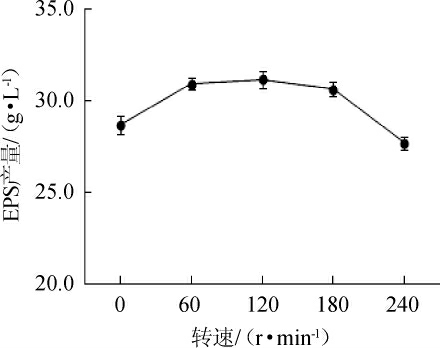
图6 转速对菌株PFY-8胞外多糖产量的影响
Fig.6 Effect of rotation speed on exopolysaccharide production of strain PFY-8
2.2.3 接种量对EPS产量的影响
接种量对菌株G.frateurii PFY-8产EPS的影响结果见图7。由图7可知,随着接种量的增加,菌株产EPS的含量呈现先增加后降低的趋势。当接种量为9%时,EPS产量最低,为(29.04±0.208)g/L,这说明过大的接种量,使培养基内的营养物质加速消耗,导致合成EPS的前体物质减少,反而降低EPS产量[28]。当接种量为5%时,EPS含量最高,为(4.10±0.08)g/L。因此,菌株的最适接种量为5%。
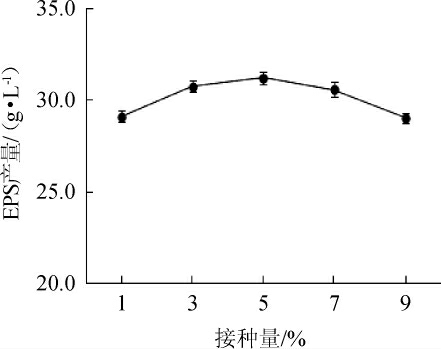
图7 接种量对菌株PFY-8胞外多糖产量的影响
Fig.7 Effect of inoculum on exopolysaccharide production of strain PFY-8
2.2.4 培养时间对EPS产量的影响
培养时间对菌株G.frateurii PFY-8产EPS影响结果见图8。由图8可知,在一定时间内,随着培养时间的延长,EPS含量逐渐增加,培养时间为96 h时,EPS含量最高,可达到(34.33±0.31)g/L。但超过一定范围后,EPS含量开始下降,可能由于培养成分的消耗,阻碍了菌株的正常生长,进而影响了EPS的生成[29]。因此,选择最佳培养时间为96 h。
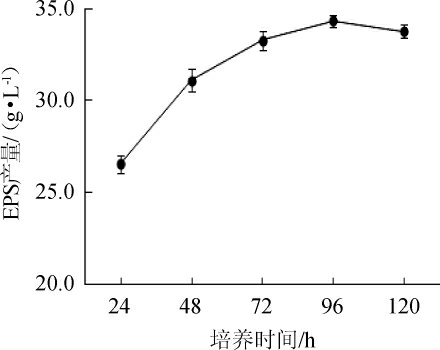
图8 培养时间对菌株PFY-8胞外多糖产量的影响
Fig.8 Effect of culture time on exopolysaccharide production of strain PFY-8
2.2.5 初始pH值对EPS产量的影响
菌株生长和EPS的合成需在最适的pH值条件下进行,pH值可影响菌体细胞膜的功能、细胞的形态和细胞对营养物质的代谢[30]。初始pH值对菌株G.frateurii PFY-8产EPS影响结果见图9。由图9可知,过高和过低的初始pH值均不利于菌株G.frateurii PFY-8合成EPS,当初始pH值为5.5时,EPS产量最高,为(36.75±0.47)g/L,说明偏酸性环境有利于菌株EPS的积累。因此,选择最佳初始pH值为5.5。
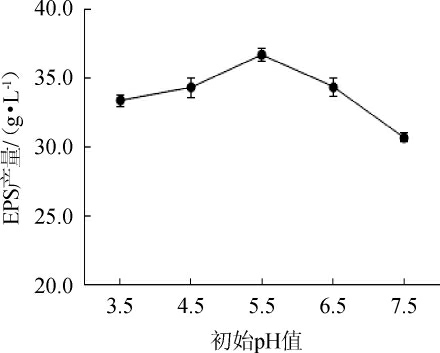
图9 初始pH值对菌株PFY-8胞外多糖产量的影响
Fig.9 Effect of initial pH value on exopolysaccharide production of strain PFY-8
2.3 PB试验分析
在单因素试验基础上,筛选出对EPS影响较为显著的因素,进行PB试验。PB试验设计及结果见表3,方差分析结果见表4。
由表4可知,模型F值为23.48,P值为0.004 3<0.01,说明试验模型具有显著性。相关系数R2=0.976 2,说明存在97.62%的试验数据可用该模型解释,调整相关系数R2=0.934 7,二者均接近1,说明预测值与试验值之间相关度高,可以用该模型模拟菌株EPS的发酵过程。信噪比=16.198(>4),证明该模型可以很好的拟合试验数据。各变量对EPS影响显著程度依次为X1>X7>X5>X4>X2>X6>X3,即蔗糖添加量、转速和初始pH值对菌株产EPS影响极显著(P<0.01)。因此,进一步选择蔗糖添加量(X1)、转速(X5)和初始pH值(X7)进行响应面试验。
表3 PB试验设计与结果
Table 3 Design and results of PB experiments
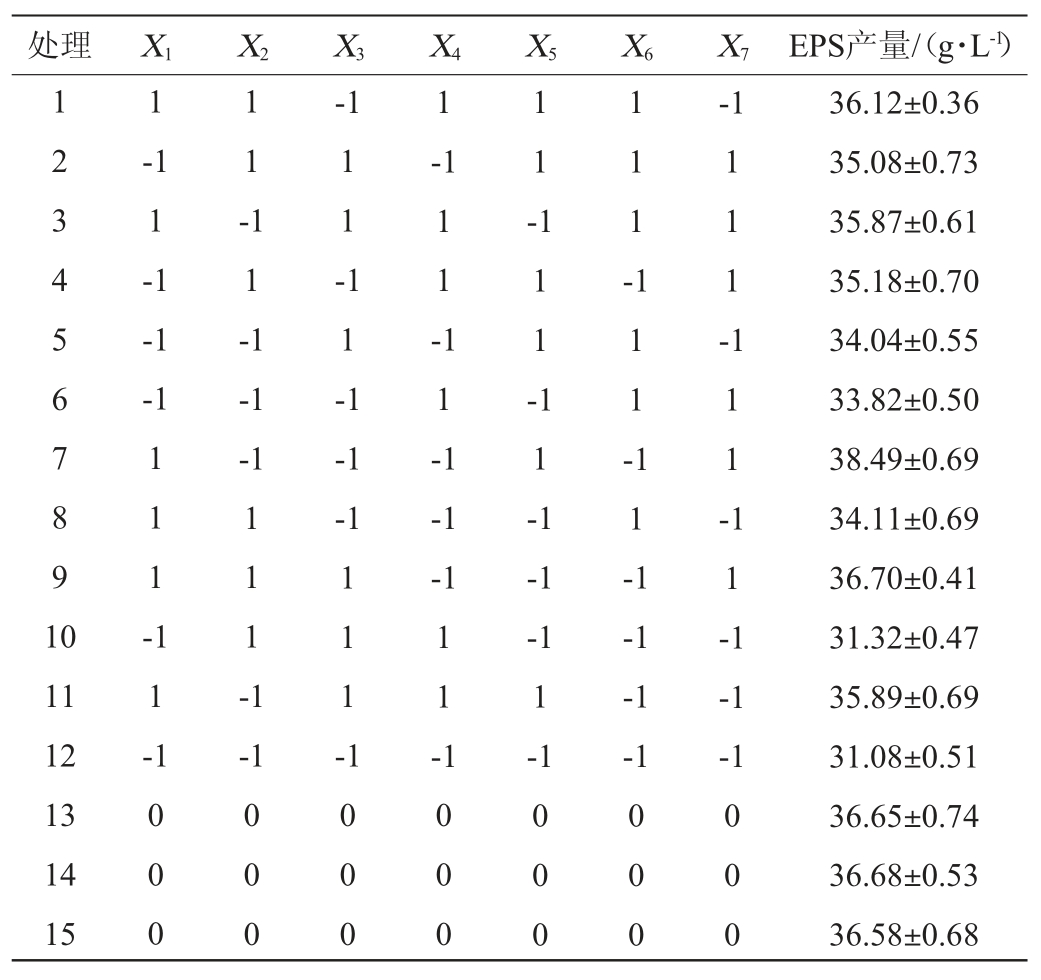
表4 PB试验结果方差分析
Table 4 Variance analysis of PB experiments results
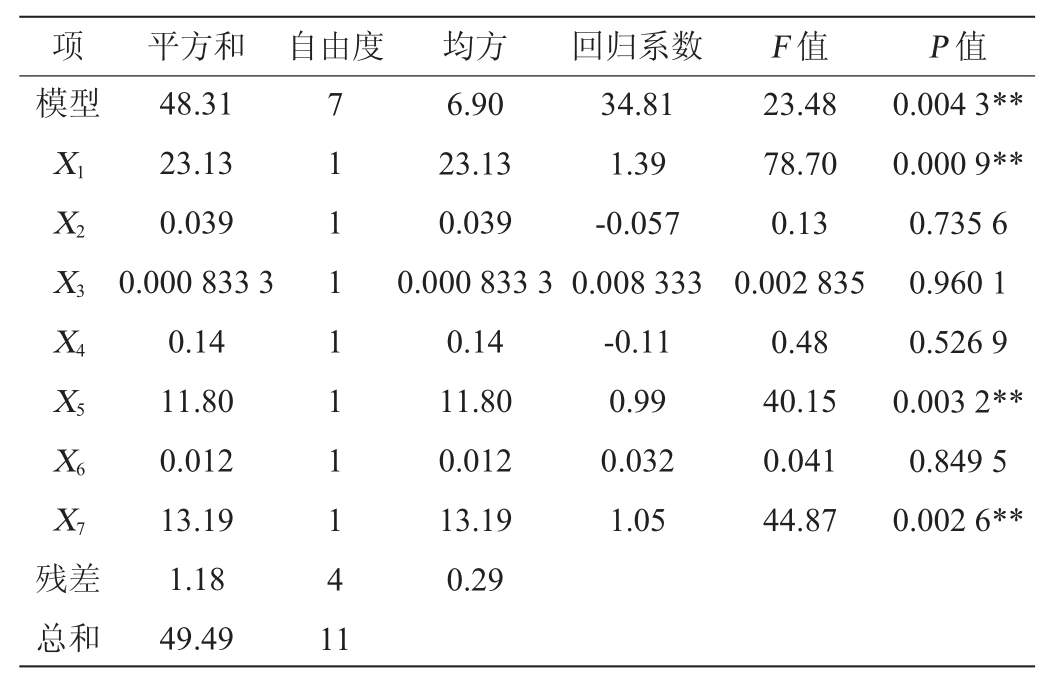
注:“**”表示对结果影响极显著(P<0.01)。
2.4 响应面试验分析
在PB试验基础上,选择蔗糖添加量(X1)、转速(X5)和初始pH值(X7)为影响因子,EPS产量(Y)为响应值,响应面试验结果见表5,方差分析结果见表6。
由表6可知,回归模型的F值为2 632.15,P<0.000 1,决定系数R2=0.999 6,调整决定系数R2=0.999 2,信噪比=138.977(>4),变异系数(coefficient of variation,CV)=0.18%,说明试验精确度和准确度高。模型失拟项P=0.164 8>0.05,说明所选模型拟合性较好,无其他显著性影响因素。因此,可以判断CCD是可靠的,该模型可以较好的应用于G.frateurii PFY-8合成EPS的理论预测。一次项(X1、X5、X7)和二次项(X12、X52、X72)对菌株产EPS有极显著影响(P<0.01),交互项(X1X5、X5X7)对菌株产EPS有显著影响(P<0.05),交互项(X1X7)对菌株产EPS无显著影响(P>0.05)。
表5 中心组合试验设计与结果
Table 5 Design and results of central composite experiments
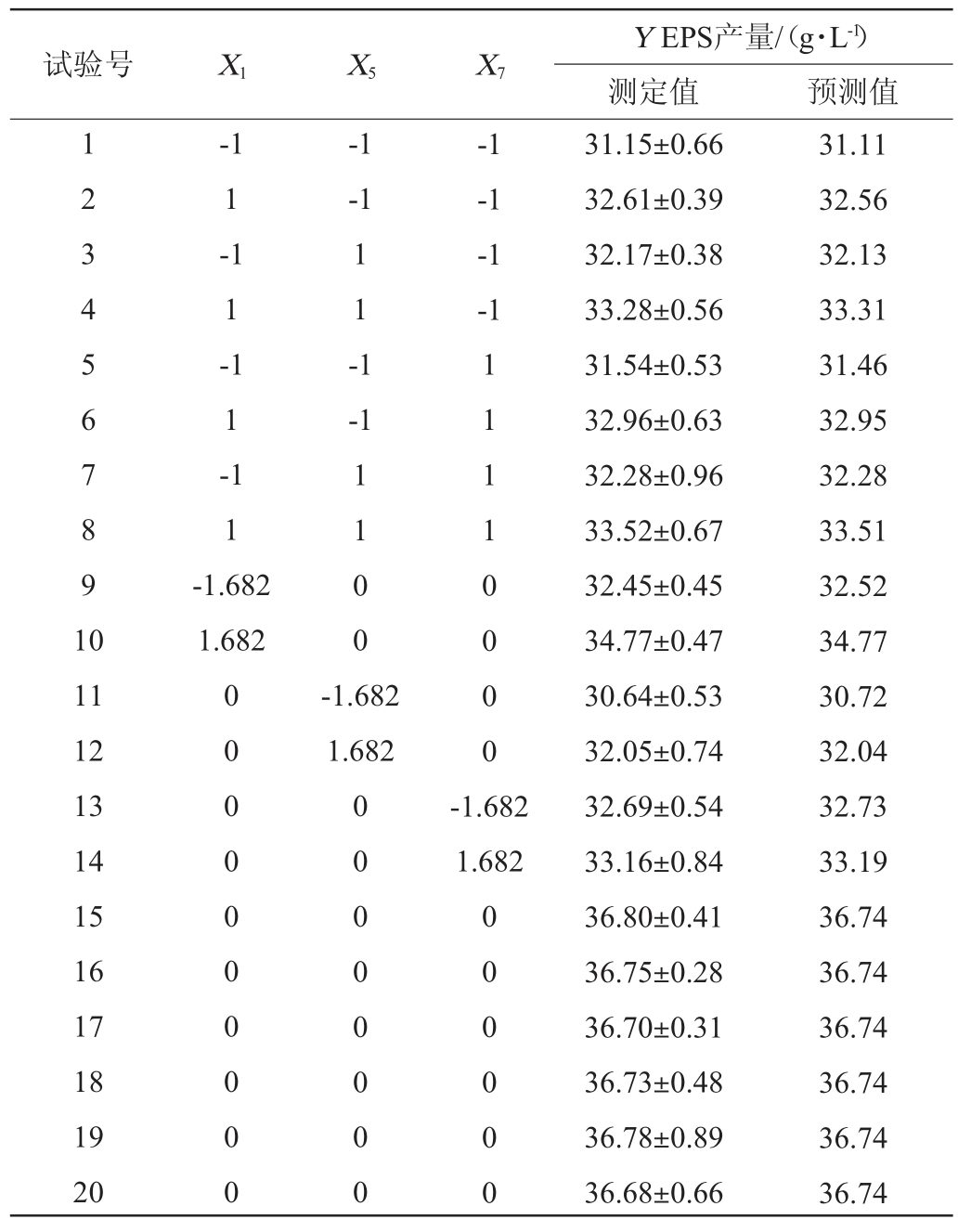
表6 回归模型方差分析
Table 6 Variance analysis of regression model
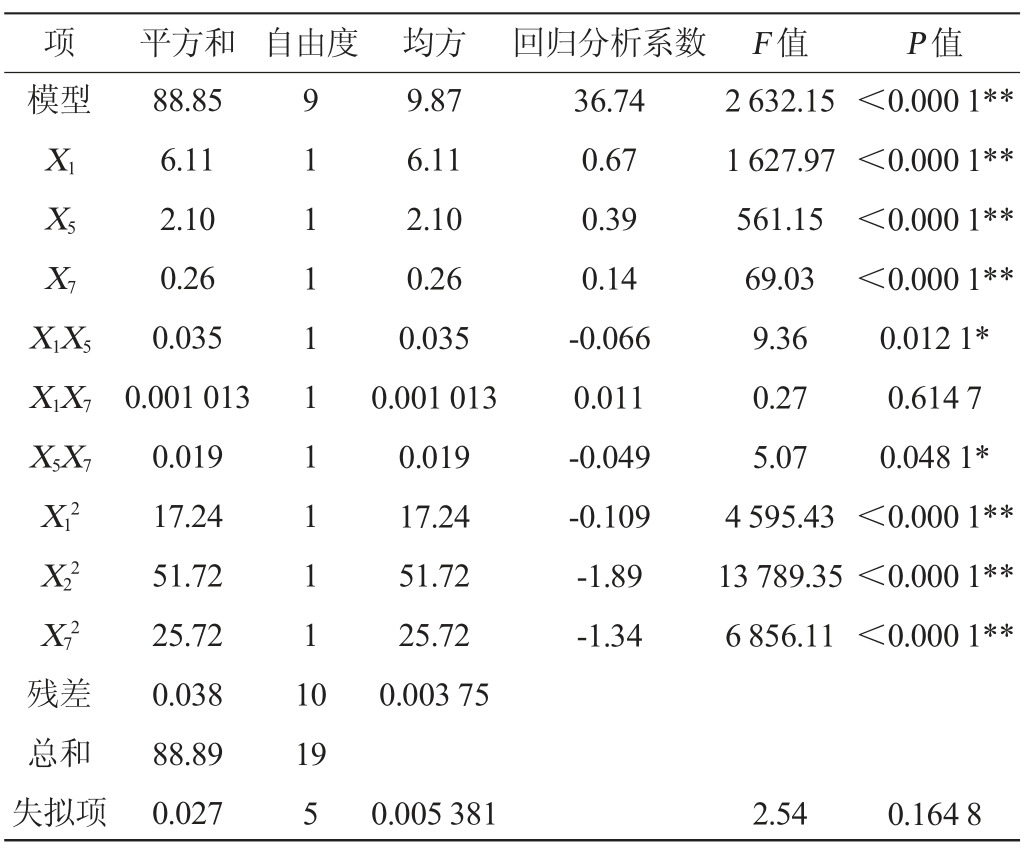
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
根据响应面试验结果,得到模型拟合方程如下:
各因素之间的交互作用对G.frateurii PFY-8产EPS影响的响应面图见图10。
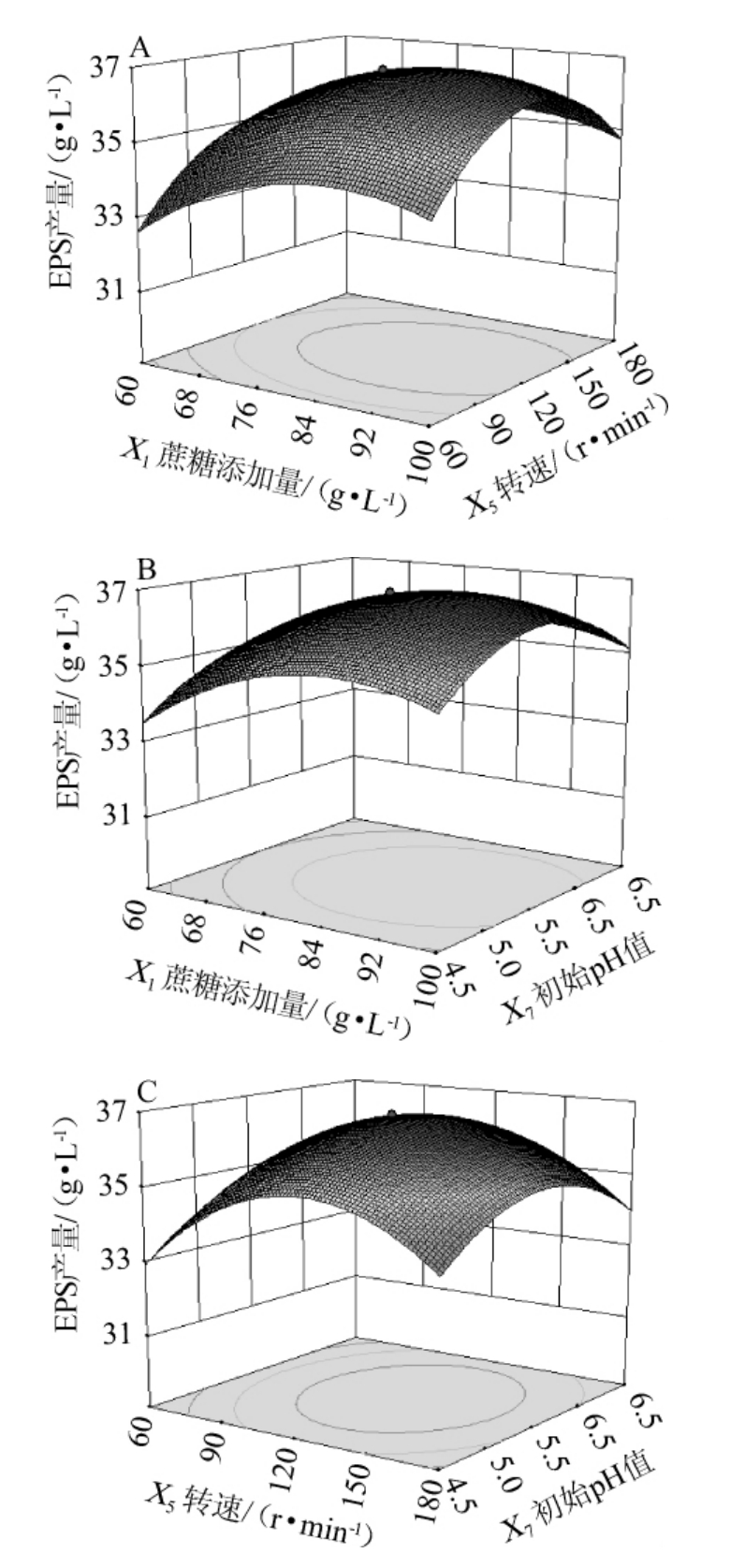
图10 蔗糖添加量、转速和初始pH值对菌株PFY-8产胞外多糖影响的响应面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between sucrose addition,rotation speed and initial pH value on exopolysaccharide production of strain PFY-8
由图10A可知,当初始pH值为5.5时,蔗糖添加量和转速的交互作用对EPS的合成影响显著。由图10B可知,当转速为120 r/min时,蔗糖添加量和初始pH值的交互作用对EPS的合成影响不显著。由图10C可知,当蔗糖添加量为80 g/L时,转速和初始pH值的交互作用对EPS的合成影响显著。蔗糖添加量、转速和初始pH值三者之间有较明显的交互作用,其交互作用强弱的顺序为X1X5>X5X7>X1X7。
2.5 验证试验
通过Design Expert 8.0.6软件求解方程,得出预测的最优条件为蔗糖添加量86.11 g/L、转速125.92 r/min和初始pH值5.55,在该条件下EPS产量预测值为36.86 g/L。为后续试验方便,将拟合最优条件修正为蔗糖添加量86g/L、转速130r/min、初始pH值5.6。为检测拟合结果的可信度,采用修正后的条件进行验证试验,测得G.frateurii PFY-8的EPS产量实际值为(37.07±0.38)g/L,与预测值无显著差异(P>0.05),是优化前的1.55倍。
3 结论
为提高菌株G.frateurii PFY-8的EPS产量,本研究联合采用单因素试验和RSM法,建立菌株G.frateurii PFY-8发酵EPS的多项式模型,确定其最佳培养基为葡萄糖20 g/L,蔗糖86 g/L,牛肉浸膏10 g/L,酵母提取物8 g/L,蛋白胨15 g/L,CH3COONa 5 g/L,K2HPO4 2 g/L,MnSO4 0.25 g/L,柠檬酸铵3 g/L,MgSO4·7H2O 0.58 g/L,吐温-80 1 mL/L。最佳培养条件为培养温度25 ℃、摇床转速130 r/min、接种量5%、培养时间96 h、初始pH值5.6。在此优化条件下,G.frateurii PFY-8的EPS产量为(37.07±0.38)g/L,是优化前的1.55倍。本研究为进一步利用G.frateurii PFY-8大量生产EPS提供理论依据,同时也为其EPS分离纯化、结构分析和功能研究提供理论支持。
[1]韩勇.微生物胞外多糖提取纯化研究进展[J].黑龙江农业科学,2019(5):159-161.
[2]ROSCA I,PETROVICI A R,PEPTANARIU D,et al.Biosynthesis of dextran by Weissella confusa and its in vitro functional characteristics[J].Int J Biol Macromol,2018,107:1765-1772.
[3]崔学敏.益生菌胞外多糖分离与生物学活性研究[D].沈阳:辽宁大学,2016.
[4]邸维,张兰威,易华西,等.乳酸菌胞外多糖结构及其功能多样性的研究进展[J].中国乳品工业,2017,45(5):32-37.
[5]蔡国林,刘逸凡,李晓敏,等.解淀粉芽孢杆菌胞外多糖对乳酸菌生长及代谢的调控作用[J].食品与发酵工业,2019,45(10):16-21.
[6] RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].Int Dairy J,2002,12(2-3):163-171.
[7]张嘉文,刘达,刘党生,等.乳酸菌胞外多糖产生菌的筛选与初步研究[J].中国微生态学杂志,2019,31(9):1027-1033.
[8]DAN T,JIN R,REN W,et al.Characteristics of milk fermented by Streptococcus thermophilus MGA45-4 and the profiles of associated volatile compounds during fermentation and storage[J].Molecules,2018,23(4):878.
[9]XIONG Z Q,KONG L H,LAI P F,et al.Genomic and phenotypic analyses of exopolysaccharide biosynthesis in Streptococcus thermophilus S-3[J].J Dairy Sci,2019,102(6):4925-4934.
[10]张文平,赵英杰,罗晟,等.高产胞外多糖植物乳杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
[11]梁增澜,李慧,张睿,等.植物乳杆菌KF5 胞外多糖合成条件的优化研究[J].食品研究与开发,2019,40(3):14-18.
[12]DU R P,XING H W,ZHOU Z J,et al.Isolation,characterisation and fermentation optimisation of glucansucrase-producing Leuconostoc mesenteroides DRP105 from sauerkraut with improved preservation stability[J].Int J Food Sci Tech,2017,52(12):2522-2530.
[13]姜静,杜仁鹏,郭尚旭,等.融合魏斯氏菌胞外多糖的分离纯化及其生化特性[J].食品科学,2020,41(1):9-15.
[14]陈媛,贾斯斯,胡露,等.食窦魏斯氏菌SJ-02 产胞外多糖发酵工艺优化[J].食品与机械,2018,34(7):194-199.
[15] JAKOB F,STEGER S,VOGEL R F.Influence of novel fructans produced by selected acetic acid bacteria on the volume and texture of wheat breads[J].Eur Food Res Technol,2012,234(3):493-499.
[16] HERMANN H,PETERMEIER H,VOGEL R F.Development of novel sourdoughs with in situ formed exopolysaccharides from acetic acid bacteria[J].Eur Food Res Technol,2015,241(2):185-197.
[17]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,27(1):38-41.
[18] THOMPSON D R.Response surface experimentation[J].J Food Proc Pres,1982,6(3):155-188.
[19]代志凯,张翠,阮征.试验设计和优化在其发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
[20]刘开放,席志文,黄琳娜,等.布拉酵母高密度发酵培养基及发酵工艺优化[J].食品科学,2019,40(8):56-62.
[21]王永菲,王成国.响应面法的理论与应用[J].中央民族大学学报:自然科学版,2005,14(3):236-239.
[22]慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[23]叶广彬,陈源红,王长丽,等.柠檬明串珠菌TD1 产胞外多糖条件的响应面法优化及其抗氧化性研究[J].中国酿造,2018,37(11):70-75.
[24]李晶晶.酵母多糖提取方法的探究及其对体外发酵参数的影响[D].呼和浩特:内蒙古农业大学,2016.
[25]冯芳.产胞外多糖乳酸菌的筛选及其分子特性的研究[D].天津:天津大学,2018.
[26]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:136-138.
[27]王正齐,张薄博,陈磊,等.响应面法优化樟芝胞外多糖的发酵条件[J].食品工业科技,2018,39(11):99-107.
[28]刘刚,梁琪,宋雪梅,张炎.Plackett-Burman 和Box-Behnken 试验优化嗜热链球菌Q4F8 产胞外多糖工艺[J].食品科学,2019,40(20):136-143.
[29]POLAK-BERECKA M,CHOMA A.Physicochemical characterization of exopolysaccharides produced by Lactobacillus rhamnosus on various carbon sources[J].Carbohyd Polym,2015,117:501-509.
[30]李彦岩,张彩,范熠,等.一株解淀粉芽孢杆菌产糖条件的优化[J].食品科学,2013,34(7):185-189.