淀粉酶是一类水解淀粉和糖原的酶类总称,可分为α-淀粉酶、β-淀粉酶、异构淀粉酶等[1-2]。淀粉酶作为一类重要的工业酶,广泛应用于饲料、食品、发酵、医疗等领域[3-5]。在制糖、酿酒行业中,淀粉的糊化、液化、糖化等过程大多是在高温下进行的[6],因此淀粉加工过程中需要耐高温的淀粉酶,否则会耗费大量的冷凝水,提高淀粉加工的成本[7-9]。
自然界中能分泌合成α-淀粉酶的主要微生物有黑曲霉[10]、扣囊复膜孢酵母[11]、芽孢杆菌[12]、古细菌[13]等。目前关于α-淀粉酶的研究主要集中在产α-淀粉酶菌株的分离筛选及选育、产酶发酵条件的优化及酶学特性研究等[11,13]。ROHBAN R等[14]在高盐度的湖泊中分离出可产淀粉酶、蛋白酶等多种酶类的极端微生物;谢建华等[15]从酒厂附近的土壤中分离筛选到一株产淀粉酶的解淀粉芽孢杆菌。本实验从温泉中分离筛选到一株产高温淀粉酶的菌株,对该菌株进行了初步鉴定分析,为该菌在酿酒、制曲等生产中的应用奠定一定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
分离样品:福建省旗山温泉的底泥(40 ℃);
生工SK8255柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、Taq DNA聚合酶、琼脂糖、DNA Marker、正向引物16S-F(5'-CAGAGTTTGATCCTGGCT-3')、反向引物16S-R(5'-AGGAGGTGATCCAGCCG-CA-3')等(均为分析纯):生工生物工程(上海)有限公司;蛋白胨、酵母粉、麦芽糖、可溶性淀粉、乙醇等(均为分析纯):国药集团化学试剂有限公司。
1.1.2 培养基
分离/斜面培养基:蛋白胨10 g/L,氯化钠10 g/L,酵母粉5 g/L,可溶性淀粉2 g/L,琼脂20.0 g/L,pH 7.2;
富集培养基:蛋白胨10 g/L,氯化钠10 g/L,酵母粉5 g/L,可溶性淀粉2 g/L,pH 7.2;
发酵培养基:可溶性淀粉10 g/L,NH4Cl·12H2O 8 g/L,豆粕粉30 g/L,CaCO3 1 g/L,pH 7.0;
LB固体培养基:胰蛋白胨10 g/L,酵母粉5 g/L,MaCl 5 g/L,pH 7.0。
以上培养基均在121 ℃灭菌20 min。
1.2 仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;FA2204B型电子分析天平:上海越平科学仪器有限公司;SPX-150B-Z生化培养箱:上海博迅实业有限公司;722SP分光光度计:上海棱光技术有限公司;TG16-WS高速台式离心机:上海湘仪有限公司;THZ-C台式恒温振荡器:太仓市华美生化仪器厂;SW-CJ-2FD超净工作台:福州伍联医疗器械有限公司;CDZX-50KB立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 α-淀粉酶产生菌的富集培养
取1 g土样接种于富集培养基,40 ℃、150 r/min振荡培养24 h。
1.3.2 α-淀粉酶产生菌的分离与初筛
将上述富集液稀释涂布于分离培养基,40 ℃倒置培养24 h。采用点接法,将单菌落用灭过菌的牙签点接于分离培养基平板,40 ℃倒置培养24 h后,加入碘液,分别测量透明圈直径与菌落直径,并算出二者比值,将比值大的菌落接种于试管斜面。每个菌株做3个重复。
1.3.3 α-淀粉酶产生菌的复筛
将初筛得到的菌株接种于试管斜面,40 ℃活化培养24 h;挑取活化后的菌株1环,接种于液体发酵培养基中,150 r/min振荡培养24 h;将活化后的种子液按3%(V/V)的接种量接种于液体发酵培养基,40 ℃、150 r/min振荡培养48 h,发酵液8 000 r/min离心10 min,测定发酵上清液中α-淀粉酶的活性。每株重复3个平行。
1.3.4 α-淀粉酶产生菌的形态特征及生理生化实验
将试管保存的菌株划线接种于LB固体培养基,40 ℃倒置培养24 h。
参考文献[16-17]对α-淀粉酶的产生菌进行形态观察及生理生化研究。
1.3.5 菌株16S rDNA基因序列的测定与分析
菌株基因组DNA按照试剂盒说明书进行提取。采用细菌通用引物进行PCR扩增,PCR扩增条件为:纯化的PCR产物(10 ng/μL)1 μL、2.5 mmol/L三磷酸脱氧核糖核苷酸(deoxyribonucleotide triphosphate,dNTP)8 μL、Taq酶0.2 μL,引物(3.2 pmol/μL)1 μL,加灭菌的去离子水10 μL。PCR扩增条件为96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,循环25次;60 ℃再延伸10 min,4 ℃保温。
16S rDNA基因序列测序委托上海生工生物工程股份有限公司完成。测序序列与美国国家生物信息中心(national center for biotechnology information,NCBI)网站的已知序列进行blast。采用MAGE4.0软件中的邻接法(neighbor joining,NJ)算法(BootStrap的设定值为1 000)构建系统进化树[18-19],进行菌株系统发育分析。
1.3.6 温度对菌株生长的影响
将菌株接种于试管斜面活化24 h;挑取活化后的菌株1环,接种于液体发酵培养基中,40 ℃、150 r/min振荡培养24 h;将活化后的种子液按3%(V/V)接种量接种于发酵培养基中,在不同温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃)条件下,150 r/min振荡培养24 h,测定发酵液OD600nm值。
1.3.7 酶活力测定方法
发酵液8 000 r/min、4 ℃离心10 min,其上清液即为粗酶液。淀粉酶活力的测定采用3,5二硝基水杨酸(3,5-dinitrosalicylic acid)法[20-22]。
α-淀粉酶酶活单位定义:pH 5.5,温度为60 ℃的条件下,1 mL酶液1 min水解淀粉产生1 μg葡萄糖的酶用量为1个酶活单位(U/mL)。
式中:C为从标准曲线上查的的葡萄糖含量,mg;VT为淀粉酶原液总体积,mL;VS为反应所用的α-淀粉酶原液体积,mL;W为样品的质量,g;t 为反应时间,min。其中VT=25 mL,VS=1 mL,T=5 min,W=0.001 g。
2 结果与分析
2.1 高产α-淀粉酶菌株的分离筛选
2.1.1 高产耐高温α-淀粉酶菌株的分离
通过富集培养、稀释涂布及平板分离等方法,从土壤中分离筛选到10株透明圈直径(D)与菌落直径(d)比值比较大的菌株。结果见表1。
表1 α-淀粉酶产生菌的初筛结果
Table 1 Preliminary screening results of α-amylase-producing strain
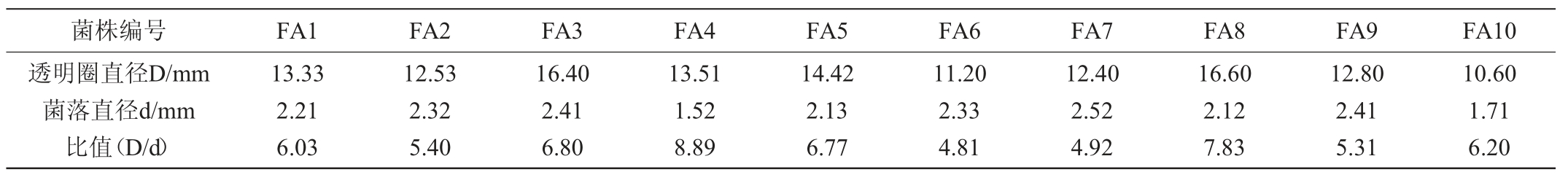
由表1可知,不同菌株产α-淀粉酶活性有一定的差异,根据菌株的D/d值,可以看出所筛选得到的菌株产α-淀粉酶活性的强弱如下:FA4>FA8>FA3>FA5>FA10>FA1>FA2>FA9>FA7>FA6。
2.1.2 高产耐高温α-淀粉酶产生菌的复筛
将初筛得到的10株D/d值较大的菌株进行摇瓶复筛,发酵培养24 h,测定该菌株产α-淀粉酶的酶活力,结果见图1。
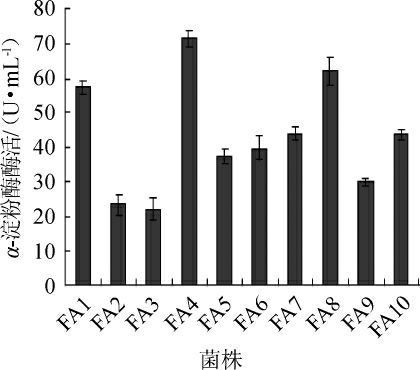
图1 淀粉酶产生菌的复筛结果
Fig.1 Secondary screening results of amylase-producing strain
由图1可知,菌株产淀粉酶活性强弱如下:FA4>FA8>FA1>FA7>FA10>FA6>FA5>FA9>FA2>FA3,与菌株D/d值有一定的差异,其中菌株FA4的淀粉酶活性最强,其酶活可达71.56 U/mL。所以选择菌株FA4进行后续实验。
2.2 菌株FA4的签定
2.2.1 菌株FA4的形态特征及生理生化实验
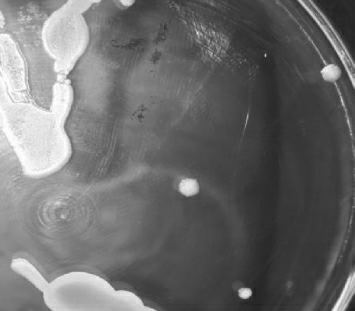
图2 菌株FA4的形态观察结果
Fig.2 Morphological observation results of strain FA4
由图2可知,菌株FA4在LB固体培养基上培养24 h后,菌落呈乳白色,表面较湿润,不透明,隆起,边缘光滑。显微镜下观察该菌体呈杆状,革兰染色为阳性。参照《常见细菌系统鉴定手册》对菌株进行生理生化实验,结果见表2。
表2 菌株FA4与芽孢杆菌的生理特征比较
Table 1 Physiological and morphological characteristics of strain FA4 and Bacillus sp.

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
由表2可知,菌株FA4能利用柠檬酸盐、亚硝酸盐、硝酸盐及丙二酸,能分解过氧化氢,能水解淀粉和酪氨酸,甲基红试验呈阳性,V-P试验呈阳性,吲哚试验和苯丙氨酸脱氨酶试验阴性。
2.2.2 菌株FA4的16S rDNA序列分析鉴定
将提取到的菌株基因组DNA为模板进行PCR扩增产物大小约为1 375 bp的16S rDNA基因。将所得到的16S rDNA基因序列进行测序,测序后,与NBCI网站上的数据库进行序列同源性比对,结果显示该菌株序列与Bacillus thuringiensis的多菌株具有99%以上的同源性。抽取若干条同源性较高的序列进行系统进化树的构建,结果见图3。

图3 菌株FA4的序列分析
Fig.3 Sequence analysis of the strain FA4
由图3可知,菌株FA4的基因序列与登录号NR043403.1、MN643161.1的16S rDNA序列的同源性达到99%,表明菌株FA4与Bacillus thuringiensis亲缘性最近。再结合菌株的形态及生理生化特征,将该菌命名为苏云金芽孢杆菌FA4(Bacillus thuringiensis)。
2.3 培养温度对菌株FA4生长的影响
不同的培养温度对菌株FA4生长的影响结果见图4。由图4可知,菌株的OD600nm值随着培养温度的升高,逐渐升高,当培养温度达到40 ℃时,OD600nm值达到最大值,表明40 ℃是该菌株的最适生长温度;之后,随着培养温度的升高,生物量反而逐渐减少,当培养温度为55 ℃时,菌体仍有一定的生长,表明该菌株具有较强的耐热性。
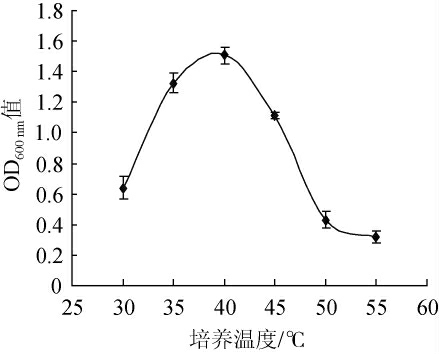
图4 培养温度对菌株FA4生长的影响
Fig.4 Effect of temperature on the growth of strain FA4
3 结论
本研究从温泉底泥中分离筛选到一株耐高温的淀粉酶菌株,从菌株形态、生理生化特性及16S rRNA遗传分析,初步鉴定为芽孢杆菌属,将其命名为苏云金芽孢杆菌(Bacillus thuringiensis),该菌株具有具有较强的稳定性,在55 ℃条件下仍能生长。
[1]郑昆,杨红.淀粉酶的研究现状与进展[J].食品安全导刊,2019,42(18):53.
[2]罗春雷,韦宇拓.淀粉酶的分离及应用研究进展[J].广西科学,2018,36(3):248-252.
[3]唐小懿,马杰,陈清华,等.淀粉酶在畜禽饲料中的应用研究进展[J].饲料研究,2017,468(11):4-7.
[4]徐挺亮,唐诗哲,彭晶,等.芽孢杆菌属产α-淀粉酶的研究进展[J].生命科学研究,2019,23(7):65-72.
[5]张余慧,程晓芳,袁丹丹,等.浅谈淀粉酶在动物生产中的应用研究进展[J].广东饲料,2018,213(3):33-35.
[6]DEEPIKA M,TULASI S.Bacterial and archaeal α-amylases:diversity and amelioration of the desirable characteristics for industrial applications[J].Front Microbiol,2016,7:11-29.
[7] FINCAN S A,ENEZ B.Production,purification,and characterization of thermostable α-amylase from thermophilic Geobacillus stearother-mophilus[J].Starch-Starke,2014,66(10):182-189.
[8] PEIXOTO S C,JORGE J A,TERENZI H F,et al. Rhizopus microspores var.rhizopodiformis:a thermotolerant fungus with potential for production of thermostable amylases[J].Int Microbiol,2003,6(4):269-273.
[9]石方方,焦国宝,丁长河,等.耐酸耐高温α-淀粉酶的研究进展[J].中国食品添加剂,2014,125(4):171-176.
[10]SINGH S,GUPTA N,KAUR J,et al.Valorization of S al deoiled cake as media for acidic amylase and invertase coproduction by Aspergillus niger NJ-1:optimization by response surface methodology and application in oligosaccharide synthesis[J].J Food Process Pres,2015,39(6):2548-2561.
[11]孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019,45(21):31-37.
[12]EMTENANI S,ASOODEH A,EMTENANI S.Gene cloning and characterization of a thermostable organic-tolerant α-amylase from Bacillus subtilis DR8806[J].Int J Biol Macromol,2015,72:290-298.
[13]贾冬梅,华晓曼,王玉华,等.耐酸性α-淀粉酶研究进展[J].食品科技,2016,41(10):224-228.
[14]ROHBAN R,AMOOZEGAR M A,VENTOSA A.Screening and isolation of halophilic bacteria producing extracellular hydrolyses from Howz Soltan Lake,Iran[J].J Ind Microbiol Biotechn,2009,36(3):333-340.
[15]谢建华,师永生,杜丽琴,等.一株产酸性-淀粉酶菌株的筛选、纯化及酶学性质[J].应用与环境生物学报,2011,17(1):95-99.
[16]东秀珠,蔡秒英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-380.
[17]中国科学院微生物研究所细菌分类组.一般细菌常用的鉴定方法[M].北京:科学出版社,1978:31-34.
[18]董安国,高琳,赵建邦,等.基于DNA 序列的系统进化树构建[J].西北农林科技大学学报(自然科学版),2008,36(10):221-226.
[19]陈正福,徐丽华,姜成林,等.构建微生物分子分类系统进化树的快速运算法与数据结构[J].微生物学通报,1997,24(1):22-26.
[20]刘贺红,万金泉,马邕文,等.DNS 比色法测定污泥中淀粉酶活性的研究[J].安徽农业科学,2008,36(33):14369-14371.
[21]张继千,吴波,郑冰心,等.海洋菌W11 产中温淀粉酶的酶学特性[J].基因组学与应用生物学,2010,29(1):71-74.
[22]王秀奇,秦淑媛,高天慧,等.基础生物化学试验(第二版)[M].北京:高等教育出版社,2007:205-209.
[23]赵淑琴,杨孝朴.一株α-淀粉菌株的分离、筛选与鉴定及酶学性质研究[J].甘肃农业大学学报,2018,37(2):209-216,224.
[24]张皎皎.一株高产淀粉酶菌株的筛选鉴定及其应用研究[D].重庆:西南大学,2018.