蜂蜜是昆虫蜜蜂从开花植物的花中采得的花蜜在蜂巢中酿制的蜜,其主要成分为单糖(葡萄糖、果糖)(占总糖的85%~95%),还含有丰富的酶、矿质元素、维生素、氨基酸等[1-2],稀释的蜂蜜经酵母菌发酵可制成具有保健作用的蜂蜜酒[3-5]。蜂蜜酒需要较长时间发酵,可能在最终产品中引入令人不快的气味[6-7]。蜂蜜酒的发酵过程若蜜汁的浓度过低,酵母菌会因碳源不足衰老自溶[8],而高浓度的蜜汁有较高的渗透压,要求用于发酵的酵母需适应蜂蜜的抑菌和高渗环境。目前国内售的蜂蜜酒多为蜂蜜与酒勾兑而成,缺乏适用于蜂蜜酒发酵的菌株,筛选合适的菌株成为蜂蜜酒研制的关键问题。通常从高糖环境中筛选耐高糖酵母[9],研究表明原生的蜂蜜中含有耐高渗酵母菌及其他微生物[10-13],但鲜见从蜂蜜中分离菌株发酵蜂蜜酒的报道。云南野生蜂蜜资源丰富,本研究从云南文山的蜂蜜样品中分离酵母菌,通过形态学鉴定和基因间隔序列(internal transcript space,ITS)分析进行菌种鉴定,经过感官评价筛选性能较优的酵母,并将其应用于蜂蜜酒研制,采用同时蒸馏萃取(simultaneous distillation extraction,SDE)-气质联用(gas chromatography-mass spectrometry,GC-MS)方法对发酵液进行挥发性成分分析[14-15],旨在为蜂蜜酒的开发提供菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
采自云南文山的12份蜂蜜样品(编号1~12号)。
1.1.2 试剂
真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖凝胶DNA回收试剂盒:天根生化科技(北京)有限公司;FTC-3000P型聚合酶链反应(polymerase chain reaction,PCR)仪:加拿大Funglyn Biotech公司;二氯甲烷、NaCl、葡萄糖、蛋白胨、酵母膏、琼脂粉(均为分析纯或生化试剂):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeastextractpeptonedextrose,YPD)固体培养基:葡萄糖20 g/L,蛋白胨20 g/L,琼脂20 g/L,酵母膏10 g/L,pH 自然,121 ℃灭菌25min。
蜂蜜稀释液:蜂蜜与水按3∶7的体积比进行混合,75 ℃灭菌30 min。
1.2 仪器与设备
ZHWT-2012 恒温摇床:上海智城分析仪器制造有限公司;LRH-250-G恒温干燥培养箱:广东省医疗器械厂;SW-CJ-2PD超净工作台:苏净安泰空气技术有限公司;YXQLS-100SII立式压力蒸汽灭菌器锅:上海博迅实业有限公司;THERMOFISHER(ISQ)气相色谱/质谱联用仪、TR-5MS(30 m×0.25 mm×0.25 μm)毛细管色谱柱:美国赛默飞世尔科技(中国)有限公司;Scout SE电子天平:奥豪斯仪器(常州)有限公司;共同蒸馏萃取装置(定制);HH-S2电热恒温水浴锅:江苏大地自动化仪器厂;GelDoc EZ型凝胶成像系统:美国Bio-Rad公司。
1.3 方法
1.3.1 酵母菌的分离纯化
取1 g 蜂蜜样品,加入9 mL无菌生理盐水中,混匀后进行10倍梯度稀释,选取适宜的浓度梯度,用涂布法接种于YPD 固体培养基,32 ℃恒温培养箱倒置培养48 h,挑取具有典型酵母菌形态特征的菌落,平板划线纯化,直至获得纯培养菌株。挑取单菌落转接到YPD 斜面,于32 ℃恒温培养48 h,装入密封袋置于4 ℃冰箱保藏。
1.3.2 酵母菌的鉴定
(1)菌株的形态特征
采用划线法接种少量已纯化好的菌种于YPD平板上,28 ℃培养48 h,观察菌落干湿、隆起、颜色、菌落边缘、表面光泽、质地等形态特征,选取单个菌落制成装片光学显微镜高倍下观察记录细胞形态。
(2)聚合酶链式反应扩增和DNA 测序
以平板划线法对保存斜面菌种活化验纯,挑取单菌落接种于YPD试管斜面作为种子,将每只试管种子接种于装液量为150 mL/250 mL YPD液体培养基中,30 ℃培养5 d,再次验纯,培养物13 000 r/min 离心10 min,收集菌体。参照说明书,使用真菌基因组DNA提取试剂盒提取高质量的菌体基因组DNA。采用酵母菌通用引物ITS1F:5'-CTTGGTCATTTAGAGGAAGTAA-3'和ITS4B:5'-CAGGAGACTTGTACACGGTCCAG-3'对5.8S rDNA-ITS序列进行扩增[16]。25μLPCR反应体系为:2×PowerTaq PCRMasterMix12.5μL,引物各2 μL,模板2 μL,加无酶水补足25 μL。PCR反应条件为:95 ℃预热3 min,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸45 s,72 ℃终延伸5 min,30 个循环后72 ℃末端延伸10 min,4 ℃保存[17]。切下500~750 bp左右的目标片段,使用琼脂糖凝胶DNA回收试剂盒进行回收。PCR回收产物的测序工作由昆明硕擎测序公司完成。
1.3.3 ITS序列比对及系统发育树分析
从GeneBank中获取Z.siamensis、Z.mellis、Z.pseudorouxii、Z.rouxii和Z.sapae等菌株的ITS序列。在MEGA-X[18]中使用MUSCLE[19]进行多序列比对,并采用邻接(neighbour-joining,NJ)法[20]以1 000次bootstrap[21]推测系统发育树。
1.3.4 蜂蜜酒发酵酵母菌的筛选
将分离得到的菌株制备种子液,分别以5%的接种量接种到200 mL蜂蜜稀释液中,每个菌株接种3瓶。28 ℃静置培养30 d,制备蜂蜜酒。通过感官评价筛选出口感好、香味浓郁的发酵菌株。
1.3.5 蜂蜜酒挥发性成分分析
利用同时蒸馏萃取(SDE)-气质联用(GC-MS)法对蜂蜜酒样品中挥发性成分进行分析,量取300 mL蜂蜜酒样品置于500 mL样品瓶,加入2.0 g NaCl,电热套加热样品保持微沸,量取40 mL二氯甲烷置于溶剂瓶中,用60 ℃恒温水浴加热,蒸馏萃取2 h停止加热。萃取溶剂中加入适量无水硫酸钠静置密封,置于冰箱中冰冻过夜,0.45 μm滤头过滤后供GC-MS分析。
气相色谱条件为TR-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;载气为氦气(He);柱流量为0.5 mL/min;进样模式:分流模式(分流比为20∶1)。
程序升温:起始温度为40 ℃,保持3 min,以4 ℃/min的速率升至100 ℃保持3 min,以10 ℃/min的速率升温至230 ℃保持8 min。
质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV,倍增器电压1 600 V。质谱扫描范围为10~500 amu,扫描方式:全扫描,扫描速度:0.2 scan/s。离子源温度为230 ℃,传输线温度:250 ℃。
定性定量分析:各组分通过美国国家标准技术研究所(national institute of standards and technology,NIST)11谱库检索进行定性分析,采用面积归一法进行定量分析。
2 结果与分析
2.1 菌株的分离及形态特征
从第3、5、7、9和10号蜂蜜样品中分别分离到Y3、Y5、Y7、Y9和Y10等5株菌,其形态观察结果见表1。由表1可知,5株菌的细胞形态相似,均呈椭圆,菌株Y3、Y5、Y9和Y10菌落特征相似,菌株Y7菌落较为扁平,其菌落及细胞形态如图1所示,5株菌均呈现典型的酵母菌落特征,初步判定这5株菌为酵母菌。
表1 分离菌株菌落及细胞形态观察结果
Table 1 Colony and cell morphology of isolated strains
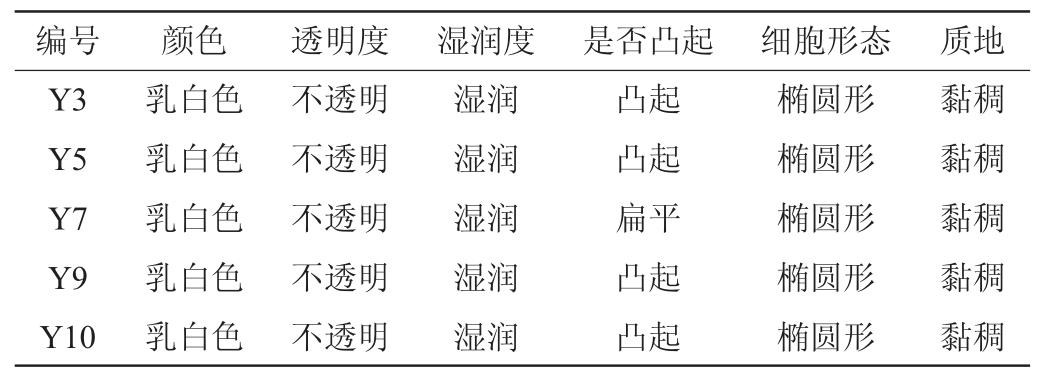
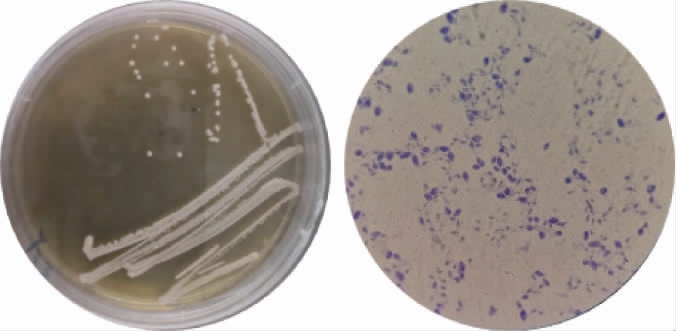
图1 菌株Y3的菌落(a)及细胞(b)形态特征
Fig.1 Colony (a) and cell (b) morphological characteristics of strain Y3
2.2 分离菌株分子鉴定结果
2.2.1 分离菌株的PCR 结果
5株分离菌株的PCR 扩增结果见图2。由图2可知,5株菌的PCR产物片段大小在500~750 bp 之间,判断为5株酵母菌的ITS序列扩增产物。
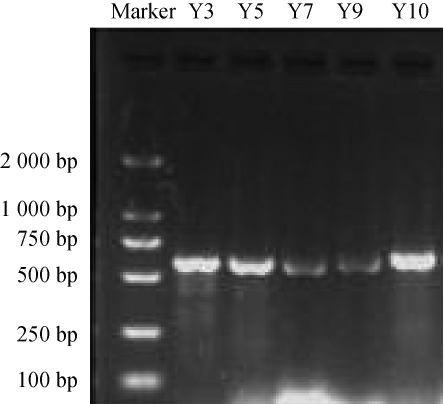
图2 分离菌株PCR扩增的结果
Fig.2 PCR amplification results of isolated strains
2.2.2 分离菌株的分子生物学鉴定结果
分离菌株5.8S rDNA-ITS序列相似性基本局部比对搜索工具(basic local alignment search tool,BLAST)查询结果如表2所示,菌株Y3、Y5、Y9和Y10与菌株Zygosaccharomyces siamensis AB565769.1相似性在99%以上,菌株Y7与菌株Zygosaccharomyces siamensis AB565768.1相似性在99%以上。
表2 酵母5.8S rDNA-ITS序列相似性Blast查询结果
Table 2 Blast search results of 5.8S rDNA-ITS sequence similarity of isolated strains

分离菌株的ITS序列比对后,在MEGA-X中以邻接法构建系统发育树,结果见图3。由图3可知,菌株Y3、Y5、Y9和Y10与Zygosaccharomyces siamensis AB565769.1聚为一簇,Y7与Zygosaccharomyces siamensis AB565768.1聚为一簇。初步鉴定5株酵母菌均为暹罗接合酵母(Zygosaccharomyces siamensis)。
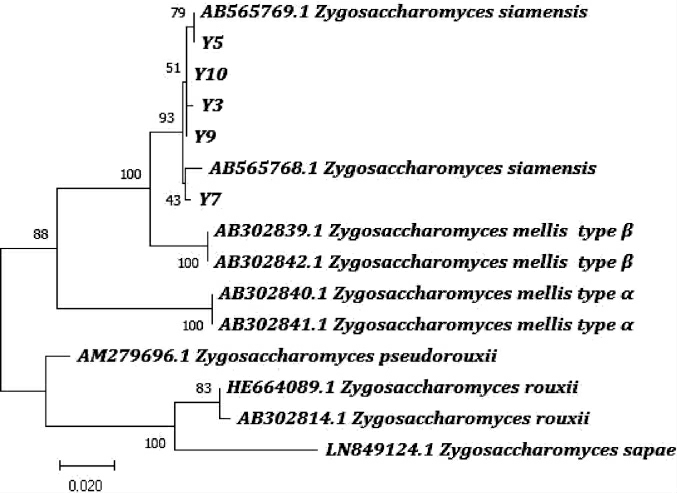
图3 分离菌株基于ITS基因序列的系统进化树
Fig.3 Phylogenetic tree of isolated strains based on ITS gene sequences
2.3 蜂蜜酒发酵酵母菌的筛选
以5株酵母菌发酵蜂蜜酒,其感官评价结果见表3。
表3 酵母菌发酵蜂蜜酒的感官评价
Table 3 Sensory evaluation of mead fermented with yeasts

由表3可知,发酵得到的蜂蜜酒都呈淡黄色,其中菌株Y7发酵的蜂蜜酒杂味较多,菌株Y3、Y5、Y9和Y10发酵蜂蜜酒的香型比较接近,都有独特果香,其中以菌株Y3发酵的蜂蜜酒酒香和果香最为浓郁,发酵过程产生二氧化碳气泡,入口微辣,口感清爽,菌株Y5、Y9和Y10的酒香和果香较淡,选择菌株Y3进行蜂蜜酒发酵进一步研究。
2.4 蜂蜜酒发酵样品挥发性成分分析
采用GC-MS对Y3发酵蜂蜜酒样品的挥发性成分进行分析,其总离子流色谱图见图4。
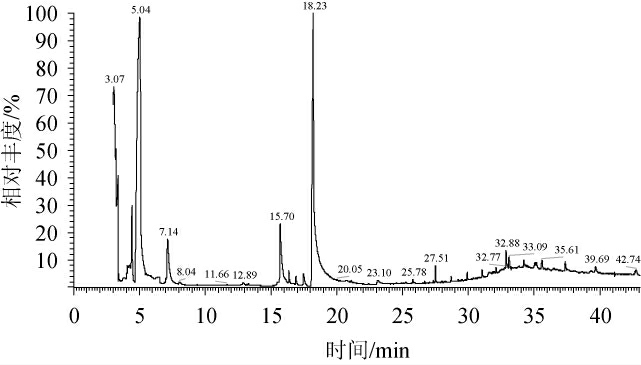
图4 蜂蜜酒样品挥发性成分GC-MS分析总离子流图
Fig.4 Total ion chromatogram of volatile components in the mead sample analysis by GC-MS
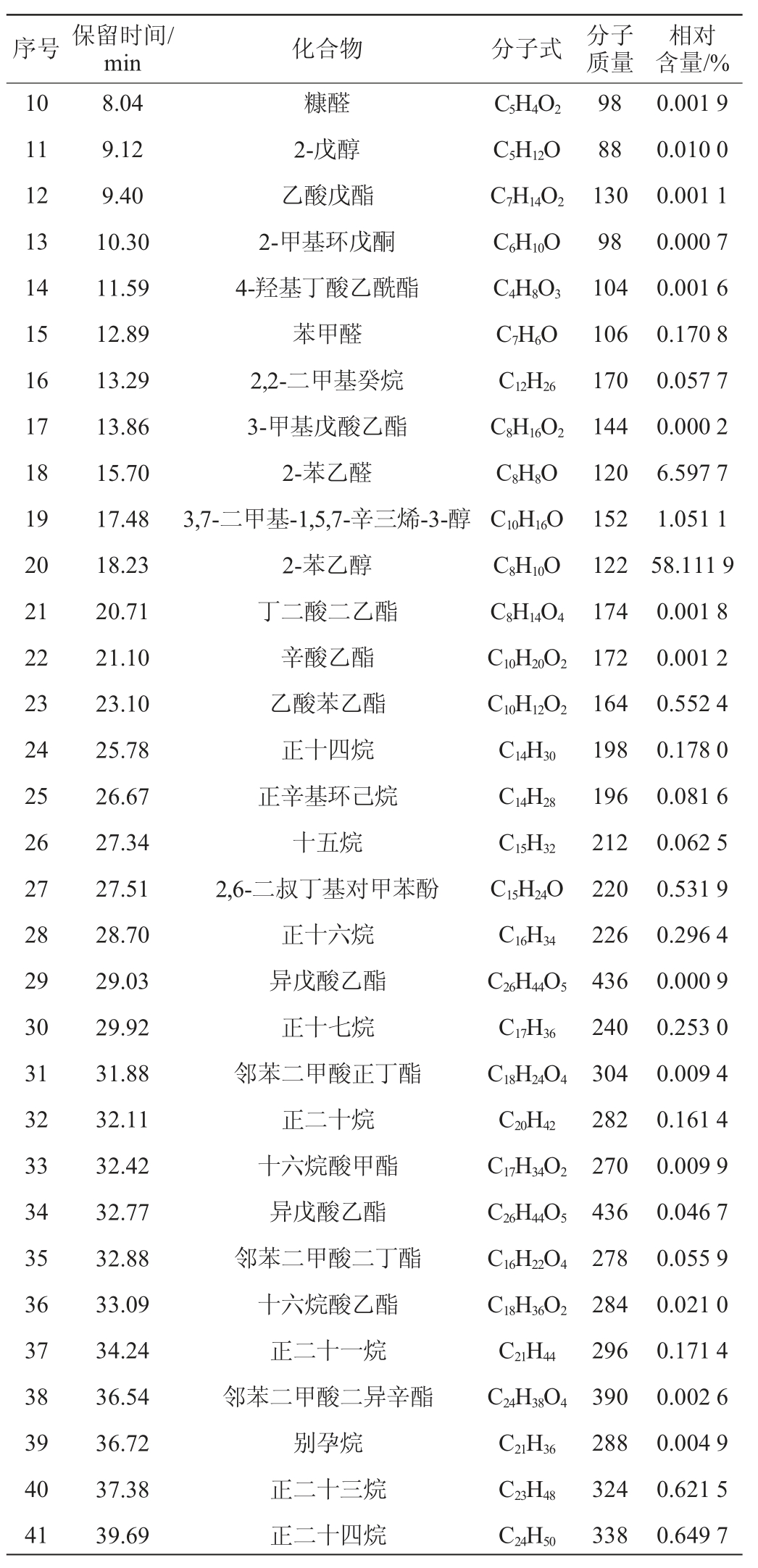
经过NIST11谱库检索得到挥发性化合物的种类,计算相对含量结果见表4。由表4可知,样品共检出41种挥发性成分,其中酯类14种,醇类7种,酸类2种、醛酮4种、烷烃12种。醇类物质和酯类物质是发酵样品香气的主要成分,醇类组分有2-甲基丙醇、苯乙醇、异戊醇等。其中,2-苯乙醇和异戊醇的相对含量分别为58.11%和25.43%;异戊醇具香蕉香味,刺舌头,微涩。2-苯乙醇与玫瑰花香相似,微带苦涩感。酯类物质有4-羟基丁酸乙酰酯,3-甲基戊酸乙酯,乙酸戊酯,辛酸乙酯,这些酯类产生的香气相互综合,赋予发酵样品浓郁的酯香。此外,在发酵样品中检测到酸类、醛类,含量低,可能对发酵样品香气的直接贡献不大,但使发酵样品的香气更加饱满。
表4 蜂蜜酒样品挥发性成分GC-MS分析结果
Table 4 Results of volatile components in the mead sample analysis by GC-MS
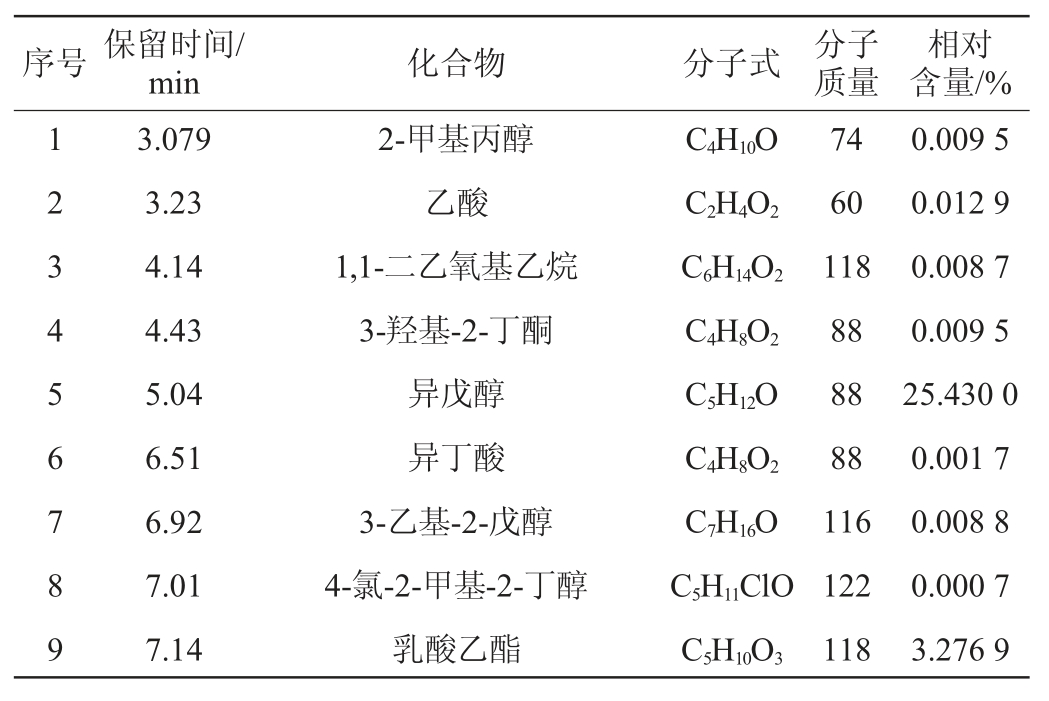
续表
3 结论
本研究从12份云南文山蜂蜜样品中分离得到5株酵母菌,结合菌株形态学特征和分子生物学分析,鉴定5株酵母菌均为暹罗接合酵母(Zygosaccharomyces siamensis)。5株酵母菌都可发酵蜂蜜稀释液,其中菌株Y3发酵的蜂蜜酒酒香和果香最为浓郁。以SDE-GC/MS方法分析菌株Y3发酵蜂蜜酒,蜂蜜酒样品中含41种挥发性成分,2-苯乙醇和异戊醇相对含量达到58.11%和25.43%,是发酵液中主要的挥发性成分。实验结果为蜂蜜酒开发提供了菌株资源。
[1]翟文俊.蜂蜜酒的营养价值与保健作用[J].食品科技,2004,29(8):62-65.
[2] NAVRATIL M,STRDFK E,GEMEINER P.Batch and continuous mead production with pectate immobilised,ethanol-tolerant yeast[J].Biotechnol Lett,2001,23(12):977-982.
[3] AMORIM T S,LOPES S B,BISPO J A,et al.Influence of acerola pulp concentration on mead production by Saccharomyces cerevisiae AWRI 796[J].LWT-Food Sci Technol,2018,97:561-569.
[4] PEREIRA A P,MENDES-FERREIRA A,OLIVEIRA J M,et al.A highcell-density fermentation of Saccharomyces cerevisiae for the optimization of mead production[J].Food Microbiol,2013,33(1):114-123.
[5] MENDES-FERREIRA A,COAME F,BARBOSA C,et al.Optimization of honey must preparation and alcoholic fermentation by Saccharomyces cerevisiae for mead production[J].Int J Food Microbiol,2010,144(1):193-198.
[6] ANTONIAO I,ANAIAS P,ALTINO B,et al.Developments in the fermentation process and quality improvement strategies for mead production[J].Molecules,2014,19(8):12577-12590.
[7] RAMALHOSA E,GOMES T,PEREIRA A P,et al.Mead production:Tradition versus modernity[J].Adv Food Nutr Res,2011,63:101-118.
[8]吴大平,颜复志.耐高渗蜂蜜酒酵母的选育[J].福建农学院学报,1993,22(3):349-352
[9]朱宝生,刘功良,白卫东,等.耐高糖酵母筛选及其高糖胁迫机制的研究进展[J].中国酿造,2016,35(6):11-14.
[10]CARVALHO C,MEIRINHO S,ESTEVINHO M,et al.Yeast species associated with honey:different identification methods[J].Arch Zootecn,2010,59(225):103-113.
[11]樊洁,韩烨,周志江,等.蜂蜜中耐高渗透压酵母菌的分离与鉴定[J].食品工业科技,2014,35(9):165-168.
[12]史莹,张丽珍,曾志将,等.山乌桕蜂蜜酒酿造酵母的筛选、鉴定及应用[J].中国食品学报,2013,13(10):197-204.
[13]PEREIRA A P,DIAS T,ANDRADE J,et al.Mead production:Selection and characterization assays of Saccharomyces cerevisiae strains[J].Food Chem Toxicol,2009,47(8):2057-2063.
[14]肖燕清,白卫东,汪微,等.SDE-GC-MS 分析奶香发酵风味物的致香成分[J].现代食品科技,2010,26(11):1276-1279.
[15]VALERO E,SANZ J,MARTINEZ-CASTRO I.Direct thermal desorption in the analysis of cheese volatiles by gas chromatography and gas chromatography-mass spectrometry:comparison with simultaneous distillationextraction and dynamic headspace[J].J Chromatogr Sci,2001,39(6):222-228.
[16]李梦琦,赵一凡,郑飞云,等.耐高糖产香酵母菌的分离鉴定及其应用[J].食品与发酵工业,45(24):45-51.
[17]孙丽,吴祖芳,沈锡权.5.8 S rDNA-ITS 克隆文库法分析腌制冬瓜的酵母菌多样性[J].中国食品学报,2015,15(2):201-206.
[18]KUMAR S,STECHER G,LI M,et al.MEGA X:molecular evolutionary genetics analysis across computing platforms[J].Mol Biol Evol,2018,35(6):1547-1549.
[19]EDGAR R C.MUSCLE:a multiple sequence alignment method with reduced time and space complexity[J].BMC Bioinformat,2004,5(1):113.
[20]SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4(4):406-425.
[21] FELSENSTEIN J.Confidence limits on phylogenies:an approach using the bootstrap[J].Evolution,1985,39(4):783-791.