高血脂症是指血脂水平过高,主要表现为胆固醇和甘油三酯水平过高。高血脂症常常会并发糖尿病[1]、动脉粥样硬化[2]等疾病,严重危害人体健康。据美国国家卫生统计中心的数据分析,自1999-2012年以来,高胆固醇血症的患病率从1999-2000年的3%增加到2011-2012年的6.3%[3],同时,高血脂症也越来越趋于年轻化[4]。目前,针对高血脂症的治疗多为化学药物,具有一定的毒副作用[5],越来越多的人将研究的重点转移到天然活性产物中来[6-7]。大豆蛋白是一种营养价值较高的植物性蛋白质,其必需氨基酸组成符合联合国粮农组织(Food and agriculture organization,FAO)/世界卫生组织(world health organization,WHO)标准模式,是良好的蛋白质补充剂。大豆蛋白经过物理或化学处理后,得到的大豆多肽不仅具有溶解度高、稳定性好等优良的加工特性[8],同时还具有多种生理功能活性,包括抗氧化[9-11]、降血压[12-13]、降血脂[14-15]、抗癌[16-17]等,极具研究和开发价值。
目前,国内外对大豆多肽降血脂活性及其作用机制的研究日趋深入,高梦笛[18]利用斑马鱼高血脂模型来研究大豆多肽Lunasin的降血脂活性,推测其机理主要是通过参与胆固醇代谢来调节血脂,进而降低血脂水平。LAMMI C等[14,19]研究发现,从大豆球蛋白中分离出的三个多肽(IAVPGEVA,IAVPTGVA和LPYP)能够通过激活低密度脂蛋白受体-固醇调节元件结合蛋白2(LDLR-SREBP2)途径来抑制羟甲基戊二酸单酰辅酶A还原酶(HMGCoAR)的活性并调节胆固醇代谢,从而增加人肝癌细胞(HepG2)摄取低密度脂蛋白的能力。本研究通过HepG2肝癌细胞构建高胆固醇细胞模型,以大豆蛋白为对照组,分析大豆多肽对HepG2细胞内总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high densitylipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和超氧化物歧化酶(superoxide dismutase,SOD)活力的影响,从而评价大豆多肽的体外降血脂活性。同时,采用凝胶过滤层析法和纳米技术-高效液相色谱-串联质谱(nano-high performance liquid chromatography-tandem mass spectrometry,Nano-HPLC-MS/MS)技术对大豆多肽的组成和结构进一步分析、鉴定,旨在为降血脂大豆多肽的开发和应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
大豆蛋白(蛋白含量91.90%):临沂山松生物制品有限公司;大豆多肽(经复合蛋白酶酶解制备而成,蛋白含量为91.25%):中慈保健品生物有限公司;乙腈(色谱纯):庞博生物有限公司;橄榄油:益海粮油工业有限公司;胰脂肪酶(酶活力为500 U/mg)、曲拉通X-100(分析纯)、胆固醇(纯度≥99.00%):美国Sigma公司;最小必需培养基(minimal essential medium,MEM)、总胆固醇试剂盒、甘油三脂试剂盒、高密度脂蛋白胆固醇试剂盒、低密度脂蛋白胆固醇试剂盒、超氧化物歧化酶试剂盒:美仑生物有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JW-3021离心机:安徽嘉文仪器装备有限公司;HWS-12恒温水浴锅:上海一恒科技有限公司;SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;YX-18HDD高压灭菌锅:江阴滨江医疗设备有限公司;HF细胞培养箱:力新仪器(上海)有限公司;RT-6000酶标仪:深圳雷杜生命科学股份有限公司;EASY-nano-LC 1200 Q Exactive plus质谱仪:美国Thermo Fisher Scientific公司;Acclam PepMap C18分析柱(75 μm×15 cm):上海希言科学仪器有限公司。
1.3 实验方法
1.3.1 MTT细胞增殖及毒性实验
利用四甲基偶氮唑蓝(methylthiazalyltetrazolium,MTT)比色法检测不同浓度的大豆蛋白、大豆多肽对HepG2细胞增殖的影响,以此确定最适的样品浓度。取对数期的HepG2细胞(含有1%双抗+10%胎牛血清的MEM培养基在37 ℃、5%CO2的二氧化碳养箱中培养),加入0.25%的胰酶消化1~2 min,计数,接种于96孔板中,每孔加100 μL,使其细胞数为5 000个/孔,于37 ℃、5%CO2条件下静置培养24 h,每孔更换100 μL新的培养基,添加不同质量浓度(1.25 μg/mL、12.50 μg/mL、25.00 μg/mL、50.00 μg/mL、100.00 μg/mL、200.00μg/mL、500.00μg/mL、1000.00μg/mL、5000.00μg/mL)[20]的样品,作用24 h后,弃去上清液,随后添加100 μL的MTT溶液(5 mg/mL),孵育4 h后,添加一定量的二甲基亚砜(dimethyl sulfoxide,DMSO)溶解液,待底部的结晶紫完全溶解后,将96孔板置于酶标仪上,于波长490 nm处测定其吸光度值,细胞存活率的计算公式如下:
1.3.2 高胆固醇细胞造模实验
待肝癌细胞HepG2铺满细胞瓶底的80%~90%时,用胰酶消化、悬浮、计数,按照终浓度为2×105个/mL接种于96孔板中,在二氧化碳培养箱中静置培养24~48 h,当细胞单层长满孔板底部时,换成无血清培养基,并在培养基中加入不同质量浓度(5μg/mL、10μg/mL、15μg/mL、20μg/mL、25 μg/mL)的胆固醇溶液,作用24 h后,弃去培养基,用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗3遍后,用胰酶消化,完全培养基终止消化。将细胞悬浮液转入离心管中,于1 500 r/min离心4 min,弃去上清液,用PBS清洗一遍,离心,弃上清,用PBS悬浮细胞,细胞破碎仪破碎细胞后,按照试剂盒说明,测定各组细胞内的胆固醇浓度。
1.3.3 大豆多肽对HepG2细胞中TG、TC的影响
待细胞培养瓶中细胞长满瓶底至80%~90%时,用胰酶消化、离心、稀释至一定浓度后,将细胞接种于96孔板中,加入一定浓度的胆固醇于完全培养基中,每孔加样量为2.5mL,作用一段时间后,添加不同质量浓度(10 μg/mL、50 μg/mL、100 μg/mL)的样品,培养24 h,随后吸去上清液,用胰酶消化,离心,PBS清洗3遍,添加250 μL的1%Triton X-100,随后于4 ℃冰浴裂解30~40 min。采用TG、TC试剂盒检测其含量。
1.3.4 大豆多肽对HepG2细胞中LDL-C、HDL-C和SOD的影响
待细胞培养瓶中细胞长满瓶底至80%~90%时,用胰酶消化、离心、稀释至一定浓度后,将细胞接种于96孔板中,加入一定浓度的胆固醇于完全培养基中,每孔加样量为2.5mL,作用一段时间后,添加不同质量浓度(10μg/mL、50μg/mL、100 μg/mL、200 μg/mL、500 μg/mL)的样品,培养24 h,随后吸去上清液,用胰酶消化,离心,PBS清洗三遍,添加250 μL的1%Triton X-100,随后于4 ℃冰浴裂解30~40 min。采用LDL-C、HDL-C和SOD试剂盒检测其含量。
1.3.5 体外胰脂肪酶活性的测定
在50 mL的三角瓶中加入4 mL的橄榄油和5 mL pH值为7.5的PBS缓冲液,混匀至乳液状后,置于40 ℃保温5 min,加入1 mL 5 mg/mL的胰脂肪酶,其中空白组加入1 mL的胰脂肪酶,实验组加入1 mL的胰脂肪酶和1 mL的待测样品,混匀后在40 ℃准确反应30 min,以15 mL的体积分数为95%乙醇终止反应后,在溶液中加入2~3滴1%的酚酞指示剂,用0.025 mol/L的NaOH滴定至淡红色出现,并且在30 s内不褪色,记录消耗的NaOH溶液体积,胰脂肪酶活力的计算公式如下[21]:
式中:VA为样品组消耗NaOH滴定液的体积,mL;VB为空白组消耗NaOH滴定液的体积,mL;M为NaOH滴定液的浓度,mol/L;W为胰脂肪酶的取样量,g;T为反应时间,min。
1.3.6 大豆多肽的分子质量分布
采用国标GB/T22492—2008《大豆肽粉》中的检测方法,稍加修改。具体方法如下:采用高效凝胶过滤色谱法进行检测,其中色谱柱为TSKgel G2000 SWXL(300 mm×7.8 mm)(内径)的凝胶柱,流动相∶乙腈∶水∶三氟乙酸=200∶800∶1(V/V),流速为0.5 mL/min,检测波长为220 nm[22]。
1.3.7 凝胶过滤层析
采用葡聚糖凝胶SephadexG15作为填料,装填至60mm×2.5 mm的玻璃层析柱中,平衡2~3个柱体积后上样,以去离子水为洗脱液,洗脱流速为1 mL/min,检测波长为220 nm,用自动收集器收集各组分,将属于同一峰的组分合并、浓缩并冻干,待后续备用[23]。
1.3.8 Nano-HPLC-MS/MS
将样品复溶于水后经由配备在线纳喷离子源的HPLCMS/MS分析。流动相:0.1%甲酸-水(A)和0.1%甲酸-乙腈(B),上样3 μL样品,以线性梯度分离,0~60 min,8%~40%B。柱流量控制在200 nL/min,柱温为40 ℃,电喷雾电压2 kV。
1.3.9 数据分析
串联质谱图经过PEAKSStudioX软件分析。实验数据采用SPSS 23.0进行分析,每组数据均为3次测定的平均值,结果以“平均值±标准差”表示,采用Duncan法进行单因素显著性差异分析,采用t检验进行组间显著性差异分析。
2 结果与分析
2.1 大豆多肽的分子质量分布
通过凝胶过滤色谱法对大豆多肽样品的分子质量分布进行分析,结果见表1。由表1可知,大豆多肽中分子质量在190~451 Da范围内为其主要成分,占68.95%,其次是分子质量在451~1 452 Da范围内的组分,占18.80%,分子质量>6 500 Da的组分最少,仅占0.94%。其中,分子质量<1 500 Da的组分占比>87%,这表明该大豆多肽主要由小分子肽构成。INOUE N等[24]从大豆蛋白酶解液中分离出3个二肽(KA、VK和SY),进一步研究发现,KA、VK和SY均可以显著降低HepG2细胞中甘油三酯的合成量(P<0.05),其中,SY能够有效抑制载脂蛋白-B的分泌,具有一定的降血脂活性。NAGAOKA S等[25]研究发现,大豆多肽(WAWWMY)的胆酸结合能力与降血脂药物消胆胺相当,能够显著降低大鼠血清、肝脏和肠道的胆固醇含量(P<0.05)。
表1 大豆多肽的分子质量分布
Table 1 Molecular weight distribution of soybean peptides

2.2 大豆多肽的体外降血脂实验
2.2.1 MTT实验[26]
本实验考察了8个浓度梯度的样品对HepG2肝癌细胞的抑制作用,结果见图1。由图1可知,在1.25~5 000 μg/mL的质量浓度范围内,HepG2细胞的存活率均>99.00%,这表明在该浓度范围内大豆多肽和大豆蛋白对HepG2细胞不具有细胞毒性作用,且不具有显著性差异(P>0.05),在此浓度范围内可以进行后续的实验。
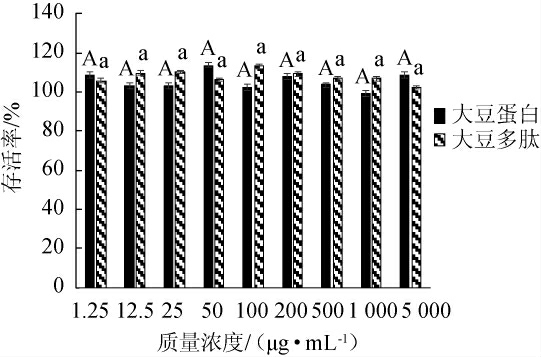
图1 大豆蛋白和大豆多肽对HepG2肝癌细胞的存活影响
Fig.1 Effect of soybean protein and soybean peptides on the survival of HepG2 liver cancer cells
不同大写字母与小写字母表示具有显著性差异(P<0.05);“*”表示具有显著性差异(P<0.05),“**”表示具有显著性差异(P<0.01),下同。
2.2.2 高胆固醇细胞造模实验
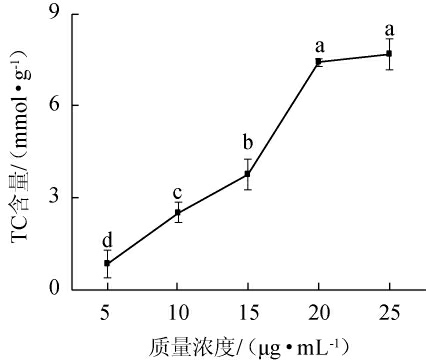
图2 不同质量浓度的胆固醇对总胆固醇含量的影响
Fig.2 Effect of different concentrations of cholesterol on total cholesterol content
以HepG2肝癌细胞来构建高胆固醇细胞模型,其结果见图2。由图2可知,当胆固醇质量浓度<20 μg/mL时,胆固醇的含量随着胆固醇浓度的增加而增加,胆固醇质量浓度<20 μg/mL时,胆固醇的含量不再显著增加(P>0.05),胆固醇质量浓度为20 μg/mL时,对应的胆固醇含量为7.41 mmol/L,高于正常水平时的胆固醇含量,这表明当胆固醇质量浓度为20 μg/mL时,高胆固醇细胞模型构建成功,因此,将此胆固醇质量浓度20 μg/mL作为造模浓度。
2.2.3 大豆多肽对HepG2细胞中TG和TC含量的影响
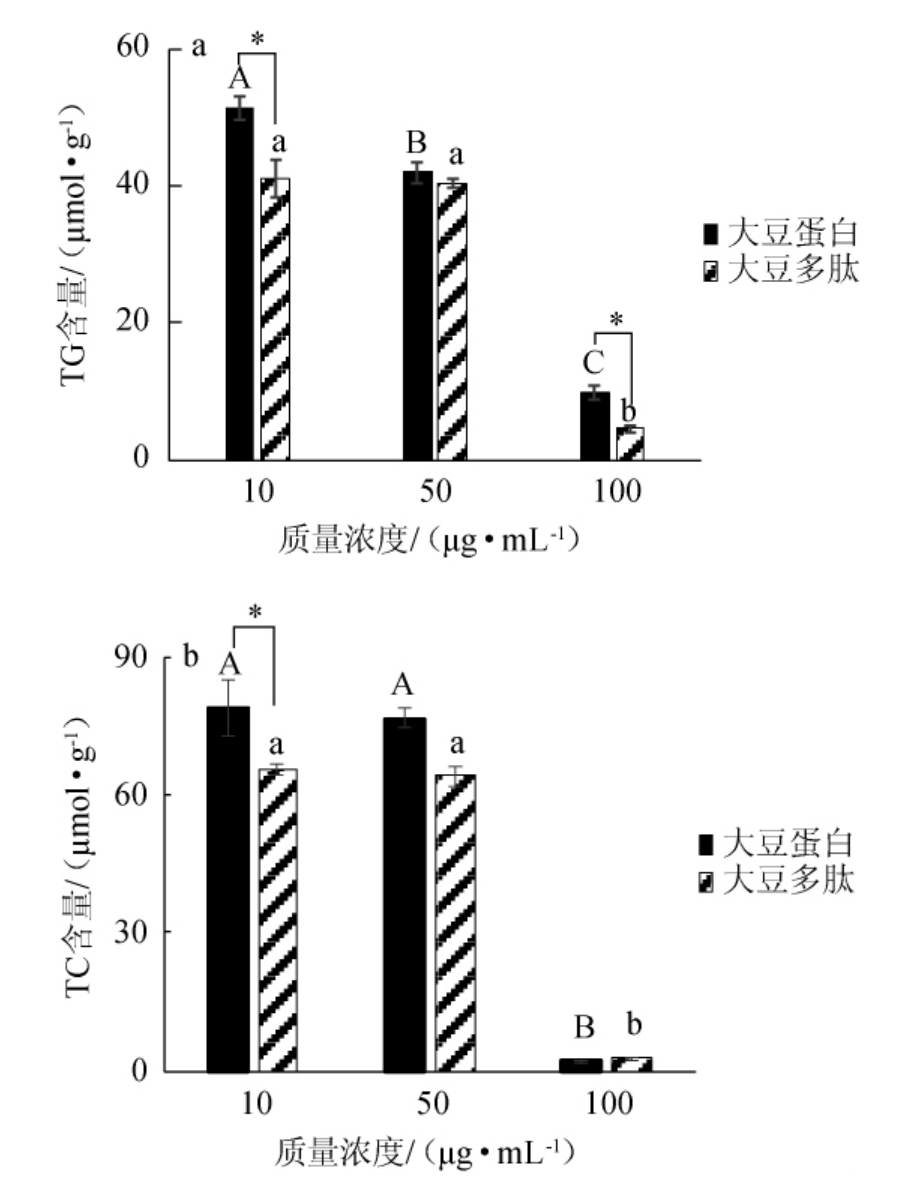
图3 不同质量浓度的大豆蛋白和大豆多肽对HepG2细胞中TG(a)及TC(b)含量的影响
Fig.3 Effect of different concentrations of soybean protein and soybean peptides on TG (a) and TC (b) contents
以大豆蛋白为对照组,通过添加不同质量浓度(10μg/mL、50 μg/mL、100 μg/mL)的大豆多肽,研究其对HepG2细胞中甘油三酯(TG)和总胆固醇(TC)含量的影响。细胞中TG含量的变化如图3a所示,在10~100 μg/mL的质量浓度范围内,细胞中TG的含量随着大豆多肽和大豆蛋白浓度的升高而降低,当质量浓度达到100 μg/mL时,大豆蛋白和大豆多肽对应的TG浓度分别为9.8μmol/g和4.6μmol/g,与10μg/mL时对应的TG浓度相比,分别降低了810%和880%。这表明,大豆蛋白和大豆多肽均能够在一定程度上抑制细胞中TG的产生,与大豆蛋白对照组相比,大豆多肽在浓度10μg/mL、100 μg/mL时对TG具有显著性降低作用(P<0.05)。细胞中TC含量的变化如图3b所示,在10~100 μg/mL的质量浓度范围内,大豆蛋白和大豆多肽对细胞中TC含量的影响与TG基本一致,均与样品浓度呈负相关。100 μg/mL的大豆多肽和大豆蛋白对应的TC浓度分别为2.9μmol/g和2.1 μmol/g,与10 μg/mL的样品浓度对应的TC浓度相比(65.5 μmol/g和78.9 μmol/g),显著降低(P<0.05)。综合以上分析,大豆多肽能够在一定程度上抑制细胞中TG和TC的产生,且大豆多肽对TG的抑制作用稍强于对照组大豆蛋白。
2.2.4 大豆多肽对HepG2细胞中LDL-C和HDL-C含量的影响[27]
以大豆蛋白为对照组,通过添加不同质量浓度(10 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、500 μg/mL)的大豆多肽,研究其对HepG2细胞中LDL-C和HDL-C含量的影响,结果见图4。
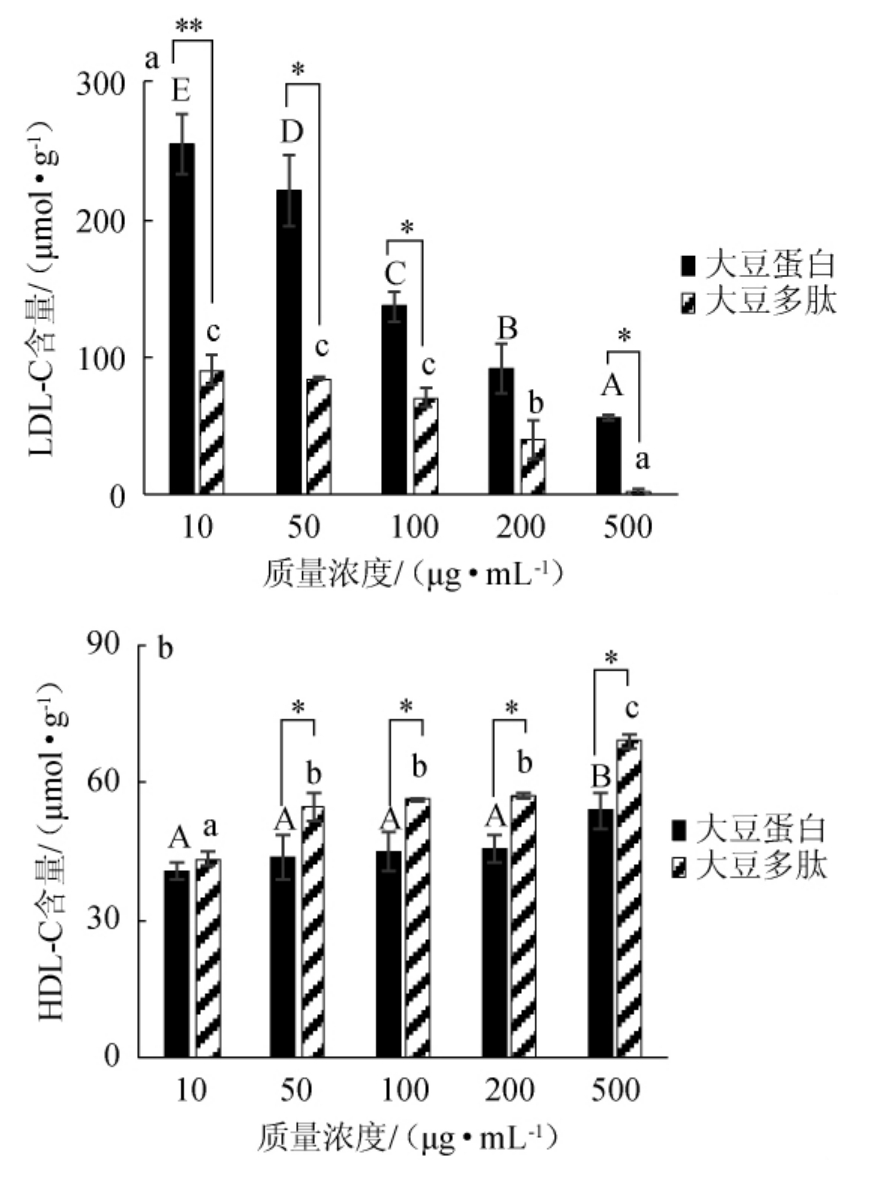
图4 不同质量浓度的大豆蛋白和大豆多肽对HepG2细胞中LDL-C(a)及HDL-C(b)含量的影响
Fig.4 Effect of different concentrations of soybean protein and soybean peptides on LDL-C (a) and HDL-C (b)production in HepG2 cells
由图4a可知,细胞中LDL-C的含量与大豆蛋白和大豆多肽的浓度呈负相关。10 μg/mL的大豆蛋白和大豆多肽对应的LDL-C浓度分别为255.3 μmol/g和90.2 μmol/g,而当质量浓度达到500 μg/mL时,对应细胞中LDL-C浓度分别为55.8 μmol/g和2.7 μmol/g,对比降低了460%和3 340%。在相同的样品质量浓度下,大豆多肽对应的细胞中LDL-C浓度要显著低于大豆蛋白。这表明大豆多肽对细胞中LDL-C的抑制作用显著高于大豆蛋白对照组(P<0.05)。由图4b可知,随着大豆蛋白和大豆多肽浓度的升高,细胞中HDL-C的含量随之升高。当质量浓度为500 μg/mL时,大豆蛋白和大豆多肽对应的细胞中HDL-C浓度分别为54.0 μmol/g和69.2 μmol/g,与10 μg/mL时相比,分别增长了24.4%和37.3%。与对照组大豆蛋白相比,大豆多肽对细胞中HDL-C的产生具有更强的促进作用。综合以上分析,大豆多肽能够抑制细胞中LDL-C的产生并促进HDL-C的产生,且对HDL-C的促进作用显著高于对照组大豆蛋白(P<0.05)。
2.2.5 大豆多肽对HepG2细胞中SOD活力的影响
以大豆蛋白为对照组,通过添加不同质量浓度(10μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、500 μg/mL)的大豆多肽,研究其对HepG2细胞中超氧化物歧化酶(SOD)活力的影响,结果见图5。由图5可知,随着大豆蛋白和大豆多肽质量浓度的增加,细胞中SOD活力随之增加。当样品质量浓度由10 μg/mL增加至500 μg/mL时,大豆多肽的SOD活力由0.634 U/g增加到0.987 U/g,增幅为35.71%。与对照组大豆蛋白相比,在相同质量浓度下,大豆多肽对细胞中SOD活力的促进作用极显著增强(P<0.01)。综上所述,大豆多肽能够在一定程度上促进细胞中SOD活力,且大豆多肽的促进作用显著高于对照组大豆蛋白(P<0.05)。
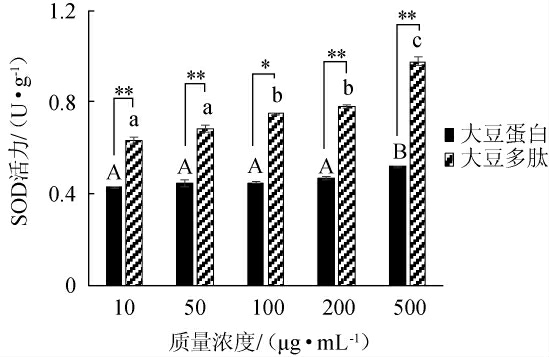
图5 不同浓度的大豆蛋白和大豆多肽对HepG2细胞中SOD活力的影响
Fig.5 Effect of different concentrations of soybean protein and soybean peptides on SOD activity in HepG2 cells
2.3 大豆多肽的分离纯化及鉴定
2.3.1 凝胶过滤层析法
采用Sephadex G-15凝胶柱对大豆多肽进行分离纯化,其结果见图6。
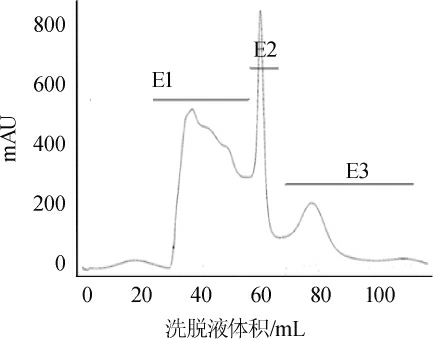
图6 大豆多肽分离纯化凝胶层析图
Fig.6 Gel chromatogram of soybean peptide separation and purification
由图6可知,经过G-15葡聚糖凝胶色谱分离后得到三个主要的多肽峰,分别为E1、E2、E3,根据凝胶层析的原理可知,组分E3为分子量最小的组分,随后将三个组分收集后浓缩、冻干,留待备用。
将上述三个组分用去离子水配制成质量浓度10 mg/mL的溶液,分析各个组分的胰脂肪酶抑制率,结果见图7。由图7可知,纯化后的组分E2、E3与未纯化的大豆多肽相比,其抑制胰脂肪酶抑制率显著性提高(P<0.05),而与组分E1相比则没有显著性差异,其中组分E3的胰脂肪酶抑制率最高,达22.33%,因此选择纯化后的组分E3用于下一步的纯化和鉴定。
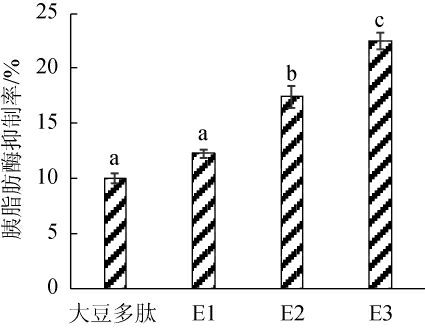
图7 不同组分对应的胰脂肪酶抑制率
Fig.7 Pancreatic lipase inhibition rate of different components
2.3.2 Nano-HPLC-MS/MS
采用Nano-HPLC-MS/MS技术对大豆多肽组分E3进行进一步的分析与鉴定,根据二级质谱中母离子和碎片离子的特性,在数据库中筛选出匹配度最高的多肽序列,该方法为数据库比对法。对于数据库中未匹配到的肽段,可利用碎片离子的质量差,得到对应的氨基酸残基,采用从头测序法进行进一步的分析。通过以上两种方法,可以对大豆多肽进行全面地筛选。
(1)数据库比对结果分析
通过数据库搜库比对匹配后得到的大豆肽段有6744条,最小的大豆多肽为七肽,最大的大豆多肽为四十五肽,分子质量分布在500~5 000 Da,电荷数在1~7之间,大豆多肽最大的峰面积为4.21×109。其中多肽百分含量最高的是九肽,为11.09%,共有748个;其次是十一肽,百分含量为10.97%,共有740个,第三是十二肽;百分含量为9.83%,共有663个;二十肽到四十五肽共有335个,百分含量为4.97%,其中LIDSVLDVVRK百分含量最高,其分子质量为1 255.75 Da,占比为0.31%。
(2)从头测序法结果分析
利用从头测序法鉴定出10 540种多肽,含有2~39个氨基酸,其中十五肽以下的游离肽占比为92.89%,十六肽到三十九肽的数量为749个、十五肽226个、十四肽331,十三肽389个、十二肽460个、十一肽443个、十肽540个、九肽552、八肽690个、七肽973个、六肽1 514个、五肽1 603个、四肽1 439、三肽630个、二肽为1个,含量排在前三位的分别是五肽、六肽和四肽,其中五肽的百分含量最高,占多肽总含量的15.21%。
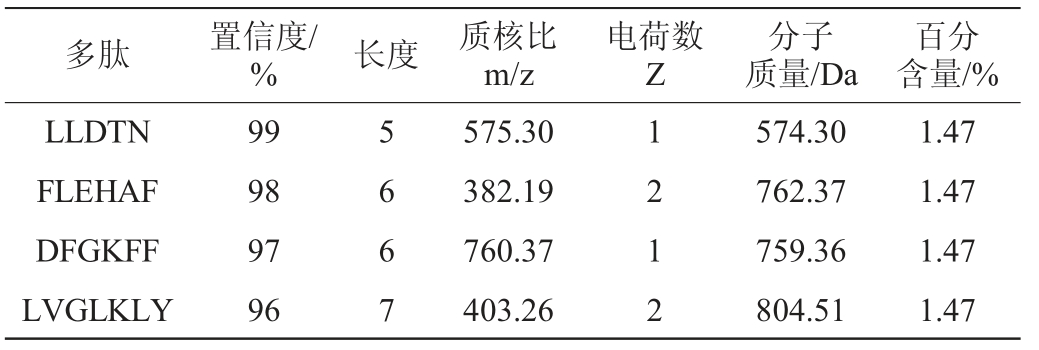
氨基酸局部置信度(amino acid local confidence,ACL)为从头测序数据结果的置信度,通常认为结果较为可信的,其ACL>80%,非常可信时ACL>95%,对此将从头测序结果中ACL>95%、百分含量最高的4个多肽结果统计在表2中,结果显示,这4个肽中包括1个五肽、2个六肽和1个七肽,对其多肽序列分别为LLDTN、FLEHAF、DFGKFF和LVGLKLY,对应的分子质量分别为574.30 Da、762.37 Da、759.36 Da、804.51 Da。
表2 从头测序法分析的游离肽
Table 2 The free peptides using de novo sequencing methods
3 结论
结果表明,大豆多肽的分子质量<1 500 Da的组分占比>87%,主要由小分子肽构成。通过HepG2肝癌细胞构建高胆固醇细胞模型,以大豆蛋白为对照组,分析大豆多肽对细胞内TC、TG、HDL-C、LDL-C和SOD活力的影响。大豆多肽对细胞中TG、TC、LDL-C的产生具有一定的抑制作用,对细胞中HDL-C的产生和SOD活力具有促进作用,且大豆多肽对TG、LDL的抑制作用及对HDL-C和SOD活力的促进作用均强于对照组大豆蛋白,具有良好的体外降血脂活性。通过凝胶过滤层析法和Nano-HPLC-MS/MS技术对大豆多肽进行纯化和鉴定,最终筛选出5个多肽,分别为LLDTN、FLEHAF、DFGKFF、LVGLKLY和LIDSVLDVVRK,对应的分子质量为574.30 Da、762.37 Da、759.36 Da、804.51 Da和1 255.75 Da。本研究表明,大豆多肽具有良好的体外降血脂活性,同时对大豆多肽进行了分离和结构鉴定,这为降血脂大豆多肽的开发和工业化应用提供了新思路和理论基础。
[1]ZHOU X,ZHANG W,LIU X,et al.Interrelationship between diabetes and periodontitis:role of hyperlipidemia[J].Arch Oral Biol,2015,60(4):667-674.
[2] ZHAO Y,YANG Y,XING R,et al.Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats[J].Atherosclerosis,2018,271:26-35.
[3] SONG Y,LIU X,ZHU X,et al.Increasing trend of diabetes combined with hypertension or hypercholesterolemia:NHANES data analysis 1999-2012[J].Sci Rep,2016,6:36093.
[4] DING W,CHENG H,YAN Y,et al.10-year trends in serum lipid levels and dyslipidemia among children and adolescents from several schools in Beijing,China[J].J Epidemiol,2016,26(12):637-645.
[5]周红军,郭巍.中药治疗高血脂症的临床研究进展[J].现代中西医结合杂志,2011,20(20):2592-2593.
[6] UDENIGWE C C,ROUVINEN-WATT K.The role of food peptides in lipid metabolism during dyslipidemia and associated health conditions[J].Int J Mol Sci,2015,16(5):9303-9313.
[7]苏建辉.牡丹籽油及其复方降血糖、降血脂活性及机理研究[D].无锡:江南大学,2016.
[8]戴媛,冷进松.大豆多肽的功能性质及应用前景[J].河南工业大学学报(自然科学版),2019,40(02):132-139.
[9] JARA A M R,LIGGIERI C S,BRUNO M A.Preparation of soy protein hydrolysates with antioxidant activity by using peptidases from latex of Maclura pomifera fruits[J].Food Chem,2018,264:326-333.
[10]MARCELA G,EVA R,DEL CARMEN R M,et al.Evaluation of the antioxidant and antiproliferative effects of three peptide fractions of germinated soybeans on breast and cervical cancer cell lines[J].Plant Food Human Nutr,2016,71(4):368-374.
[11]GARCÍA-NEBOT M J,RECIO I,HERNÁNDEZ-LEDESMA B.Antioxidant activity and protective effects of peptide lunasin against oxidative stress in intestinal Caco-2 cells[J].Food Chem Toxicol,2014,65:155-161.
[12]罗贤慧,李理.高温豆粕肽粉的苦味及ACE 抑制活性研究[J].中国酿造,2012,31(10):120-123.
[13] VALLABHA V S,TIKU P K.Antihypertensive peptides derived from soy protein by fermentation[J].Int J Pep Res Therapeut,2014,20(2):161-168.
[14] LAMMI C,ZANONI C,ARNOLDI A.IAVPGEVA,IAVPTGVA,and LPYP,three peptides from soy glycinin,mouldate cholesterol metabolism in HepG2 cells through the activation of the LDLR-SREBP2 pathway[J].J Funct Food,2015,14:469-478.
[15] LAMMI C,ZANONI C,ARNOLDI A,et al.Two peptides from soy β-conglycinin induce a hypocholesterolemic effect in HepG2 cells by a statin-like mechanism:comparative in vitro and in silico modeling studies[J].J Agr Food Chem,2015,63(36):7945-7951.
[16]葛锡娟,赵城彬,杨丽丽,等.大豆抗癌肽的分离纯化及分子量分布[J].食品工业科技,2012,33(3):99-101.
[17]DAVIS K R,INABA J.Lunasin-a multifunctional anticancer peptide from soybean[J].Int J Cancer Ther,2016,4(2):4218.
[18]高梦笛.大豆多肽Lunasin 含量测定及活性研究[D].北京:中国农业科学院,2018.
[19] SATOSHI N.Structure-function properties of hypolipidemic peptides[J].J Food Biochem,2019,43(1):e12539.
[20]PAN F,WANG L,GUO N,et al.QRPR and HCQRPQ,two peptides from soybean,have an inhibitory effect on the proliferation of HepG2 cells[J].Protein Peptide Lett,2018,25(10):DOI:10.2174/09298665256661810 04095501.
[21]刘丽媛,彭晨,赵楠,等.鲫鱼肽胰脂肪酶抑制活性稳定性的研究[J].食品科技,2013,38(10):245-248.
[22]蔡若纯.腐乳多肽的分离纯化及功能性研究[D].广州:华南理工大学,2017.
[23] JI N,SUN C,ZHAO Y,et al.Purification and identification of antioxidant peptides from peanut protein isolate hydrolysates using UHR-Q-TOF mass spectrometer[J].Food Chem,2014,161:148-154.
[24] INOUE N,NAGAO K,SAKATA K,et al.Screening of soy protein-derived hypotriglyceridemic di-peptides in vitro and in vivo[J].Lipid Health Dis,2011,10(1):85.
[25]NAGAOKAS,NAKAMURAA,SHIBATAH,et al.Soystatin(VAWWMY),a novel bile acid-binding peptide,decreased micellar solubility and inhibited cholesterol absorption in rats[J].Biosci Biotech Biochem,2010,74(8):1738-1741.
[26]PRÄBST K,ENGELHARDT H,RINGGELER S,et al.Basic colorimetric proliferation assays:MTT,WST,and Resazurin [M]//Method in Molecular Biology.Amsterdam:Springer,2017.
[27]王茵,苏永昌,吴靖娜,等.紫菜多肽降血脂及抗氧化作用的研究[J].食品工业科技,2013,34(16):334-337.