窖泥主要用于浓香型白酒生产,其中栖息着大量兼性及专性厌氧微生物,如乳酸菌属(Lactobacillus)、片球菌属(Pediococcus)、产己酸菌属(Caproiciproducens)、梭菌属(Clsotridium)、Petrimonas、嗜蛋白菌属(Proteiniphilum)、甲烷囊菌属(Methanoculleus)和甲烷短杆菌属(Methanobrevibacter)等原核微生物及酵母(Saccharomyces和Pichia)和霉菌(Rhizopus和Aspergillus等)等真核微生物[1-4]。其中窖泥细菌数量远多于真菌[5],且窖泥中原核微生物群落α-及β-多样性与窖泥窖龄及质量均有明显的关联性,如新窖和退化窖泥中厚壁菌门含量明显高于老窖和优质窖泥,拟杆菌门和广古菌门则相反[6-7]。
微生物群落解析技术如磷酸脂肪酸(phospholipid fatty acids,PLFAs)技术、核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)基因克隆文库技术、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gel electrophoresis,PCR-DGGE)及高通量测序等的不断涌现和更新[8],尤其是高通量测序技术在窖泥微生物研究中的广泛应用,极大地丰富了对窖泥微生物多样性的认识,如HU X L等[7]从江苏某酒企窖泥中检测到33个原核微生物门及225个属,明晰了窖泥中的优势微生物如厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)及广古菌门(Euryarchaeota)等及稀有微生物Saccharibacteria和泉古菌门(Crenarchaeota)等[3,6-7,9]。目前高通量测序技术在窖泥研究中的应用主要包括不同窖龄、质量、性状、地理位置及窖池空间位置窖泥菌群的研究,且主要为四川产区的窖泥样品[3,6,9-13]。但是,对我国北方(河南和山东等)浓香型白酒主产区窖泥微生物群落的演替性及空间异质性研究较少。此外,郑佳等[14]研究发现,窖泥香气成分的含量与其在窖池空间位置(共9个位置)存在一定的相关性,且每个位置窖泥能较好地聚类。但目前对窖泥原核微生物群落多样性在窖池空间分布特征的系统研究鲜有报道,之前大多数研究仅选取窖壁泥[11]或窖底泥[6]分别单独研究,或者将窖壁上层或中层窖泥与窖底进行比较研究[3,15-16]。因此,本研究以河南某浓香型白酒酒企6年和12年窖龄窖池中上层、中层、下层及窖底窖泥为研究对象,分析供试窖池中窖泥微生物群落多样性及组成,及其演替性、空间分布特征和影响因素,以期为进一步认识我国北方窖泥微生物菌群组成及其随窖龄及空间的变化特征提供基础数据,以及为探究不同位置窖泥微生物菌群结构对窖泥老熟、白酒风味形成等的具体贡献提供一定的科学理论依据。
1 材料与方法
1.1 材料与试剂
窖泥样品:河南某浓香型白酒企业提供;重铬酸钾、酒石酸锑钾、亚硝基铁氰化钾、邻苯二甲酸氢钾、氢氧化钠、高氯酸钠、酒石酸钾钠、浓硫酸、盐酸、硼酸、氯化铵、钼酸铵、氟化铵(均为分析纯):国药集团化学试剂有限公司;Magen HiPure Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:广州美基生物科技有限公司。
1.2 仪器与设备
PB-10 PH计:德国Sartorius公司;UV BlueStar A紫外分光光度计:北京莱伯泰科仪器股份有限公司;DF-1集热式恒温磁力搅拌锅:常明市金坛区中大仪器厂;MP200A精密电子天平:上海良丰仪器仪表有限公司;101-1电热鼓风干燥箱:北京中兴伟业仪器有限公司;TGL-20M高速冷冻离心机:上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 窖泥样品采集
针对该企业6年和12年窖龄窖池进行取样,每个窖龄随机选取1口连续使用的窖池。每口窖池窖壁上(PT)、中(PM)、下层(PU)窖泥样品的采集参照ZHENG J等[17]方法,不同之处是上、下层窖泥取样位置分别距窖口和窖底平面垂直距离为0.3 m,且每层的两个样品混匀后作为该层的代表样。窖底泥(PB)代表样品为窖底平面对角线交界点处窖泥和任一条对角线的一个四分位点处窖泥的混合物。因此,每口窖池共取4个代表样品,共计8个窖泥样品并做好标记,其中PT6/12、PM6/12、PU6/12和PB6/12分别代表6/12年窖池的上、中、下层及窖底样品。将每个窖泥代表样品均分为2份于-20 ℃冰箱保存,分别用于窖泥理化性质分析和窖泥微生物高通量分析。
1.3.2 理化指标测定
参照李俊辉等[18]的烘干法和电位法分别测定窖泥含水量及pH;采用酸碱中和滴定法测定总酸含量[19];参照农业行业标准NY/T 1121.7—2014《土壤检测第7部分:土壤有效磷的测定》测定窖泥中有效磷含量;采用靛酚蓝比色法测定窖泥中铵态氮含量[20]。
1.3.3 窖泥宏基因组提取及Illumina Miseq测序
利用Magen HiPure Soil DNA Kit试剂盒并参照说明书对窖泥样品总脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,然后用Qubit 2.0荧光定量仪测定其浓度和纯度。将合格的DNA委托苏州金唯智生物科技有限公司完成建库及Illumina MiSeq双端测序。其中16S rDNA扩增子引物对为F:5'-CCTACGGRRBGCASCAGKVRVGAAT-3'和R:5'-GGACTACNVGGGTWTCTAATCC-3',扩增区域为16SrDNA的V3-V4区。
1.3.4 数据分析
采用Cutadapt(v1.9.1)、Vsearch(v1.9.6)及QIIME(v1.9.1)软件对高通量测序序列进行质控。使用VSEARCH(v1.9.6)将有效序列进行聚类,其中相似性>97%的序列归为1个操作分类单元(operational taxonomic unit,OTU)。利用核糖体数据库程序(ribosomal database program,RDP)贝叶斯算法对OTU 的代表性序列进行物种分类学注释。采用金唯智云平台完成基于样品OTUs信息(进化及丰度)的加权(weighted)UniFrac distance 聚类分析。采用软件Canoco 5绘制冗余分析(redundancy analysis,RDA)图谱;采用Heml软件绘制热图。
2 结果与分析
2.1 窖泥样品理化指标及微生物群落α-多样性
由表1可知,随窖池深度增加,窖壁泥含水量呈增加趋势,窖底泥处于窖壁上层和下层窖泥之间;窖池下部(PU和PB,下同)窖泥中pH、铵态氮和有效磷含量均高于窖池上部(PT和PM,下同),其中窖底泥的铵态氮和有效磷含量高于窖壁;总酸变化趋势与之相反。随着窖龄增加,窖泥理化性质也出现不同程度的变化,如相同位置窖泥(窖底泥除外)的铵态氮及有效磷呈下降趋势,总酸含量上升(中层窖泥除外)等。整体上,窖池上部和下部窖泥之间的理化性质差异明显,而上部之间、下部之间以及同一位置不同窖龄之间窖泥理化性质差异相对较小,如不同窖龄上部窖泥PT6、PM6、PT12和PM12的pH分别为3.46、3.56、3.53和3.67,而下部窖泥PU6、PB6、PU12和PB12的pH分别为5.95、5.50、4.81和5.67。
表1 不同窖龄及位置窖泥样品理化指标及窖泥微生物群落α-多样性
Table 1 Physicochemical indexes and α-diversity of microbial community of pit mud samples of different-aged cellars and positions
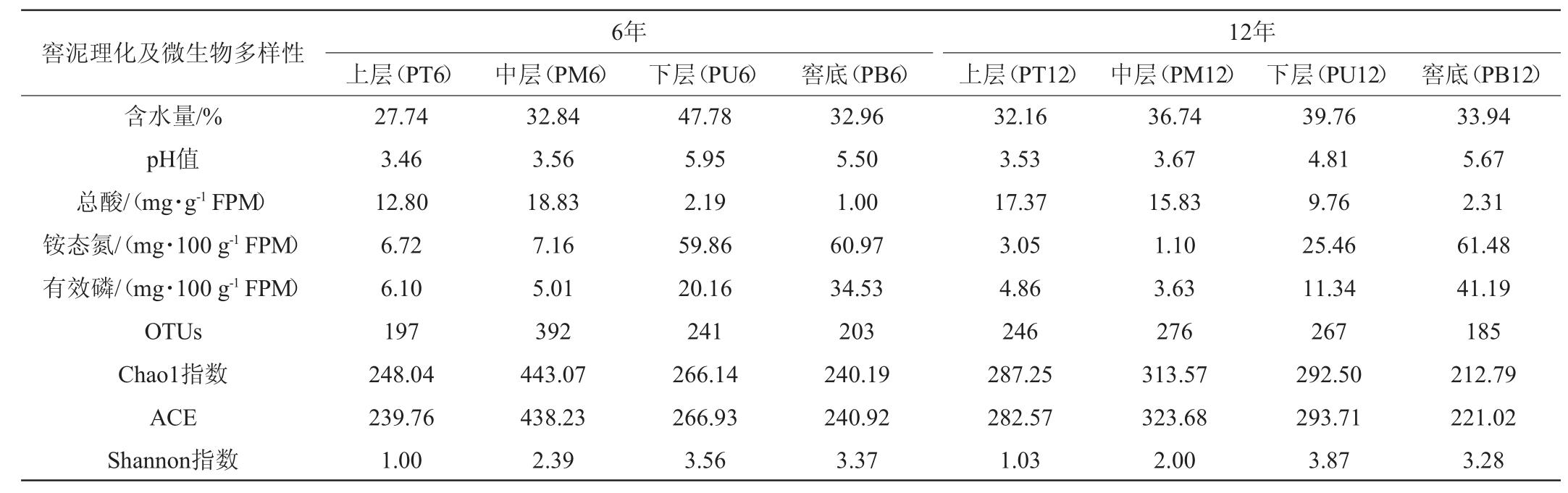
注:FPM为新鲜窖泥。
由表1可知,供试窖泥样品中OTU数量在185~392个之间,Chao1指数在212.79~443.07之间,Shannon指数在1.00~3.87之间。从窖池位置分析,随窖池深度增加,Shannon指数结果显示不同窖龄窖泥物种多样性均呈先升后降趋势,下层最高,且下部窖泥明显高于上部窖泥。OTU数量、Chao1和ACE指数表明窖泥微生物物种丰度也均呈先升后降趋势,中层物种丰度最高,这与WANG C D等[11,21]的研究结果一致。随着窖龄增加,同一位置窖泥的物种多样性差异不大;但物种丰度存在一定的差异,尤其是6年窖池中层窖泥物种丰度明显高于12年窖池中层窖泥。
2.2 窖泥微生物群落β-多样性
2.2.1 基于UniFrac分析的窖泥样品聚类
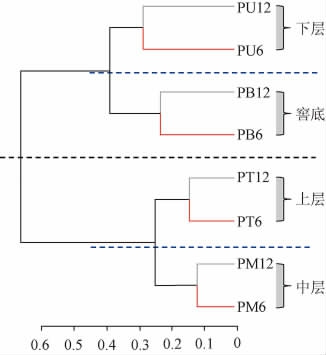
图1 基于6年和12年窖池不同位置窖泥菌群的weighted UniFrac distance聚类分析
Fig.1 Weighted UniFrac distance cluster analysis based on microbial community in pit mud at different positions of 6-year and 12-year cellars
Weighted UniFrac(同时考虑物种有无及其丰度信息)聚类分析结果见图1。由图1可知,供试窖泥样品分为2组,分别为窖池上部和下部窖泥,这主要是由于窖池上部窖泥之间理化性质相似,下部窖泥之间相似,但两者差异较大(见表1)。此外,每个组又可以分为2个亚组,将窖池4个位置的窖泥完全区分开来。不同年份的窖泥分布于不同亚组,表明在供试窖池中,较之于窖龄,不同位置环境理化指标是造成窖泥微生物群落差异的主要因素。张会敏等[3]的研究结果(Weighted UniFrac分析)也与该结论相似,如老窖池(>50年)的窖底泥与新窖池(5年)的窖底泥能更好地聚在一起,而与部分老窖池(>50年)的窖壁泥分属不同的分类组。
2.2.2 窖泥原核微生物门/属水平组成
窖泥原核微生物门水平组成检测结果见图2。由图2可知,在门水平,共检测到12个细菌门和1个古菌门(广古菌门(Euryarchaeota))。其中5个优势菌门(所有样品中平均含量>1%的门,图2中下滑实线标注)及4个次优势菌门(至少在一个样品中含量>1%的门,图2中下滑虚线标注)占每个样品总含量的99%以上。优势菌厚壁菌门(Firmicutes)(72.3%)>拟杆菌门(Bacteroidetes)(13.0%)>广古菌门(Euryarchaeota)(6.0%)>变形菌门(Proteobacteria)(4.8%)>Cloacimonetes(1.6%)。从窖池空间位置分析,两类窖龄窖泥门水平微生物群落组成的空间变化规律基本一致,如厚壁菌门(Firmicutes)(41.2%~97.7%)随窖池深度增加均呈先下降再上升的趋势,下层窖泥含量(PU6 41.2%、PU12 52.8%)最低;而拟杆菌门(Bacteroidetes)(0.6%~39.9%)变化规律与之相反,下层窖泥含量最高。此外,变形菌门(Proteobacteria)在窖池上部的含量(平均值9.46%)远大于窖池下部窖泥(0.05%),且中层窖泥含量最高(16.6%);窖池下部窖泥中广古菌门(Euryarchaeota)含量(11.7%)明显高于窖池上部窖泥(0.31%)。从窖龄看,相同位置窖泥之间一些菌门的含量也发生了变化,随着窖龄增加,窖池上层和中层的变形菌门(Proteobacteria)及下层的广古菌门(Euryarchaeota)含量明显增加,窖壁下层的Cloacimonetes和软壁菌门(Tenericutes)及窖底的广古菌门(Euryarchaeota)含量则明显下降等。
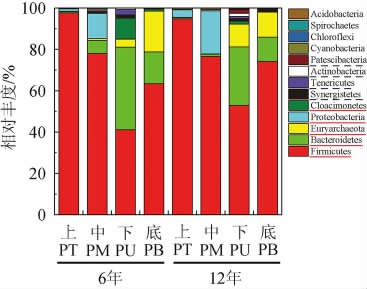
图2 窖泥原核微生物门水平组成
Fig.2 Composition of prokaryotic microorganisms in pit mud at phyla level
在属水平,所有样品中共检测到165个属,其中下层窖泥PU6和PU12注释度最低,分别仅有81.1%和77.2%序列被注释,其余样品注释度均高于93%。本研究选取每个样品含量前10的属(Top10,共33个)进行热图分析从更小分类等级水平揭示供试窖泥的微生物群落组成差异,结果见图3。由图3可知,其占每个样品的65.6%~98.7%,涵盖了所有优势属(>1%,共14个,图3中下划线标注),分属于芽孢杆菌纲(Bacilli)和梭状芽胞杆菌纲(Clostridia)等7个纲;且窖池上部和下部窖泥分别聚为i和ii两簇,与图1结果吻合。
从窖泥位置分析,Top10属可分为两类,其中①类相关属是指其在上部窖泥的平均含量>下部的属,共14个属,含3个优势属;②类相关属变化情况与①类属相反,共19个属,含11个优势属。随窖池深度增加,57.6%(19/33)的属变化规律完全一致(见图3),占所有样品含量的69.5%,表明其窖池空间分布可能与窖龄无关。
不同窖龄窖泥优势属含量的空间分布特征见图4。由图4可知,以优势属为例,64.3%(9/14)的优势属含量在6年和12年窖龄窖池中的空间分布特征完全一致。如乳杆菌属(Lactobacillus)含量随着窖池深度增加而下降,且下部窖泥(1.5%)远低于上部窖泥(78.6%);产己酸菌属(Caproiciproducens)和嗜蛋白菌属(Proteiniphilum)与之相反等。甲烷囊菌属(Methanoculleus)等5个属在两类窖龄窖池中分布存在异同,差异主要为其在6年窖池上部随深度增加而增加,在12年窖池上部持平或降低;相同之处是其(Petrimonas除外)在窖池下部随深度均增加。整体上,窖泥微生物的空间分布差异主要体现为上部和下部窖泥之间,其中78.6%(11/14)的优势属在两类窖池下部窖泥含量高且集中在梭状芽胞杆菌纲(Clostridia)和拟杆菌纲(Bacteroidia)。

图3 基于每个样品中含量前10属的热图分析
Fig.3 Heatmap analysis based on genera with Top 10 content in each sample
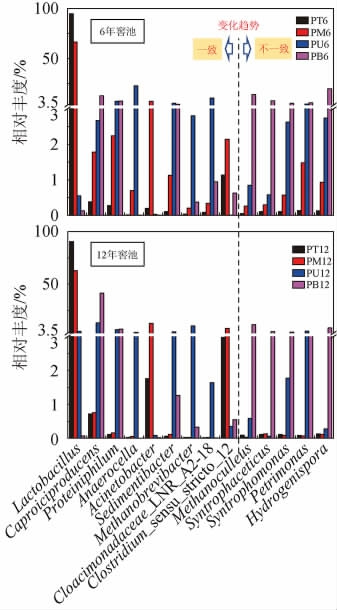
图4 不同窖龄窖泥优势属含量的空间分布特征
Fig.4 Spatial distribution characteristics of dominant genera content in pit mud of different-aged cellars
查阅相关文献发现多数新窖泥、窖壁上层泥及退化窖泥中主要为乳杆菌属(Lactobacillus)和不动杆菌属(Acinetobacter)[3,6-7,12],与供试窖池上部窖泥相似;而隶属于梭状芽胞杆菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、甲烷微菌纲(Methanomicrobia)及甲烷杆菌纲(Methanobacteria)中的部分属主要分布在老窖泥、窖底泥、正常及优质窖泥中[6-7,9,11],与供试窖池下部窖泥相似。此外,梭状芽胞杆菌纲(Clostridia)、拟杆菌纲(Bacteroidia)中的属及甲烷菌是维持窖泥菌群网络结构稳定、微生态平衡及代谢白酒中重要呈香物质及其前体物质(如己酸、丁酸等)的主要微生物[6-7],如产己酸菌属(Caproiciproducens)、互营单胞菌属(Syntrophomonas)、梭菌属(Clostridium)、Petrimonas和甲烷短杆菌属(Methanobrevibacter)等;而高含量的乳酸杆菌属(Lactobacillus)是导致窖泥微生态失衡,乳酸积累、pH下降及窖泥退化的主要因素[6-7]。上述结果有助于从微生物群落层面解释生产实践中窖池上部窖泥易于退化而窖底泥易老熟的现象。
从窖龄分析,随窖龄增加,Top10属(占每个样品微生物含量的65.6%~98.7%)共存在132个(33个属×4个位置)变化(增加、减少和不变情形的数量),但75.6%的变化均<1%,表明两类窖龄的供试窖池中Top10属含量变化不大。这可能是由于窖泥自然老熟是一个缓慢(25年左右)的过程[6],而本研究所取窖泥的窖龄仅为6和12年,正处在窖泥老熟过程中。此外,仅有12.1%(4/33)的属在所有层次窖泥中随时间的变化趋势完全一致,表明窖泥Top10属变化趋势与其位置相关性更高(见图3)。各层窖泥优势属随窖龄变化趋势见图5。

图5 各层窖泥优势属随窖龄变化趋势
Fig.5 Change trends of dominant genera in different layers of pit mud with pit age
“*”表示该属含量变化超过3%。
由图5可知,随窖龄增加各位置窖泥中变化趋势完全一致的属仅有嗜蛋白菌属(Proteiniphilum)、沉积菌属(Sedimentibacter)、Cloacimonadaceae_LNR_A2-18 和 不 动杆菌属(Acinetobacter),其中前3个属含量均下降而后者均增加,其余属在各位置窖泥中的变化趋势存在差异,如Caproiciproducens含量随窖龄增加,其在中层窖泥中含量下降,在下层和窖底窖泥中均增加。将属含量增加或减少超过3%的情形定义为明显变化,共有8个属在相应位置发生了明显变化。其中下层窖泥中发生明显变化的属数量最多(5个),这主要是由于6年和12年窖池下层窖泥的理化性质变化明显大于其他位置窖泥(见表1),尤其是显著影响窖泥微生物群落组成的pH、铵态氮和有效磷均发生了较大的变化[6-7,13]。
2.3 窖泥理化因子与微生物群落的冗余分析
如前所述,空间位置及窖龄在一定程度上均影响供试窖泥的原核微生物群落α-及β-多样性(见图1和图5),这主要是由于不同窖龄和位置窖泥的理化性质存在差异,其是影响微生物群落多样性改变的本质因素[22]。窖泥理化性质与Top10属之间的相关性冗余分析(RDA)结果见图6,其中该图中仅显示了每个Top10属名称的缩写(前8个字母),结合图3可知其全称。由图6可知,样品的分布和聚类情况表明供试窖泥原核微生物群落的分布具有明显的窖池空间异质性,且受窖龄影响较小。两个主成分对两者相关性的总解释度83.7%,其中与pH、铵态氮和总酸相关性高(其与坐标轴夹角小)[3]的轴1对两者相关性的解释度最高(64.3%),表明其对窖泥菌群分布影响较大,尤其是区分窖池上、下部窖泥样品;轴2主要用于区分下层和窖底泥微生物群落组成,解释度19.4%,与含水量和有效磷相关性最高。诸多研究表明,pH、铵态氮、有效磷和含水量均能显著影响窖泥微生物群落结构(P<0.05),进而影响窖泥老熟及质量提升等[3,7]。条件限制效应(conditional term effects)综合分析了各理化因子对菌群结构影响的贡献度及显著性,其中铵态氮(60.4%)和有效磷(17.7%)对菌群影响较大且呈极显著相关(P<0.01),然后依次为含水量、pH和总酸但均不显著。这主要由于铵态氮和有效磷为环境中微生物生长繁殖提供快速利用的氮和磷营养物质,进而显著影响窖泥微生物群落β-多样性[6-7,13]。这也表明铵态氮和有效磷对供试窖泥微生物群落组成的空间异质性和演替程度影响可能要高于pH及含水量等。此外,Top10属与窖泥理化性质存在明显的交互作用,如乳杆菌属(Lactobacillus)与总酸含量呈强烈的正相关,与pH呈明显负相关,这主要是由于乳酸为其主要代谢物,乳酸的积累会导致总酸含量增加而pH下降;嗜蛋白菌属(Proteiniphilum)和Petrimonas与pH呈明显的正相关,这主要是由于这两个属的部分细菌最适pH为碱性(7.1~8.0)[23]。
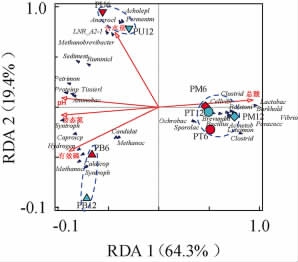
图6 基于窖泥Top10属微生物与其理化指标的冗余分析
Fig.6 Redundancy analysis based on top 10 genera microorganisms in pit mud and physicochemical indexes
3 结论
本实验对河南某浓香型白酒企业6年和12年窖池中窖泥微生物群落组成、以及其演替性及空间分布特征进行研究。在供试窖泥样品范围内,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、广古菌门(Euryarchaeota)、变形菌门(Proteobacteria)和Cloacimonetes为其优势菌门;乳杆菌属(Lactobacillus)、产己酸菌属(Caproiciproducens)、嗜蛋白菌属(Proteiniphilum)及甲烷囊菌属(Methanoculleus)等14个属为其优势属。门和属水平微生物群落β多样性分析结果均表明,位置对窖泥微生物群落组成的影响要强于窖龄,且57.6%(19/33)Top10属的空间分布规律与窖龄无关。窖泥微生物的空间分布差异主要体现为上部(上层和中层)和下部(下层和窖底)窖泥之间,如Lactobacillus在窖池下部窖泥含量远低于上部窖泥;78.6%的优势属在窖池下部含量高且集中在梭状芽胞杆菌纲(Clostridia)、拟杆菌纲(Bacteroidia)。窖泥微生物群落组成随窖龄变化较小,例如随窖龄增加,Top10属产生了132个变化,其中75.6%的变化均<1%。RDA分析显示窖泥微生物群落β-多样性与窖泥铵态氮和有效磷含量极显著相关(P<0.01),表明其可能是影响供试窖泥原核微生物菌群空间分布的主要环境因子。
本研究在一定程度上丰富了人们对河南白酒产区窖泥微生物群落的认识,证实了窖泥微生物群落具有明显的窖池空间异质性,对进一步探究不同位置窖泥微生物菌群对窖泥老熟、白酒风味形成等具体贡献可能具有一定的积极作用。由于本实验窖泥样品数量受限,因此在后续研究中增加所选窖池窖龄跨度及平行窖池的数量,从而进一步检验和完善本研究的结果是极为必要的。
[1]HU X L,WANG H Y,WU Q,et al.Development,validation and application of specific primers for analyzing the clostridial diversity in dark fermentation pit mud by PCR-DGGE[J].Bioresource Technol,2014,163:40-47.
[2]LIU M,TANG Y,ZHAO K,et al.Determination of the fungal community of pit mud in fermentation cellars for Chinese strong-flavor liquor,usingDGGE and Illumina MiSeq sequencing[J].Food Res Int,2017,91:80-87.
[3]张会敏,王艳丽,孟雅静,等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J/OL].食品科学:1-11[2020-04-08].http://kns.cnki.net/kcms/detail/11.2206.TS.20191112.1313.048.html.
[4]何培新,李芳莉,郑燕,等.浓香型白酒窖泥梭菌的分离及其挥发性代谢产物分析[J].中国酿造,2017,36(4):45-49.
[5]代金凤,罗雯,廖作敏,等.老化窖泥己酸代谢的研究[J].中国酿造,2019,38(12):148-152.
[6]TAO Y,LI J B,RUI J,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[7]HU X L,DU H,REN C,et al.Illuminating anaerobic microbial community and co-occurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[8]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2016.
[9]ZHANG H M,MENG Y J,WANG Y L,et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the productionof Chinese strong-flavor Baijiu[J].Food Chem,2020,312:126084.
[10]翟磊,于学健,冯慧军,等.宜宾产区浓香型白酒酿造生境中细菌群落结构的研究[J/OL].食品与发酵工业:1-12[2020-02-19].https://doi.org/10.13995/j.cnki.11-1802/ts.022600.
[11]WANG C D,CHEN Q,WANG Q,et al.Long-term batch brewing accumulates adaptive microbes,which comprehensively produce more flavorful Chinese liquors[J].Food Res Int,2014,62:894-901.
[12]罗雯,张倩颖,廖作敏,等.基于高通量测序技术的不同性状窖泥微生物组成研究[J].食品与发酵工业,2017,43(9):9-14.
[13]刘梅,邓杰,谢军,等.基于微生物群落结构相关的窖泥品质理化指标的筛选[J].食品科学,2018,39(19):51-57.
[14]郑佳,杨康卓,张建敏,等.浓香型白酒窖泥香气成分的空间分布规律[J].食品与发酵工业,2020,46(1):11-15.
[15]王春艳,宋建阳,吕慧鑫,等.基于高通量测序的宋河浓香型白酒不同窖龄窖泥细菌群落结构分析[J].中国酿造,2019,38(9):163-166.
[16]DING X F,WU C D,ZHANG L Q,et al.Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J].World J Microbiol Biotechn,2014,30(2):605-612.
[17]ZHENG J,LIANG R,ZHANG L,et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.
[18]李俊辉,张志伟,刘英杰,等.浓香型白酒窖泥理化性质及高通量法分析窖泥微生物[J].齐鲁工业大学学报,2018,32(6):28-31.
[19]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2012:35-36.
[20]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:129-130.
[21]向凡舒,王瑞萍,赵慧君,等.基于PCR-DGGE 技术的古襄阳白酒窖泥微生物多样性分析[J].食品研究与开发,2019,40(23):197-205.
[22]李克亚,文章,邓斌,等.不同窖龄窖泥原核生物多样性的高通量测序研究[J].食品工业,2016,37(6):121-125.
[23]HAHNKE S,LANGER T,KOECK D E,et al.Description of Proteiniphilum saccharofermentans sp.nov.,Petrimonas mucosa sp.nov.and Fermentimonas caenicola gen.nov.,sp.nov.,isolated from mesophilic labscale biogas reactors and emended description of the genus Proteiniphilum[J].Int J Syst Evol Micr,2016,66(3):1466-1475.