水蜜桃(Prunus persica)又称长寿果,其汁多味美,富含人体所需的多种营养素,营养价值高[1]。但水蜜桃易腐烂变质,即使采用低温保藏,也只能存放15 d左右,供应期短[2]。因此许多桃园都采用土法将水蜜桃发酵成酒,以减少损失。土法酿制后发现产品存在酒体偏酸,口感生硬不柔和的缺陷。经检测土法酿制的水蜜桃酒中乙酸含量为1.415 g/L,而乙酸是挥发酸的主要成分,约占挥发酸的90%[3]。挥发酸是酒中的有害物质,酸味极强,影响酒的品质[4]。因此果酒中乙酸的含量直接影响挥发酸的含量。无病虫害的水蜜桃中并不含乙酸,乙酸是在酵母发酵的过程中产生的。乙酸产生的主要原因是发酵液被醋酸菌所污染将乙醇转化成了乙酸,或者是由于酵母的不正常发酵产生了不良代谢产物[5]。乙酸的含量越高,挥发酸含量就会越高,果酒的香气越不明显,酸涩味越强,协调性越差,生硬后苦感越强[6]。目前对桃酒的研究和报道多集中在酿造工艺[7]和澄清[8]等方面,少有对乙酸含量进行研究。
本研究拟对水蜜桃酒中乙酸进行研究和控制,基于单因素试验,进行响应面试验设计,通过响应面法优化发酵条件来抑制醋酸菌的生长或给予酵母优良的发酵环境来降低乙酸含量,进而降低水蜜桃酒中挥发酸的含量。同时对水蜜桃酒的品质指标进行检测,为水蜜桃果酒进一步研究提供理论依据。
1 材料与方法
1.1 材料与试剂
水蜜桃:江苏陶然生态农业科技有限公司;酿酒酵母(Saccharomyces cerevisiae)、偏重亚硫酸钾(分析纯):烟台帝伯仕自酿机有限公司;果胶酶(≥132 000 AVJP/g):荷兰帝斯曼有限公司;白砂糖(食品级):柳州市柳冰食品厂;乙酸(分析纯)、甲醇、磷酸、磷酸二氢钾(均为色谱纯):国药集团化学试剂有限公司。
1.2 仪器与设备
DHG-9030A恒温培养箱:上海一恒科学仪器有限公司;JA5003N分析天平:上海佑科仪器仪表有限公司;labostarTM TWF UV7纯水仪:上海西门子水处理技术有限公司;1200安捷伦高效液相色谱仪:安捷伦科技(北京)有限公司;3K15高速冷冻离心机:德国Sigma实验室离心机公司;PH计:上海雷磁仪器有限公司。
1.3 方法
1.3.1 水蜜桃酒酿制工艺流程及操作要点
水蜜桃→分选清洗去核→切块破碎→SO2护色→酶解→补糖→接种酵母菌→发酵→酒糟分离→后发酵→水蜜桃酒
操作要点:
水蜜桃预处理:选取成熟、个大饱满的优良水蜜桃,清洗干净后切块去核,使用榨汁机破碎果肉得到水蜜桃浆汁。
护色:在水蜜桃浆汁中加入140 mg/L的偏重亚硫酸钾使SO2的添加量为70 mg/L。
酶解:加入2mL/100L的帝斯曼果胶酶于50℃酶解1.5 h,酶解pH为4,酶解后不进行灭酶处理。
补糖:水蜜桃浆汁的糖度为60~100 g/L,为了达到试验所需的酒精度,需要将浆汁的糖度补充至200 g/L。本试验采用两种补糖方式:一次加糖和二次加糖。一次加糖为一次性将起始糖量补充至200 g/L;二次加糖为先将水蜜桃浆汁的糖度补充至160 g/L,待发酵3 d后再补充40 g/L至200 g/L。
发酵:用10%的温糖水对活性干酵母进行活化并按照总质量的0.2%接种,置于21 ℃无氧发酵15 d,待发酵液中的含糖量低于10 g/L时结束发酵。
酒糟分离:待发酵结束后,用无菌滤布将水蜜桃酒滤出。
后发酵:为了使水蜜桃酒风味成熟,促进酒体的澄清,将滤出的水蜜桃酒于15 ℃后发酵90 d,得水蜜桃酒。
1.3.2 发酵工艺优化单因素试验
以乙酸含量为评价指标,分别考察不同起始糖量(160g/L、180 g/L、200 g/L、220 g/L、240 g/L)、不同加糖方式(一次加糖、二次加糖)、SO2的添加量(0、30 mg/L、50 mg/L、70 mg/L、90 mg/L)以及发酵温度(15 ℃、18 ℃、21 ℃、24 ℃、27 ℃)对乙酸含量的影响。
1.3.3 发酵工艺优化响应面试验
通过单因素试验,选择3个主要影响因素起始糖量(A)、SO2添加量(B)、发酵温度(C)为影响因素,以乙酸含量(Y)作为响应值,利用Design-Expert 8.0.6中的Box-Behnken进行3因素3水平的响应面设计,试验水平分别用-1、0、1来表示,试验设计水平编码值见表1。
表1 响应面试验设计优化发酵工艺因素与水平
Table 1 Factors and levels of response surface experiments design for optimization of fermentation technology

1.3.4 乙酸含量的检测
乙酸含量检测采用高效液相色谱法。
标准溶液的配制:分别配制0.312 5 g/L、0.625 0g/L、1.250 0 g/L、2.500 0 g/L、5.000 0 g/L的五个质量浓度梯度的乙酸标准溶液[9]。
样品预处理:将水蜜桃的发酵液离心后,取上清液过0.25 μm微孔滤膜[10]。
色谱条件:Waters Atlantis T3色谱柱(4.6 mm×250 mm,5 μm);进样量10 μL;流速0.8 mL/min;柱温30 ℃;波长210 nm;流动相A甲醇;流动相B水相;流动相C磷酸缓冲液;采集时间40 min[11]。
定性定量分析:将乙酸单标和不同梯度的乙酸标品进样,确定出峰时间,制作乙酸标准曲线。将水蜜桃酒样品进样,通过出峰时间进行乙酸定性,按照乙酸标准曲线回归方程计算乙酸含量。
1.3.5 水蜜桃酒品质指标的检测
总糖、总酸、酒精度的测定参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》;pH的测定:使用pH计;异丁醇、异戊醇、杂醇油:气相色谱法[12];甲醇:参照GB 5009.266—2016《食品安全国家标准 食品中甲醇的测定》;黄酮:芦丁当量法[13];总酚:福林-酚法[14]。
2 结果与分析
2.1 乙酸标准曲线的绘制

图1 乙酸标准品高效液相色谱图
Fig.1 Chromatography of acetic acid standard analysis by HPLC
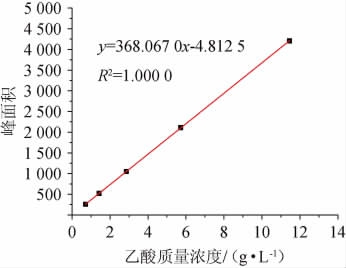
图2 乙酸标准曲线
Fig.2 Standard curve of acetic acid
乙酸含量进行高效液相色谱分析,结果见图1。以乙酸质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制乙酸标准曲线,结果见图2。
由图1可知,乙酸标准品的出峰时间为8.470 min,由图2可知,乙酸标准曲线回归方程为y=368.067x-4.8125,线性范围为0.312 5~5.000 0 g/L,相关系数R2为1.000 0,检出限为0.001 2 g/L。
2.2 发酵工艺优化单因素试验
2.2.1 起始糖量的确定

图3 不同起始糖量对乙酸含量的影响
Fig.3 Effect of different initial sugar contents on acetic acid contents
由图3可知,不同的起始糖量会导致乙酸含量的不同,随着起始糖量的降低乙酸也会随之降低,起始糖量为160 g/L、180 g/L、200 g/L、220 g/L、240 g/L时,发酵15 d时的乙酸含量分别为0.524 g/L、0.528 g/L、0.537 g/L、0.612 g/L、0.691 g/L。采用较低的起始糖量乙酸含量会明显降低,这是因为较高的起始糖量导致酵母所处环境的渗透压高[15],会抑制酵母生长,从而不能进行正常的酒精发酵,导致乙酸较高,这与蔡锦林[16]研究的结果一致。结果表明,在一定范围内降低起始糖量可以有效降低乙酸的含量,采用160 g/L、180 g/L、200 g/L的起始糖量产生的乙酸较为接近,同时考虑试验需达到的酒精度,选用最适起始糖量为200 g/L。
2.2.2 加糖方式的确定
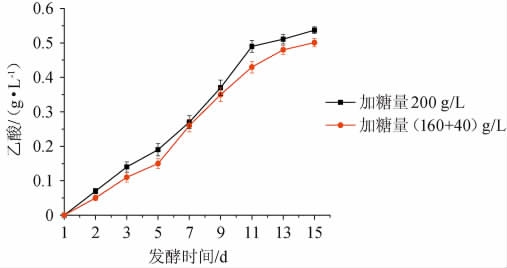
图4 不同加糖方式对乙酸含量的影响
Fig.4 Effect of different adding sugar methods on acetic acid contents
由图4可知,二次加糖方式相比于一次加糖能够有效控制乙酸的含量,乙酸随发酵时间延长而上升的趋势较平缓,乙酸含量从0.537 g/L降至0.501 g/L,比一次加糖下降了6.704%,这是因为一次加糖较二次加糖在同一时间段内产生的渗透压高,所以二次加糖更利于酵母进行酒精发酵,减少不良发酵产物产生。因此,选用二次加糖方式。
2.2.3 SO2添加量的确定
SO2是发酵中常用的食品添加剂,其作用主要有抑菌、抗氧化、降低褐变程度、增酸、改善果酒风味等[17]。过量或不足都会影响酒的口感和品质,对乙酸也会产生一定影响。由图5可知,当SO2添加量为0、30 mg/L、50 mg/L、70 mg/L、90mg/L时,发酵15d时的乙酸含量分别为0.924g/L、0.741g/L、0.659 g/L、0.537 g/L、0.575 g/L。在一定范围内乙酸含量随SO2添加量的增加在逐渐降低,相比于不添加SO2的水蜜桃酒乙酸得到明显抑制,SO2的添加可以抑制杂菌的生长,因此能有效控制乙酸的含量。但SO2也会增加果酒的酸度,同时过高的SO2含量不利于酵母的正常发酵,SO2的添加量过大时,乙酸的含量也会增加,从而当SO2为90 mg/L时,乙酸的含量较70 mg/L时有所上升,这与周浓[18]的研究结果一致。因此,选用最适SO2添加量为70 mg/L。
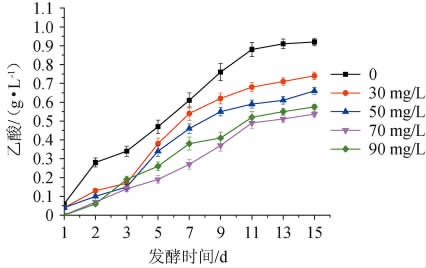
图5 不同SO2添加量对乙酸含量的影响
Fig.5 Effect of different SO2 addition on acetic acid contents
2.2.4 发酵温度的确定
酵母菌体内的酶活受发酵温度的影响,发酵温度不适会导致不正常的酒精发酵,产生乙酸[19]。由图6可知,发酵温度为15 ℃、18 ℃、21 ℃、24 ℃、27 ℃时,发酵15天时的乙酸含量为0.623 g/L、0.583 g/L、0.537 g/L、0.652 g/L、0.764 g/L,在一定范围内,随着温度的降低乙酸的含量也会降低,这是由于低温会抑制醋酸菌的生长,减少乙酸的产生,因此当发酵温度从27 ℃降至21 ℃时,乙酸含量从0.764 g/L降至0.537 g/L。当发酵温度继续降低至15 ℃时,乙酸含量有所增加,这是因为温度过低时,酵母的生长也会受到抑制,发酵迟缓,起酵速度慢,产生不良的代谢产物。因此在一定温度范围内,采用低温发酵能抑制其他杂菌的酶活,进而抑制其生长,能有效控制乙酸,这与张晶[20]的研究结果一致。因此,选用最适发酵温度为21 ℃。
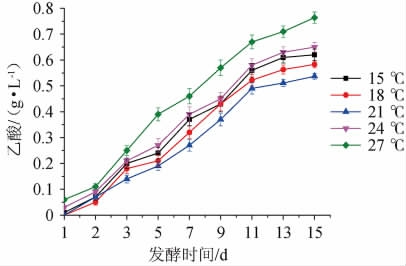
图6 不同发酵温度对乙酸含量的影响
Fig.6 Effect of different fermentation temperature on acetic acid contents
2.3 发酵工艺优化响应面试验结果及分析
在单因素试验基础上,选择3个主要影响因素起始糖量(A)、SO2添加量(B)、发酵温度(C)为影响因素,以乙酸含量(Y)作为响应值,利用Design-Expert 8.0.6软件进行设计,并按照设计进行响应面试验,每组试验设置3个平行,响应面试验结果见表2,方差分析见表3。
表2 发酵工艺优化响应面试验设计与结果
Table 2 Design and results of response surface experiments for fermentation technology optimization

对表2的数据进行分析,得到拟合方程为:
表3 回归方程方差分析
Table 3 Variance analysis of regression equation
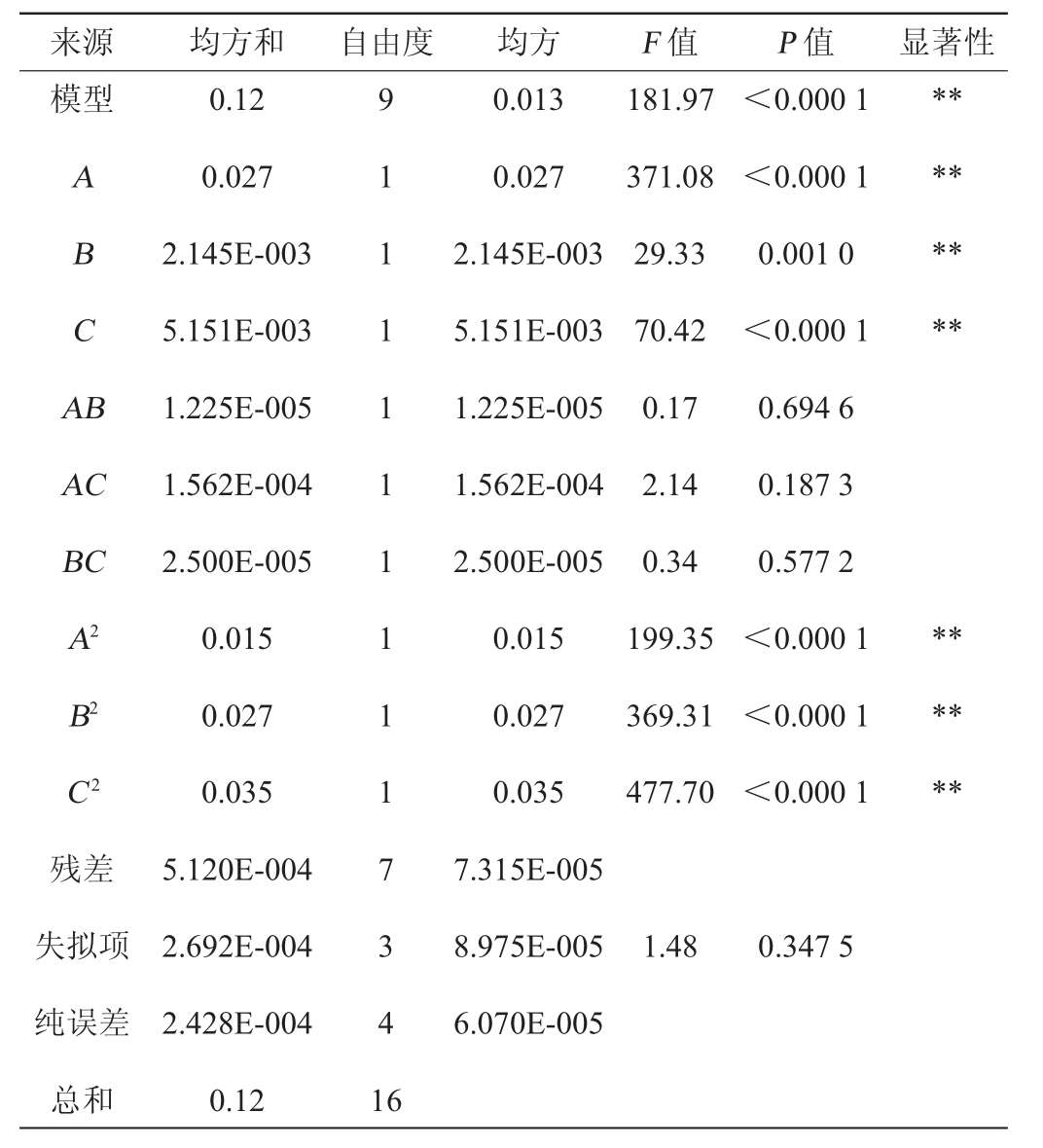
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表3可知,模型中F值=181.97,P<0.000 1,说明模型差异极显著(P<0.01);失拟项P值=0.347 5>0.05,说明失拟项不显著,说明模型可用于预测。模型决定系数R2=0.9957,调整决定系数R2adj=0.9903,预测决定系数R2pred=0.9610,都>0.9,并且R2adj与R2pred值相近,表明实验值与预测值相近,相关性好,可以用来预测水蜜桃酒控制乙酸的工艺优化。
F值表示对乙酸的影响力大小,F值越大说明对乙酸的影响越大。从表3中得出FA=371.08,FB=29.33,FC=70.42,因此A、B、C 3个因素的对乙酸的影响顺序为A>C>B,即起始糖量>发酵温度>SO2添加量,且A、B、C三个因素的都对乙酸的影响极显著(P<0.01)。
3个因素的交互响应面及等高线如图7所示,AB、AC、BC交互影响等高线为圆形,表明交互影响不显著,而A2、B2、C2对乙酸的影响极显著(P<0.01)。
根据响应面试验得到发酵过程中控制乙酸的最佳发酵工艺为起始糖量179.80 g/L,SO2添加量72.12 mg/L,发酵温度20.53 ℃,在此条件下乙酸含量预测值为0.498 g/L。为了便于实际操作,将最佳发酵工艺修正为起始糖量180 g/L,SO2添加量72 mg/L,发酵温度21 ℃。在此优化条件下进行3次平行验证试验,乙酸含量实际值为0.499 g/L,与预测值相近,证明模型有意义,采用最佳工艺能有效降低乙酸含量。
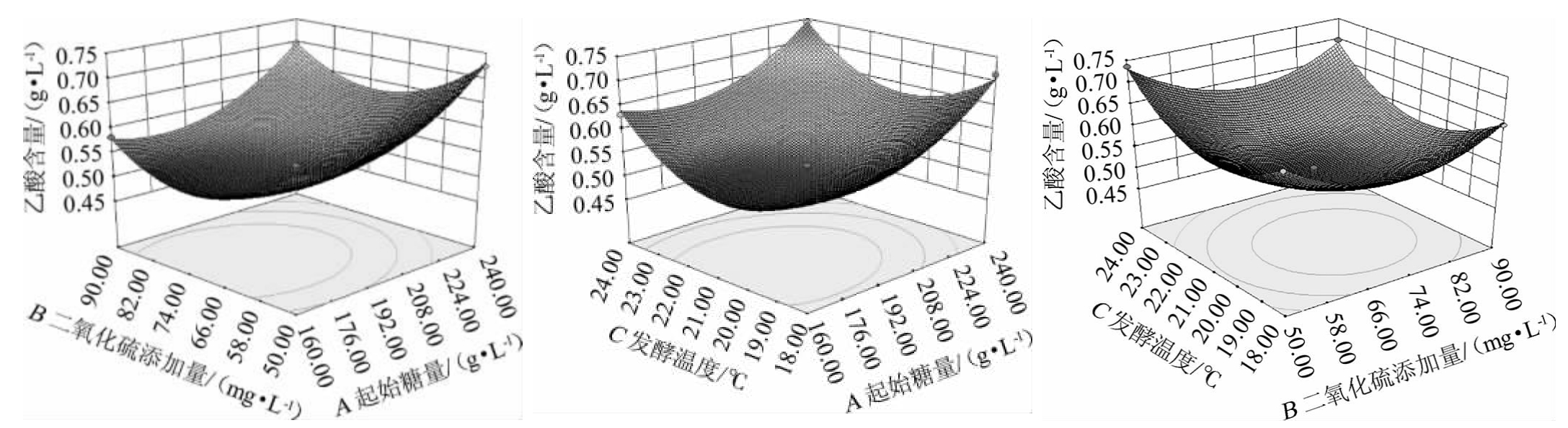
图7 起始糖量、SO2添加量、发酵温度交互作用对乙酸含量影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effects of interaction between initial sugar contents,SO2 addition and fermentation temperature on acetic acid contents
2.4 水蜜桃酒品质指标的检测
由表4可知,水蜜桃酒的各项指标均符合GB/T 15037—2006《葡萄酒》的要求,且乙酸、杂醇油含量较低,黄酮、总酚含量分别为84.053 mg/L、87.302 mg/L,品质较高。该水蜜桃酒果香馥郁、醇香浓厚,酒体协调。
表4 水蜜桃酒品质指标检测结果
Table 4 Detection results of quality indexes of peach wine

3 结论
本试验针对水蜜桃酒酒体酸涩的问题,通过响应面的方法对发酵工艺进行优化,有效降低了水蜜桃酒中乙酸的含量,得到了控制乙酸的最佳发酵工艺参数为:起始糖量180 g/L,SO2添加量72 mg/L,发酵温度21 ℃。在此优化工艺条件下,乙酸含量为0.499 g/L,与土法酿制的水蜜桃酒相比,乙酸含量降低了64.73%,为今后水蜜桃酒中乙酸的控制与研究提供了理论依据。
[1]何晨,吉姆·哈迪,曾令文.水蜜桃酒的酿造工艺研究[J].食品科技,2017,42(8):109-114.
[2]张永,林鹭,王凯纯,等.冷冻干燥法在水蜜桃加工中的应用[J].安徽农业科技,2017,45(24):91-93.
[3]ZERAVIK J,FOHLEROVA Z,MILOVANOVIC M,et al.Various instrumental approaches for determination of organic acids in wines[J].Food Chem,2016,194:432-440.
[4]赵莹,谭晓辉,胡鹏刚,等.青梅酒的总酸和挥发酸控制技术研究[J].中国酿造,2018,37(7):121-126.
[5]曾竟蓝,马胤鹏,秦丹,等.果酒中有机酸的作用及检测方法研究[J].中国酿造,2018,37(6):183-187.
[6]COELHO E M,DA SILVA PADILHA C V,MISKINIS G A,et al.Simultaneous analysis of sugars and organic acids in wine and grape juices by HPLC:Method validation and characterization of products from northeast Brazil[J].J Food Compos Anal,2018,66:160-167.
[7]贺琼娇,童军茂,单春会.发酵蟠桃酒的工艺研究[J].现代食品科技,2013,29(4):841-844.
[8]康孟利,林旭东,凌建刚,等.干白水蜜桃酒发酵关键工艺研究[J].食品研究与开发,2010,31(10):98-100.
[9]WANG X Q,SU H N,ZHANG Q H,et al.The effects of pulsed electric fields applied to red and white wines during bottle ageing on organic acid contents[J].Food Sci Technol,2015,52(1):171-180.
[10]张延超,刘帅,王春天.高效液相色谱法测定葡萄酒中的柠檬酸[J].农业科技与信息,2017(16):31-33.
[11]倪慧,李华佳,李可,等.高效液相色谱法测定猕猴桃酒中4 种有机酸含量[J].食品研究与开发,2019,40(12):205-211.
[12]延鑫.气相色谱法测定地方白酒中乙酸乙酯、杂醇油含量[J].北京联合大学学报,2009,23(03):53-56.
[13]AMIR M,MUJEEB M,KHAN A,et al.Phytochemical analysis and in vitro antioxidant activity of Uncaria gambir[J].Int J Green Pharmacy,2012,6(1):67.
[14]DEWANTO V,WU X,ADOM K K,et al.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J].J Agr Food Chem,2002,50(10):3010-3014.
[15]裴广仁,李记明,于英,等.冰葡萄酒中高含量挥发酸的影响因素分析[J].食品与发酵工业,2014,40(3):58-62.
[16]蔡锦林.番木瓜果酒品质改善研究[D].广东:华南理工大学,2014.
[17]方强.苹果酒发酵中SO2 的控制及其对苹果酸乳酸发酵的影响[D].北京:中国农业大学,2005.
[18]周浓.SO2 添加量和添加方式对菠萝果酒品质的影响[J].食品工业,2006(4):22-24.
[19]许禔森,李学贵,李向勇,等.梨果酒酵母发酵条件的研究[J].德州学院学报,2019(6):6.
[20]张晶,左勇,谢光杰,等.发酵条件对桑椹果酒中挥发酸的影响[J].食品工业科技,2018,39(1):117-121.