近20年来,随着现代分子生物学技术的发展,不同香型白酒大曲中的微生物(主要是细菌和真菌)种群结构及其组成得到有效解析,如所有香型白酒大曲中均鉴定出乳杆菌属(Lactobacillus);浓香和酱香型白酒大曲中优势菌群为芽孢杆菌属(Bacillus)[1-2];扣囊复膜孢酵母(Saccharomycopsis fibuligera)和总状横梗霉(Lichtheimia ramosa)在清香和浓香型白酒大曲中被检测到;酱香型白酒大曲中特殊微生物为疏棉状嗜热丝孢菌(Thermomyces lanugino sus)[3]。由于白酒酿造主要原料高粱中含有的淀粉不能被大多数酵母菌和细菌直接利用,需要通过丝状真菌产生的α-淀粉酶和糖化酶水解为可发酵糖[4],所以真菌在大曲酿造过程中发挥重要作用。如成熟茅台风味大曲中检测出多种真菌:曲霉属(Aspergillus)、毛霉属(Mucor)和根霉属(Rhizopus),总状毛霉(Mucor racemosus)和嗜热子囊菌(Thermoascus crustaceus)[5-6]。微生物区系对成品大曲香气的优劣有着直接的影响[7]。然而,目前微生物群落结构组成的研究大部分集中在浓香、酱香和清香型等主流白酒酿造过程,关于北方不同香型白酒大曲中微生物相关的研究还较少。
高通量测序技术已被广泛用于分析发酵食品(如白酒、葡萄酒、醋和酱油等)微生物群落的组成[8-10]。基于该技术,本实验研究了贾湖白酒大曲发酵过程中理化性质和微生物(细菌和真菌)结构的动态变化;确定大曲样品中细菌和真菌类群的相对丰度和多样性,对鉴定和判断大曲制曲过程相关的主要微生物、指导大曲生产,具有重要的意义。
1 材料与方法
1.1 材料与试剂
大曲样品:河南漯河贾湖酒业集团有限责任公司曲房制作过程中的样品曲,取样点为入房(JH1)、第1次翻曲(JH2)、第2次翻曲(JH3)、第3次翻曲(JH4)、出房(JH5)5个点。每次取样固定为同一点,每次取样3个曲块,将样品粉碎混合为一个区域的综合样(实验样品),共获取5个综合实验样品。实验样品迅速置于-20 ℃保藏备用。

E.Z.N.ATMMag-BindSoilDNA试剂盒:美国OMEGA公司;Qubit3.0 DNA检测试剂盒:美国Life公司;2×Taq Master Mix:南京诺唯赞生物科技有限公司;MagicPureSizeSelection DNA Beads:北京全式金生物有限公司。
1.2 仪器与设备
Heraeus X1R台式离心机:Thermo Fisher公司;BE-1200漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6E型电泳仪电源,DYCP-31C型电泳槽:北京市六一仪器厂;Biodoc-IT凝胶成像系统:美国UVP公司;Qubit 3.0荧光计:Invitrogen公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;Research plus 单道可调量程移液器:德国Eppendorf公司。
3.0荧光计:Invitrogen公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;Research plus 单道可调量程移液器:德国Eppendorf公司。
1.3 方法
1.3.1 大曲水分和酸度测定
按照QB/T 4257—2011酿酒大曲通用分析方法测定大曲水分和酸度。
1.3.2 脱氧核糖核酸提取
称取200 mg样品,放入灭菌2 mL离心管中,加入1 mL体积分数70%的乙醇,振荡混匀,室温条件下10 000 r/min离心3 min,弃置上层液体。加入磷酸缓冲盐溶液(phosphate buffer saline,PBS),振荡混匀,室温条件下10 000 r/min离心3 min,弃置上层液体。倒置2 mL管于吸水纸上1 min,直至没有液体流出。将样品管放入55 ℃烘箱10 min,使残留酒精完全挥发,保证后续实验操作。脱氧核糖核酸(deoxyribo nucleic acid,DNA)具体提取步骤参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA试剂盒的使用说明书[11]。
1.3.3 16S 核糖体核糖核酸和真菌种属基因测序及序列分析
16S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)基因PCR扩增所用的引物为已经融合了Miseq测序平台的V3-V4通用引物:
341F 引 物:CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG
805R 引 物:GACTGGAGTTCCTTGGCACCCGAGAATTCCA GACTACHVGGGTATCTAATCC
PCR反应条件:95 ℃预变性2 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s,25次循环后,72 ℃延伸5 min,10 ℃保持至停止。
真菌种属(internal transcribed spacer,ITS)PCR扩增所用的引物为已经融合了Miseq测序平台的ITS1-2通用引物:
ITS1F 引 物:CCCTACACGACGCTCTTCCGATCTN(barcode)CTTGGTCATTTAGAGGAAGTAA
ITS2R引物:GTGACTGGAGTTCCTTGGCACCCGAGAATTCCA GCTGCGTTCTTCATCGATGC
PCR反应条件:95 ℃预变性2 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s,25次循环后,72 ℃延伸5 min,10 ℃保持至停止。
PCR反应结束后,产物进行琼脂糖(2%)电泳检测。回收的DNA利用Qubit3.0 DNA检测试剂盒精确定量,按照1∶1等量混合后测序。等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。
1.3.4 生物信息学分析
Illumina MiseqTM得到的原始图像数据文件经CASAVA碱基识别分析转化为原始测序序列[12],序列中含有barcode序列,以及测序时加入的引物和接头序列。首先去除引物接头序列,再根据双末端(paired-end,PE)reads之间的overlap关系,将成对的reads拼接成一条序列,然后按照barcode标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本的有效数据。采用软件Usearch将所有样本序列按照序列间的距离进行聚类,后根据序列之间的相似性将序列分成不同的操作分类单元(operational taxonomic units,OTUs)[13]。通常在97%的相似水平下的OTU进行生物信息统计分析。将获得的每个OTU的代表序列与在线数据库(ribosomal database project,RDP)[14]进行比对,筛选出OTU序列的最佳比对结果,并对比对结果进行过滤,默认满足相似度>90%且Coverage>90%的序列被用来后续分类[15],确定每个OTU的分类水平,即门、纲、目、科、属、种水平。
2 结果与分析
2.1 大曲样品水分和酸度变化
大曲在制备过程中,由于温度的变化,大曲水分含量逐渐降低,根据大曲质量检验标准的相关规定,大曲中的水分含量不能超过13%[16]。由图1A可知,出房大曲(JH5)水分含量为8.38%(取样时间为夏季,水分挥发较快)。大曲生产过程中由于水分低的关系生酸量低,常规酸度不会超过1.0。酸度主要是由产酸微生物在大曲中进行有机酸代谢而形成,酸度大小可揭示大曲中产酸微生物的数量多寡,同时也归因于大曲中脂肪酶和蛋白酶活力强弱[17]。由图1B可知,大曲在入房时由于代谢旺盛,产酸最高,大曲JH1中酸度达到0.22 mmol/g。酸度的大小和微生物数量变化有很密切的关系,研究表明酸度大小与芽孢杆菌数量有正相关性[18]。本研究结果也证实该结论。在发酵期间,不同时间点大曲样品芽孢杆菌属相对丰度分别为2.90%、0.23%、0.10%、0.12%和0.18%,酸度也随之降低和升高。所以,大曲生产过程中严格控制酸度有助于调控和平衡大曲中的微生物组成与数量,同时产生的有机酸还将与醇类化合物反应产生浓郁的白酒风味化合物[19-21]。
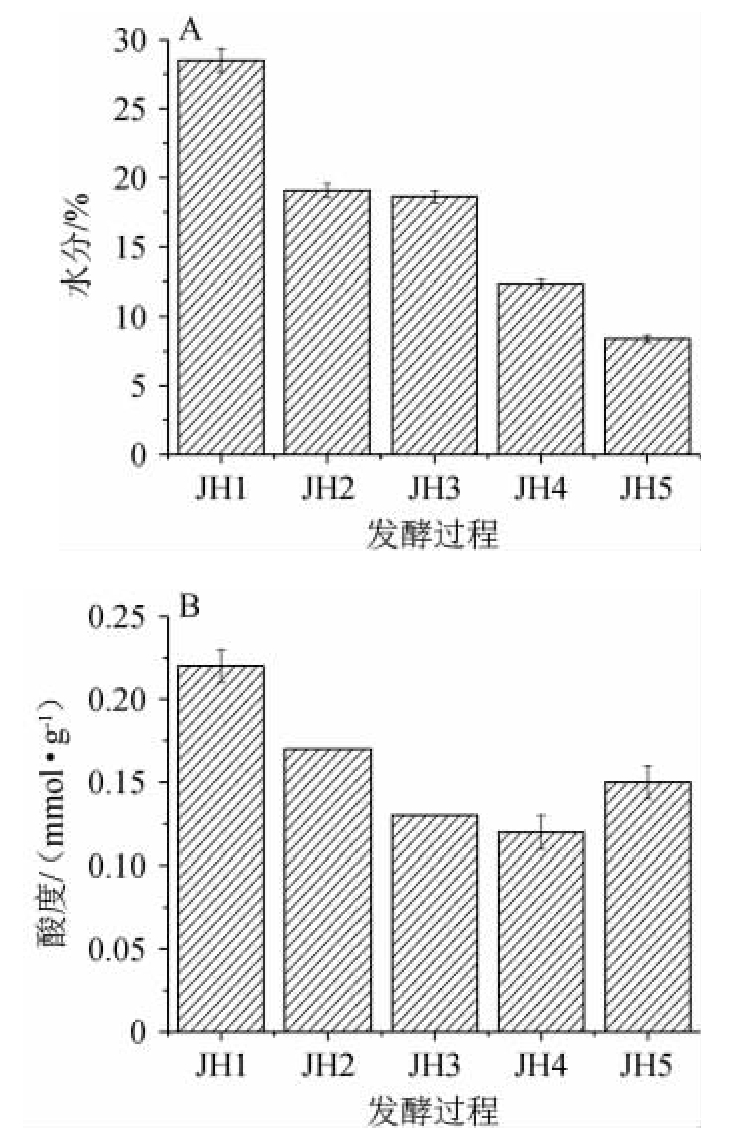
图2 大曲生产过程中水分(A)和酸度(B)变化
Fig.2 Changes in water content and acidity during Daqu fermentation
2.2 大曲微生物OTU多样性
本研究划分细菌和真菌OTU 分类信息样本文库覆盖率(Coverage指数)都超过0.97,说明本次测序结果能代表样本的真实情况,完全能够反映该区域细菌和真菌群落的种类和结构。由图2可知,从大曲样品入房到出房,细菌和真菌微生物多样性指数(OUT值)表现出先升高后降低的趋势,并且都在曲温达到顶温时(大曲JH3)达到最高值。这也印证了整个培曲过程遵循“前缓、中挺、后缓落”的发酵规律[22],即大曲的培菌、生香转化主要在40 ℃~60 ℃~40 ℃这一温度变化区域内进行,因而大曲中富集很多耐高温微生物,而后续的真菌和细菌群落的详细分析数据也验证了该结论。

图2 DNA测序法测定大曲操作分类单元数目
Fig.2 Number of operational taxonomic units in Daqu determined by DNA sequencing
2.3 大曲真菌群落ITS2 rRNA基因序列分析
由图3A可知,所有大曲样品中的真菌种群共5个门:子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和梳霉门(Kickxellomycota),其中子囊菌门在大曲JH1占主导地位(相对丰度74.03%)。随着发酵的进行,子囊菌门相对丰度逐渐减少,大曲JH3中减少到最低为26.94%,之后,又逐渐上升至大曲JH5中的47.38%。与之对应的是毛霉亚门的此消彼长,由大曲JH1中的13.14%上升至大曲JH3中的71.47%,逐渐降低至大曲JH5中的36.28%。这可能是由于发酵过程中翻曲操作引起曲块温度的变化导致真菌结构的演替:温度升高有利于毛霉亚门类生长,而对子囊菌门类生长和繁殖有阻碍作用。当曲温达到顶温阶段(大曲JH3)时,毛霉亚门类相对丰度达到最高,担子菌门类相对丰度降至最低为0.14%,被孢霉门和梳霉门类已检测不到,说明绝大多数微生物停止生长。
由图3B可知,入房大曲JH1中假丝酵母属(Candida),酵母属(Saccharomycetales),根霉属(Rhizopus)和曲霉属(Aspergillus)是优势菌属,其相对丰度占全部真菌群落的74.46%以上,其中最优势菌属是假丝酵母属,约占35.69%,假丝酵母属是大曲发酵过程重要的真菌之一,主要产酒精和酯类物质[23],而且大量产生酮类、烯类、酚类等挥发性化合物[24],对大曲品质有着决定性的影响。由于入房时温度较低,霉菌和酵母菌均大量生长,给大曲的多种功能打下基础。随着温度升高,霉菌生长越来越旺盛,其中毛霉属(Rhizomucor)在大曲JH2、JH3中的相对丰度分别达到21.17%、29.63%,相比较于大曲JH1,同比增加了21.13%、29.59%。当曲温达到顶温时,横梗霉属(Lichtheimiaceae)成为优势菌群,相对丰度达到40.60%。在出房大曲JH5中,毛霉属重新占据优势,相对丰度达到34.44%,其次是根霉属和曲霉属。霉菌被视为大曲糖化降解动力的主要来源,为曲酒的酿造提供糖化力、液化力、蛋白质分解能力及多种有机酸等物质[25-26]。
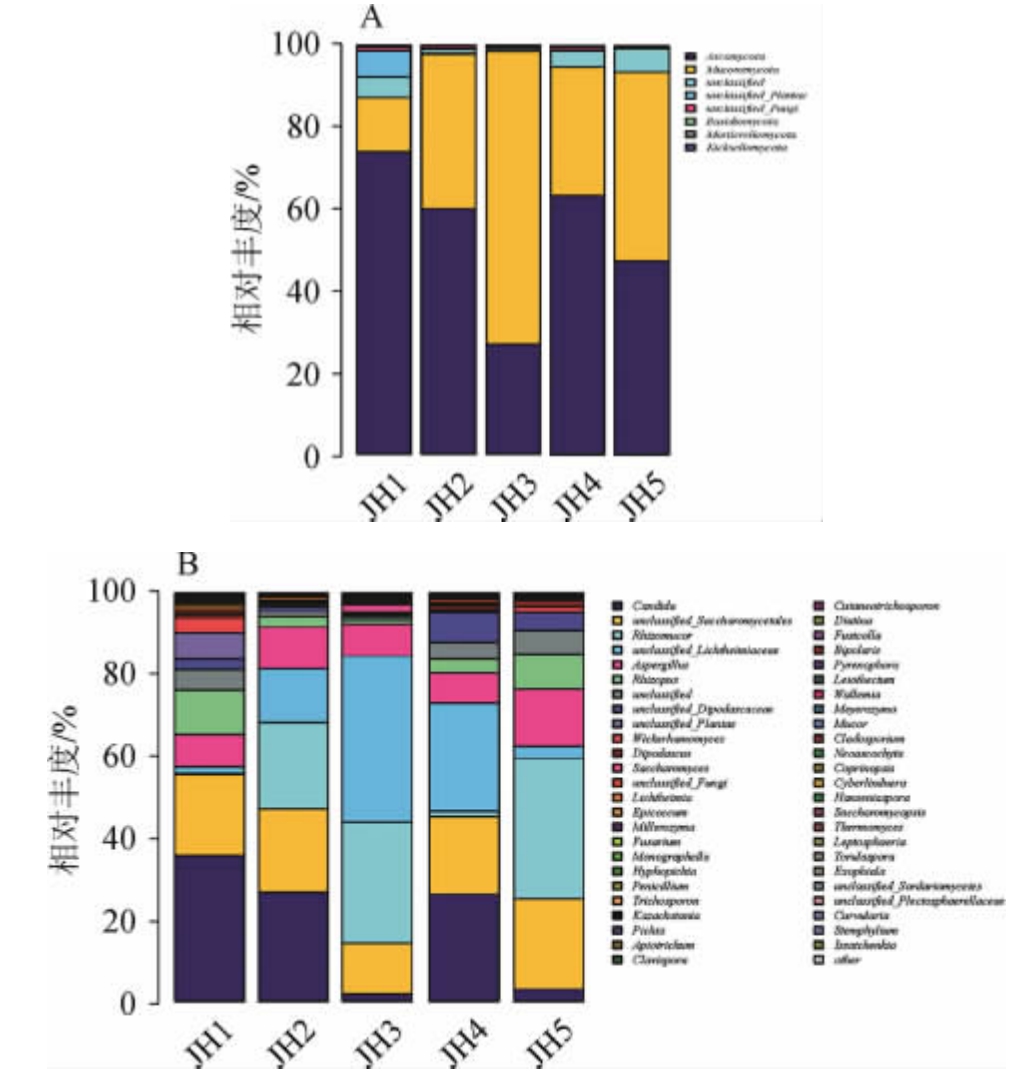
图3 大曲样品中真菌在门(A)和属(B)分级水平上的种类和相对丰度
Fig.3 Types and relative abundance of fungi in Daqu samples at phylum level (A) and genus level (B)
2.3 大曲细菌群落16S rRNA基因序列分析
由图4A可知,所有大曲样品中的细菌种群共37个门,其中厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)在大曲JH1占主导地位,其相对丰度占全部细菌群落的97.29%以上。随着发酵的进行,厚壁菌门相对丰度逐渐增加,在大曲JH3中达到最高为87.27%,之后,又逐渐降低至大曲JH5中的67.97%。与之对应的是变形菌门的此消彼长,由大曲JH1中的18.87%降低至大曲JH3中的1.86%,逐渐增加至大曲JH5中的18.87%。这可能是由于发酵过程中翻曲操作引起曲块温度的变化导致细菌结构的演替:温度升高有利于厚壁菌门类生长,而对变形菌门类生长和繁殖有阻碍作用。当曲温达到顶温阶段(大曲JH3)时,厚壁菌门类相对丰度达到最高,变形菌门类相对丰度降至最低。
由图4B可知,入房大曲JH1中分别检测到乳杆菌属(Lactobacillus),魏斯氏菌属(Weissella),葡萄球菌属(Staphylococcus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、泛菌属(Pantoea)和芽孢杆菌属(Bacillus),其中最优势菌是乳杆菌属,约占20.10%,乳杆菌属是白酒生产中非常重要的微生物之一,在酿造过程中具有促进美拉德反应、促进酿酒的发酵、维护与保持酿酒微生态环境等作用[27]。魏斯氏菌属属于乳酸细菌,分解葡萄糖产生CO2异型发酵产生乳酸,有利于乳酸乙酯的形成及酒质的稳定,是白酒酿造中的重要微生物之一[28]。当曲温达到顶温时,高温放线菌科克罗彭斯特菌属(Kroppenstedtia)成为明显优势菌群,相对丰度达到60.67%,乳杆菌属降至最低为15.41%。高温放线菌科克罗彭斯特菌的发现应该属于贾湖白酒大曲特殊微生物,结果说明高温放线菌不单只存在于高温大曲中,在中低温大曲中同样存在。该菌在酱香、浓香等主流香型白酒大曲中都未见报道,只在清香和芝麻香型白酒高温大曲中被检测出来[29-30],还可能是因为科克罗彭斯特菌在大曲发酵过程中生存时间较短,不易于取样检测。随着温度降低,在出房大曲JH5中,科克罗彭斯特菌属丰度已经降低至0.28%,而乳杆菌属重新占据优势,相对丰度达到31.89%。
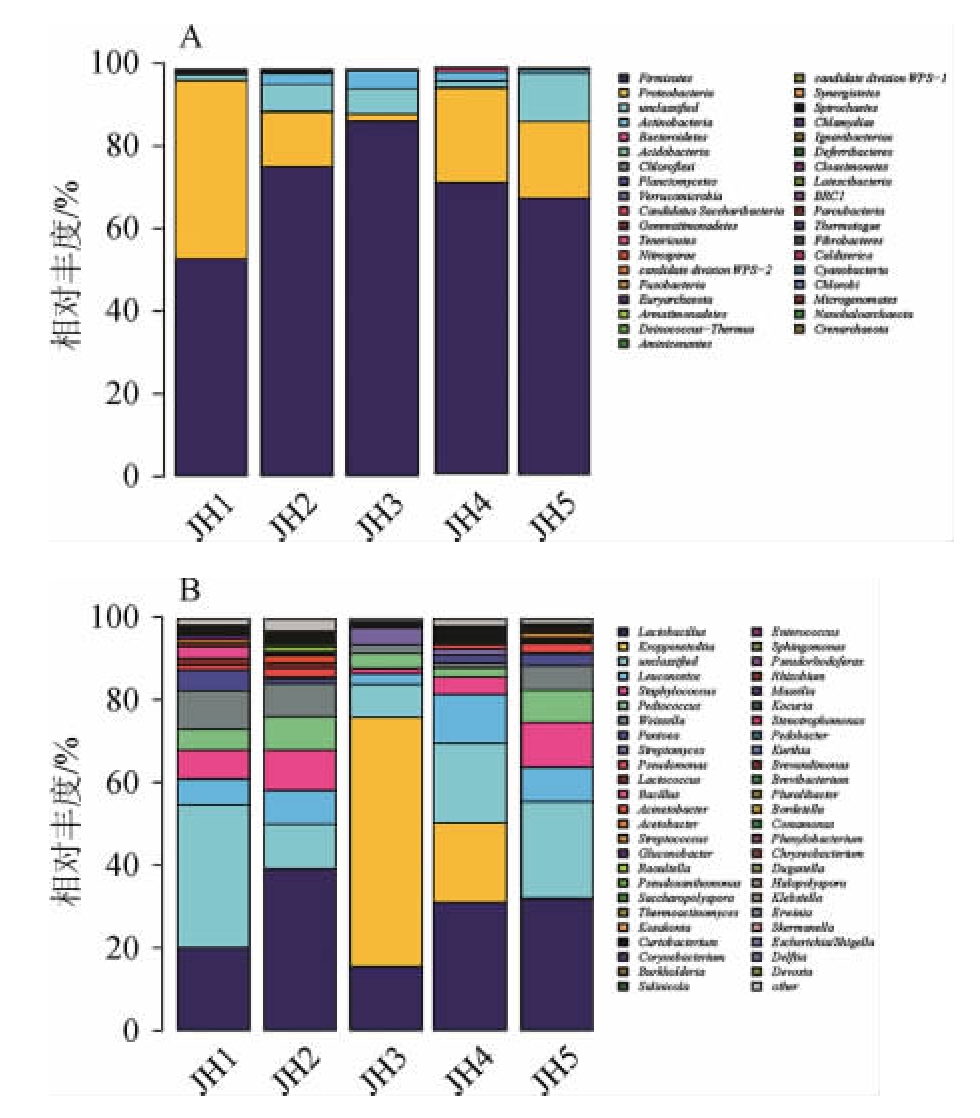
图4 大曲样品中细菌在门(A)和属(B)分级水平上的种类和相对丰度
Fig.4 Types and relative abundance of bacteria in Daqu samples at phylum level (A) and genus level (B)
3 结论
本研究分析了贾湖白酒大曲在整个发酵过程中的理化性质以及真菌和细菌的组成。研究结果得到一个大曲数据库,包含了5个不同发酵阶段获得的5个样品的测序数据。大曲样品从入房到出房,细菌和真菌微生物多样性指数(OTU值)表现出先升高后降低的趋势,并且都在曲温达到顶温时(大曲JH3)达到最高值。这也印证了整个培曲过程遵循“前缓、中挺、后缓落”的发酵规律,即大曲的培菌、生香转化主要在40 ℃~60 ℃~40 ℃这一温度变化区域内进行。贾湖白酒大曲生产过程中发酵前期真菌主要有假丝酵母属(Candida)、根霉属(Rhizopus)和曲霉属(Aspergillus),当曲温达到顶温时,横梗霉属(Lichtheimiaceae)成为优势菌群,发酵后期以毛霉属(Rhizomucor)和曲霉属为主。贾湖白酒大曲入房和出房样品中细菌组成变化不大,乳杆菌属(Lactobacillus)在整个发酵过程中一直存在。在发酵期间,不同时间点大曲样品芽孢杆菌属相对丰度分别为2.90%,0.23%、0.10%、0.12%和0.18%,酸度也随之降低和升高,表明大曲酸度大小与芽孢杆菌数量呈现正相关性。当曲温达到顶温时,高温放线菌科克罗彭斯特菌属(Kroppenstedtia)成为优势菌群,相对丰度达到60.67%,该菌属微生物应该属于贾湖白酒大曲中特殊微生物之一。细菌和真菌成分的这种动态变化是由大曲生产工艺过程翻曲操作和温度变化引起的。由于整个发酵过程中未接种发酵剂,这种相对稳定的细菌和真菌结构还可能与发酵环境有关。
[]ZHANG L,WU C,DING X,et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCR-DGGE[J].World J Microbiol Biotechn,2014,30:3055-3063.
[2]唐贤华,田伟,张崇军,等.中温大曲在发酵和贮存过程中微生物群落结构分析[J].中国酿造,2019,38(6):113-118.
[3]ZHENG X W,YAN Z,ROBERT NOUT M J,et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microbiol Biotechn,2015,31(1):199-208.
[4]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[5]WANG C L,SHI D J,GONG G L.Microorganisms in Daqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microbiol Biotechn,2008,24(10):2183-2190.
[6]LIU X,GUO K L,ZHANG H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCRdenaturing gradient gel electrophoresis[J].World J Microbiol Biotechn,2012,28(6):2375-2381.
[7]向慧平,林宜锦,关统伟,等.四川浓香型大曲生产中酵母菌、芽孢杆菌与工艺指标的关联性分析[J].食品科学,2020,41(2):196-201.
[8]SULAIMAN J,GAN H M,YIN W F,et al.Microbial succession and the functional potential during the fermentation of Chinese soy sauce brine[J].Front Microbiol,2014,5:556.
[9]TANG J,TANG X X,TANG M,et al.Analysis of the bacterial communities in two liquors of soy sauce aroma as revealed by high-throughput sequencing of the 16S rRNA V4 hypervariable region[J].Bio Med Res Int,2017,6271358.
[10]WANG Z M,LU Z M,SHI J S,et al.Exploring flavour-producing coremicrobiota in multispecies solid-state fermentation of traditional Chinese vinegar[J].Sci Rep,2016,6:26818.
[11]唐贤华,田伟,张崇军,等.中温大曲在发酵和贮存过程中微生物群落结构分析[J].中国酿造,2019,38(6):113-118.
[12]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Methods,2010,7:335-336.
[13]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460.
[14]COLE J R,CHAI B,FARRIS R J,et al.The ribosomal database project(RDP-II):introducing myRDP space and quality controlled public data[J].Nucleic Acids Res,2006,35:169-172.
[15]DESANTIS T Z,HUGENHOLTZ P,LARSEN N,et al.Greengenes,a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J].Appl Environ Microbiol,2006,72(7):5069-5072.
[16]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[17]李祖明,王德良,马美荣,等.不同酒曲酶系与发酵性能的比较研究[J].酿酒科技,2010(1):17-19.
[18]YAN Z,ZHENG X,CHEN J,et al.Effect of different Bacillus strain on the profile of organic acids in a liquid culture Daqu[J].J I Brewing,2013,119(1-2):78-83.
[19]FAN G S,SUN B G,FU Z L,et al.Analysis of physicochemical indices,volatile flavor components,and microbial community of a light-flavor Daqu[J].J Am Soc Brew Chem,2018,76(3):209-218.
[20]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biotechn,2015,42(12):1601-1608.
[21]ZOU W,YE G B,ZHANG K Z.Diversity,Function,and application of Clostridium in Chinese strong flavor Baijiu ecosystem:A review[J].J Food Sci,2018,83(5):1193-1199.
[22]HUANG Y H,YI Z L,JIN Y L,et al.New microbial resource:microbial diversity,function and dynamics in Chinese liquor starter[J].Sci Rep,2017,7(1):14577.
[23]祝云飞,黄治国,邓杰,等.浓香型大曲中一株酵母菌的分离鉴定及其挥发性产物分析[J].四川理工学院学报(自然科学版),2016,29(1):7-11.
[24]WU Q,CHEN L Q,XU Y.Yeast community associated with the solidstate fermentation of traditional Chinese Maotai-flavour liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[25]夏玙,罗惠波,周平,等.不同处理方式的大曲真菌群落差异分析[J].食品科学,2018,39(22):173-179.
[26]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:23-26.
[27]LONVAUD-FUNEL A.Lactic acid bacteria in the quality improvement and depreciation of wine[M].Berlin:Springer Netherlands,1999:95-100.
[28]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[29]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012(6):6-11.
[30]魏金旺.清香型白酒酿造过程中可培养高温放线菌的分离与鉴定[J].酿酒科技,2019(1):47-50,55.