大曲通过传统工艺自然接种生产,是富集、培养有益微生物及其代谢产物的载体,因此大曲是多种微生物及酶的混合体系,包括细菌、酵母菌和霉菌[1],在酿酒发酵过程中起着重要的糖化、发酵等作用[2]。在浓香型大曲中,酵母菌是关键的一类菌群,主要有酿酒酵母属(Saccharomyces)、假丝酵母属(Candida)、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)、汉逊酵母属(Hansenula)、结合酵母属(Zygosaccharomyces)、德巴利氏酵母属(Debaryomyces)和红酵母属(Rhodotorula)[3-5],是产酒与生香的关键功能菌,影响白酒的出品率及其香味成分。因此,对大曲中功能性酵母菌的研究势在必行[6]。
目前,对大曲酵母菌的研究多集中于酵母菌的分离、筛选及鉴定方面[7],也有对筛选出的酿酒酵母的耐高温、耐乙醇、耐酸等特性研究[8-13]。将耐高温、耐酒精等耐受性较好且产生较好风味的酵母应用到浓香型白酒生产中,有利于提高白酒品质和缩短发酵周期,对维持夏季的正常生产具有重要的意义[14-15]。有学者[16]从大曲中分离出2株耐性较好的优良菌株,并将其应用到酿酒生产中,取得良好的效果。
本研究以浓香型大曲为研究对象,采用稀释涂布平板法从中分离酵母菌,对其形态特征进行观察;采用2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)显色法初筛,通过发酵力、产酒能力、耐高温、耐酒精能力实验进行复筛,筛选一株优良的功能性酵母菌,利用Biolog微生物自动分析系统对其进行鉴定,并利用顶空固相微萃取-气相色谱-质谱联用技术(head space solid phase micro-extraction-gas chromatography-mass spectrometry,HS-SPMEGC-MS)对其液态发酵产物进行分析,以筛选出优良的功能酵母菌,丰富菌种资源,为浓香型白酒的品质提升提供思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲:亳州市某酒厂。YT鉴定板:美国Biolog公司。
1.1.2 主要试剂
2,3,5-氯化三苯基四氮唑(纯度≥98.0%):青岛海博生物技术有限公司;无水乙醇(纯度≥99.7%):国药集团化学试剂有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:国药集团化学试剂有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g,蛋白胨20 g,酵母膏10 g,蒸馏水1 000 mL,pH 5.0~5.5,115 ℃灭菌20 min。YPD固体培养基中添加20 g/L琼脂粉,115 ℃高压灭菌20 min。
发酵培养基[17]:取高粱粉1.8 kg,加蒸馏水7.2 L,蒸煮糊化90 min,取出,待温度降至90 ℃时加入2%淀粉酶(2 000 U/g),88~90 ℃保温水解1 h。待温度降至60 ℃时加入2%糖化酶(50 000 U/g)保温糖化1 h,糖化结束后取1滴与碘液反应,碘液不显蓝色即为反应彻底。过滤,得滤液。将滤液冷藏过夜澄清,取上清液,调糖度为12°Bx,115 ℃高压灭菌20 min。
1.2 仪器与设备
SX-700高压灭菌锅:日本TOMY公司;MH400-S生化培养箱:美国赛默飞世尔科技公司;DMI6000B荧光倒置显微镜:德国Leica公司;7890A-5975C气相色谱质谱联用仪、聚二甲基硅氧烷(polydimethylsiloxane,PDMS)萃取头:美国Agilent科技有限公司;UV-9000紫外可见分光光度计:上海元析仪器有限公司;Biolog自动微生物鉴定系统:美国Biolog公司。
1.3 方法
1.3.1 大曲菌悬液的制备
将大曲粉碎,过40目筛,称取10 g曲样加入90 mL无菌0.1%蛋白胨水溶液中,30 ℃、120 r/min振荡30 min,静置澄清,取上清液10倍逐级稀释至适当稀释度,制备稀释样。
1.3.2 酵母菌的分离及纯化
分别吸取稀释梯度为10-3倍、10-4倍、10-5倍的稀释液100 μL涂布于孟加拉红琼脂培养基,30 ℃培养48~72 h。挑取生长较好的、菌落形态不一的单菌落,接种于PDA培养基培养,多次划线分离,直至得到单菌落。对菌株的菌落形态及细胞形态进行观察,参照《常见与常用真菌》[18]对菌株进行初步鉴定。
1.3.3 酵母菌的初筛
将分离获得的酵母菌接种于YPD固体培养基,30 ℃条件下培养24 h,在其上覆盖一层TTC显色剂[19],于30 ℃恒温培养3 h,取出,观察颜色。初筛出显色较深、生长良好的菌株。
1.3.4 酵母菌发酵力测定
将分离得到的酵母菌划线于YPD培养基上,30 ℃培养24 h,连续划线2次,将活化的酵母菌接种于装有发酵培养基的试管中,装液量10 mL,30 ℃条件下培养48 h,获得种子液。按1%(V/V)接种量将种子液接种于发酵培养基,装液量为100 mL/250 mL,28 ℃条件下培养72 h,采用发酵栓法[20]测定发酵力。
1.3.5 酵母菌产乙醇能力测定
将种子液按10%(V/V)的接种量接种于发酵培养基,装液量为100 mL/250 mL,30 ℃条件下培养,分别在发酵3 d、5 d、7d时取样,采用蒸馏法测定酒精度[21]。
1.3.6 酵母菌耐高温特性测定
将种子液按10%(V/V)的接种量接种于YPD培养基,分别置于28 ℃、33 ℃、38 ℃、42 ℃和45 ℃条件下培养24 h,取样,在波长660 nm处测定吸光度值,以空白培养基为对照。
1.3.7 酵母菌耐酒精能力测定
将种子液按10%(V/V)的接种量接种于酒精度分别为10%vol~17%vol的麦芽汁(糖度10 °Bx)中,放置杜氏小管,30 ℃培养。分别在发酵8 h、12 h、24 h时取样,观察产气情况[22-23]。
1.3.8 酵母菌的鉴定
在无菌条件下,制备透光率为47%的菌悬液,将菌悬液接种于YT鉴定板上,每孔100 μL,26 ℃恒温培养24 h、48 h后,采用Biolog自动微生物鉴定系统进行鉴定[24]。
1.3.9 菌种发酵产物GC-MS分析
将种子液按10%(V/V)的接种量接种于发酵培养基,装液量为100 mL/250 mL,30 ℃条件下培养72 h。吸取50 mL发酵液,5 000 r/min离心10 min,取8 mL上清液,加入3.0 g氯化钠,采用PDMS萃取头顶空萃取30 min,采用GC-MS法[25]对发酵产物进行分析。
2 结果与分析
2.1 大曲中酵母菌的分离及形态观察
根据菌株在培养基上的菌落特征,分离获得9株菌株,命名为NDY-01~NDY-09,其菌落形态及细胞形态见图1。由图1可知,9株菌株菌落形态均为乳白色,圆润,易挑起,显微镜观察其细胞形态为椭圆状,根据菌落和细胞形态初步鉴定9株菌株为酵母菌属。

图1 9株酵母菌的菌落形态及细胞形态
Fig.1 Colony and cell morphology of 9 strains of yeast
2.2 大曲中功能酵母菌的筛选
2.2.1 TTC显色结果
根据菌株产酒能力越强,显色越明显的原理[10,26],从9株酵母菌中筛选得到3株使菌落呈深紫红色的菌株,分别为菌株NDY-01、NDY-02、NDY-06。
2.2.2 酵母菌的发酵力
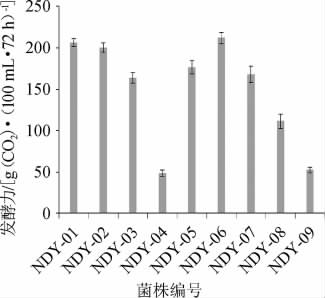
图2 筛选菌株的发酵力
Fig.2 Fermentation capacity of screened strains
9株菌株的发酵力测定结果见图2。由图2可知,9株酵母菌的发酵力为48.7~211.9g(CO2)/(100mL·72h),其中菌株NDY-06的发酵力最高,为211.9 g(CO2)/(100 mL·72 h);菌株NDY-01和NDY-02次之,分别为206.3g(CO2)/(100 mL·72 h)、200.5 g(CO2)/(100 mL·72 h);菌株NDY-04的发酵力最低,仅为48.7g(CO2)/(100mL·72h)。
2.2.3 酵母菌的产乙醇能力
选取发酵力较高的酵母菌NDY-01、NDY-02及NDY-06,测定其发酵3d、5d及7d的产乙醇能力,结果见表1。
表1 筛选菌株的产乙醇能力
Table 1 Alcohol production ability of screened strains

由表1可知,菌株NDY-02的产乙醇能力最高,发酵7d时,馏出液的酒精度可达5.2%vol,菌株NDY-06次之(4.9%vol),菌株NDY-01最差(4.4%vol)。
2.2.4 酵母菌的耐高温性能
对菌株NDY-01、NDY-02及NDY-06的耐高温性能进行测定,结果见图3。
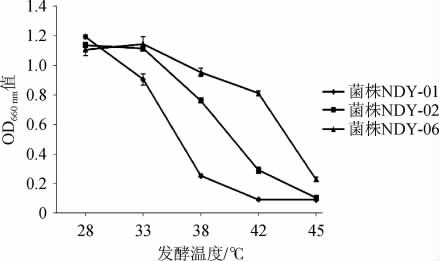
图3 不同温度下筛选菌株的生长情况
Fig.3 Growth situation of screened strains at different temperatures
由图3可知,随着发酵温度的升高,3株菌株的OD660nm值均逐渐降低,其中菌株NDY-06与NDY-02均可耐受42 ℃,且在42 ℃时,菌株NDY-06的OD660nm值>菌株NDY-02,菌株的NDY-06的耐高温性能最好,而菌株DNY-01可耐受38 ℃的温度。
2.2.5 酵母菌的耐酒精能力
选取产乙醇能力较高且耐高温性好的菌株NDY-06进行耐酒精试验,结果见表2。
表2 筛选菌株的酒精耐受性
Table 2 Alcohol tolerance of screened strains

注:“+”表示气体约占杜氏小管体积的1/5;“+++”表示气体约占杜氏小管体积的2/5;“+++”表示气体约占杜氏小管体积的3/5;“++++”表示气体约占杜氏小管体积的4/5;“+++++”表示杜氏小管充满气体。
由表2可知,当酒精度<16%vol时,酵母菌NDY-06均能产气;当酒精度为17%vol时,有微弱的产气。因此,确定菌株NDY-06的耐酒精度为16%vol。
2.3 酵母菌NDY-06的鉴定
通过Biolog自动微生物鉴定系统鉴定酵母菌NDY-06为产香酵母Zygosaccharomyces cidri。
2.4 酵母菌NDY-06发酵产物GC-MS分析结果
采用HS-SPME-GC-MS方法对酵母菌NDY-06发酵液中的挥发性风味物质进行分析,结果见表3。
表3 菌株NDY-06液态发酵产物GC-MS分析结果
Table 3 Analysis results of liquid state fermentation products of strain NDY-06 by GC-MS

续表

由表3可知,通过GC-MS从菌株NDY-06液态发酵产物中共检测35种挥发性风味物质,其中,醇类物质7种,相对含量最大(75.97%),且乙醇相对含量最高,为33.24%,其次为3-甲基丁醇和苯乙醇,分别占23.89%和18.33%。3-甲基丁醇是一种高级醇,具有果香味[27],苯乙醇具有玫瑰香,高级醇类是白酒中香气与后味的过渡桥梁,起到调和作用[28]中重要的呈香物质。酯类物质13种,相对含量仅次于醇类,为8.69%,包括辛酸乙酯、癸酸乙酯、乙酸乙酯、庚酸乙酯等酯类。在浓香型白酒的主体香味成分中,辛酸乙酯的绝对含量并不高,但其香气强度贡献值比传统观点认为的四大乙酯中的乙酸乙酯、乳酸乙酯、丁酸乙酯均要大,仅次于己酸乙酯,呈现较强的果香味[27,29]。酸类物质共检测出7种,其中包括辛酸、癸酸、己酸等,酸类化合物大多呈现酸味、奶酪香,是浓香型白酒中重要的一类风味物质[30]。此外,还检测出3种吡嗪类物质,不同类化合物间含量的比例对风味品质的影响也极其重要[31],这些物质共同构成了该酵母的产香成分。
3 结论
本研究通过稀释涂布平板法从浓香型大曲中共分离出9株酵母菌,通过TTC显色法初筛,发酵力、产乙醇能力、高温及酒精耐受性复筛筛选得到一株功能性酵母菌NDY-06,其可耐受42 ℃的高温,16%vol的酒精度,且具有一定的发酵产酒能力;利用Biolog微生物自动分析系统鉴定其为一株产香酵母Zygosaccharomyces cidri;通过HS-SPME结合GC-MS从该菌株液态发酵产物中共检测到35种挥发性物质,包括醇类物质7种,酯类物质13种,酸类物质7种,吡嗪类物质3种,对白酒香气成分有一定的贡献。
[1]炊伟强.泸州老窖大曲感官特征与微生物、理化指标和生化性能的关联研究[J].食品与生物技术学报,2011,30(5):761-766.
[2]侯召华,宁浩然,聂帅,等.国内外酒曲研究进展[J].特产研究,2013(3):72-75.
[3]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[4]赵爽,杨春霞,徐曼,等.浓香型白酒生产中酿酒微生物研究进展[J].食品与发酵科技,2012,48(1):24-29.
[5]周庆伍,汤斌,李安军.基于纯种分离技术对古井贡酒桃花曲微生物进行分离鉴定的研究[J].酿酒科技,2016(3):37-41.
[6]侯小歌,王俊英,李学思,等.浓香型白酒窖池主要功能性微生物的研究进展[J].酿酒科技,2013(2):96-106.
[7]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[8]张杰,侯小歌,王俊英.高温大曲中酵母菌的分离鉴定及耐高温性[J].中国酿造,2011,30(11):112-114.
[9]赖颖,赵锦慧,胡炳义.中高温大曲中耐高温酵母菌的筛选及其发酵特性的研究[J].酿酒科技,2014(11):35-38.
[10]宋瑶,缪礼鸿,高素芹,等.耐高温酒精酵母菌株的筛选及发酵能力比较[J].中国酿造,2009,28(5):38-42.
[11]汤有宏.高温曲中酵母茵的分离及耐热性研究[J].酿酒,2012,39(5):35-37.
[12]姚小飞,吴晓慧,叶璐.高酒精耐受性产酒酵母菌的选育[J].化学与生物工程,2013,30(7):67-70.
[13]刘海臣,冉淦侨,张兴.酒糟中超高温耐高酒精度酵母菌株的选育[J].酿酒科技,2007(5):27-29.
[14]崔海灏,孟姣姣.大曲中耐高温酵母菌的分离及性能测定[J].酿酒,2015,42(3):81-83.
[15]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:114-125.
[16]王勇.牛栏山酒厂优良酿酒酵母的筛选及鉴定[J].酿酒科技,2017(4):61-67.
[17]董琪,汤有宏,李晓欢,等.古井桃花曲中一株酵母菌的鉴定及其发酵代谢产物分析[J].酿酒,2018,45(1):62-66.
[18]中国科学院微生物研究所《常见于常用真菌》编写组.常见与常用真菌[M].北京:科学出版社,1978:254-256.
[19]王敏,朱会霞,孙金旭,等.高温酵母的分离及其特性研究[J].中国酿造,2006,25(11):38-41.
[20]周娜,简何,唐贤华,等.中高温浓香型大曲发酵力测定条件的优化研究[J].酿酒,2015,42(4):73-75.
[21]杨斌,周健,明红梅.浓香型大曲中1 株高发酵力芽孢杆菌的筛选和鉴定[J].酿酒科技,2018(5):7-12.
[22]陈忠军,杨小冲,赵洁,等.具高乙醇耐受力酵母菌的选育及其在猕猴桃果酒中的应用[J].食品工业科技,2018,39(2):141-145,151.
[23]成少宁,许先猛,马欣,等.废糖液酒精发酵中酵母菌的分离、筛选和验证[J].食品与发酵科技,2016,52(1):6-10.
[24]李金霞,程池,姚栗,等.Biolog 微生物自动分析系统-酵母菌鉴定操作规程的研究[J].食品与发酵工业,2006,32(7):50-53.
[25]吴文睿,李安军,汤有宏,等.古井贡酒窖泥中芽孢杆菌发酵风味的研究[J].食品科技,2016,41(3):27-30.
[26]王梅,张彭湃,帅桂兰,等.TTC 在黄酒酵母选育中的应用[J].酿酒,2001,28(5):62-64.
[27]李志斌,李净.浓香型白酒中辛酸乙酯含量及其风味贡献分析[J].酿酒科技,2013(4):65-67.
[28]程铁辕,李明春,张莹,等.主成分分析法在浓香型白酒酒质评价中的应用研究[J].中国酿造,2011,30(1):89-90.
[29]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):25-27.
[30]赵东瑞.古井贡酒风味物质及酚类风味物质的抗氧化性和抗炎性的研究[D].广州:华南理工大学,2019.
[31]WANG P P,LI Z,QI T T,et al.Development of a method for identification and accurate quantitation of aroma compounds in Chinese Daohuaxiang liquors based on SPME using a solgel fibre[J].Food Chem,2015,169:230-240.