泡菜是一类有着悠久历史的传统食品,按产地及口味主要分为中国泡菜、韩国泡菜和日本泡菜,日本泡菜属于非发酵型,中国泡菜和韩国泡菜属于发酵型[1]。朝鲜族泡菜是极具民族特色的中国泡菜之一,种类繁多,各具独特的风味且富含乳酸菌和乳酸[2]。樱菜是朝鲜族人种植的特色蔬菜,营养丰富,味道适合大众口味,但生长期短且具有季节性,因此,将其制成朝鲜族泡菜,提高了其营养价值和贮藏性[3]。
朝鲜族泡菜是一种风味独特的乳酸发酵蔬菜制品,富含活性乳酸菌,可以调节肠道菌群平衡。部分学者已对朝鲜族泡菜中的微生物进行了研究,孟令帅等[4]从25份朝鲜族家庭制作的传统发酵辣白菜中分离出81株乳酸菌,其中34株杆菌、47株球菌,归属于2个属6个种,45株屎肠球菌(Enterococcus faecium)、25 株植物乳杆菌(Lactobacillus plantarum)、4株干酪乳杆菌(Lactobacillus casei)、3株戊糖乳杆菌(Lactobacillus pentosus)、2株短乳杆菌(Lactobacillus brevis)、2株坚强肠球菌(Enterococcus durans);刘长蕾等[5]对朝鲜族辣白菜发酵过程中微生物变化进行了研究,结果表明,明串珠菌(Leuconostoc)是发酵蔬菜食品发酵初期的优势菌,发酵至8 d时明串珠菌数量达到最高,发酵20 d后,检测不到明串珠菌。目前对朝鲜族泡菜的研究集中于朝鲜族辣白菜,对传统发酵樱菜的研究报道甚少。此外,朝鲜族泡菜制作简便、成本低廉、食用方便,但发酵过程中存在着食用安全的问题,最值得关注的就是亚硝酸盐,因此,分离降解亚硝酸盐的菌株很有必要。
肠膜明串珠菌是乳酸菌中明串珠菌属(Leuconostoc sp.)的重要菌种[6-8],是自然发酵食品中的优势细菌[9]。对人和动物均无毒性和致病作用,尤其是肠膜明串珠菌肠膜亚种已被我国卫生部(2012年第8号公告)与美国食品药品监督管理局(food and drug administration,FDA)列为可食用菌种之一[10]。肠膜明串珠菌具有促进营养物质吸收,改善产品风味,同时具有抗氧化能力和拮抗致病菌能力[11-12]。因其能够产生特殊风味物质,在乳和泡菜等食品领域广泛应用[3,13-14]。
本研究从具有民族特色的延边朝鲜族地区采集24份传统发酵樱菜,从中分离筛选具有降解亚硝酸盐功能的肠膜明串珠菌,通过形态观察、生理生化试验和16S rDNA基因序列分析进行鉴定,并对其生长特性、产酸特性、耐盐特性和耐酸碱特性进行研究。旨在为进一步研究其生理功能和开发应用提供基础数据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
24份传统发酵樱菜分别取自延边朝鲜族自治州金刚山泡菜专卖店、农贸市场和超市,取样时间为2017年4月9日。
1.1.2 主要试剂
亚硝酸钠(分析纯):昆山东南化工材料有限公司;氯化钠(分析纯):东莞市聚鹏化学有限公司;1%万古霉素(分析纯):青岛高科园海博生物技术有限公司;扁桃苷、熊果糖、水杨苷、赤藓醇(均为优级纯):上海麦克林生化科技有限公司;甘露糖(优级纯):德国MERCK公司;L-鼠李糖(分析纯):上海化学试剂总厂试剂二厂;半乳糖、山梨醇、纤维二糖、乳糖、麦芽糖、蔗糖、果糖、L-阿拉伯糖、海藻糖、D-木糖、棉子糖、L-山梨糖、蜜二糖(均为优级纯):美国Sigma公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、SanPrep柱式DNA胶回收试剂盒:生工生物工程(上海)股份有限公司。
1.1.3 培养基
最低必需培养基(lowest minimal medium,LMM)、MRS固体培养基、MRS液体培养基:青岛高科园海博生物技术有限公司。
1.2 仪器与设备
PRESOCLAVE-Ⅱ高压灭菌器:西班牙SELECTA公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;HC-2518R冷冻高速离心机:安徽中科中佳科学仪器有限公司;CX41-RF荧光显微镜:日本OLYMPUS公司。
1.3 试验方法
1.3.1 肠膜明串珠菌的分离与纯化
无菌条件下,取延边朝鲜族传统发酵樱菜汁1 mL涂布于LMM固体培养基,28 ℃倒置恒温有氧培养48~72 h。挑取周围产生水滴状粘稠性多糖的菌落,在含有30 μg/mL万古霉素的MRS固体培养基上划线分离纯化2~3次。挑取单菌落,经镜检,确认获得单一菌种。
1.3.2 降解亚硝酸盐菌株的筛选
以不加亚硝酸钠的MRS液体培养基为空白对照,取分离的菌株,以3%(V/V)的接种量分别接种于含质量浓度为150 μg/mL亚硝酸钠的MRS液体培养基中,30 ℃、140 r/min条件下恒温振荡培养24 h,采用盐酸萘乙二胺法[15]测定菌液中亚硝酸盐含量,并计算亚硝酸盐降解率,其计算公式如下:
式中:X为亚硝酸盐降解率,%;Y为亚硝酸钠初始含量,mg/kg;Y1为发酵后亚硝酸钠含量,mg/kg。
选筛亚硝酸盐降解率>50%以上的菌株。
1.3.3 降解亚硝酸盐菌株的鉴定
(1)形态观察及生理生化试验[16-18]
参照《伯杰氏细菌鉴定手册》[17]和《乳酸细菌分类鉴定及实验方法》[18]的方法对筛选菌株进行形态观察及生理生化鉴定。生理生化试验项目包括37 ℃生长试验、1 ℃生长试验、过氧化氢酶试验、耐盐性试验、精氨酸水解试验、葡聚糖生成试验、柠檬酸利用试验、七叶苷水解试验和碳水化合物发酵试验。
(2)分子生物学鉴定
采用Ezup柱式细菌基因组DNA抽提试剂盒提取筛选菌株的基因组DNA,以其为模板,选用16S rRNA通用引物进行PCR扩增[19-20],正向引物为7F:5'-CAGAGTTTGATCCTGGCT-3';反向引物为1540R:5'-AGGAGGTGATCCAGCCGCA-3'。
PCR扩增体系:基因组DNA(20~50 ng/μL)0.5 μL、10×Buffer(含Mg2+)2.5 μL、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)1 μL、Takara Taq酶0.2 μL、引物7F0.5μL、引物1540R0.5μL、加双蒸水(ddH2O)至25μL。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。
PCR扩增结束后,用1%琼脂糖凝胶电泳检测PCR扩增产物,选取碱基长度为1 500 bp处亮度和长度适宜的条带,委托生工生物工程(上海)股份有限公司测序。
将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对工具(basic localalignmentsearch tool,BLAST)检索,选取序列同源性最高的已知菌种的16S rRNA序列,采用MEGA软件中的邻接(neighbor-joining,NJ)法构建系统发育树[21]。
1.3.4 降解亚硝酸盐菌株生长特性研究
最适生长温度的测定:取活化的筛选菌株,以2%(V/V)的接种量接种于MRS液体培养基中,分别置于25 ℃、28 ℃、30 ℃和36 ℃培养48 h,采用分光光度计在波长600 nm处测定其吸光度值(OD600nm值)。
生长曲线的测定:以不接菌的MRS液体培养基为空白对照。将活化好的筛选菌株以2%(V/V)的接种量接种于MRS液体培养基中,30 ℃、140 r/min条件下恒温振荡培养,每隔2 h取样,采用分光光度计测定其在波长600 nm处的吸光度值(OD600nm值)。
产酸能力的测定:以不接菌的MRS液体培养基为空白对照。将活化好的筛选菌株,以2%(V/V)的接种量接种于MRS液体培养基中,30 ℃、140 r/min条件下恒温振荡培养,每隔2 h取样,测定其pH值。
耐盐性能的测定:取活化的筛选菌株,以2%(V/V)的接种量分别接种于含0、4%、6%、8%和10% NaCl的MRS液体培养基中,30 ℃、140 r/min条件下恒温振荡培养24 h,采用分光光度计测定其在波长600 nm处的吸光度值(OD600nm值)。
耐酸碱性能的测定:以不接菌的MRS液体培养基为空白对照,将活化好的筛选菌株以2%(V/V)的接种量分别接种于初始pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的MRS液体培养基中,30 ℃、140 r/min条件下恒温振荡培养24 h,采用分光光度计测定其在波长600 nm处的吸光度值(OD600nm值)。
1.3.5 数据处理与分析
采用SPSS Statistics 17.0和Excel 2007软件进行数据处理与分析。
2 结果与分析
2.1 肠膜明串珠菌的分离与纯化
通过LMM培养基分离,从24份传统发酵樱菜中共分离出20株带有水滴状粘稠性多糖的菌落;其中17株能在含30 μg/mL万古霉素的MRS固体培养基上生长。
2.2 降解亚硝酸盐菌株的筛选
测定分离得到的17株菌株的亚硝酸盐降解能力,亚硝酸盐降解率见图1。
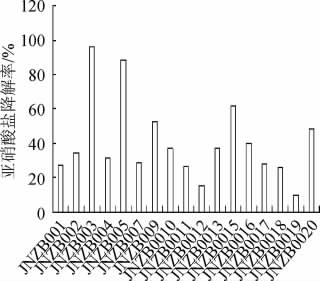
图1 17株菌株的亚硝酸盐降解能力
Fig.1 Nitrite degradation capacity of 17 strains
由图1可知,菌株JNZB003、JNZB005、JNZB009 和JNZB015的亚硝酸盐降解率均>50%,分别为95.92%、88.36%、52.71%、61.62%。
2.3 降解亚硝酸盐菌株的鉴定
2.3.1 形态学特征
4株具有降解亚硝酸功能的菌株中,菌株JNZB003在LMM培养基和含30 μg/mL万古霉素的MRS培养基上的菌落形态见图2,4株菌株革兰氏染色镜检结果图3。

图2 菌株JNZB003在LMM培养基(a)和含30 μg/mL万古霉素MRS固体培养基(b)上的菌落形态
Fig.2 Colony morphology of strain JNZB003 on LMM medium (a) and MRS solid medium with vancomycin 30 μg/ml (b)
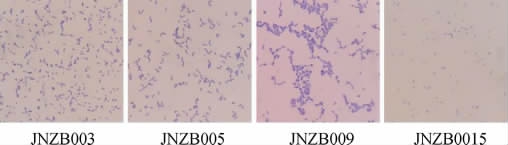
图3 筛选菌株的革兰氏染色结果
Fig.3 Gram staining results of screened strains
由图2可知,菌株JNZB003在LMM培养基上呈水滴状菌落,在30 μg/mL万古霉素MRS培养基上,菌落呈圆形、乳白色、表面光滑,其他菌株菌落形态相似。由图3可知,4株菌株均为革兰氏阳性菌,细胞形态呈球形和短杆形,成对或成短链排列。
2.3.2 生理生化试验
将4株具有降解亚硝酸盐功能的菌株进行生理生化试验,结果见表1~表2。
表1 筛选菌株生理特性鉴定结果
Table 1 Identification results of physiological characteristics of screened strains

注:“+”代表生长;“-”代表不生长。
由表1可知,4株菌株均对30 μg/mL万古霉素具有耐受性,过氧化氢酶阴性,1 ℃条件下均不生长,37 ℃条件下均生长;在3%和6.5%氯化钠溶液中不同程度生长,其中菌株JNZB003、JNZB009和JNZB015在3%和6.5%氯化钠溶液中生长良好,菌株JNZB005在3%氯化钠生长良好,但在6.5%氯化钠溶液中微弱生长。
表2 筛选菌株生化特性鉴定结果
Table 2 Identification results of biochemical characteristics of screened strains
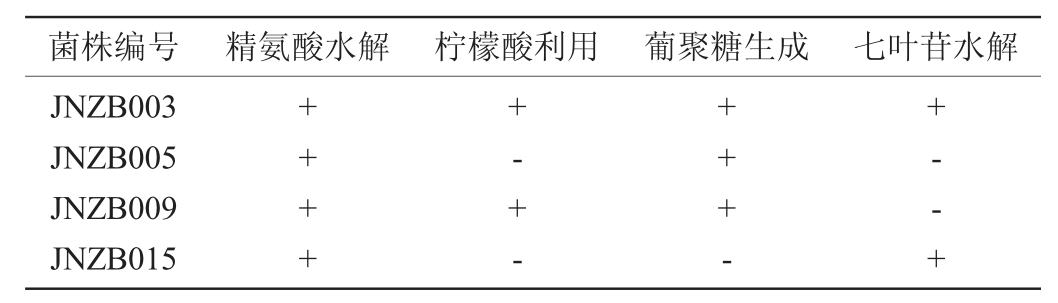
注:“+”表示结果呈阳性;“-”表示结果呈阴性。下同。
由表2可知,4株菌株精氨酸水解试验均为阳性反应;菌株JNZB003和JNZB009能够代谢柠檬酸,而菌株JNZB005和JNZB015不能代谢柠檬酸;菌株JNZB003和JNZB015能水解七叶苷,而菌株JNZB005和JNZB009不能水解七叶苷;菌株JNZB003、JNZB005和JNZB009能生成葡聚糖,而菌株JNZB015不能生成葡聚糖。
表3 筛选菌株的碳源利用试验结果
Table 3 Results of carbon source utilizing tests of screened strains
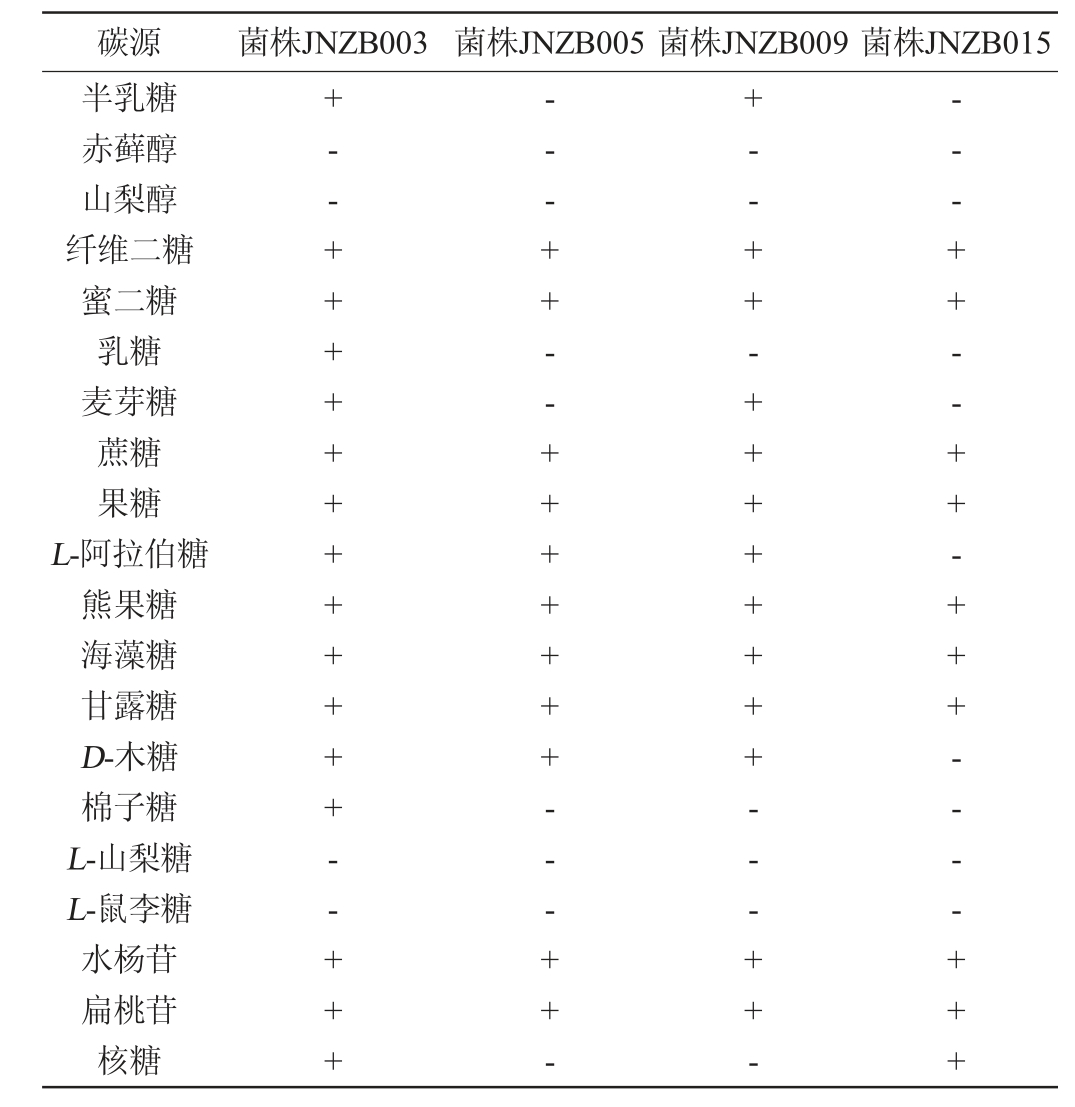
由表3可知,4株菌株都可以利用纤维二糖、蜜二糖、蔗糖、果糖、熊果糖、海藻糖、甘露糖、水杨苷、扁桃苷;都不能利用赤藓醇、山梨醇、L-山梨糖和L-鼠李糖;此外,菌株JNZB003可以利用半乳糖、麦芽糖、D-木糖、棉子糖、L-阿拉伯糖和核糖;菌株JNZB005可以利用D-木糖和L-阿拉伯糖;菌株JNZB009可以利用半乳糖、麦芽糖、L-阿拉伯糖和D-木糖。
根据《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》中对明串珠菌属的描述,结合形态学特征、生理生化特性试验,初步判断4株菌株均为明串珠菌属(Leuconostoc sp.)。
2.3.3 菌株的16S rRNA基因序列分析
在形态学特征和生理生化试验基础上,对筛选的4株菌株进行16S rRNA序列分析,构建系统发育树。以提取的4株菌株基因组为模板,利用16S rRNA通用引物,分别扩增出1.5 kb的目的片段。通过PCR产物纯化、克隆、测序,获得4株菌株的近乎全长16S rRNA 基因片段。通过NCBI数据库BLAST检索,选取序列同源性最高的已知菌种的16S rRNA序列,采用MEGA软件中的邻接(neighbor-joining,NJ)法构建系统发育树,结果见图4。

图4 基于16S rRNA基因序列4株菌株的系统发育树
Fig.4 Phylogenetic tree of 4 strains based on 16S rDNA gene sequences
由图4可知,4株菌株均属于明串珠菌属(Leuconostoc sp.)。其中菌株JNZB003与肠膜明串珠菌(Leuconostoc mesenteroides)亲缘关系最近;菌株JNZB005和JNZB009与冷明串珠菌(Leuconostoc gelidum)亲缘关系最近;菌株JNZB015与肉明串珠菌(Leuconostoc carnosum)亲缘关系最近。
综上,综合形态学特征、生理生化特性和16S rRNA基因序列分析,将菌株JNZB003鉴定为肠膜明串珠菌(Leuconostoc mesenteroides),菌株JNZB005、JNZB009鉴定为冷明串珠菌(Leuconostoc gelidum),菌株JNZB015鉴定为肉明串珠菌(Leuconostoc carnosum)。
2.4 肠膜明串珠菌JNZB003的生长特性分析
同种微生物因来源不同,在某些特性上存在一定的差异。因此,对既具有民族地方特色又是新菌源分离的肠膜明串珠菌JNZB003的生长特性进行分析,结果见图5。
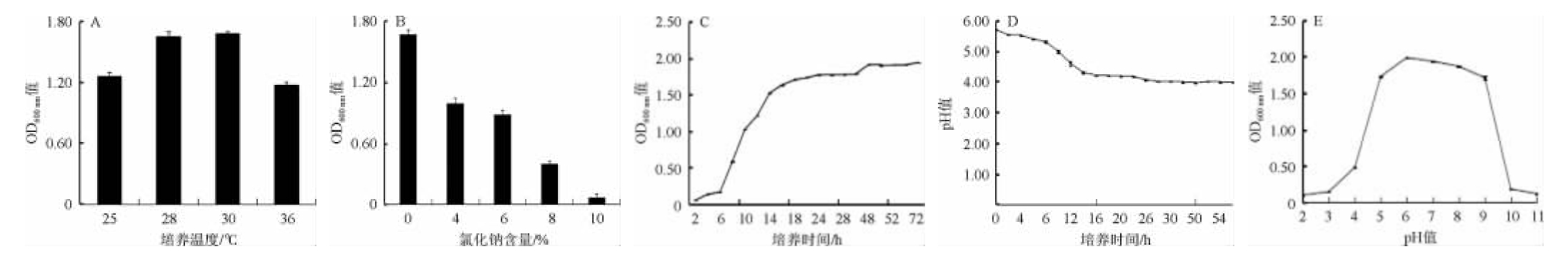
图5 肠膜明串珠菌JNZB003的生长特性
Fig.5 Growth characteristic of Leuconostoc mesenteroides JNZB003
由图5A可知,肠膜明串珠菌JNZB003的生长温度范围较宽,在25~30 ℃范围内均能良好生长,最适生长温度为30 ℃。
由图5B可知,随着NaCl含量的增加,肠膜明串珠菌JNZB003生长能力逐渐减弱,当NaCl含量为8%时,菌株生长缓慢,当NaCl含量达到10%时,菌株微弱生长。朝鲜族泡菜含盐量一般在8%~10%,表明此菌在这个环境条件下有活性。
由图5C可知,肠膜明串珠菌JNZB003具有良好的生长特性,培养0~6 h,为迟滞期;培养6~14 h,为对数期;培养14 h后进入稳定期,此时OD600nm值达到1.52;培养48 h时,OD600nm值最高,达1.91,之后OD600nm值开始缓慢降低,进入衰减期。
由图5D可知,肠膜明串珠菌JNZB003产酸较快,培养12 h时,pH值降至4.60;培养24 h时,pH值降至4.16;培养28 h时,pH值降至3.98;培养28 h后,pH趋于稳定。产酸快,影响发酵程度及产品的风味和品质,且能抑制杂菌生长。
由图5E可知,肠膜明串珠菌JNZB003的最适生长pH值为6.0。当pH值<4.0和pH值>10.0时,菌株生长缓慢;当pH值为2.0和11.0时,菌株也能微弱生长,说明此菌耐酸碱性能较好。
3 结论
本研究从具有民族特色的延边朝鲜族地区采集24份传统发酵樱菜,从中分离筛选出4株具有降解亚硝酸盐功能的疑似肠膜明串珠菌。通过形态学特征、生理生化试验和16S rRNA序列分析鉴定菌株JNZB003为肠膜明串珠菌(Leuconostoc mesenteroides),菌株JNZB005、JNZB009为冷明串珠菌(Leuconostoc gelidum),菌株JNZB015为肉明串珠菌(Leuconostoc carnosum)。肠膜明串珠菌JNZB003在含150 μg/mL亚硝酸盐的MRS液体培养基中培养24 h时,亚硝酸盐降解率高达95.92%,其最适生长温度为30 ℃,最适生长pH值为6.0,培养14 h生长进入稳定期,培养12 h pH值降至4.60,当NaCl含量为8%和pH值为3~10时,能够生长,具有良好的降解亚硝酸盐能力、生长特性、产酸能力,且耐盐和耐酸碱。
[1]LEE B H,HYUN J Y,MYEONG S P,et al.Transformation of the glycosides from food materials by probiotics and food microorganisms[J].Mi-crobiol Biotechn,2006,16(4):497-504.
[2]马艳弘,魏建明,侯红萍,等.发酵方式对山药泡菜理化特性及微生物变化的影响[J].食品科技,2016,37(17):179-184.
[3]李冬梅,白月娥,李玲,等.SDS-PAGE 电泳法分析朝鲜族辣白菜中乳酸菌分布[J].食品科技,2012,37(11):10-13.
[4]孟令帅,张颖,皱婷婷,等.辣白菜中乳酸菌的分离鉴定[J].食品科学,2015,36(11):130-133.
[5]刘长蕾,苗乘源,文宇萍,等.东北酸菜和朝鲜族辣白菜发酵过程中微生物的变化[J].东北农业科学,2019,44(3):74-77,82.
[6]鄢明辉.肠膜明串珠菌BD3749 亚种水平的鉴定及其生长特性研究[J].食品科学技术学报,2017,35(4):42-48.
[7]GAO C X,YAN M H,WU Z J.Subspecies identification of Leuconostoc mesenteroides BD1710 using specific primers[J].J Dairy Sci Technol,2016,39(1):5-7.
[8]李婧,张柏林.肠膜明串珠菌6055 合成低聚葡萄糖培养条件的优化[J].宁夏农林科技,2019,60(11):60-62.
[9]崔亮,岳媛媛,乌日娜.明串珠菌应用研究进展[J].乳业科学与技术,2018,41(5):28-34.
[10]DONG H,ROWLAND I,YAQOOB P.Comparative effects of six probiotic strains on immune function in vitro[J].Brit J Nutr,2012,108(3):459-470.
[11]韩亚楠,程方方,武亚婷,等.辣椒酱发酵菌肠膜明串珠菌C27 高密度培养条件优化[J].中国酿造,2020,39(3):99-103.
[12]熊涛,肖阳生,李军波,等.温度对四川泡菜中菌系及其代谢产物分布的影响[J].食品发酵与工业,2016,42(2):77-81.
[13]杨玉新,韦鹏,李丹,等.新疆特色食品中优良乳酸菌的筛选及分离鉴定[J].中国酿造,2017,36(4):50-53.
[14]孙擎,张恕铭,谭霄,等.一株高产葡聚糖肠膜状明串珠菌肠膜亚种的筛选及发酵条件优化[J].食品科技,2019,44(7):16-22.
[15]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.33—2016 食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[16]HOLZAPFEL W H,WOOD B J B.The family Leuconostocaceae[J].Berlin:Springer,2014:377-380.
[17]BUCHANNAN R E,GIBONS R E.伯杰细菌鉴定手册[M].北京:化学工业出版社,2006.
[18]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:85-89.
[19]乌日娜.内蒙古传统酸马奶中乳杆菌的分离鉴定及16S rDNA 序列同源性分析[D].呼和浩特:内蒙古农业大学,2005.
[20]SCARPELLlNI M,MORA D,COLOMBO S,et a1.Development of genus/species-specific PCR analysis for identification of Carnobacterium strdms[J].Curr Microbiol,2002,5(1):24-29.
[21]LAU S K,WOO P C,WOO G K,et al.Catheter-related Microbacterium bacteremia identified by 16S rRNA gene sequencing[J].J Clin Microbiol,2002,40(7):2681-2685.