高级醇(又称杂醇)一般指具有两个以上的碳原子的一元醇[1],酵母碳代谢和氨基酸代谢途径中的重要副产物[2],常见于各类酒精饮品中,在葡萄酒中主要以异丁醇、异戊醇、β-苯乙醇等为主导[3]。低浓度的高级醇和它们的酯,对葡萄酒的风味和香味起着关键作用[4-5],但高浓度杂醇给葡萄酒带来异味,容易引起饮酒后“上头”,甚至给身体健康造成伤害[6-9]。在我国部分葡萄酒产区,受原料、工艺等影响导致酒中高级醇含量通常偏高,因此,对于这些产区内的葡萄酒生产企业而言,利用经济、简便的高级醇检测分析手段,发现并控制葡萄酒中高级醇的来源,是亟需解决的技术问题。
葡萄酒中高级醇的检测方法主要有气相色谱法(gas chromatography,GC)、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)和比色法(GB/T 5009.48—2003《蒸馏酒及配制酒卫生标准的分析方法》)[10]。气相色谱法和气质联用法可以利用高级醇标准品,对葡萄酒的单个高级醇进行相对定量或者绝对定量,分析准确性较高,是目前实验检测使用较为普遍的方法,但存在标准样品昂贵且不便保存、样品前处理操作复杂、设备价格昂贵等缺点[11],并不适宜国内众多中小型酒类生产企业在生产过程中快速检测的实际需要和实验室以高级醇含量为观测点的大批量菌株的快速初筛。比色法则起初用于蒸馏酒中杂醇的检测,其根据高级醇(正丙醇除外)与浓硫酸脱水转化为不饱和烃,与对二甲胺基苯甲醛发生缩合反应,生成橙黄色化合物的原理来测定。该法操作简单,不需要昂贵检测设备,检验量大且经济,依然是生产企业实际生产中适用的方法。但是比色法除了不能定量单一高级醇的缺陷外,还存在加热温差大容易导致爆管、针对葡萄酒检测条件不明晰、干扰因素多、显色不稳定等问题。
葡萄酒中的高级醇产量一方面与酿造工艺技术有关,如葡萄汁初始糖含量[12]、氮源的种类[13-14]及含量[15-16],发酵温度,pH值、溶氧量和贮存时间等;另一方面,由于葡萄酒中的高级醇主要是酵母代谢产生[20],研究人员主要围绕酵母的Ehrlich途径,通过测序研究其基因结构及功能[21],以及通过基因调控互作[22-24]研究等,来揭示酵母的高级醇代谢调控途径,从而为低产高级醇酵母的基因工程育种提供理论支撑。
本研究在国标比色法[27]和前人研究的基础上[12,26-27]进行多个条件优化,建立了一种显色稳定、能够准确检测高级醇含量的方法,随后以商业酵母CECA为对照,采用优化比色法和GC-MS法对课题组核心酵母种质资源库中的6株本土酿酒酵母产高级醇能力进行检测分析,旨在筛选得到具有较好发酵特性且低产高级醇的本土酿酒酵母,为实际生产提供应用指导。
1 材料与方法
1.1 材料与试剂
实验材料为本实验室前期从新疆、宁夏、内蒙古葡萄酒产区筛选得到的发酵性能优良、具有商业化潜力的6株本土酿酒酵母(Saccharomyces cerevisiae),对照菌株为商业酵母CECA,均于实验室-80 ℃冰箱中保存。
对二甲氨基苯甲醛:上海叶源生物科技公司;异戊醇、异丁醇等高级醇标准品(均为色谱纯);无水乙醇、浓硫酸、吐温80(均为国产分析纯):国药集团化学试剂有限公司。对二甲氨基苯甲醛-硫酸溶液(5 g/L):0.5 g对二甲氨基苯甲醛加硫酸溶解至100 mL。高级醇标准使用液:称取0.08 g异戊醇,0.02 g异丁醇,50 mL无杂醇油乙醇,定容至100 mL配成高级醇标准溶液Ⅰ,随后吸取5 mL溶液Ⅰ到50 mL容量瓶中,加水稀释至刻度线(相当于0.1 mg/mL高级醇)。酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、Triple M模拟葡萄汁[28]:自制。
1.2 仪器与设备
UV1800 紫外分光光度计:日本岛津公司;7890B GC、5975B MS气相色谱-质谱联用仪:美国Agilent公司;HH-4数显恒温水浴锅:国华电器有限公司;ZHWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;BK1301生物显微镜:重庆光电仪器有限公司;ELX800酶标仪:美国BioTek公司。
1.3 方法
1.3.1 样品制备
-80 ℃取菌,YPD固体培养基划线培养,挑单菌落进行二次纯化,镜检后接入50mLTripleM模拟汁中28℃、150r/min培养24 h,随后以5×105 CFU/mL接入300 mL模拟汁中,每株菌设置3个平行,模拟白葡萄酒发酵条件25 ℃静置发酵。每天监控CO2质量损失,待糖降至4 g/L以下结束发酵,装入100 mL样品瓶中存放于-30 ℃冰箱待测。测定残糖采用3,5二硝基水杨酸(dinitrosalicylic acid,DNS)法[29]。
1.3.2 比色法测定酒中的高级醇含量
国标法常用于蒸馏酒中高级醇的检测,具体测步骤详见GB/T5009.48—2003《蒸馏酒及配制酒卫生标准的分析方法》[27],其标准曲线绘制所用高级醇标准使用液的体积按照0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1 mL加入反应体系,比较高级醇质量浓度在0~40 mg/L、0~50 mg/L、0~60 mg/L、0~70 mg/L和0~100 mg/L间的线性关系。优化实验则通过使用乙醇检测剩余的蒸发馏出液作为检测初始样品以简化复杂的前处理步骤,后分别对酒样稀释倍数(未稀释,稀释5、10、20倍)、加样静置时间(1 min、3 min、5 min)、水浴条件(100 ℃15 min、90 ℃20 min、80 ℃20 min、90 ℃30 min、80 ℃30 min)和稀释剂种类(水、50%硫酸溶液、浓硫酸)进行优化条件探索,摇匀10 min后,用1 cm比色杯以“0”调节零点,波长520 nm处测吸光度值,每个样品平行检测5次,测定结果及相对标准偏差(relative standard deviation,RSD)。
1.3.3 GC-MS法测定酒中的高级醇含量
参考蔡建[30]的检测方法。标准溶液配制:将内标物4-甲基-2-戊醇(1.0 g/L)及醇类标准物溶于酒精度12%vol、酸7 g/L(以酒石酸计)、pH3.3、葡萄糖2 g/L的模拟汁中,现配现用保存于4 ℃。
顶空固相微萃取:AgilentPALRSI85进样系统,吸取5mL的酒样、1 g NaCl置于15 mL样品瓶,PTFE-硅隔膜盖紧,400 r/min、40 ℃条件下加热30 min,后解吸25 min。
GC-MS条件:HP-INNOWAX毛细管柱(60mm×0.25mm×0.25 μm);载气高纯氦气(He)(流速1 mL/min);250 ℃热解吸25 min,柱温箱的升温50 ℃保持1 min,以3 ℃/min的速度升温至220 ℃,保持5 min;质谱接口温度280 ℃;离子源温度230 ℃;电离方式为电子电离(electron ionization,EI)源;电子能量70 eV;质量扫描范围29~350 u;运行时间62.67 min;每个样品重复两次。依据标样色谱保留时间、质谱信息,比对美国国家生物信息中心(national center of biotechnology information,NIST)14.L标准谱库进行定性分析,采用内外标法进行定量分析。
1.3.4 统计分析
数据采用Excel2016整理绘制,以平均值±标准差(![]() ±S)形式表示;显著性差异分别用t检验和单因素方差分析,采用Minitab18软件分析;图表使用Origin 8.5软件绘制。
±S)形式表示;显著性差异分别用t检验和单因素方差分析,采用Minitab18软件分析;图表使用Origin 8.5软件绘制。
2 结果与分析
2.1 葡萄酒高级醇检测方法的优化
2.1.1 待测样品的稀释
实验首先利用国标法测定高级醇质量浓度在0~40mg/L、0~50 mg/L、0~60 mg/L、0~70 mg/L和0~100 mg/L间的线性关系,结果见图1。

图1 高级醇标准曲线
Fig.1 Standard curve of higher alcohol
由图1可知,高级醇检测浓度与吸光度值在一定范围内才具有良好线性关系,当检测样品的高级醇含量在不高于40 mg/L时,最大吸光度值达0.351 1,其线性系数(R2)可以达到0.999,而当高级醇质量浓度超过70 mg/L时,其吸光度值极不稳定。在葡萄酒中,高级醇含量一般在90~300 mg/L范围内,常高于标准曲线的最高检出浓度,因此针对葡萄酒样品检测分析时,有必要将样品的高级醇浓度进行稀释。
而在国标法中并未明确规定样品稀释倍数,本实验将同一发酵酒样分别进行不稀释、稀释5倍、10倍和稀释20倍进行吸光度值和相对标准偏差比较,结果见图2。
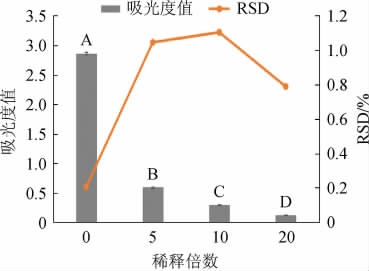
图2 酒样稀释倍数对吸光度值及精密度的影响
Fig.2 Effect of sample dilution times on absorbance and precision
大写字母不同表示差异显著(P<0.05)。下同。
由图2可知,4种处理的吸光度随着稀释倍数的增加而逐渐减小,且RSD均在5%以内,其中未稀释酒样精密度虽最好但平均吸光值达0.982 6,显著高于标准曲线最高检出限,而剩余3种处理中稀释20倍的样品其标准偏差最小,表示精密度更高,显色也更稳定。
2.1.2 加样静置时间、稀释剂及反应体系条件的优化
将稀释后的酒样置于试管中,沿管壁缓慢加入二甲氨基苯甲醛-硫酸显色剂,等其沉至管底后再将各管同时摇匀进行加热,不同静置时间对检测值的影响见图3。
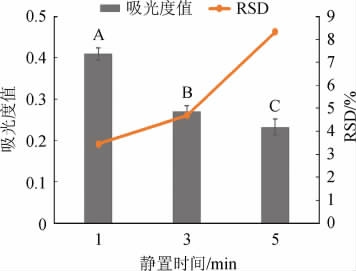
图3 加样静置时间对吸光度值及精密度的影响
Fig.3 Effect of sample standing time on absorbance and precision
由图3可知,静置时间与吸光度值成反比,与RSD值成正比,即静置时间越短显色度和精密度越高。从反应稳定性和显色强度来考虑,在加样后静置1 min时,吸光度值为0.409±0.014,RSD(3.45%)最低,为最优实验水平。因此,实验要求加样尽量迅速并把控时间在1 min内,避免静置时间过长导致吸光度值及精密度过低的问题。
GB/T 5009.48—2003《蒸馏酒与配制酒卫生标准的分析方法》中选择蒸馏水作为样品稀释剂,本实验分别比较了蒸馏水、50%硫酸溶液和浓硫酸作稀释剂对检测值的影响,结果如图4所示。
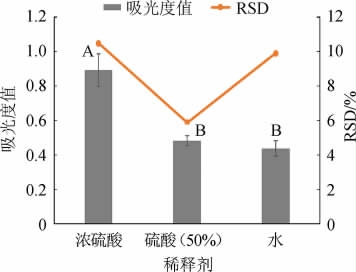
图4 稀释剂种类对吸光度值及精密度的影响
Fig.4 Effect of diluent type on absorbance and precision
由图4可知,以浓硫酸为稀释剂时,因硫酸液体黏稠等因素,会造成检测结果的精密度偏低。而将浓硫酸稀释至50%硫酸溶液后,实验精密度较水和浓硫酸条件下提高近1倍,且吸光度平均值为0.482±0.028,与以水为稀释剂(0.439±0.043)无显著差异。综上,50%硫酸溶液较水精密性更好,较浓硫酸更具经济效益和安全性。
GB/T 5009.48—2003中,需要将盛有反应体系的玻璃试管从沸水中立即放入冰水中,但由于温差悬殊,容易造成爆管、鼓塞等,给实验带来诸多不便,因此需要进行水浴条件优化。以100 ℃沸水浴15 min为对照,进一步比较90 ℃水浴20 min、30 min及80 ℃水浴20 min、30 min的吸光度值和精密度,结果见图5。
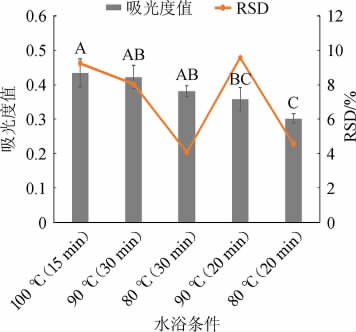
图5 水浴条件对吸光度值及精密度的影响
Fig.5 Effect of water-bath conditions on absorbance and precision
由图5可知,与沸水浴15 min相比较,90 ℃水浴30 min和80 ℃水浴30 min,样品检测的吸光度值无显著差异,但80 ℃水浴30 min条件下,其精密度RSD(4.08%)是最高的,这说明80 ℃水浴30 min处理反应体系可以在不影响吸光度值的前提下让显色更稳定,同时温和的反应条件也大大降低了爆管风险。
2.1.3 优化方法的精密度和回收率
通过对实验条件的分析,发现当葡萄酒酒样在梯度稀释20倍,加样静置1 min,80 ℃水浴30 min且以50%硫酸溶液作为稀释剂的条件下,实验得到最优水平,随后分别按国标方法与优化方法绘制高级醇标准曲线,结果见图6。由图6可知,在0~40 mg/L质量浓度范围内,吸光度值与高级醇质量浓度均呈具有良好的线性关系。
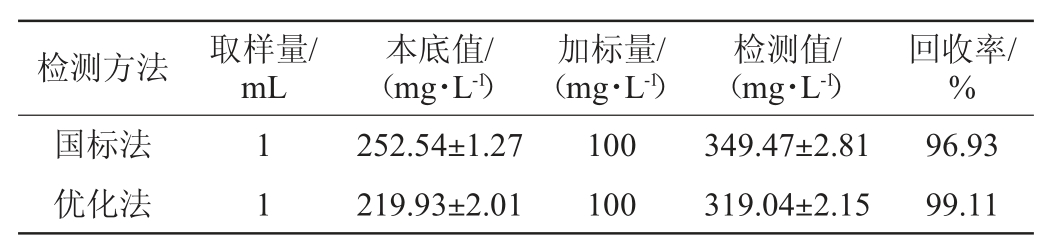
随机抽取一酒样,利用国标方法和优化方法将其平行检测5次,精密度试验结果以及回收率试验结果分别见表1和表2。结果表明,国标方法检测的高级醇含量的标准偏差为32.297,相对标准偏差为6.052%,而优化方法检测的高级醇含量的标准偏差仅为7.008,相对标准偏差为1.665%,这表明优化后的方法精密度更好,测量结果更接近真实值。取同一酒样1 mL于试管,加入100 mg/L的高级醇标准使用液10 μL,后分别采用国标法和优化法平行检测6次并计算样品加标回收率,结果两种方法的加标回收率均>95%,说明实验方法准确可行。其中优化方法加标回收率为99.11%,高于国标方法的加标回收率(96.930%),进一步说明优化方法检测高级醇时准确度更高,数据更可靠。

图6 国标法与优化法标准曲线比较
Fig.6 Comparison of standard curves between national standard method and optimized method
表1 国标方法与优化比色方法的精密度比较
Table 1 Comparison of precision between national standard method and optimized method

表2 国标方法与优化比色方法的回收率比较
Table 2 Comparison of recovery rate between national standard method and optimized method
2.2 优化比色法与国标法检测高级醇含量对比
通过优化比色法对实验室保存的50株酿酒酵母模拟发酵液中的高级醇含量进行初筛,后结合发酵特性筛选6株本土酿酒酵母,以商业酵母CECA为对照(CK),利用GC-MS法对7株酿酒酵母的高级醇产量进行了检测分析,结果见表3。由表3可知,优化比色法所测结果与GC-MS法所测结果之间在统计学上没有显著差异(P<0.05),从而证明优化比色法检测更准确、稳定,可应用于实践。
以商业酵母CECA为对照(CK),利用GC-MS法测定6株本土酿酒酵母发酵液中的高级醇,结果见图7。由图7可知,且异戊醇、异丁醇、苯乙醇为本土酵母中的主要高级醇类,正辛醇、正丁醇、异辛醇、正庚醇、正己醇、正戊醇6种醇的含量较低,仅占到高级醇总量的0.74%~2.22%。通过进一步分析发现,相对于CK和菌株LE25来说,其他菌株高级醇总量的降低主要是由于异丁醇和异戊醇产量的显著降低,而菌株间苯乙醇含量差异的影响对导致醇类总量差异贡献较小。与菌株LE25相比,菌株LP29和LP25的异丁醇产量分别降低了约占85.76%和94.19%,异戊醇产量分别降低了43.85%和44.01%,该菌株可在进一步生产试验中保证葡萄酒品质的基础上为降醇提供应用。此外,每株低产菌中异戊醇生成量均高于异丁醇,而在CK及LE25中则相反,这也为后续利用基因工程对相关代谢通路进行差异性分析提供了思路。
表3 优化方法与GC-MS法所测7株酿酒酵母菌株高级醇产量比较
Table 3 Comparison of higher alcohols content of 7 strains detected by optimized method and GC-MS method

注:同列相同小写字母表示没有显著差异(P>0.05),n=3。

图7 酒样中主要高级醇含量
Fig.7 Contents of main higher alcohols in wine sample
(A)异戊醇、异丁醇、苯乙醇含量;(B)正辛醇、正丁醇、异辛醇含量;(C)正戊醇、正己醇、正庚醇含量。
3 结论
本研究对GB/T 5009.48—2003中比色法测定酒中高级醇含量的方法进行条件优化。优化后的分析步骤为:取1 mL梯度稀释20倍的蒸馏酒样于试管(置于冷水浴)中,将2 mL质量浓度为5 g/L的对二甲胺基苯甲醛-硫酸溶液沿管壁缓缓加入,盖塞使其沉至管底静置1 min后,将各管同时摇匀置于80 ℃水浴锅中水浴30 min,取出后迅速冲水冷却,立即加入2 mL 50%硫酸溶液混匀,冷却10 min后倒入1 cm比色皿中,在波长520 nm处测定吸光度值。优化后得到标准曲线回归方程y=0.016 6x-0.018 2,相关系数R2=0.995,精密度试验结果相对标准偏差为1.665%,加标回收率99.1%,较国标法的96.9%更接近100%,证明优化法标准曲线相关系数更高,样品检测的精密度较高,准确度更好。
利用优化比色法对6株本土酿酒酵母的高级醇产量进行了检测分析,并利用GC-MS法进行对比验证。一方面,发现两种方法均可准确检测葡萄酒中高级醇总量,且在评价酵母菌株产高级醇总量上无统计学差异,优化比色法在过程监控中相较于GC-MS法更加经济、适用,可以完全满足企业生产中葡萄酒高级醇检测的需要;另一方面,筛选获得2株极低产高级醇的本土酿酒酵母菌株LP29和LP25,这将为我国部分葡萄酒产区葡萄酒高级醇含量相对较高的问题提供解决方案。
[1]WATERHOUSE A L,SACKS G L,JEFFERY D W.Understanding Wine Chemistry[M].Chichester:John Wiley&Sons,2016:51-52.
[2]PIRES E J,TEIXEIRA J A,BRÁNYIK T,et al.Yeast:the soul of beer's aroma-a review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Appl Microbiol Biotechn,2014,98(5):1937-1949.
[3]MORAKUL S,MOURET J R,NICOLLE P,et al.A dynamic analysis of higher alcohol and ester release during wine making fermentations[J].Food Bioproc Technol,2013,6(3):818-827.
[4]PRETORIUS I S.Tailoring wine yeast for the new millennium:novel approaches to the ancient art of winemaking[J].Yeast,2000,16(8):675-729.
[5]LALLI N,IRMA N,HEIKKI S.Distribution of esters produced during sugar fermentation between the yeast cell and the medium[J].J Inst Brew,1977,83(1):32-34.
[6]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
[7]CARVALLO J,LABBE M,PÉREZ-CORREA J R,et al.Modelling methanol recovery in wine distillation stills with packing columns[J].Food Control,2011,22(8):1322-1332.
[8]吴丹丽,李高磊,王明月,等.低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵[J].食品科学,2019,40(6):100-105.
[9]KŁOSOWSKI G,MIKULSKI D,MACKO D,et al.Influence of various yeast strains and selected starchy raw materials on production of higher alcohols during the alcoholic fermentation process[J].European Food Research & Technology,2015,240(1):233-242.
[10]ZHANG C Y,LIN N B,CHAI X S,et al.A rapid method for simultaneously determining ethanol and methanol content in wines by full evaporation headspace gas chromatography[J].Food Chem,2015,183:169-172.
[11]REZAEE M,ASSADI Y,MILANI HOSSEINI M,et al.Determination of organic compounds in water using dispersive liquid-liquid microextraction[J].J Chromatogr A,2006,1116(1-2):1-9.
[12]TOMASSETTI M,ANGELONI R,MEROLA G,et al.Catalytic fuel cell used as an analytical tool for methanol and ethanol determination.Application to ethanol determination in alcoholic beverages[J].Electrochimica Acta,2016,191:1001-1009.
[13]HERNANDEZ-ORTE P,BELY M,CACHO J,et al.Impact of ammonium additions on volatile acidity,ethanol,and aromatic compound production by different Saccharomyces cerevisiae strains during fermentation in controlled synthetic media[J].Aust J Grape Wine Res,2010,12(2):150-160.
[14]GOBERT A,TOURDOTMARÉCHAL,RAPHAËLLE,MORGE C,et al.Non-Saccharomyces yeasts nitrogen source preferences:impact on sequential fermentation and wine volatile compounds profile[J].Front Microbiol,2017,8:2175.
[15]姜越,潘婷,惠竹梅.模拟葡萄汁中可同化氮和还原糖对酵母发酵特性的影响[J].食品科学,2018,39(2):131-137.
[16]LIU P,WANG Y,YE D,et al.Effect of the addition of branched-chain amino acids to non-limited nitrogen synthetic grape must on volatile compounds and global gene expression during alcoholic fermentation[J].Aust J Grape Wine Res,2017,24(2):197-205.
[17]靳国杰,李爱华,刘浩,等.发酵温度对霞多丽干白葡萄酒香气质量的影响[J].中国食品学报,2017,17(10):134-144.
[18]PABLO F E,GARRIDO J,CARMEN A.Influence of a Saccharomycescerevisiae selected strain in the volatile composition of rosé wines evolution during fermentation[J].J Agr Food Chem,2000,48(5):1789-1798.
[19]VIDAL E E,MORAIS M A D,FRANOIS J M,et al.Biosynthesis of higher alcohol flavour compounds by the yeast Saccharomyces cerevisiae:impact of oxygen availability and responses to glucose pulse in minimal growth medium with leucine as sole nitrogen source[J].Yeast,2015,32(1):47-56.
[20]郝瑞颖,王肇悦,张博润,等.葡萄酒中酿酒酵母产生的重要香气化合物及其代谢调控[J].中国食品学报,2012,12(11):121-127.
[21]DICKINSON J R.An investigation of the metabolism of isoleucine to active amyl alcohol in Saccharomyces cerevisiae[J].J Biol Chem,2000,275(15):10937-10942.
[22]MENDES I,SANCHEZ I,FRANCODUARTE R,et al.Integrating transcriptomics and metabolomics for the analysis of the aroma profiles of Saccharomyces cerevisiae strains from diverse origins[J].Bmc Genomics,2017,18(1):455.
[23]CORDENTE A G,SOLOMON M,SCHULKIN A,et al.Novel wine yeast with ARO4 and TYR1 mutations that overproduce 'floral' aroma compounds 2-phenylethanol and 2-phenylethyl acetate[J].Appl Microbiol Biotechn,2018,102(14):5977-5988.
[24]EDER M,SANCHEZ I,BRICE C,et al.QTL mapping of volatile compound production in Saccharomyces cerevisiae during alcoholic fermentation[J].Bmc Genomics,2018,19(1):166.
[25]中华人民共和国卫生部GB/T 5009.48—2003 蒸馏酒与配制酒卫生标准的分析方法[S].北京:中国标准出版社,2003.
[26]黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-106.
[27]张建才,孟军,王雷.比色法测葡萄酒中杂醇油含量的方法优化[J].中国酿造,2013,32(5):121-124.
[28]FLERIANOS I,SPIROPOULOS A,BISSON L F,et al.Characterization of hydrogen sulfide formation in commercial and natural wine isolates of"Saccharomyces"[J].Am J Enol Viticult,2000,51(3):233-248.
[29]王春晓,江璐,刘延琳.DNS 法监控葡萄酒发酵进程的应用研究[J].中国酿造,2012,31(9):24-27
[30]蔡建.发酵前处理工艺对天山北麓‘赤霞珠’葡萄酒香气改良研究[D].北京:中国农业大学,2014.