多菌自然发酵是中国白酒的一大特色[1]。浓香型白酒除了糟醅、大曲的多菌种自然发酵外,还包括泥窖的窖泥中多种微生物的作用。而且泥窖是浓香型曲酒酿制之本,老窖是产好酒的最根本条件[2]。泥窖的窖泥中存在多种微生物,经过长时间持续不断地生产活动,形成稳定的微生态系统[3],这些微生物以窖泥为基地,不仅自身代谢产生的一些物质会进入糟醅中,而且会通过黄水进入糟醅中进行代谢活动[4],其中的一些代谢物质(如己酸、己酸乙酯等)会通过糟醅蒸馏进入酒中,成为浓香型白酒的关键风味物质,进而影响浓香型白酒的质量和风格[5]。因此研究窖泥微生物,可以进一步弄清楚白酒多菌种自然发酵原理,对提高浓香型白酒质量具有重要意义。
1 基于传统微生物技术对窖泥微生物的认识
对窖泥中微生物的重要性的认识始于20世纪60年代,1964年在茅台窖池底部的窖泥中发现了产丁酸和己酸的梭状芽孢杆菌,最终证明了己酸乙酯的确是窖底香味成分,并对浓香型白酒发展起到了促进作用[6]。由此拉开了窖泥微生物研究的序幕。随后吴衍庸等[7-11]对浓香型白酒窖泥微生物进行了深入研究,包括不同窖龄酒窖窖泥细菌数量分布,各类厌氧细菌在不同窖泥中的数量分布,酿酒功能菌的分离鉴定以及利用功能菌制作人工窖泥等。其中对己酸梭菌、甲烷菌等作了重点研究,也取得了很多非常有意义的成果。就己酸菌来说,内蒙古轻工科学研究所首先从浓香型白酒窖池窖泥中分离得到梭菌[12]。一些有代表性的菌株有:吴衍庸等[13-14]从五粮液与泸州老窖窖泥中分离的产己酸梭菌被命名为卢型梭菌(后经鉴定为巴氏梭菌(Clostridium barkeri);徐占成等[15]从剑南春集团窖泥中分离到耳涡形梭菌(Clostridium cochleatum);黑龙江省轻工所的黑轻80#己酸菌[16],辽宁大学的L-Ⅱ等[17],这几种菌虽然都产己酸但生理生化性质不同。从五粮液和泸州老窖窖泥分离的梭菌,兼性厌氧,利用乙醇和乙酸盐合成己酸,产生少量乙酸、丁酸,发酵葡萄糖产生少量丁酸[13-14]。克氏梭菌不利用葡萄糖,利用乙醇和乙酸生成丁酸和己酸,严格厌氧。耳涡形梭菌严格厌氧,在改良的巴氏培养基或厌氧培养基中,发酵生成正丁醇、丁酸与己酸[15]。甲烷菌也是窖泥中重要的功能微生物,目前的研究已证明,老窖窖泥的甲烷菌数量明显多于新窖,可作为老窖一种指针菌。甲烷菌更重要的作用是与己酸菌和其他氢型发酵菌的相互耦联关系,实现“种间氢转移”,实验与生产实践都已证明甲烷菌与己酸共同发酵可以促进己酸的生成[18]。
2 基于PCR的分子生物学技术对窖泥微生物的认识
在窖泥微生物研究中,基于聚合酶链式反应(polymerase chain reaction,PCR)的分子生物学技术应用较为广泛,目前应用较多的是变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)技术,此外还有技术核糖体脱氧核糖核酸(deoxyribonucleic acid,DNA)扩增片段限制性内切酶分析(amplifed ribosomal DNA restriction analysis,ARDRA)等,构建16S rDNA/rRNA克隆文库,再深度测序技术。这些技术的应用使得对窖泥微生物的认识从单一微生物到微生物群落的转变。通过DGGE等技术认识到窖泥中除了有细菌外,还有古菌和真菌,见表1。
表1 基于PCR-DGGE等技术的窖泥微生物群落结构
Table 1 Microbial community structure in pit mud based on PCR-DGGE and other techniques
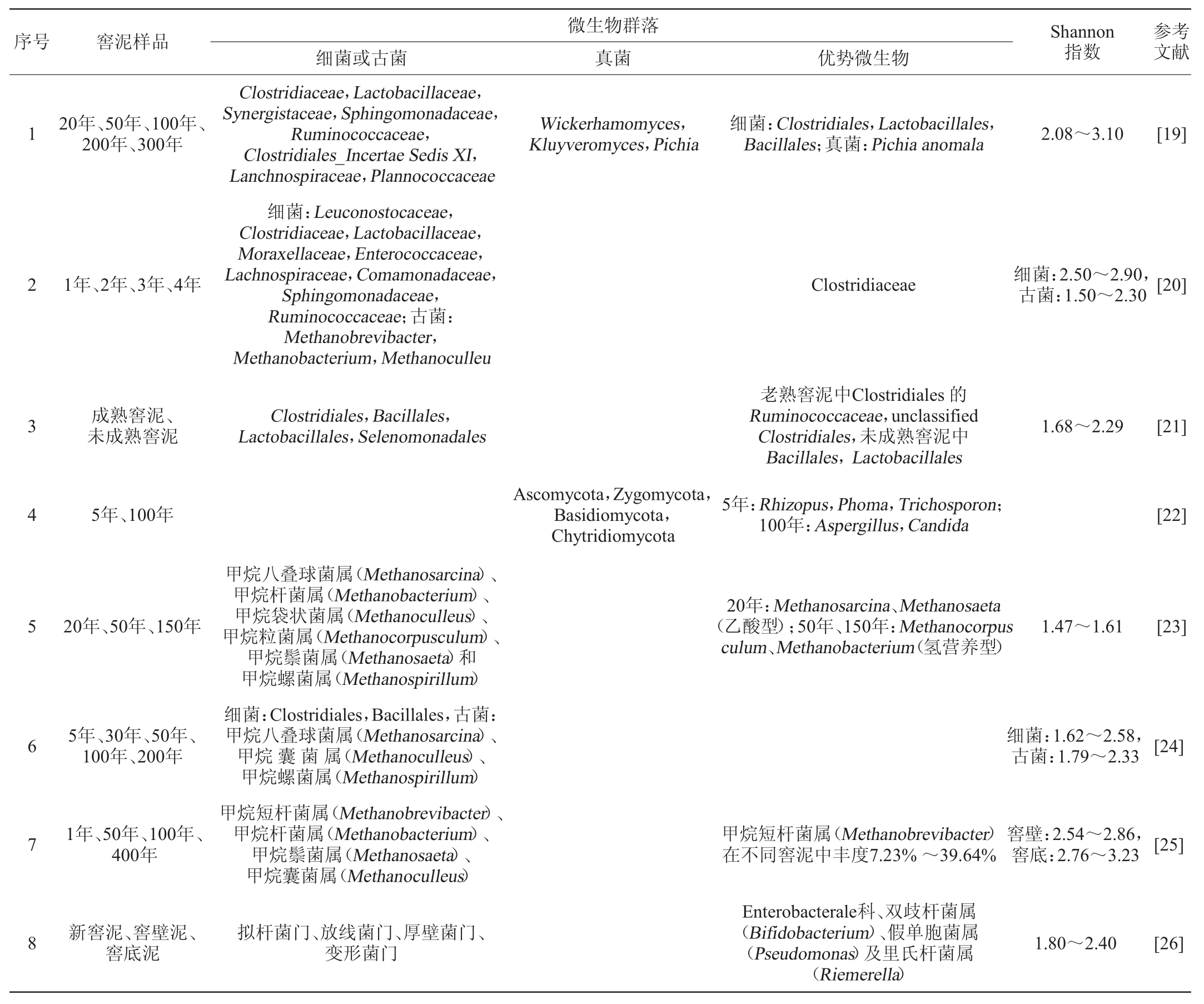
由表1可知,不论是新窖泥还是老窖泥,厚壁菌门微生物始终是优势微生物。在新窖泥中一般是乳杆菌目(Lactobacillales)和芽孢杆菌目(Bacillales)为优势微生物,而老窖泥中为(梭菌目Clostridiales)。而且随着窖泥的老熟,Lactobacillales和Bacillales的丰度逐渐减少,而Clostridiales的丰度逐渐增加。窖泥中的古菌主要是甲烷菌,有氢营养性和乙酸营养性的甲烷菌,而且随着窖泥的老熟甲烷菌的丰度也是逐渐增加的。窖泥微生物的Shannon(香农)多样性指数多在1.50~3.00。
至于真菌,窖泥的数量较少,有研究发现,有四个门,子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)和壶菌门(Chytridiomycota),Ascomycota为优势微生物,新窖泥中根霉(Rhizopus)、茎点霉(Phoma)和丝孢酵母属(Trichosporon)丰度较高,老窖泥中曲霉(Aspergillus)和假丝酵母(Candida)丰度较高。Candida在窖泥老熟过程中丰度增加明显。
以上可以看出,DGGE技术的应用确实加深窖泥微生物群落的认识,但是DGGE技术本身的缺点,限制了其进一步的应用。DGGE技术的信息量较少[27],这也能从窖泥微生物多样性Shannon指数看出,最高只能到3.00左右,对微生物群落的认识还不全面,只能认识到一些丰度非常高的微生物,而且不能同时对细菌、真菌、古细菌进行分析。
随着测序技术的发展和成本的降低,高通量测序技术在窖泥微生物中的应用是越来越广泛。一般是先提取样本总DNA,用引物进行PCR扩增,构建库,然后对16S rDNA/rRNA的V3、V4等高变区序列进行高通量测序,见表2。
表2 基于16S rDNA/rRNA基因高通量测序的窖泥微生物群落
Table 2 Microbial community in pit mud based on 16S rDNA/rRNA gene high throughput sequencing

续表

由表2可知,检测到的微生物种群数量大大增加,一般获得操作分类单元(operational taxonomic unit,OTU)数目在400~700甚至更多,微生物的Shannon多样性指数也一般在3.50~7.00,甚至更高。进一步明确了窖泥中占绝对优势的厚壁菌门微生物,其他优势微生物还有广古菌门,拟杆菌门微生物等。优质老熟窖泥的优势微生物,在纲水平一般为梭菌纲(Clostridia),在属水平一般有梭菌属(Clostridium)、己酸菌属(Caproiciproducens)、沉积微生物属(Sedimentibacter)、碱棒菌(Alkalibaculum)、互营单胞菌属(Syntrophomonas)等。优质老熟窖泥中的古菌一般为氢营养型的甲烷菌,甲烷杆菌属(Methanobacterium),甲烷短杆菌属(Methanobrevibacter)和甲烷囊菌属(Methanoculleus)。窖泥老熟过程中,产己酸的微生物丰度一般会逐渐增加(Clostridium、Caproiciproducens),甲烷菌Methano brevibacter丰度也会同步增加,而乳杆菌属(Lactobacillus)的丰度会逐渐下降。
以上研究中有相同点,但是也有很多不同的地方,不同地区、不同厂家的取样地点、不同窖龄的窖泥样品可能会对窖泥微生物的群落结构产生影响,但是窖泥测序中所用不同引物,也会对微生物的检出有很大影响,如有细菌和古菌的通用引物(515F和806R),可以同时检测出古菌和细菌,有细菌专用引物341F和806R,古菌专用引物519F和915R等。
3 基于组学技术对窖泥微生物的认识
以上研究中虽然对窖泥微生物的认识比传统技术方法更加全面深刻,但是所用样品的DNA都要经过PCR扩增,在此过程中PCR扩增条件(如扩增效率、胶浓度、电泳条件等)以及PCR技术本身的缺陷(如很难检出微生物总量低的微生物)[27],都会对微生物群落的检出及认识产生影响。因此为了进一步深入研究窖泥微生物,揭示窖泥老熟的机制,宏基因组学技术开始应用于窖泥微生物的研究。目前对窖泥微生物研究应用到的组学技术主要有宏基因组学、宏转录组学、宏蛋白组学。宏基因组学和宏转录组学都是先提取窖泥中总DNA或RNA,不经过PCR扩增,直接进行高通量测序,然后进行分析。宏基因组学可以研究某一环境条件下微生物群落的整体结构信息,而宏转录组学可以研究一定时期群体细胞转录的所有RNA(包括mRNA和非编码RNA)的类型及拷贝数,既研究在特定时期、特定环境条件下所有活跃的微生物群体[38-39]。宏基因组学和宏转录组学除了研究微生物群落结构外,还可以预测研究群体微生物的各种功能,例如比较不同窖泥样品中微生物特定功能基因的差别以及所表达酶的差别等。两种技术分别从DNA和RNA水平更全面精细地展示整个群落的功能代谢谱和表达谱,进而从原理上阐明微生物群落在生态系统中发挥作用的根本机制。
两种技术在窖泥研究中都已经开始应用。GUO M Y等[40]利用宏基因组学对不同地区不同窖龄窖泥研究发现,主要的微生物群落组成为:Firmicutes(54.6%),Euryarchaeota(15.3%),Bacteroidetes(10.1%),γ-变形菌门(Gammaproteobacteria 5.8%),后鞭毛生物(Opisthokonta 5.7%)和未分类细菌(Unclassified_Bacteria 2.3%)。在133个主要的属中活跃的微生物有Lactobacillus、Sedimentibacter、Syntrophomonas、甲烷囊菌属(Methanoculleus)、Methanobacterium、Bacillus、Clostridium、耐碱酵母属(Galactomyces)、Candida、毕赤酵母属(Pichia)、青霉菌属(Penicillium)、Aspergillus,为合成浓香型白酒挥发性香味物质的主要微生物。Bacteroidetes在不同窖龄窖池中差别很大,窖龄越老,丰度越高。Euryarchaeota能显著表现出酒的地理特征。
TAO Y等[41]利用宏基因组和高通量测序技术研究了25年和50年窖泥中活跃微生物,原核微生物为主占95.3%,而真核微生物丰度仅为1.8%。在所有的可读宏基因组序列中,主要的原核微生物丰度分别为Firmicutes(拟杆菌门)48.0%,广古菌门(Euryarchaeota)19.0%,Bacteroidetes13.5%,放线菌门(Actinobacteria)2.5%,变形菌门(Proteobacteria)2.1%。并结合16S rDNA和16S rRNA分析,Clostridial cluster IV,Lactobacillus,喜热菌属(Caloramator),Clostridium,Sedimentibacter,Bacteroides,卟啉单胞菌属(Porphyromonas)是活跃微生物。Clostridial cluster IV和Clostridium非常可能参与了己酸和合成。在窖泥宏基因组中检测到了通过扩链反应合成己酸的大部分酶的基因,还检测到了氢营养型和乙酸营养型甲烷菌合成甲烷的关键酶基因,推测出己酸合成过程中存在种间氢转移。
张倩颖[42]对老熟窖泥进行宏转录研究发现,窖泥中虽然广古菌门(Euryarchaeota)的丰度低于厚壁菌门(Firmicutes),但是mRNA转录活性远高于厚壁菌门;在属水平mRNA转录活性较高的为甲烷囊菌属与甲烷八叠球菌属。在老熟窖泥微生物中,碳水化合物代谢最为活跃,主要由梭菌纲(Clostridia)和甲烷微菌纲(Methanomicrobia)微生物参与。老熟窖泥中乳酸含量较低的重要原因是因为L-乳酸脱氢酶活性低,丙酮酸在老熟窖泥中代谢生产的乙酰辅酶A(coenzyme A,CoA)远多于乳酸。而对于乳酸菌和合成来说,耐酸乳杆菌(L.acetotolerans)有利于L-乳酸合成,而古甲烷八叠球菌属和甲烷囊菌属则有利于D-乳酸的合成。
张应刚[43]同时利用宏基因组学和宏转录组学对老熟窖泥研究发现如下:高表达物种有Methanoculleus、Clostridium、嗜蛋白质菌属(Proteiniphilum)、Syntrophomonas 和Lactobacillus。Lactobacillus的丰度虽然低,但是在窖泥中发挥了非常重要的作用。所有注释到的产甲烷菌在窖泥中都是属于活跃表达的。己酸的合成代谢在窖泥中非常活跃。窖泥中存在大量与氢营养型产甲烷菌互营的,并且高表达的微生物:Syntrophomonas、互营热菌属(Syntrophothermus)和Syntrophaceticus。窖泥中存在以甲醇为底物合成甲烷的代谢途径。
从以上研究可以看出,利用组学技术除了对微生物群落结构进行分析外,还对微生物群落的各种功能进行了研究。而对于宏转录组学来说,虽已应用,但是还存在技术难题,窖泥RNA的提取非常困难。窖泥成分复杂,富含腐殖质,而且主要以厌氧微生物为主,这些都可能是影响RNA的因素。特别是腐殖质对RNA的提取有很大的影响[44]。
蛋白质组学可以研究窖泥微生物的功能基因表达、特殊功能蛋白质开发以及生态元素循环等,应用较少,但开始有人利用此技术对窖泥微生态进行研究,如ZHENG Q等[45]首先从30年和300年的窖泥微生物中提取总蛋白质和DNA,然后利用基于iTRAQ蛋白组学技术研究微生物表达形成香味的功能蛋白质。在检测到的63种表达功能香味成分的蛋白中,有59种在300年窖泥中高效表达。这些功能蛋白在己酸、丁酸和甲烷的代谢途径中都有表达。通过高通量测序发现Methanobacterium是一种非常重要的生成香味成分的微生物。
综合以上研究可以看出,随着新技术的发展和应用,窖泥中发现的微生物越来越多,窖泥是一个非常重要的微生物资源宝库。老窖泥中的标志性优势微生物,在门水平为Firmicutes,Euryarchaeota,Bacteroidetes,在纲水平为梭菌纲Clostridia,在属水平Clostridium、Sedimentibacter、Syntrophomonas、Methanobacterium,Methanobrevibacter等。甲烷菌除了对窖泥的老熟有促进作用外,对浓香型白酒的香味物质的生成也有重要作用。
4 环境因子对窖泥微生物的影响
以上的研究多是从窖泥本身的微生物群落结构的变化和功能进行研究。但是在窖池中,窖泥中的微生物是不断受外界环境的影响的。长期受到这种环境影响,窖泥才能从新窖泥逐渐老熟,其中微生物也在不断的变化中,从最初的群落结构,变成老熟状态的群落结构。如果窖池维护不当,对窖泥有利的环境条件发生变化,窖泥就会出现退化,微生物群落结构也会发生改变。同时这种影响是相互的,窖泥微生物群落的不断变化,其代谢产物也不断影响窖池内糟醅中香味物质,最终会对酒质产生影响。
窖泥的环境因子包括水分、pH、酸度、腐殖质、有效钾、有效磷、水解氮、有机酸等。LIU M K等[36]研究认为,pH值、己酸和丁酸与优质窖泥的呈正相关性,而乳酸与较差的窖泥样品呈正相关性。己酸与丁酸与Caproiciproducens和Clostridium的丰度具有非常明显的正相关性,而与Lactobacillus和Bacillus的丰度有非常明显的负相关性。乙酸与Rummeliibacillus、Sporolactobacillus的丰度呈负相关性。
陶勇等[46]认为环境因子中有效磷、氨氮、pH 对微生物群落结构的影响较大,其次是腐殖质,而水分含量的影响较小。而在另一研究中[34],乳酸主要与1年窖泥样品微生物呈正相关,而己酸与25年和50年窖泥样品微生物呈正相关。水分、腐殖质、氮等与微生物群落变化的相关性不明显。pH、NH+4与Bacteroidetes和Euryarchaeota正相关,而与厚壁菌门负相关;而乳酸与丁酸相反。pH、NH+4的增加与己酸含量的增加相一致,而与乳酸及Lactobacillus的丰度增加相反。
胡晓龙[47]的研究认为,窖泥中乳酸与水溶性有机碳含量及窖泥中乳酸菌(Lactobacillus及Pediococcus)的相对含量呈正相关,而大多数甲烷菌及梭菌纲微生物与窖泥中![]() pH值呈现正相关。
pH值呈现正相关。
5 存在的问题及展望
虽然利用分子生物学技术,对窖泥微生物的认识有了更多的了解,但还依然有很多问题没有解决。
窖泥微生物群落结构和功能的关系依然不明确。窖泥微生物群落里面的微生物群落如何相互作用,又如何影响其功能,这是研究窖泥老熟的机制的前提和基础,只有弄清楚了窖泥微生物的作用和功能,才能了解窖泥微生物群落从新窖泥如何逐渐适应环境变成老熟窖泥,才能了解窖泥老熟机制。
窖泥虽然是决定浓香型白酒风格的关键,但是窖泥到底如何影响白酒的香味成分,不是十分明确。浓香型白酒的关键香味物质,是在窖泥中合成然后进入糟醅,还是窖泥微生物通过黄水进入糟醅在合成香味物质,或者两者兼而有之,这对白酒关键香味物质的生成非常重要,值得进一步研究。
在正常生产中,窖池窖泥长期处在厌氧、高二氧化碳浓度、富含乙醇、有机酸的环境下,这种环境对窖泥微生物应该有非常大的影响,正是这种环境造成了窖泥的逐步老熟。但是那种环境因子起什么作用,如何促进窖泥老熟,需要深入研究。
现在对窖泥的评价,依然没有统一标准。在目前的生产中还是经常以时间的长短、感官、产酒指标来判断窖泥的好坏。但是这些判定都存在不确定性,没有明确的界限,无法数据化,只能靠经验。这是因为窖泥的成熟过程受到窖泥样品本身在窖池中的位置、状态、时间长短、维护以及白酒生产工艺等各种因素的影响。有些学者也尝试用一些理化指标来评价窖泥状态,但依然有局限性[48-49]。如果明确了微生物在窖泥中的分布和功能,可以把微生物作为评价窖泥状态的关键指标之一,更有利于对窖泥的评价。
[1]傅金泉.中国酿酒微生物研究与应用[M].北京:中国轻工业出版社,2008:1.
[2]余乾伟.传统白酒酿造技术[M].北京:中国轻工业出版社,2017:458.
[3]张文学.白酒酿造微生态学[M].成都:四川大学出版社,2015:8.
[4]李可,范志刚,王俊芳,等.浓香型白酒发酵黄水中微生物群落结构解析[J].食品与生物技术学报,2015,34(11):1155-1161.
[5]XU Y Q,SUN B G,FAN G S,et al.The brewing process and microbial diversity of strong flavour Chinese spirits:a review[J].J I Brewing,2017,123(1):5-12.
[6]李大和.中国白酒“三大试点”研究回顾[J].酿酒科技,2017(6):17-25.
[7]吴衍庸,薛堂荣,陈昭蓉,等.五粮液老窖厌氧菌群的分布及其作用的研究[J].微生物学报,1991,31(4):299-307.
[8]吴衍庸,齐义鹏,徐成基,等.泸州大曲酒窖泥中微生物的生态分布和嫌气发酵特征[J].微生物学通报,1980(3):108-112.
[9]韩珍琼,程道梅.浓香型大曲酒窖泥己酸菌纯培养条件的研究[J].中国酿造,2005,24(12):19-22.
[10]吴衍庸.四川浓香型名酒微生物及发酵研究新进展[J].食品与发酵工业,1986,12(5):64-67.
[11]代金凤,罗雯,廖作敏,等.老化窖泥己酸代谢的研究[J].中国酿造,2019,38(12):148-152.
[12]沈怡芳.白酒生产技术全书[M].北京:中国轻工业出版社,1998:128.
[13]吴衍庸,易伟庆.泸州老窖己酸菌分离特性及产酸条件的研究[J].食品与发酵工业,1986,12(5):1-6.
[14]薛堂荣,陈昭蓉,卢世珩,等.己酸菌W1 的分离特性及产酸条件研究,食品与发酵工业,1988(4):1-5.
[15]徐占成,王加辉.窖泥己酸菌新菌种—耳涡形梭菌的发现与其形态及生理特性研究[J].酿酒,2005,32(5):1-3.
[16]周恒刚,沈怡方,高月明.回顾三十年来白酒生产技术的成就[J].黑龙江发酵,1982(1):1-8.
[17]刘复今,朱世瑛,张显科,等.己酸菌L-Ⅱ菌株及其应用研究[J].黑龙江发酵,1979(3):15-19.
[18]吴衍庸,刘光烨.窖泥甲烷细菌与浓香型曲酒[J].酿酒,1988,15(2):29-32.
[19]ZHENG J,LIANG R,ZHANG LQ,et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.
[20]DING X F,WU C D,HUANG J,et al.Eubacterial and archaeal community characteristics in the man-made pit mud revealed by combined PCRDGGE and FISH analyses[J].Food Res Int,2014,62:1047-1053.
[21]LIANG H P,LI W F,LUO Q C,et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].J Sci Food Agr,2015,95:2729-2735.
[22]LIU M K,TANG Y M,ZHAO K,et al.Determination of the fungal community of pit mud in fermentation cellars for Chinese strong-flavor liquor,using DGGE and Illumina MiSeq sequencing[J].Food Res Int,2017,91:80-87.
[23]王明跃,张文学,王海英,等.不同窖龄窖泥古菌的系统发育多样性分析[J].应用与环境生物学报,2012,18(6):1043-1048.
[24]钟姝霞,邓杰,卫春会,等.不同窖龄窖泥微生物群落结构与理化指标的相关分析[J].生物技术通报,2016,32(7):119-125.
[25]刘茂柯,唐玉明,邹兰,等.浓香型白酒窖泥古菌群落结构及其多样性[J].食品与发酵工业,2013,39(10):22-28.
[26]卢振,孟镇,钟其顶,等.应用PCR-DGGE 技术分析不同性状窖泥的细菌群落结构[J].中国酿造,2018,37(3):28-32.
[27]吴莉,余育和,冯伟松.PCR-DGGE 技术在环境型微生物群落研究中的应用[J].合肥师范学院报,2010,28(6):103-108.
[28]赵东,郑佳,彭志云,等.高通量测序技术解析五粮液窖泥原核微生物群落结构[J].食品与发酵工业,2017,43(9):1-8.
[29]任聪,辜杨,杜海,等.基于新老窖泥的微生物菌群结构判定浓香型白酒生产中的主体己酸菌[J].食品与发酵工业,2018,44(12):8-14.
[30]于春涛,项明,王蕾,等.浓香型白酒窖泥变质前后古菌群落差异分析[J].酿酒科技,2016(8):60-64.
[31]陶勇,芮俊鹏,李家宝,等.浓香型白酒窖泥中细菌和古菌的组成与多样性[J].化工学报,2017,65(5):1800-1807.
[32]张应刚,邓宇.基于高通量测序的不同窖龄窖泥微生物结构与多样性分析[J].中国沼气,2019,37(3):3-8.
[33]曾丽云,袁玉菊,张倩颖,等.窖泥细菌群落结构与基酒挥发性组分相关性分析[J].食品科技,2017,42(2):9-13.
[34]TAO Y,LI J B,RUI J P,et al.Prokaryotic Communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[35]ZHANG Q Y,YUAN Y J,LUO W,et al.Characterization of prokaryotic community diversity in new and aged pit muds from Chinese Luzhou-flavor liquor distillery[J].Food Sci Tech Resh,2017,23(2):213-220.
[36]LIU M K,TANG Y M,GUO X J,et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[37]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82:2506-2515.
[38]李晓军,李鑫鑫,张维,等.宏转录组学在微生物生态学研究中的应用[J].中国农业科技导报,2011,13(4):58-65.
[39]朱允华,李俭,方俊,等.宏基因组技术在开发极端环境未培养微生物中的应用[J].生物技术通报,2011(9):52-58.
[40]GUO M Y,HOU C J,BIAN M H,et al.Characterization of microbial community profiles associated with quality of Chinese strong-aromatic liquor through metagenomics[J].J Appl Microbiol,2019,127(3):750-762.
[41]TAO Y,WANG X,LI X,et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strongflavour liquor[J].Microb Biotechnol,2017,10(6):1603-1615.
[42]张倩颖.老熟窖泥分子微生态分析及克氏梭菌己酸合成调控研究[D].成都:四川大学,2017.
[43]张应刚.产甲烷菌对窖泥香味成分的影响[D].成都:农业部沼气科学研究院所,2019.
[44]赵俊,莫永亮,贾仲君.土壤宏转录组RNA 的提取方法评价[J].微生物学报,2018,58(4):724-743.
[45]ZHENG Q,LIN B R,WANG Y B,et al.Proteomic and high-throughput analysis of protein expression and microbial diversity of microbes from 30-and 300-year pit muds of Chinese Luzhou-flavor liquor[J].Food Res Int,2015,75:305-314.
[46]陶勇,徐占成,李东迅,等.窖泥细菌群落结构演替及其与环境因子的相关性[J].酿酒科技,2011(9):42-46.
[47]胡晓龙.香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
[48]朱莉莉,罗惠波,黄治国,等.浓香型白酒窖泥质量评价理化指标的筛选[J].中国酿造,2018,37(12):33-39.