裂褶菌(Schizophyllum commune F.)又称白参、树花、八担柴,隶属于真菌门,担子菌纲,伞菌目,裂褶菌科,裂褶菌属(Schizophyllum),是一种具有较高食药用价值的大型食用菌[1-2],具有清肝明目、滋补强身的功效[3-4],在我国主要分布于河北、黑龙江、安徽、江苏、浙江、福建、海南等省份。
裂褶菌多糖(schizophyllan polysaccharide,SPG)又称裂褶菌素,是裂褶菌主要的活性物质之一,其结构主要是β-(1→3)和β-(1→6)糖苷键组成的β-葡聚糖[5]。JAYAKUMAR G C等[6]研究发现,SPG具有广谱性的抑菌活性,赵岳等[7]进一步证实SPG对假单胞杆菌(Pseudomonas syringae)和大肠杆菌(Escherichia coli)的抑制效果。MAYAKRISHNAN V等[8]研究发现,裂褶菌子实体的提取物具有一定的抗氧化活性,杨娜等[9]进一步证实SPG具有抗氧化活性。此外,周林等[10]对SPG的保湿性能进行了评价,结果表明SPG是化妆品较优良的保湿性原料。
SPG来源于裂褶菌的子实体、发酵液和菌丝体。使用发酵手段获取SPG利于规模化的开发利用。SINGH M K等[11]使用以银合欢(Leucaena leucocephala)木粉碎物为主成分等14种组分的培养基进行发酵产SPG,产量达到4.2 g/L;吴丽华[12]发现发酵培养基中添加聚合物如谷氨酸及透明质酸等可以提高发酵体系的溶氧传质效率,从而提升SPG的产量。
本研究以胞内总多糖产量为评价指标,在单因素试验确定对发酵影响较大的主效碳、氮源基础上,采用Box-Benhnken响应面试验考量3种聚合物(羟甲基淀粉钠、透明质酸、β-环糊精)及谷氨酰胺、抗坏血酸、KH2PO4复合体系对裂褶菌产多糖的影响,确定裂褶菌液态深层发酵产多糖的最佳培养基配方,并对其抑菌活性、抗氧化性及保湿活性进行研究,以期为裂褶菌多糖的开发利用提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
裂褶菌(Schizophyllum commune)经野外组织分离,保存于本实验室,编号为SCLT NO.990715。
1.1.2 试剂
葡萄糖标准品(纯度≥98%):天津市优谱化学试剂有限公司;1,1-二苯肼-2-三硝基苯肼(1,1-diphenyl2-picrylhydrazyl,DPPH):北京索莱宝科技有限公司;2,2'-联氨双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2'-azino-bis(3-ethbenzothiazoline-6-sulfonicacid)diammoniumsalt,ABTS)(纯度≥98%)、水杨酸(纯度≥98%):宜兴市申光医药化工有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基、活化培养基使用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,121 ℃高压灭菌20 min。
液体种子培养基[13]:马铃薯200 g,葡萄糖10 g,蔗糖10 g,酵母膏2 g,牛肉膏2 g,蛋白胨2 g,KH2PO4 2 g,MgSO4 1 g,蒸馏水1 000 mL,121 ℃高压灭菌20 min。
发酵培养基[14]:葡萄糖20 g,酵母浸粉6 g,KH2PO4 1 g,抗坏血酸0.01 g,蒸馏水1 000 mL,121 ℃高压灭菌20 min。
1.2 仪器与设备
DLHR-D 2802型恒温振荡培养箱:北京东联哈尔仪器制造有限公司;Spectronic 200型紫外分光光度计:美国赛默非世尔科技公司;GFL-125型电热鼓风干燥箱:天津莱玻特瑞仪器有限公司;MJ-78A型高压蒸汽灭菌锅:上海施都凯仪器设备有限公司;SW-CJ-2F型无菌操作台:苏州安泰空气技术有限公司;KDC-1044型低速离心机:科大创新股份有限公司;Biotech-10BG2A型发酵罐:上海虔钧科学仪器有限公司。
1.3 试验方法
1.3.1 裂褶菌的发酵培养
菌种的活化:将4 ℃低温保存的斜面试管菌种接种到活化培养基中,25 ℃条件下培养5~10 d,待其长满后接种。
种子液的制备:使用打孔器取5块直径为1 cm的菌块,接入种子培养基,装液量为100 mL/250 mL,于25 ℃、150 r/min条件下培养5 d。
裂褶菌液态深层发酵培养:将种子液按5%(V/V)的接种量接种于液体发酵培养基,装液量为100 mL/250 mL,于25 ℃、150 r/min条件下培养5 d。
1.3.2 裂褶菌液态深层发酵培养基优化
(1)最佳碳源与氮源的确定:改变发酵培养基中的碳源为乳糖、葡萄糖、麦芽糖、甘露醇、蔗糖,质量浓度为20 g/L,改变发酵培养基中的氮源为酵母浸粉、蛋白胨、牛肉膏、酵母膏,质量浓度为6 g/L,其他组分不变,25 ℃、150 r/min条件下摇床培养5 d,研究不同碳源对裂褶菌胞内总多糖产量的影响,筛选出最佳碳源与氮源。
(2)裂褶菌液态深层发酵培养基优化响应面试验
确定最佳的碳氮源后,以胞内总多糖产量(Y)为考察指标,选择碳源(X1)、氮源(X2)、KH2PO4(X3)、β-环糊精(X4)、透明质酸(X5)、抗坏血酸(X6)、羧甲基淀粉钠添加量(X7)和谷氨酰胺(X8)共计8个因素进行Plackett-Burman试验,考察8个因素对裂褶菌胞内总多糖产量影响的正负效应,试验因素与水平见表1。
表1 Placket-Burman试验因素与水平
Table 1 Factors and levels of Placket-Burman tests

依据Plackett-Burman试验结果确定显著因子,根据各因素影响的正负效应设计最陡爬坡试验的方向和步长,通过最陡爬坡试验确定显著因子水平的中心值。在最陡爬坡试验结果的基础上,进行Box-Benhnken响应面试验。
1.3.3 裂褶菌胞内总多糖产量的测定
裂褶菌菌丝体干质量的测定参照文献[15]的方法;裂褶菌菌丝体粗多糖的提取步骤参照文献[16]的方法;裂褶菌多糖质量分数的测定参照文献[17],总多糖产量的计算方法参照文献[15]。
1.3.4 发酵曲线试验
采用最优发酵培养基培养裂褶菌,测定胞内总多糖产量绘制发酵曲线,确定摇床发酵阶段的最优培养时间。
1.3.5 发酵罐试验
在摇床培养的基础之上,进行发酵罐培养试验,将种子培养液以10%(V/V)的接种量接种于10 L发酵罐中,装液量6 L,搅拌转速300 r/min,通气量1.00~2.00 vvm,25 ℃,培养7 d,pH自然。通过测定胞内总多糖产量绘制发酵曲线,确定通过发酵罐培养获得最大产量的时间。
1.3.6 裂褶菌多糖抑菌活性测定
参照文献[18],以青霉素为阳性对照,采用二倍稀释法配制质量浓度分别为0.625 mg/mL、1.250 mg/mL、5.000 mg/mL、10.000 mg/mL的裂褶菌粗多糖溶液,利用紫外分光度法探究裂褶菌多糖对大肠杆菌、绿脓杆菌、枯草芽孢杆菌、金黄葡萄球菌的抑菌活性,并计算抑菌率,其计算公式如下:
式中:A0为空白对照吸光度值;A1为样品测定管吸光度值;A2为样品本底管吸光度值。
1.3.7 裂褶菌多糖抗氧化性测定
以维生素C(vitamin C,VC)为阳性对照,采用二倍稀释法配制成质量浓度分别为0.125 mg/mL、0.250 mg/mL、0.500 mg/mL、1.000 mg/mL、2.000 mg/mL的裂褶菌粗多糖溶液,参照文献[19]测定其·O2-清除率,参照文献[20]测定其DPPH·及·OH清除率,参照文献[21]测定其ABTS自由基清除率。
1.3.8 裂褶菌多糖保湿性测定
以透明质酸为阳性对照,参照文献[22]测定质量浓度为2.00 mg/mL的裂褶菌多糖在相对湿度(relative humidity,RH)分别为43%和81%条件下放置8 h的保湿率。
2 结果与分析
2.1 碳源与氮源种类的确定
碳、氮源对裂褶菌液态深层发酵的影响结果见图1。由图1可知,葡萄糖作为碳源时,总多糖产量最高,为2.24 g/L;酵母浸粉作为氮源时,总多糖产量最高,为2.49 g/L。因此,确定葡萄糖、酵母浸粉分别为最佳碳、氮源。

图1 不同的碳源、氮源对裂褶菌液态深层发酵的影响
Fig.1 Effect of different carbon source and nitrogen source on the submerged fermentation of Schizophyllum commune
2.2 裂褶菌液态深层发酵培养基优化响应面试验
2.2.1 Plackett-Burman试验
Plackett-Burman试验设计及结果见表2,各因素效应分析见表3,方差分析见表4。
表2 Plackett-Burman试验设计与结果
Table 2 Design and results of Plackett-Burman tests

表3 Plackett-Burman试验各因素的效应分析
Table 3 Effect analysis of each factor of Plackett-Burman tests

由表3可知,酵母浸粉(X2)、β-环糊精(X4)和抗坏血酸(X6)的贡献值分别为58.61%、17.03%、6.79%,对裂褶菌总多糖产量的影响最大,且酵母浸粉(X2)和β-环糊精(X4)影响为正效应,抗坏血酸(X6)影响为负效应,选择这三个因素进行最陡爬坡试验。其他组分,葡萄糖(X1)、KH2PO4(X3)、透明质酸(X5)为正效应,分别使用20.0 g/L、0.6 g/L和0.1 g/L,羟甲基淀粉钠(X7)、谷氨酰胺(X8)为负效应,分别使用3.0 g/L和0.000 5 g/L。由表4可知,模型的P值<0.01,说明模型所拟合的方程达到极显著水平。
表4 Plackett-Burman试验回归模型的方差分析
Table 4 Variance analyses of regression model for Plackett-Burman tests

注:“**”表示对结果影响极显著(P<0.01)。
2.2.2 最陡爬坡试验
根据Plackett-Burman试验的结果选择合适的步长对酵母浸粉(A)、β-环糊精(B)和抗坏血酸(C)进行最陡爬坡试验,试验设计与结果见表5。
表5 最陡爬坡试验设计与结果
Table 5 Design and results of the steepest ascent tests
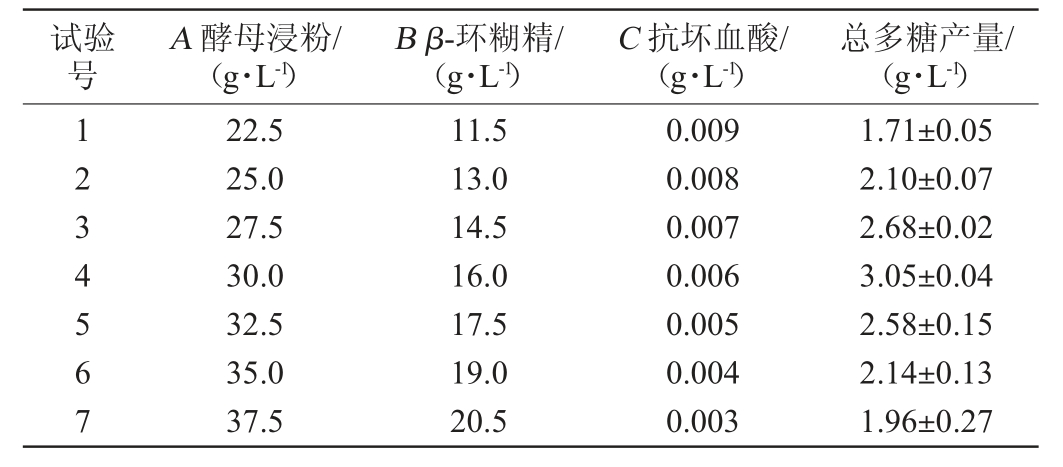
由表5可知,第4组试验条件下,即酵母浸粉30 g/L、β-环糊精16 g/L、抗坏血酸0.006 g/L时,裂褶菌总多糖产量最高,为12.84 g/L。因此,以第4组试验因素的水平为中心点进行Box-Benhnken试验。
2.2.3 Box-Benhnken试验
根据最陡爬坡试验结果设计Box-Benhnken试验,试验结果与分析见表6,方差分析见表7。
表6 Box-Behnken试验设计与结果
Table 6 Design and results of Box-Behnken tests
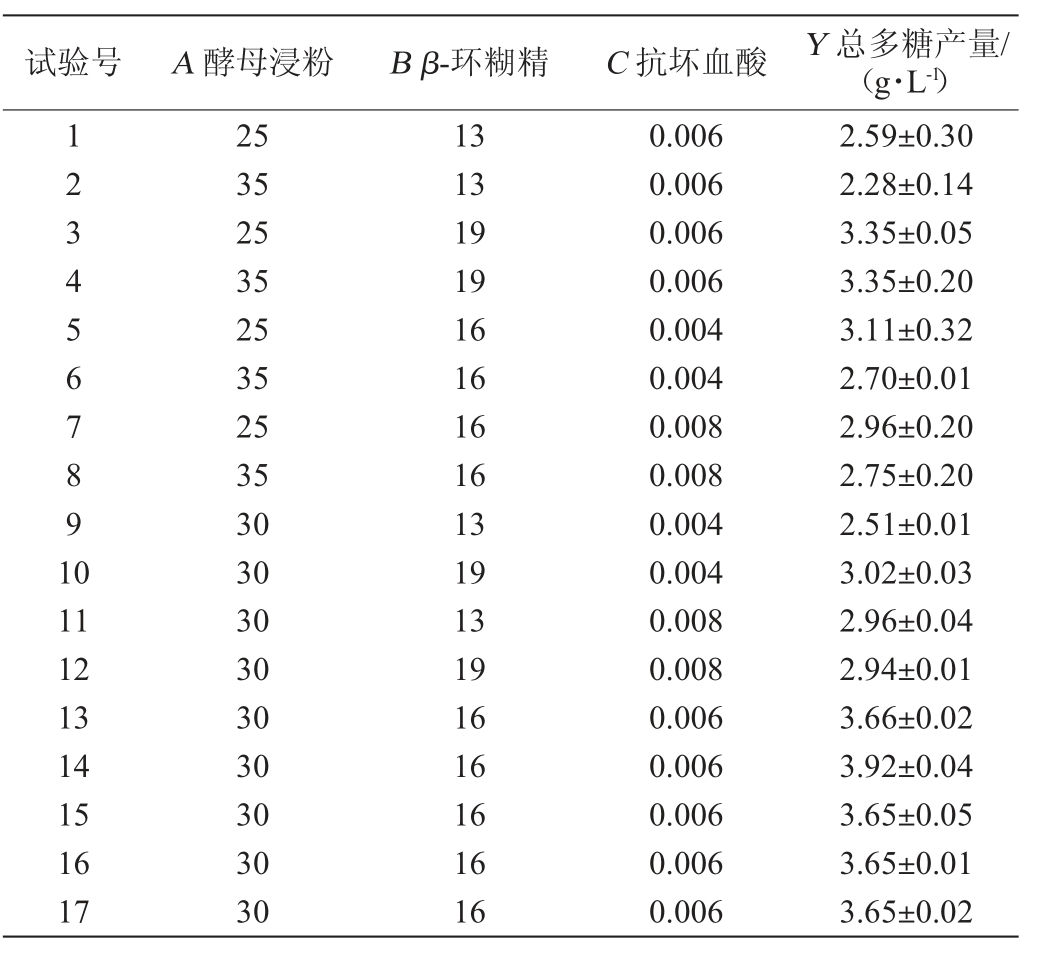
利用统计软件Design-Expert10.0.4.0对表6的试验结果进行多元回归拟合,得到二次多元回归方程:
表7 Box-Behnken试验回归模型的方差分析
Table 7 Variance analysis of regression model of Box-Behnken tests
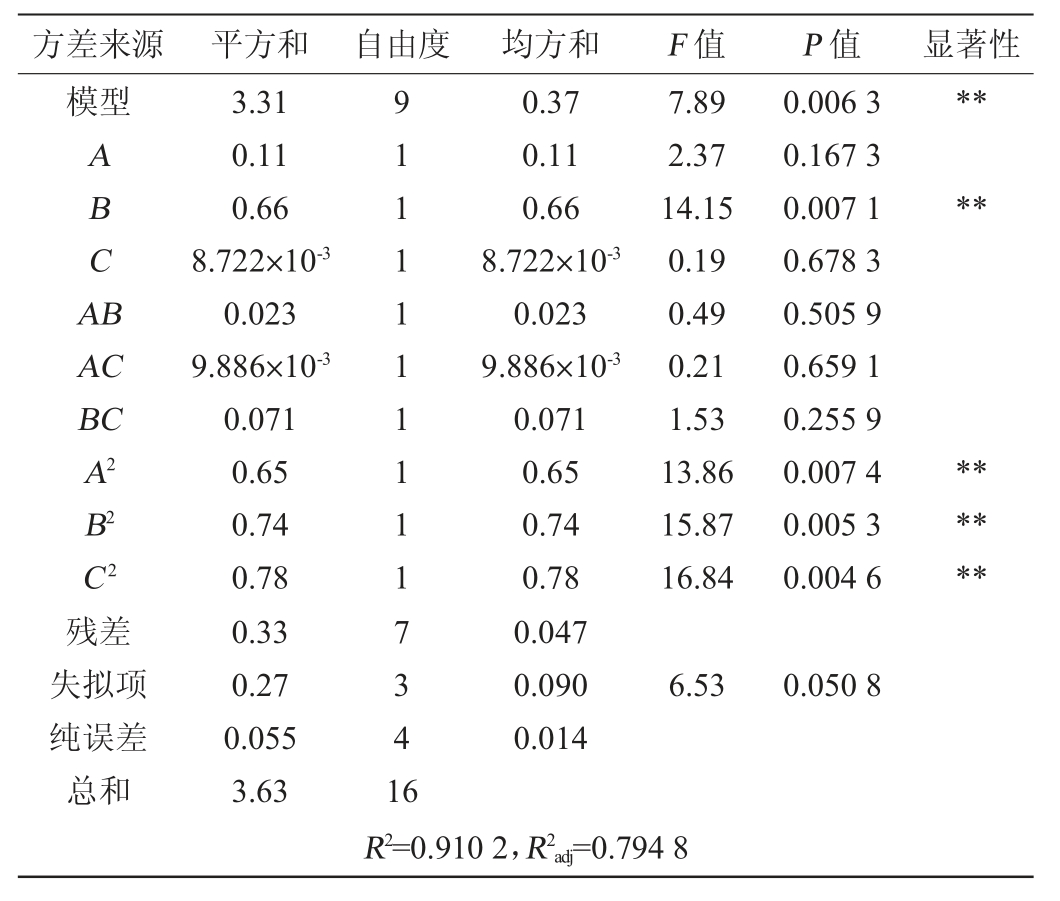
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表7可知,模型的P值<0.01,极显著,失拟项P值>0.05,不显著,说明所构建的模型很好,与试验的差异较小;决定系数R2为0.910 2,调整决定系数R2adj为0.794 8,说明预测值与试验值有较好的相关性,试验误差较小;模型的信噪比为7.879,远大于4,则表明该模型适合用于裂褶菌菌丝体总多糖产量的预测。在该模型中,一次项B、二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。根据F值大小可知,各因素对裂褶菌胞内总多糖产量影响的主次顺序为:β-环糊精添加量(B)>酵母浸粉添加量(A)>抗坏血酸添加量(C)。各因素间交互作用的响应面及等高线见图2。
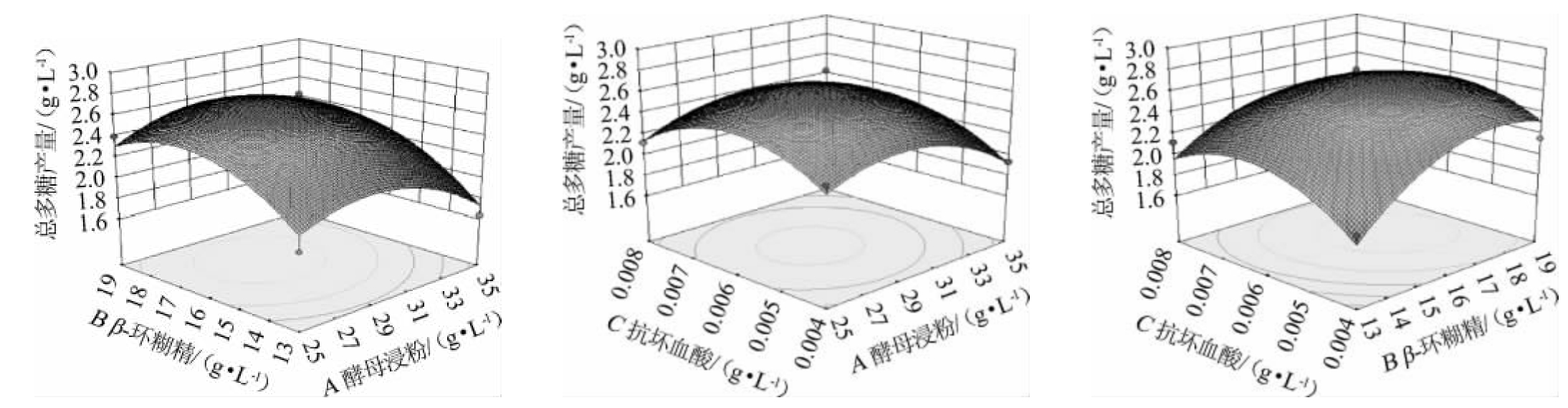
图2 各因素间交互作用对裂褶菌总多糖产量影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between each factors on the yield of total schizophyllan polysaccharide fromSchizophyllum commune
由图2可知,响应曲面呈向上的凸面,说明存在最大值;等高线接近圆形,说明各因素间交互作用对裂褶菌胞内总多糖产量的影响不显著,与方差分析结果一致。
对拟合出的二次多项式回归方程分别求A、B和C的偏导数,得到裂褶菌菌丝体产多糖的最优培养基为酵母浸粉29.402 g/L、β-环糊精17.006 g/L、抗坏血酸0.006 g/L,裂褶菌胞内总多糖产量最高理论值为3.765 g/L。考虑到实际操作的可行性,将培养基组分调整为酵母浸粉29.5 g/L、β-环糊精17.0 g/L、抗坏血酸0.006 g/L,其他组分为葡萄糖20 g/L、KH2PO4 0.6 g/L、谷氨酰胺0.000 5 g/L、透明质酸0.05 g/L、羧甲基淀粉钠3 g/L。
在此条件下通过3次平行重复试验验证,测得实际胞内总多糖产量为3.715 g/L,与理论偏差为1.33%。实际值与理论值基本相符,说明采用响应面法优化得到的发酵培养基参数可靠,具有一定参考价值。
2.3 摇瓶发酵曲线试验结果
在最优培养基下,裂褶菌摇瓶发酵产多糖曲线见图3。由图3可知,裂褶菌发酵11 d时,总多糖产量最高,为5.35 g/L。因此,确定摇瓶发酵裂褶菌产总多糖的最佳培养时间为11d。
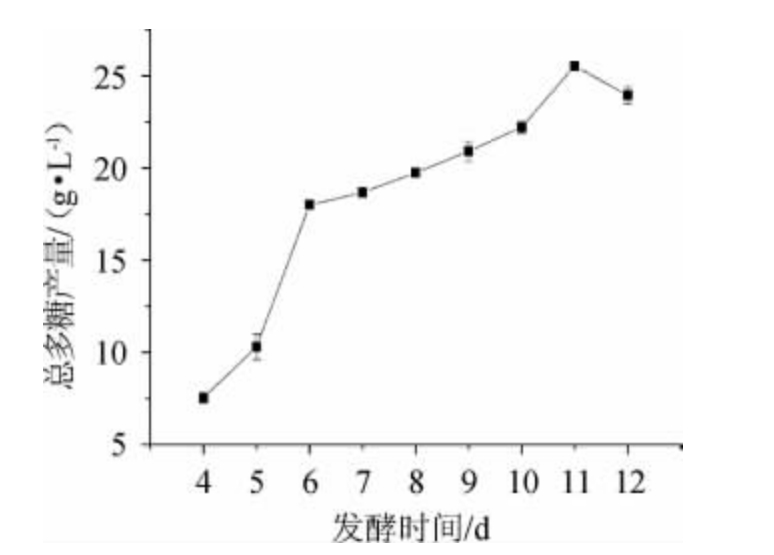
图3 裂褶菌总多糖产量的变化曲线
Fig.3 Change curve of total schizophyllan polysaccharide yield
2.4 发酵罐试验结果
在最优培养基下,采用10 L发酵罐对裂褶菌进行发酵,发酵曲线见图4。由图4可知,当发酵6 d时,总多糖产量最高,为6.39 g/L。为裂褶菌进一步中试生产提供了试验依据。

图4 最佳培养条件下裂褶菌总多糖产量的变化曲线
Fig.4 Change curve of total schizophyllan polysaccharide yield under the optimal culture condition
2.5 裂褶菌多糖活性研究结果
2.5.1 抑菌试验结果
由图5可知,裂褶菌多糖质量浓度在0.625~10.000mg/mL范围内对4种指示菌的抑制作用均呈正相关关系,且抑制率均低于阳性对照(青霉素)。当裂褶菌多糖质量浓度为10 mg/mL时,抑菌率均达到最大,对大肠杆菌、绿脓杆菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌率分别为56.24%、33.75%、32.62%、42.51%。结果表明,裂褶菌多糖溶液对4种指示菌均具有抑制作用。
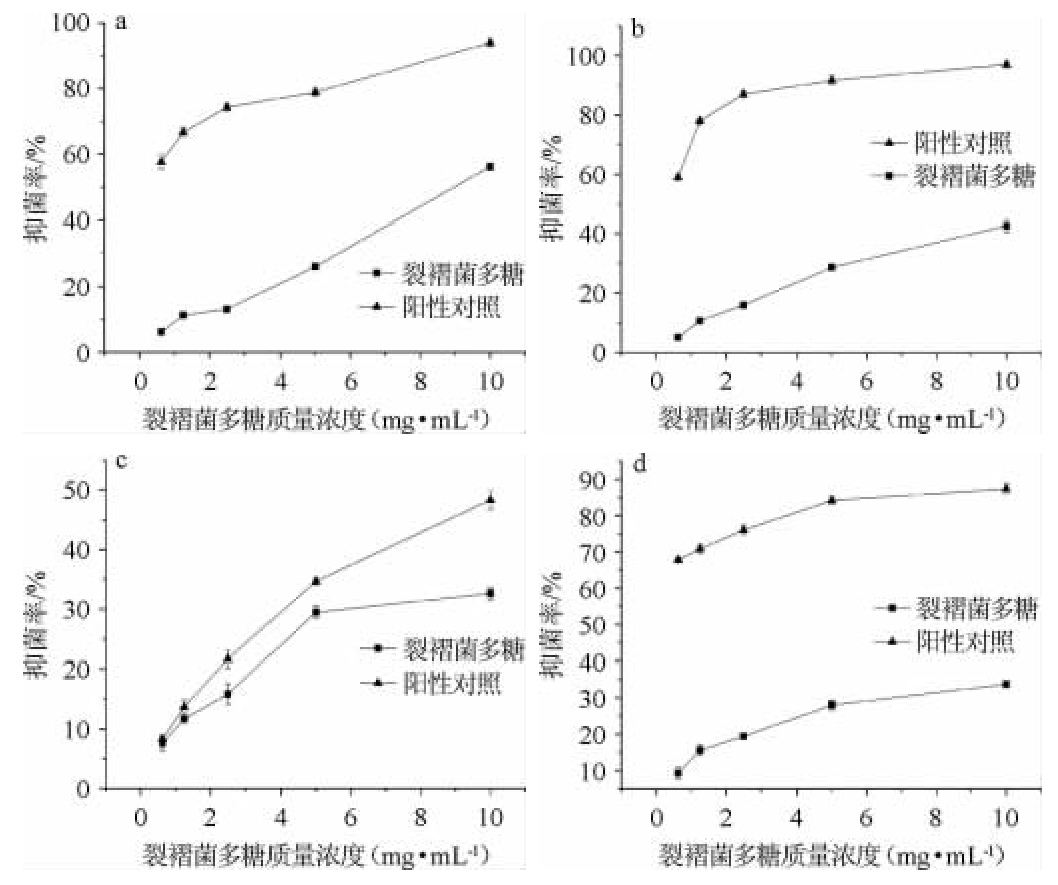
图5 裂褶菌多糖对不同细菌的抑菌率
Fig.5 Antibacterial rate of schizophyllan polysaccharide on different bacteria
a为大肠杆菌;b为金黄色葡萄球菌;c为枯草芽孢杆菌;d为绿脓杆菌。
2.5.2 抗氧化活性试验结果
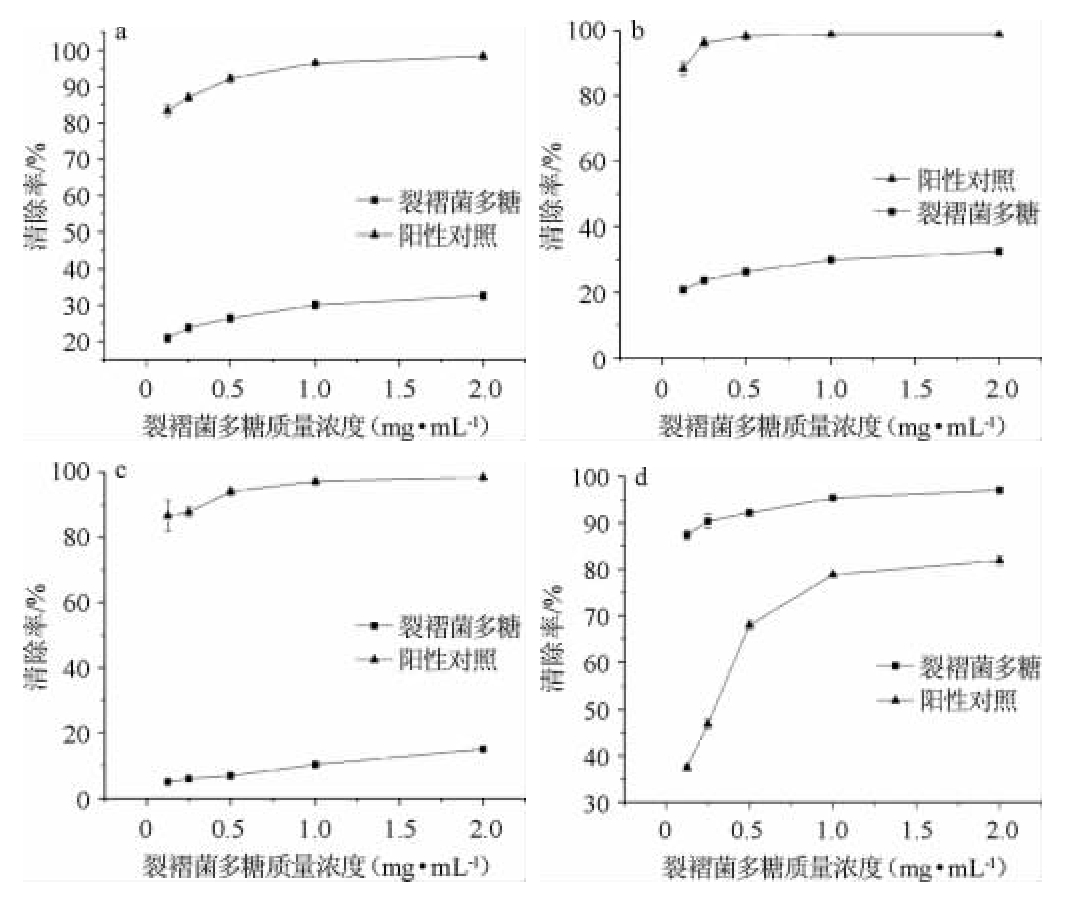
图6 裂褶菌多糖对不同自由基的清除率
Fig.6 Scavenging rate of schizophyllan polysaccharide on different free radicals
a为DPPH·;b为ABTS自由基;c为·OH;d为·O2-。
裂褶菌多糖对·O2-、·OH、DPPH·和ABTS自由基的清除作用见图6。由图6可知,裂褶菌多糖质量浓度在0.125~2.000 mg/mL的范围内对四种不同的自由基的清除作用呈正相关关系,且清除率均低于阳性对照(VC)。当裂褶菌多糖质量浓度为2.000 mg/mL时,自由基清除率均达到最大,对·O2-、·OH、DPPH·和ABTS自由基的清除率分别为84.58%、15.08%、18.61%和32.60%。结果表明,裂褶菌多糖对4种自由基均具有清除作用。
2.5.3 保湿活性试验结果
裂褶菌的保湿性见图7。由图7可知,在RH 43%和RH 81%的环境中,放置0~6 h,裂褶菌多糖的保湿性与透明质酸的一致,仅在8 h后裂褶菌多糖的保湿率下降至98.2%,保湿活性略低于透明质酸。结果表明,裂褶菌多糖具有很强的保湿活性,略低于透明质酸。
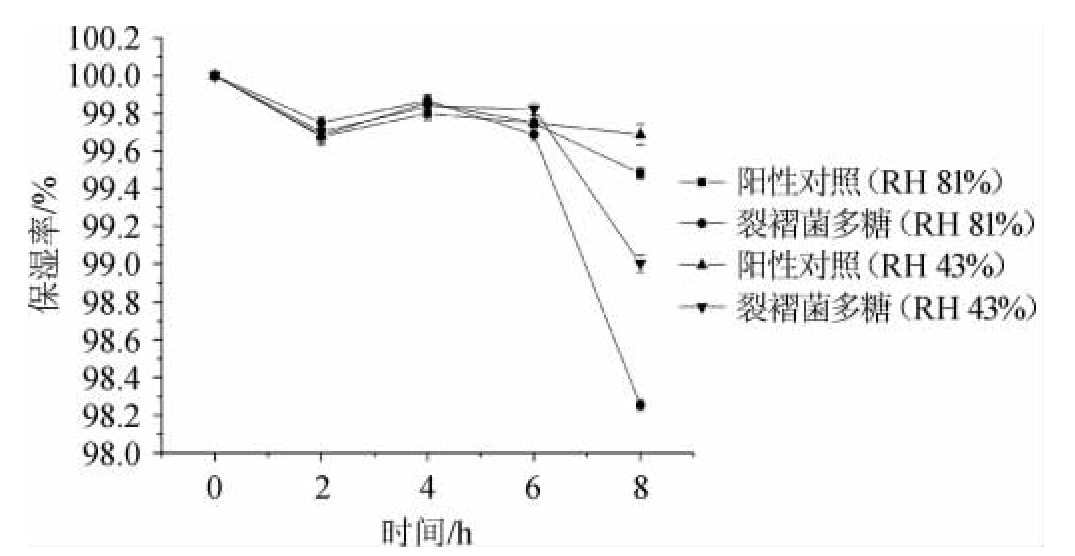
图7 裂褶菌多糖在不同湿度环境下的保湿率
Fig.7 Moisture-retention of schizophyllan polysaccharide under different humidity environment
3 结论
通过单因素和响应面试验确定裂褶菌液态深层发酵产胞内多糖最佳发酵培养基配方为葡萄糖20.0 g/L、酵母浸粉29.5 g/L、KH2PO4 0.6 g/L、抗坏血酸0.006 g/L、β-环糊精17 g/L、谷氨酰胺0.000 5 g/L、透明质酸0.05 g/L、羧甲基淀粉钠3 g/L,采用最优培养基摇瓶发酵11 d,总多糖产量为5.35 g/L,10 L发酵罐发酵6 d,总多糖产量为6.39 g/L。当裂褶菌多糖质量浓度为2 mg/mL时,对·O2-、·OH、DPPH·和ABTS自由基的清除率分别为84.58%、15.08%、18.61%和32.6%;当裂褶菌多糖质量浓度为10 mg/mL时,对大肠杆菌、绿脓杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌率分别为56.24%、33.75%、32.62%和42.51%;在RH 43%和RH 81%的环境下放置8 h内,裂褶菌多糖溶液的保湿性均高于98%。结果表明,裂褶菌多糖具有较好的抗氧化、抑菌、保湿性能,其具有应用于食品、化妆品领域的潜力。
[1]李玉.菌物资源学[M].北京:中国农业出版社,2013:42-131.
[2]覃拥灵,何海燕,张云开,等.酯酶高产菌株的诱变选育与发酵条件优化研究[J].中国酿造,2007,26(7):45-48.
[3]陈聪,钟葵,林伟静,等.固体发酵裂褶菌多糖提取方法比较[J].核农学报,2011,25(6):1211-1215.
[4]刘伟峰,陈莹,王琦.裂褶菌液体发酵多糖对荷瘤小鼠化疗的减毒增效作用[J].时珍国医国药,2012,23(2):321-322.
[5]李兆兰.裂褶多糖的结构研究[J].南京大学学报(自然科学版),1994(3):482-487.
[6]JAYAKUMAR G C,KANTH S V,CHANDRASEKARAN B,et al.Preparation and antimicrobial activity of scleraldehyde from Schizophyllum commune[J].Carbohydr Res,2010,345(15):2213-2219.
[7]赵岳,杨娜,沈晓俊,等.响应面优化裂褶菌多糖酶解工艺及抑菌研究[J].菌物学报,2015,34(1):139-149.
[8]MAYAKRISHNAN V,ABDULLAH N,ABIDIN M H Z,et al.Investigation of the antioxidative potential of various solvent fractions from fruiting bodies of Schizophyllum commune (Fr.) mushrooms and characterization of phytoconstituents[J].J Agr Sci,2013,5(6):259-261.
[9]杨娜,王鸿飞,郝艳佳,等.裂褶菌多糖提取工艺及抗氧化活性研究[J].中国食品学报,2014,14(8):92-98.
[10]周林,郭祀远,蔡妙颜,等.裂褶多糖的吸湿和保湿性能初步研究[J].天然产物研究与开发,2005,17(6):708-711.
[11]SINGH M K,KUMAR M,THAKUR I S.Proteomic characterization and schizophyllan production by Schizophyllum commune ISTL04 cultured on Leucaena leucocephala wood under submerged fermentation[J].Bioresource Technol,2017,236:29-36.
[12]吴丽华.裂褶菌多糖的发酵条件优化及控制[D].广州:华南理工大学,2017.
[13]鲁铁.几种多孔菌的培养特性及白蜡多年卧孔菌生药学研究[D].长春:吉林农业大学,2013.
[14]鲁铁.蒙古白丽蘑的遗传多样性及其保育学研究[D].长春:吉林农业大学,2018.
[15]冯杰,冯娜,刘艳芳,等.面向规模化应用的竹荪多糖液态深层发酵工艺优化[J].食品科学,2020,41(2):181-187.
[16]杨娜,王鸿飞,宋佳敏,等.超声波辅助提取裂褶菌多糖及分离纯化的研究[J].核农学报,2014,28(11):2015-2024.
[17]董群,郑丽伊,方积年.改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J].中国药学杂志,1996(9):38-41.
[18]孟俊龙,冯翠萍,常明昌,等.香菇多糖抑菌作用的研究[J].山西农业大学学报(自然科学版),2012,32(3):261-264.
[19]吴亚楠,鲁晓翔,连喜军,等.玉米须黄酮清除自由基活性的研究[J].食品研究与开发,2009,30(1):5-8.
[20]邓加聪,曾锈华,陈婕,等.牛肝菌多糖的提取及抗氧化性研究[J].中国酿造,2019,38(10):158-161.
[21]MILLER N J,RICE-EVANS C,DAVIES M J,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clin Sci,1993,84(4):407-412.
[22]陈景斯,李奕彤,王晓佳,等.油茶果壳多糖乙醇提取工艺的优化及其吸湿保湿性能[J].中成药,2019,41(5):970-974.