芽孢杆菌(Bacillus)是一类重要的工业应用微生物,被广泛应用于工业、农业、医学、环保等领域[1-3]。高温大曲是以小麦粉为原料经多菌种高温发酵[4]后长期储存的一种传统曲药,芽孢杆菌是其中最为广泛的微生物,被认为是酱香型白酒风味的重要来源[5]。目前,多种芽孢杆菌菌种已从高温大曲中被筛选出来,如解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[6]、蜡样芽孢杆菌(Bacillus cereus)[7]、巨大芽孢杆菌(Bacillus megaterium)[10]、萎缩芽孢杆菌(Bacillus atrophaeus)[8]等。其中,枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)最为常见。林群等[9]从大曲中分离到地衣芽孢杆菌和枯草芽孢杆菌,并以高粱为基质进行固态发酵对其代谢产物进行分析,结果表明前者能提供更多的风味产物,如2-甲基吡嗪、2,3,5-三甲基吡嗪和3-甲基丁醇等;王霜等[10]比较了源于兼香型白酒酒醅的地衣芽孢杆菌和枯草芽孢杆菌发酵特性,发现两株芽孢杆菌均能产5-甲基糠醛、β-苯乙醇、苯乙酸和α-亚麻酸。可见,枯草芽孢杆菌和地衣芽孢杆菌的代谢既有共性,也有不同。
酱香型白酒的酿造过程离不开酵母菌与芽孢杆菌的参与,单一菌株生产的白酒风味淡薄、单一、缺乏多菌株白酒发酵的自然感。现如今,对白酒风味的研究往往基于醇、酸、酯以及吡嗪类物质的检测,从这些角度不能说明酱香型白酒风味的组分。而氨基酸除自身营养功能外,还可作为其他风味物质前体,如苯丙氨酸是白酒中重要风味物质苯乙醇的前体,游离氨基酸在美拉德反应下形成不同的吡嗪类物质[11]。了解氨基酸代谢特征有助于进一步研究白酒风味,但氨基酸的代谢却极少引起重视。
前期已经对地衣芽孢杆菌与四种酵母共发酵时的代谢特征进行研究[12]。本实验以小麦粉为基质,采用枯草芽孢杆菌和汉逊酵母(Hansenula)、弗比恩毕赤酵母(Pichia fabianii)、酿酒酵母(Saccharomyces cerevisiae)和鲁氏酵母(Zygosaccharomyces rouxii)四种酵母菌共发酵,通过对不同发酵体系中还原糖、乙醇及氨基酸的检测分析酵母菌与枯草芽孢杆菌共发酵时的代谢特征,为后续研究多种芽孢杆菌与多种酵母菌株的菌株复配奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
小麦粉:武汉市太阳行食品有限责任公司。
1.1.2 菌株
枯草芽孢杆菌(Bacillus subtilis)、酿酒酵母(Saccharomyce cerevisiae)、汉逊酵母(Hansenula)、弗比恩毕赤酵母(Pichia fabianii)、鲁氏结合酵母(Zygosaccharomyces rouxii):湖北宜昌安琪酵母股份有限公司。
1.1.3 试剂
酵母粉、蛋白胨(均为生化试剂):北京双旋微生物培养基制品厂;乳酸标准品:山东科学院生物研究所;L-丙氨酸(L-alanine,Ala)、L-甘氨酸(L-glicine,Gly)、L-缬氨酸(L-valine,Val)、L-亮氨酸(L-leucine,Leu)、L-异亮氨酸(L-isoleucine,Ile)、L-苏氨酸(L-threonine,Thr)、L-脯氨酸(L-proline,Pro)、L-丝氨酸(L-serine,Ser)、L-天冬酰胺(L-asparagine,Asn)、L-蛋氨酸(L-methionine,Met)、L-谷氨酸(L-glutamic acid,Glu)、L-谷氨酰胺(L-glutanine,Gln)、L-苯丙氨酸(L-phenylalanine,Phe)、L-半胱氨酸(L-cysteine,Cys)、L-组氨酸(L-histidine,His)、L-赖氨酸(L-lysine,Lys)、L-酪氨酸(L-tyrosine,Tyr)、L-色氨酸(L-tryptophan,Trp)标准品:美国Sigma 公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、氢氧化钠、无水乙醇、吡啶、氯仿、碳酸氢钠、无水硫酸钠(均为分析纯):国药集团化学试剂有限公司;氯甲酸乙酯(ethyl chloroformate,ECF):成都市科隆化学品有限公司。
1.1.4 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH。121 ℃高压灭菌20 min。
LB培养基:酵母粉5 g,蛋白胨10 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.2~7.4。121 ℃高压灭菌20 min。
发酵培养基[17]:5 g小麦粉中添加100 mL蒸馏水,搅拌均匀,自然pH。115 ℃高压灭菌20 min。
1.2 仪器与设备
SBA生物传感仪:山东省科学院生物研究所;BL-75A高压灭菌锅:上海博迅实业有限公司;HNY-211B恒温摇床:天津欧诺仪器仪表有限公司;ZSD-A1160A恒温培养箱:上海智城分析仪器制造有限公司;CT15RE离心机:日本日立公司;V-1100D可见分光光度计:上海美谱达仪器有限公司;5804R型离心机:德国Eppendorf公司;7890B气相色谱(gas chromatography,GC)仪:美国安捷伦公司。
1.3 方法
1.3.1 菌种活化
从微生物保藏斜面挑取一环枯草芽孢杆菌菌落于LB培养基中,37 ℃、180 r/min条件下振荡培养至OD600nm值为20.0,备用。从微生物保藏斜面挑取一环酵母菌落于YEPD培养基中,30 ℃、180 r/min条件下振荡培养至OD600nm值为5.0,备用。
1.3.2 混菌发酵
分别取1 mL芽孢杆菌和酵母培养种子液于发酵培养基中,装液量100 mL/250 mL,30 ℃、180 r/min条件下振荡培养9 d,每隔24 h取样用于检测分析。
1.3.3 测定方法
发酵样品在4 ℃、8 000 r/min离心10 min,收集上清液用于葡萄糖和乙醇的测定。
葡萄糖含量的测定:采用DNS比色法测定葡萄糖含量[12]。以吸光度值(Y)为纵坐标,葡萄糖质量浓度(X)为横坐标,建立葡萄糖标准曲线回归方程:Y=1.503 1X-0.050 9,相关系数R2为0.998 2。
乙醇含量的测定:采用SBA生物传感仪检测乙醇含量[13]。
氨基酸的测定:采用ECF衍生化处理样品[14],以2%乙酸苯乙酯作为内标物,通过气相色谱检测氨基酸种类及含量[20]。气相色谱条件为HP-5毛细管色谱柱(30 m×0.32 mm×0.25 μm);升温程序:70 ℃保留5 min,以5 ℃/min升至260 ℃,保持2 min;进样口温度280 ℃;检测器温度280 ℃;载气为氮气(N2),流速1.0 mL/min;进样量1 μL;不分流模式。以氨基酸标准品的保留时间进行定性,内标法定量。其中谷氨酸和谷氨酰胺在该方法下色谱峰无法完全分离,因此,将谷氨酰胺和谷氨酸统一用Glu*表示[15]。
1.3.4 数据处理
每组实验3个平行。运用Excel计算平均值和方差,并运用Origin 8.6软件对发酵数据作图。
2 结果与分析
2.1 芽孢杆菌与酵母菌共发酵基本代谢特征
枯草芽孢杆菌分别与酿酒酵母(S)、汉逊酵母(H)、弗比恩毕赤酵母(P)和鲁氏结合酵母(Z)进行混合发酵,发酵过程中还原糖和乙醇含量的变化见图1。
由图1可知,在216 h的发酵周期内,各实验组还原糖在前48 h都是持续积累,此后出现差异性变化。除汉逊酵母外,其他3种发酵体系中还原糖含量持续增加,发酵120 h后基本稳定,枯草芽孢杆菌分别与鲁氏酵母、弗比恩毕赤酵母、酿酒酵母共发酵终点时的还原糖含量分别为(17.02±0.95)g/L、(14.34±0.55)g/L、(13.17±0.91)g/L。当枯草芽孢杆菌与汉逊酵母共发酵时,还原糖含量在共发酵48 h后开始下降,至144 h后,发酵液中还原糖含量<1 g/L。
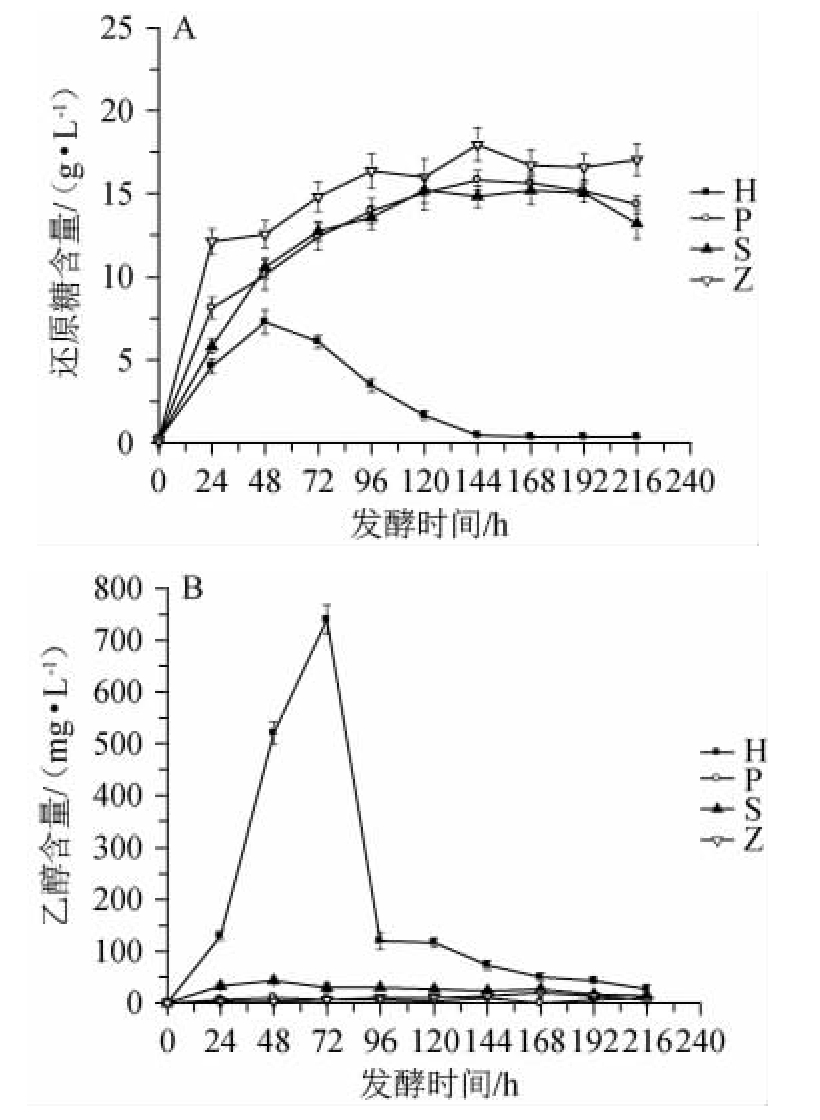
图1 枯草芽孢杆菌与酵母共发酵过程中还原糖(A)和乙醇(B)含量的变化
Fig.1 Changes of reducing sugar (A) and ethanol (B) contents during the co-fermentation process of Bacillus subtilis and yeast
与还原糖含量变化相对应,枯草芽孢杆菌与酵母的混合发酵中,只有枯草芽孢杆菌与汉逊酵母共发酵时,发酵液中有明显的乙醇积累,发酵至72 h时,乙醇含量最高,达到(740.00±28.28)mg/L,发酵72 h后,乙醇含量下降。而枯草芽孢杆菌与另外3种酵母共发酵条件下,乙醇积累水平很低。可见,枯草芽孢杆菌分别与弗比恩毕赤酵母、酿酒酵母和鲁氏结合酵母共发酵时对生成的还原糖的利用能力不强,其糖醇转化能力很差,而汉逊酵母在混菌发酵条件下具有很好的乙醇代谢活性。李欣等[12]研究发现,地衣芽孢杆菌也仅在与汉逊酵母混菌发酵时展现相似的良好的乙醇代谢活性,但乙醇含量最高仅为(93.33±4.71)mg/L。酵母和芽孢杆菌是白酒固态酿造中常见的微生物,它们通过自身代谢及与其他微生物彼此间适应性差异[16]对白酒风味会产生不同的影响[7,17-19],最典型的就是混菌发酵下乙醇积累的不同。
2.2 芽孢杆菌与酵母菌共发酵氨基酸合成代谢分析
氨基酸除具有营养功能外,还可作为其他风味物质的前体,了解氨基酸合成代谢有助于后续了解微生物与风味之间的关系。当枯草芽孢杆菌分别与汉逊酵母、弗比恩毕赤酵母、酿酒酵母和鲁氏结合酵母共发酵时,依次从发酵液中共检测到10种、10种、12种和12种氨基酸,最高总氨基酸含量分别为(210.41±18.75)μg/mL(48 h)、(160.92±9.11)μg/mL(48 h)、(3 957.35±261.47)μg/mL(72 h)和(956.71±56.64)μg/mL(48 h)。缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、组氨酸和酪氨酸在4种混合发酵条件下均被检测到,为共有氨基酸[12]。部分氨基酸只在一定的发酵时间段产生:亮氨酸只出现在枯草芽孢杆菌与汉逊酵母共发酵的前96 h;当枯草芽孢杆菌与费比恩毕赤酵母共发酵时,苯丙氨酸分别在共发酵24 h和216 h检出;当枯草芽孢杆菌与酿酒酵母共发酵时,缬氨酸在发酵中期检测不到,苯丙氨酸只存在发酵后期;当枯草芽孢杆菌与鲁氏结合酵母共发酵时,苯丙氨酸只在发酵后期积累。酵母与枯草芽孢杆菌共发酵时氨基酸呈现区间性分布说明多种酵母与枯草芽孢杆菌的混合发酵可能会更有助于发酵体系中形成丰富的氨基酸成分。
2.2.1 共有氨基酸分析
枯草芽孢杆菌分别与汉逊酵母、酿酒酵母、费比恩毕赤酵母和鲁氏结合酵母共发酵过程中共有氨基酸的差异见图2。
由图2可知,4株酵母中,酿酒酵母与枯草芽孢杆菌共发酵168 h时,缬氨酸积累量最高,为(56.24±2.83)μg/mL。酿酒酵母与枯草芽孢杆菌共发酵72 h时最有利于亮氨酸的积累,为(160.59±24.31)μg/mL,其他3种酵母与枯草芽孢杆菌共发酵均不能显著促进亮氨酸的积累。与亮氨酸相似,酿酒酵母与枯草芽孢杆菌共发酵72 h时,异亮氨酸积累量最大,达到(206.00±33.19)μg/mL。汉逊酵母和毕赤酵母分别与枯草芽孢杆菌共发酵时对积累脯氨酸几乎没有贡献,鲁氏结合酵母与枯草芽孢杆菌共发酵时能略微增加发酵液中的脯氨酸含量,酿酒酵母相比其他三株酵母更利于脯氨酸的积累,与枯草芽孢杆菌共发酵72 h时,最大积累量为(295.06±38.81)μg/mL。在毕赤酵母、酿酒酵母和鲁氏结合酵母分别与枯草芽孢杆菌共发酵过程中,苯丙氨酸均没有明显的波动,而汉逊酵母与枯草芽孢杆菌共发酵时能有效的促进苯丙氨酸的积累。除汉逊酵母和毕赤酵母外,酿酒酵母和鲁氏结合酵母分别与枯草芽孢杆菌共发酵时更有利于组氨酸的积累,其最高含量分别达到(1 043.92±132.53)μg/mL(72 h)和(536.65±42.16)μg/mL(48 h)。酪氨酸含量除在酿酒酵母与枯草芽孢杆菌共发酵72 h时增加外,其他发酵过程中没有明显的变化。综上,枯草芽孢杆菌无论与何种酵母搭配,大部分共有氨基酸的积累主要发生在发酵中前期,最佳积累时间为72 h。除汉逊酵母与枯草芽孢杆菌共发酵时发酵体系中含有较多的苯丙氨酸。其余六种共有氨基酸均为酿酒酵母与枯草芽孢杆菌共发酵体系中含量最为丰富。
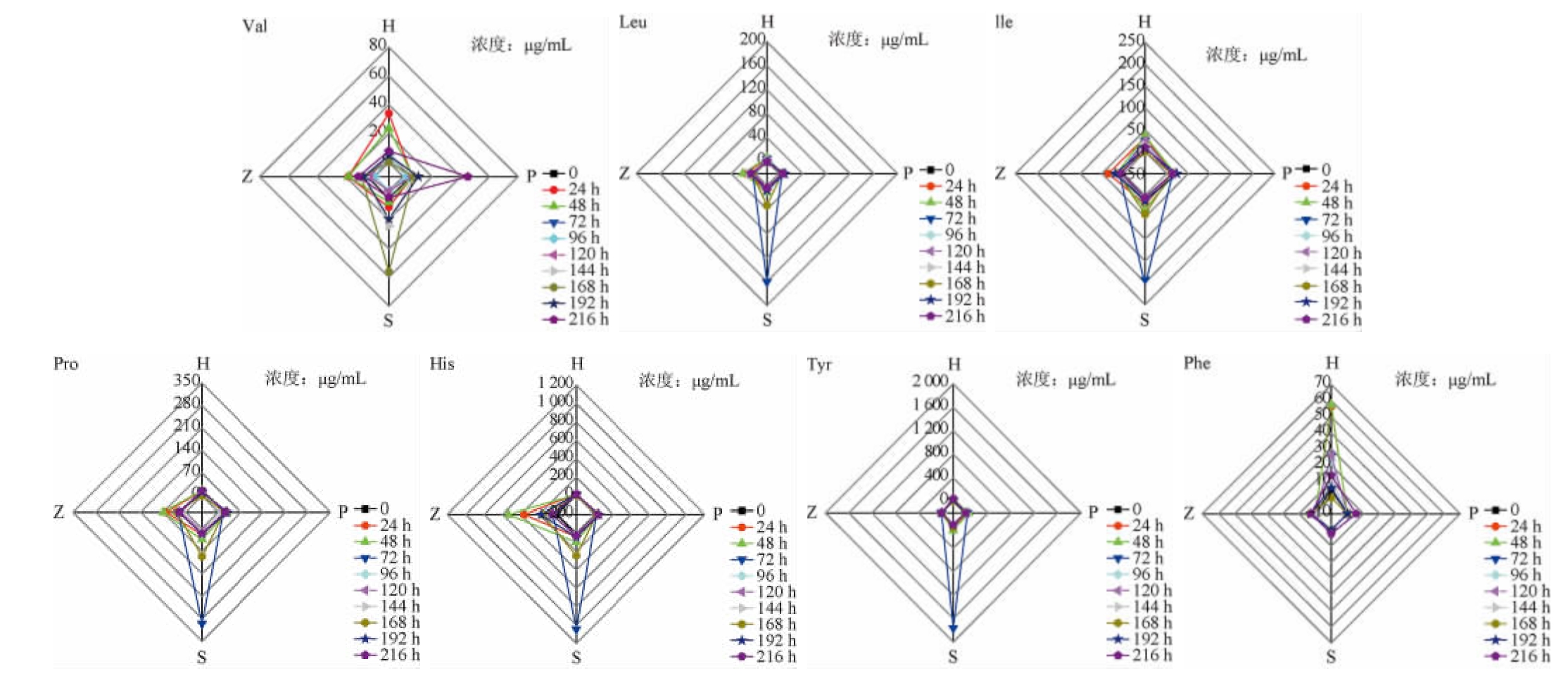
图2 枯草芽孢杆菌与酵母共发酵过程中共有氨基酸的含量变化
Fig.2 Changes of common amino acids content during the co-fermentation process of Bacillus subtilis and yeast
同为固态白酒发酵过程中常见的芽孢杆菌,地衣芽孢杆菌与酵母的共发酵体系比枯草芽孢杆菌与酵母的共发酵体系多3种共有氨基酸,分别为异亮氨酸、谷氨酸和谷氨酰胺[17,26]。同时共有氨基酸的含量与菌株搭配相关,而不是与菌株自身相关。如亮氨酸和脯氨酸主要来自枯草芽孢杆菌和酿酒酵母共发酵,而地衣芽孢杆菌和汉逊酵母或毕赤酵母的共发酵也能大量形成亮氨酸和脯氨酸。氨基酸本身具有呈味特性,是一些风味物质的前体,这表明了菌株对氨基酸的代谢变化可能会影响到风味的形成。
2.2.2 非共有氨基酸分析
枯草芽孢杆菌分别与汉逊酵母、酿酒酵母、费比恩毕赤酵母和鲁氏结合酵母共发酵过程中非共有氨基酸的变化分别见表1~表4。
表1 枯草芽孢杆菌与汉逊酵母共发酵时非共有氨基酸的变化
Table 1 Changes of non-common amino acid during the co-fermentation process of Bacillus subtilis and Hansenula sp.
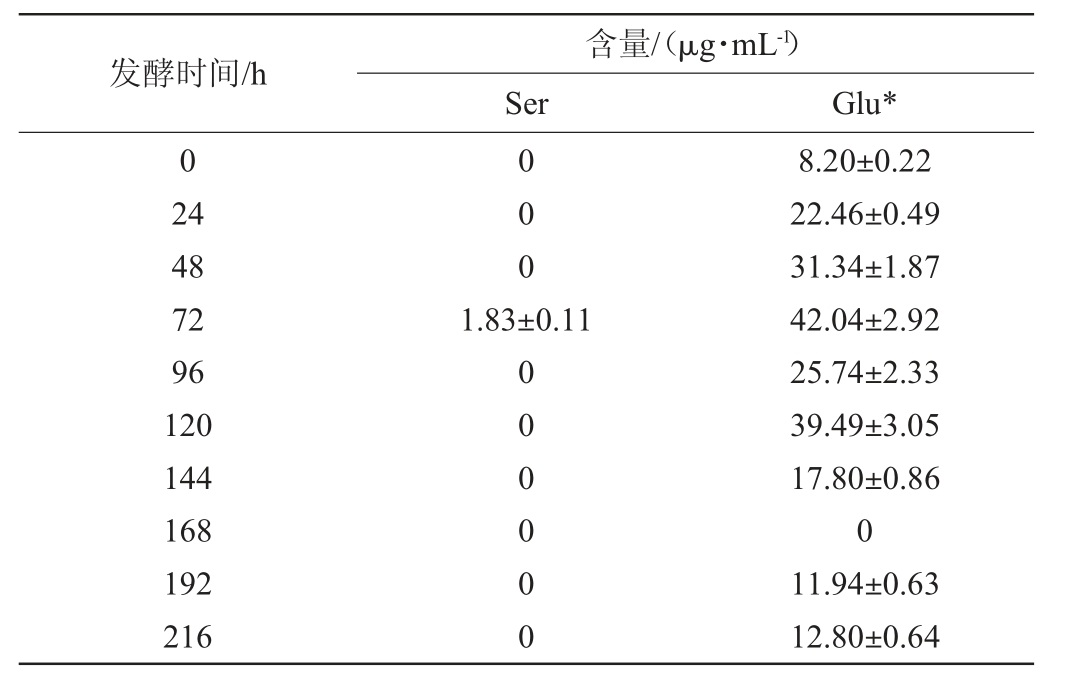
注:谷氨酸和谷氨酰胺在该方法下色谱峰无法完全分离,在这里将谷氨酰胺和谷氨酸统一用Glu*表示。下同。
表2 枯草芽孢杆菌与酿酒酵母共发酵时非共有氨基酸的变化
Table 2 Changes of non-common amino acid during the co-fermentation process of Bacillus subtilis and Saccharomyces cerevisiae
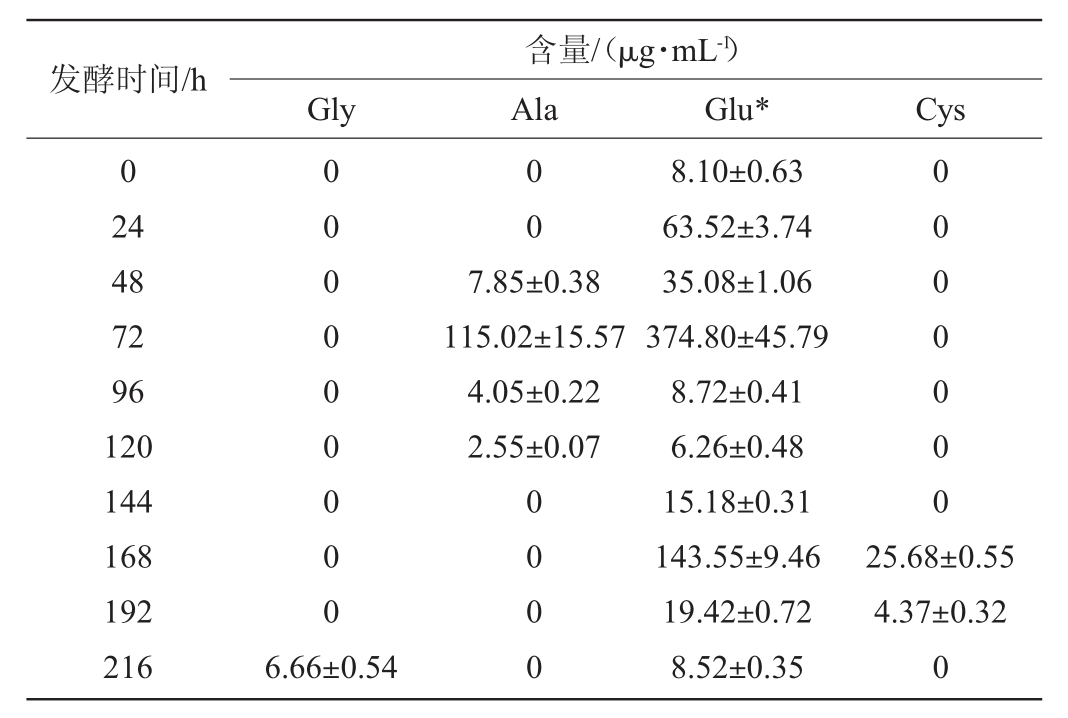
表3 枯草芽孢杆菌与弗比恩毕赤酵母共发酵时非共有氨基酸的变化
Table 3 Changes of non-common amino acid during the co-fermentation process of Bacillus subtilis and Pichia fabianii
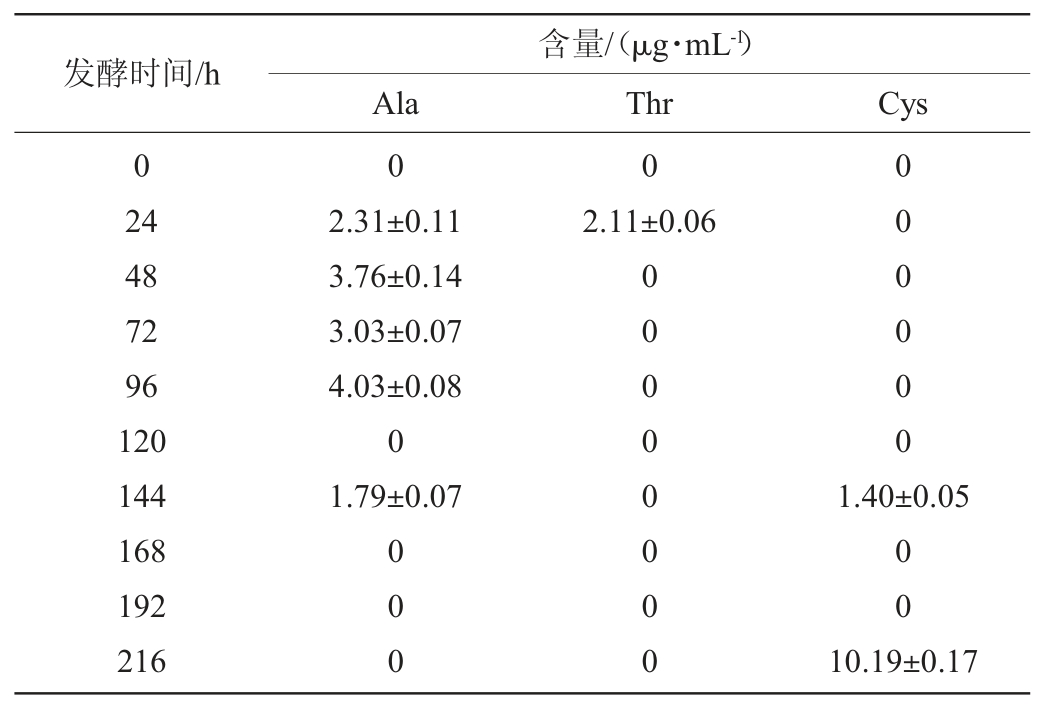
表4 枯草芽孢杆菌与鲁氏结合酵母共发酵时非共有氨基酸的变化
Table 4 Changes of non-common amino acid during the co-fermentation process of Bacillus subtilis and Zygosaccharomyces rouxii
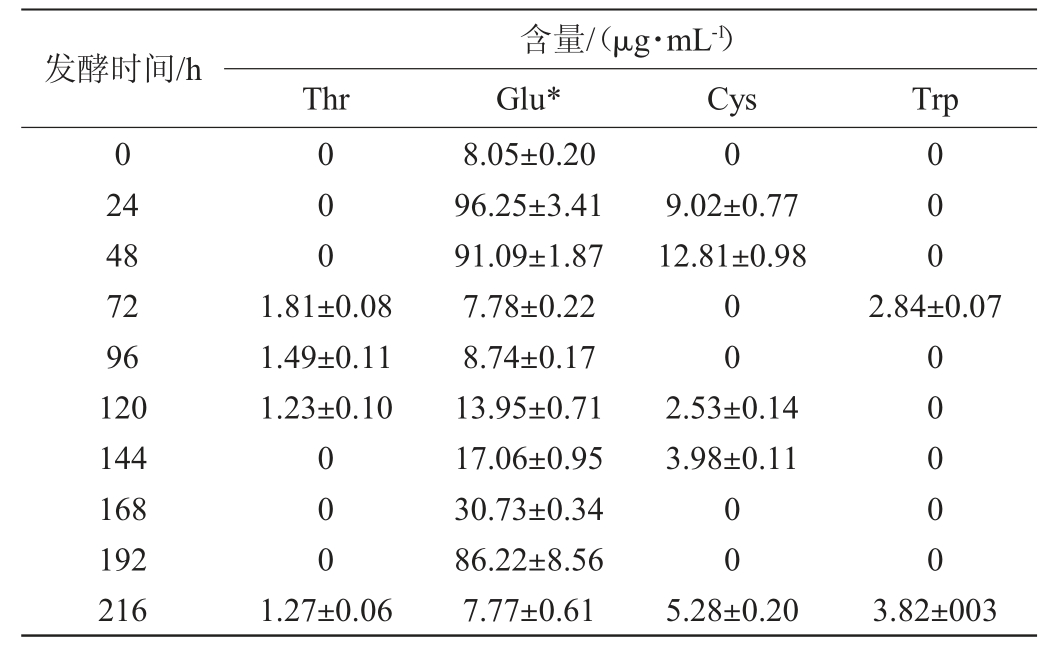
由表1~表4可知,枯草芽孢杆菌与酿酒酵母、鲁氏酵母共发酵体系中非共有氨基酸含量远高于汉逊酵母和毕赤酵母。一些非共有氨基酸只在特定条件下生成:谷氨酸和谷氨酰胺、半胱氨酸只在枯草芽孢杆菌分别与汉逊酵母、酿酒酵母或鲁氏结合酵母共发酵时被检出;丙氨酸只在枯草芽孢杆菌与毕赤酵母或酿酒酵母共发酵时被检出;苏氨酸只在枯草芽孢杆菌与汉逊酵母或鲁氏结合酵母共发酵时被检出;甘氨酸是枯草芽孢杆菌与酿酒酵母共发酵时所特有的氨基酸;色氨酸是枯草芽孢杆菌与鲁氏结合酵母共发酵时所特有的氨基酸。
当枯草芽孢杆菌与汉逊酵母共发酵168 h时未检测出任何非共有氨基酸组份,而丝氨酸只在共发酵72 h时可以被检测到,且含量很低,只有(1.83±0.11)μg/mL。当枯草芽孢杆菌与酿酒酵母共发酵时,只有少量的半胱氨酸和甘氨酸积累,而且它们分别只在发酵168~192 h或216 h时产生。当枯草芽孢杆菌与毕赤酵母共发酵时,苏氨酸在发酵第24小时产生,含量为(2.11±0.06)μg/mL,半胱氨酸在发酵第144小时和第216小时产生,含量分别为(1.40±0.05)μg/mL、(10.19±0.17)μg/mL,而丙氨酸在发酵后期未检测出。当枯草芽孢杆菌与鲁氏结合酵母共发酵时,苏氨酸主要在发酵中期积累,色氨酸只能在发酵第72小时和第216小时产生,含量分别为(2.84±0.07)μg/mL、(3.82±003)μg/mL。4种酵母与枯草芽孢杆菌共发酵时氨基酸合成代谢具有一定的差异。这种差异对后续研究芽孢杆菌与酵母菌在白酒制备上的复配方案进而研究白酒的风味形成奠定基础。
3 结论
以小麦粉为基质,枯草芽孢杆菌分别与汉逊酵母(Hansenula)、弗比恩毕赤酵母(Pichia fabianii)、酿酒酵母(Saccharomyces cerevisiae)和鲁氏酵母(Zygosaccharomyces rouxii)共发酵时,在乙醇代谢方面,Hansenula和B.subtilis共发酵最利于乙醇的合成,乙醇最高含量为(740.00±28.28)mg/L。在氨基酸合成方面,B.subtilis分别与Hansenula、P.fabianii、S.cerevisiae、Z.rouxii共发酵时氨基酸合成代谢存在差异,分别合成10、10、12、12种氨基酸,最高总氨基酸含量分别为(210.41±18.75)μg/mL、(160.92±9.11)μg/mL、(3 957.35±261.47)μg/mL、(956.71±56.64)μg/mL,其中共有氨基酸有7种,分别为缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、组氨酸和酪氨酸,非共有氨基酸为丝氨酸、甘氨酸、丙氨酸、半胱氨酸、苏氨酸以及色氨酸。S.cerevisiae与B.subtilis共发酵时最有利于氨基酸的合成。
[1]ŸZTÜRK S,ŸALIK P,ŸZDAMAR TH.Fed-batch biomolecule production by Bacillus subtilis:a state of the art review[J].Trend Biotechnol,2016,34(4):329-345.
[2]ANTONIA L,THIBAULT G,REBEKKA B,et al.Recombinant production of tailored bio-pharmaceuticals in different Bacillus strains and future perspectives[J].Eur J Pharmaceut Biopharm,2018,126:27-39.
[3]GU Y,XU X H,WU Y K,et al.Advances and prospects of Bacillus subtilis cellular factories:From rational design to industrial applications[J].Metab Eng,2018,50:109-121.
[4]明红梅,刘宇驰,等.制曲温度对酱香型大曲质量的影响[J].中国酿造,2010,29(7):157-160
[5]敞颜,赵辉,凌宏志.传统白酒发酵微生物的研究进展[J].食品工业科技,2010,31(9):425-427.
[6]吴文睿,李安军,汤有宏,等.古井贡酒窖泥中芽孢杆菌发酵风味的研究[J].食品科技,2016,41(3):27-30.
[7]钟妹霞,邓杰,汪文鹏,等.酱香型酒醅产香芽孢杆菌的分离鉴定及其代谢产物分析[J].现代食品科技,2017(4):89-95.
[8]汪文鹏,李永博,吴树坤,等.高温大曲中产吡嗪芽孢杆菌的分离鉴定及发酵产物分析[J].中国酿造,2017,36(6):63-66.
[9]林群,董胜,付秋香,等.产香风味枯草芽孢杆菌(Bacillus subtilis)分离及发酵代谢产物分析[J].酿酒科技,2013(11):30-32.
[10]王霜,缪礼鸿,张明春,等.浓酱兼香型酒醅中产酱香芽孢杆菌的筛选及发酵风味成分分析[J].中国酿造,2017,36(10):61-65.
[11]王芙蓉,范家琪,沈海亮,等.葵花籽油中吡嗪类风味化合物形成机理的研究进展[J].食品工业科技,2020,41(2):330-335,344.
[12]李欣,黄实宽,陈雄,等.以小麦粉为基质的地衣芽孢杆菌与酵母混酵氨基酸代谢特征[J].食品工业科技,2019,40(23):88-92,97.
[13]LI X,KANG YJ,YU C,et al.Exponential feeding strategy of high-density cultivation of a salt-tolerant aroma-producing yeast Zygosaccharomyces rouxii in stirred fermenter[J].Biochem Eng J,2016,111:18-23.
[14]TAO X M,LIU Y M,WANG Y H,et al.GC-MS with ethyl chloroformate derivatization for comprehensive analysis of metabolites in serum and its application to human uremia[J].Anal Bioanalyt Chem,2008,391(8):2881-2889.
[15]李晓庆,蔡颖,潘思轶,等.氯甲酸异丁酯二次衍生-气相色谱法检测柑橘中游离氨基酸[J].华中农业大学学报,2020,39(2):122-132.
[16]李欣,黄实宽,常煦,等.酵母与芽孢杆菌在小麦粉基质中共培养的生长规律[J].酿酒科技,2018(8):116-123.
[17]BAO J,ZHANG X,ZHENG J H,et al.Mixed fermentation of Spirulina platensis with Lactobacillus plantarum and Bacillus subtilis by randomcentroid optimization[J].Food Chem,2018,264:64-72.
[18]WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[19]杨春霞,廖永红,刘峻雄,等.牛栏山二锅头酒醅中芽孢杆菌分离鉴定及发酵风味分析[J].食品工业科技,2012,33(9):69-74.
[20]刘达玉,李翔,邹强,等.单曲/混曲对液态发酵法生产米酒的影响[J].食品研究与开发,2012,33(7):151-153.