细菌纤维素(bacterial cellulose,BC)是一种以β-葡聚糖链通过氢键作用形成的多孔三维网状结构的高分子聚合物[1]。细菌纤维素作为一种由微生物合成的天然高分子聚合物,具有优良的生物兼容性[2]、生物降解性、生物适应性、纳米材料特性[3]以及独特的理化性质和机械性能(如高纯度[4]、高结晶度、高抗张力[5]、高持水性[6]、高通透性等[7-8])。目前细菌纤维素已被报道在食品、医疗、化妆品、纺织、导电材料及组织工程等领域具有广阔的应用前景[9-10]。
目前已报道多种细菌纤维素生产菌株,但是能够大量合成细菌纤维素且能明显成膜的菌株主要来自醋杆菌属(Acetobacter)[7]。尽管目前已有大量关于优良菌株选育[11-13]、发酵工艺优化[14]、生物合成及调控机制[15]、细菌纤维素结构表征的相关研究[16],但是细菌纤维素产量仍较低,难以满足大规模工业化生产的要求。其中,围绕培养基组分及浓度、发酵条件及发酵方式的发酵工艺优化是提高细菌纤维素产量的有效途径。薛璐等[17]研究发现,醋酸杆菌C2利用果糖、蔗糖和甘露醇作为碳源可以获得较高的细菌纤维素产量,其中以甘露醇为碳源时的细菌纤维素产量达到4.2 g/L。SON H J等[18]对多种氮源进行对比后发现添加酵母膏为0.5%时,细菌纤维素产量最高达到2.87 g/L。马霞等[19]研究发现培养基中添加适量乙酸和乳酸可提高细菌纤维素产量。此外,细菌纤维素发酵培养基的初始pH为4.0~6.0,发酵温度为28~30 ℃[15]。上述发酵培养基及发酵条件优化大多是通过动态发酵方式实现。尽管动态方法方式具有更高的溶氧水平和底物利用效率,但是由于机械搅拌或气流运动造成的发酵过程中细菌纤维素成膜困难和性能不稳定,使得细菌纤维素产量较难提高。相对于动态发酵,静态发酵具有工艺简单、设备要求低、产物性能稳定以及细菌纤维素产量高等优点[20],是细菌纤维素生产的一种较为理想的发酵方式。
本研究以实验室自主选育获得的一株细菌纤维素生产菌株葡糖醋杆菌(Gluconacetobacter)J2-1为试验菌株,采用静态发酵方式,利用单因素和正交试验对其发酵培养基组分进行优化,以期提高细菌纤维素产量,为后续中试研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
葡糖醋杆菌(Gluconacetobacter)J2-1:广西大学生命科学与技术学院食品发酵工程实验室保藏。
1.1.2 化学试剂
葡萄糖、果糖、蔗糖、甘露醇、甘油、柠檬酸、乙酸、乳酸、苹果酸、乙醇、Na2HPO4·12H2O、MgSO4·7H2O(均为分析纯):上海泰坦科技股份有限公司;蛋白胨、胰蛋白胨、酵母膏、酵母粉(均为生化试剂):北京奥博星生物技术有限责任公司;玉米浆干粉:山东聚慈玉米生物科技有限公司。
1.1.3 培养基
种子培养基:葡萄糖40 g/L,酵母膏2.5 g/L,柠檬酸2 g/L,Na2HPO4·12H2O 2 g/L,MgSO4·7H2O 0.1 g/L;初始pH 5.0,115 ℃灭菌30 min后加入无水乙醇2%(V/V)。
基础发酵培养基:葡萄糖40 g/L,酵母膏10 g/L,柠檬酸2 g/L,Na2HPO4·12H2O 3 g/L;初始pH 5.8,115 ℃灭菌30 min后加入无水乙醇2%(V/V)。
1.2 仪器与设备
PL303精密电子天平:德国METTLERTOLEDO公司;HVE-50高压灭菌锅:日本Hirayama公司;SW-CJ-1F超净工作台:苏州安泰空气技术公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;SKY-211B摇床培养箱:上海苏坤实业有限公司。
1.3 实验方法
1.3.1 菌种培养
从斜面上挑取一环菌苔,接种至装有50 mL种子培养基的250 mL三角瓶,于28 ℃、180 r/min培养24 h,制成种子液。将种子液以2%(V/V)的接种量接种于装有50 mL初始发酵培养基的250 mL三角瓶,30 ℃静置培养7 d。
1.3.2 静态发酵培养基组分优化单因素试验
以细菌纤维素产量为评价指标,分别对培养基碳源种类(葡萄糖、果糖、蔗糖、甘露醇和甘油)及碳源添加量(20 g/L、40 g/L、60 g/L、80 g/L和100 g/L)、氮源种类(蛋白胨、胰蛋白胨、酵母膏、酵母粉和玉米浆干粉)及氮源添加量(6 g/L、10 g/L、14 g/L、18 g/L和22 g/L)、乙醇体积分数(0、1%、2%、3%、4%和5%)、Na2HPO4·12H2O添加量(0、1 g/L、2 g/L、3 g/L、4 g/L和5 g/L)、有机酸种类(柠檬酸、乙酸、乳酸和苹果酸)及最佳有机酸添加量(1 g/L、2 g/L、3 g/L、4 g/L和5 g/L)、MgSO4·7H2O添加量(0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L和0.5 g/L)进行单因素优化。培养基单因素试验中,所试验因素的浓度与基础发酵培养基中的浓度一致;其他因素的浓度,若已优化则与优化后的浓度一致,若未优化则与基础发酵培养基中的浓度一致。
1.3.3 静态发酵培养基组分优化正交试验
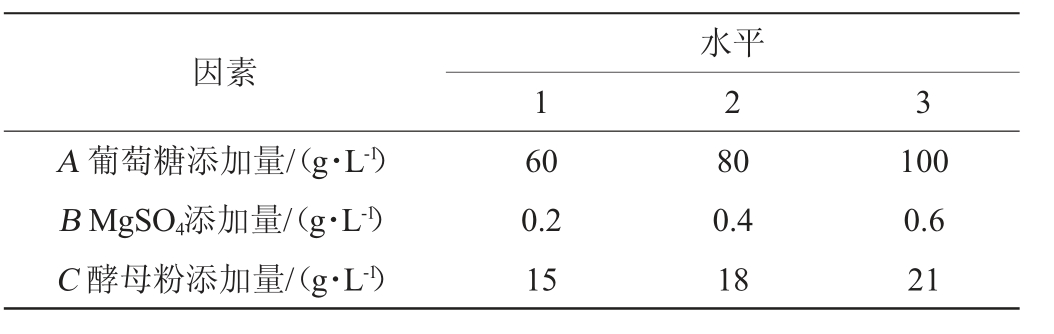
在单因素优化的基础上,选择葡萄糖添加量(A)、MgSO4·7H2O添加量(B)和酵母粉添加量(C)进行正交优化试验,正交优化试验因素与水平如表1所示。
表1 培养基组分优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for medium composition optimization
1.3.4 细菌纤维素产量测定
发酵结束后,细菌纤维素经去离子水漂洗干净后,置于0.5 mol/L NaOH溶液中沸水浴0.5 h,然后置于去离子水中反复浸泡至乳白凝胶状,90 ℃烘干至恒质量。细菌纤维素产量(g/L)计算:细菌纤维素干质量与发酵培养基体积的比值。
2 结果与分析
2.1 培养基组分优化单因素试验
2.1.1 碳源种类及最佳碳源添加量

图1 不同碳源种类(A)和葡萄糖添加量(B)对菌株J2-1细菌纤维素产量的影响
Fig.1 Effect of different carbon sources (A) and glucose addition (B)on bacterial cellulose production by strain J2-1
在细菌纤维素发酵生产过程中,碳源既是菌体生长的能量来源又是细菌纤维素合成的底物。依据文献报道及前期实验结果[17],选取葡萄糖、果糖、蔗糖、甘露醇和甘油进行碳源种类及最佳碳源添加量优化,结果见图1。由图1A可知,葡萄糖、果糖、甘露醇和甘油均有利于细菌纤维素产生,30 ℃静置培养7 d产量均在5 g/L左右;而蔗糖作为碳源时,细菌纤维素产量较低,仅为(2.34±0.12)g/L。综合考虑细菌纤维素产量及原料成本等因素,选择葡萄糖作为最优碳源。
设置葡萄糖添加量分别为20 g/L、40 g/L、60 g/L、80 g/L和100 g/L,考察葡萄糖添加量对细菌纤维素产量的影响。由图1B可知,当葡萄糖添加量为20~80 g/L时,细菌纤维素产量也随葡萄糖添加量增加而增大;当葡萄糖添加量为80 g/L时,细菌纤维素产量最高,达到(5.27±0.05)g/L;当葡萄糖添加量>80 g/L之后,细菌纤维素产量反而降低。因此,选择葡萄糖最佳添加量为80 g/L。
2.1.2 氮源种类及最佳氮源添加量

图2 不同氮源种类(A)和酵母粉添加量(B)对菌株J2-1细菌纤维素产量的影响
Fig.2 Effects of different nitrogen sources (A) and yeast extract powder addition (B) on bacterial cellulose production by strain J2-1
在细菌纤维素发酵生产过程中,一般使用有机氮源,其一方面能够为菌体生长提供氮素,另一方面有机氮源中丰富的维生素和微量元素能够作为细菌纤维素合成相关酶的辅助因子。依据文献报道及前期试验结果[18],选取蛋白胨、胰蛋白胨、酵母膏、酵母粉和玉米浆干粉进行氮源种类及最佳氮源添加量优化,结果见图2。由图2A可知,酵母膏和酵母粉更有利于细菌纤维素生产,其中以酵母粉为氮源时,30 ℃静置培养7 d细菌纤维素产量达到最大,为(5.68±0.06)g/L,因此,选择酵母粉作为最优氮源。
设置酵母粉添加量分别为6 g/L、10 g/L、14 g/L、18 g/L和22 g/L,考察酵母粉添加量对细菌纤维素产量的影响。由图2B可知,随着酵母粉添加量在6~18 g/L范围内的增加,细菌纤维素产量随之增加;当酵母粉添加量为18 g/L时,细菌纤维素产量最高,达到(7.43±0.07)g/L;当酵母粉添加量>18 g/L之后,细菌纤维素产量下降。因此,选择酵母粉最佳添加量为18 g/L。
2.1.3 乙醇体积分数
在细菌纤维素发酵生产过程中,乙醇作为辅助碳源对葡糖酸醋杆菌的生长和细菌纤维素合成具有促进作用。按体积百分比设置乙醇添加量,考察乙醇体积分数对细菌纤维素产量的影响,结果见图3。由图3可知,当培养基中不添加乙醇时,细菌纤维素产量为(6.19±0.19)g/L;随着乙醇体积分数在1%~2%范围内增加,细菌纤维素产量随之增加;当乙醇体积分数为2%时,细菌纤维素产量最高,达到(7.39±0.12)g/L,提高了19.4%,促进效果较为明显;但是,当乙醇体积分数>2%之后,细菌纤维素产量明显降低,甚至低于不添加乙醇时的细菌纤维素产量,这可能是由于过量的乙醇抑制菌体生长的结果。因此,选择最佳乙醇体积分数为2%。
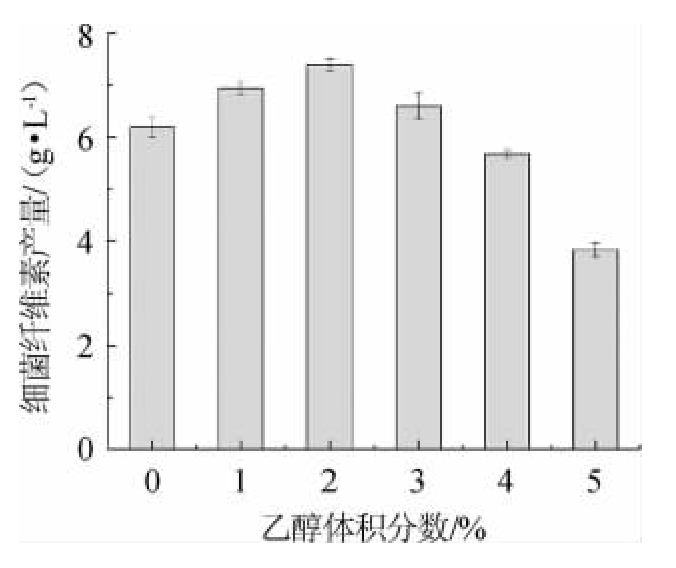
图3 乙醇体积分数对菌株J2-1细菌纤维素产量的影响
Fig.3 Effect of ethanol volume fraction on the bacterial cellulose production by strain J2-1
2.1.4 Na2HPO4·12H2O及MgSO4·7H2O添加量
在细菌纤维素发酵生产过程中,Na2HPO4·12H2O能够为菌体生长提供磷源,同时对发酵液pH具有缓冲作用。Mg2+作为细菌纤维素合成酶的激活剂,对细菌纤维素合成具有促进作用。设置Na2HPO4·12H2O添加量0、1 g/L、2 g/L、3 g/L、4 g/L和5 g/L,MgSO4·7H2O添加量0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L和0.5 g/L,考察Na2HPO4·12H2O、MgSO4·7H2O添加量对细菌纤维素产量的影响,结果见图4。

图4 Na2HPO4·12H2O(A)及MgSO4·7H2O(B)添加量对菌株J2-1细菌纤维素产量的影响
Fig.4 Effect of Na2HPO4·12H2O (A) and MgSO4·7H2O (B) addition on bacterial cellulose production by strain J2-1
由图4A可知,当培养基中不添加Na2HPO4·12H2O时,细菌纤维素产量为(6.06±0.15)g/L;当Na2HPO4·12H2O添加量为1~3 g/L时,细菌纤维素产量随之增加;当Na2HPO4·12H2O添加量为3 g/L时,细菌纤维素产量最高,达到(7.49±0.10)g/L,提高了23.6%;当Na2HPO4·12H2O添加量>3 g/L之后,细菌纤维素产量不再升高。因此,选择最佳Na2HPO4·12H2O添加量为3 g/L。
由图4B可知,当培养基中不添加MgSO4·7H2O时,细菌纤维素产量为(8.06±0.13)g/L;当MgSO4·7H2O添加量在0.1~0.4 g/L时,细菌纤维素产量随之增加;当MgSO4·7H2O添加量为0.4g/L时,细菌纤维素产量最高,达到(9.34±0.20)g/L,提高了15.9%;当MgSO4·7H2O添加量>0.4 g/L之后,细菌纤维素产量有所下降。因此,选择最佳MgSO4·7H2O添加量为0.4 g/L。
2.1.5 有机酸种类及浓度
在细菌纤维素发酵生产过程中,有机酸不仅作为辅助碳源对菌体生长和细菌纤维素合成具有促进作用,而且可以与Na2HPO4·12H2O一起对发酵液pH具有缓冲作用。依据文献报道及前期试验结果[19],以不加有机酸为对照,选取柠檬酸、乙酸、乳酸和苹果酸4种有机酸,考察有机酸种类及最佳有机酸添加量对细菌纤维素产量的影响,结果见图5。由图5A可知,当培养基中不添加任何有机酸时,细菌纤维素产量为(6.43±0.17)g/L;当培养基中添加柠檬酸、乙酸、乳酸和苹果酸任意一种有机酸时,细菌纤维素产量都有所提高,特别是培养基中添加乳酸时,细菌纤维素产量最高达到(8.35±0.24)g/L,提高了28.8%。因此,选择乳酸作为最优有机酸。设置乳酸添加量为1g/L、2g/L、3g/L、4g/L和5g/L,考察乳酸浓度对细菌纤维素产量的影响。由图5B可知,当乳酸添加量为1~2 g/L时,细菌纤维素产量随之增加;当添加2 g/L乳酸时,细菌纤维素产量最高,为(8.28±0.30)g/L;当乳酸添加量>2 g/L之后,细菌纤维素产量有所降低,这可能是由于高浓度乳酸对菌体生长有所抑制的结果。因此,选择最佳乳酸添加量为2 g/L。

图5 不同有机酸(A)和乳酸添加量(B)对菌株J2-1 细菌纤维素产量的影响
Fig.5 Effect of different organic acids (A) and lactic acid addition (B)on the bacterial cellulose production by strain J2-1
2.2 培养基组分优化正交试验
单因素优化试验结果表明,相对于乙醇、Na2HPO4·12H2O和乳酸,葡萄糖、MgSO4·7H2O和酵母粉在最优浓度条件下对细菌纤维素产量的提高更为显著。因此,以细菌纤维素产量为评价指标,选取葡萄糖(A)、MgSO4·7H2O(B)和酵母粉(C)添加量进行正交优化试验,试验结果与分析见表2,方差分析见表3。
由表2可知,葡萄糖、MgSO4·7H2O和酵母粉对细菌纤维素产量的影响程度为:葡萄糖>MgSO4·7H2O>酵母粉。根据正交试验极差分析结果,葡萄糖、MgSO4·7H2O和酵母粉的最佳组合为A2B2C2,即葡萄糖添加量80 g/L、酵母粉添加量18 g/L,MgSO4·7H2O 添加量0.4 g/L。在此最佳培养基组分条件下进行3次平行验证试验,细菌纤维素产量平均值为9.34 g/L。由表3可知,葡萄糖对细菌纤维素产量影响显著(P<0.05),而MgSO4·7H2O和酵母粉对细菌纤维素产量影响不显著(P>0.05)。
表2 培养基组分优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for medium composition optimization

表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results

注:“*”表示对结果影响显著(P<0.05)。
3 结论
利用单因素和正交试验对葡糖醋杆菌J2-1静态发酵生产细菌纤维素的培养基进行了优化,确定培养基最优组分:葡萄糖80 g/L、酵母粉18 g/L、乙醇体积分数2%(V/V)、Na2HPO4·12H2O 3 g/L、乳酸2 g/L、MgSO4·7H2O 0.4 g/L。在此优化培养基条件下,细菌纤维素产量达到9.34 g/L,是优化前细菌纤维素产量的1.89倍。下一步将在培养基优化的基础上,重点针对其中试放大开展研究,以期为细菌纤维素的大规模工业化生产奠定基础。
[1]MOHITE B V,SALUNKE B K,PATIL S V.Enhanced production of bacterial cellulose by using Gluconacetobacter hansenii NCIM 2529 strain under shaking conditions[J].Appl Biochem Biotech,2013,169(5):1497-1511.
[2]汪丽粉,李政,贾士儒,等.细菌纤维素性质及应用的研究进展[J].微生物学通报,2014,41(8):1675-1683.
[3]GUO X,CAVKA A,JÖNSSON L J,et al.Comparison of methods for detoxification of spruce hydrolysate for bacterial cellulose production[J].Microbial Cell Factories,2013,12:93.
[4]FLOREA M,REEVE B,ABBOTT J,et al.Genome sequence and plasmid transformation of the model high-yield bacterial cellulose producer Gluconacetobacter hansenii ATCC 53582[J].Sci Rep,2016,3(6):23635.
[5]KIM S S,LEE S Y,PARK K J,et al.Gluconacetobacter sp.gel SEA623-2,bacterial cellulose producing bacterium isolated from citrus fruit juice[J].Saudi J Biol Sci,2017,24(2):314-319.
[6]URBINA L,HERNÁNDEZ-ARRIAGA A M,ECEIZA A,et al.By-products of the cider production:an alternative source of nutrients to produce bacterial cellulose[J].Cellulose,2017,24(5):2071-2082.
[7]李国辉.细菌纤维素纤维复合材料的制备及其应用研究[D].无锡:江南大学,2017.
[8]谭玉静,洪枫,邵志宇.细菌纤维素在生物医学材料中的应用[J].中国生物工程杂志,2007,27(4):126-131.
[9]赵晓霞.细菌纤维素纤维的制备与性能研究[D].青岛:青岛大学,2010.
[10]李元敬.细菌纤维素生物合成的耐酸适应性机理[D].长春:中国科学院研究生院(东北地理与农业生态研究所),2016.
[11]TANSKUL S,AMORNTHATREE K,JATURONLAK N.A new cellulose-producing bacterium, Rhodococcus sp.MI 2:Screening and optimization of culture conditions[J].Carbohyd Polym,2013,92(1):421-428.
[12]朱明阳.产细菌纤维素菌株选育及细菌纤维素性质研究[D].南京:南京理工大学,2004.
[13]SETO A,KOJIMA Y,TONOUCHI N,et al.Screening of bacterial cellulose-producing Acetobacter strains suitable for sucrose as a carbon source[J].Biosci Biotech Bioch,1997,61(4):735-736.
[14]CHAWLA P R,BAJAJ I B,SURVASE S A,et al.Microbial cellulose:fermentative production and applications[J].Food Technol Biotech,2009,47(2):107-124.
[15]LEE K Y,BULDUM G,MANTALARIS A,et al.More than meets the eye in bacterial cellulose:biosynthesis,bioprocessing,and applications in advanced fiber composites[J].Macromol Biosci,2014,14(1):10-32.
[16]MOHITE B V,PATIL S V.Physical,structural,mechanical and thermal characterization of bacterial cellulose by G.hansenii NCIM 2529[J].Carbohyd Polym,2014,106:132-141.
[17]薛璐,杨谦.醋杆菌产纤维素发酵培养基的优化[J].食品科学,2004,25(11):213-215.
[18]SON H J,HEO M S,KIM Y G,et al.Optimization of fermentation conditions for the production of bacterial cellulose by a newly isolated Acetobacter sp.A9 in shaking cultures[J].Biotechnol Appl Bioch,2001,33(1):1-5.
[19]马霞,贾士儒,关凤梅,等.有机酸对木醋杆菌合成细菌纤维素的影响规律[J].纤维素科学与技术,2003,11(1):34-37.
[20]ISLAM M U,ULLAH M W,KHAN S,et al.Strategies for cost-effective and enhanced production of bacterial cellulose[J].Int J Biol Macromol,2017,102(1):1166-1173.