青枯雷尔氏菌(Ralstonia solanacearum)是一种毁灭性的土传性植物病原菌,广泛分布于热带、亚热带及温带地区[1]。青枯雷尔式菌寄主范围广,从单子叶、双子叶植物到林木,可侵染50 多个科的200余种植物[2],通过侵染植株伤口或根尖裂缝,定殖于皮层组织,入侵维管束,阻碍水分的运输,导致植株枯萎并最终死亡[3]。由于在寄生范围、致病能力、生化型等特性上存在较大差异,该菌引起的植物病害也较难防治[4]。目前,生产上防治青枯病主要依靠化学农药[5-6],但随着人类对食品安全、环境保护和克服有害生物抗性等问题的日益重视,化学杀菌剂的使用正受到越来越严格的限制[7]。微生物源防治是当前及未来植物病害防治研究的热点,毛露甜等[8]通过平板对峙法筛选出枯草芽孢杆菌等对青枯雷尔式菌的抑制效果明显。汪汉成等[9]以青枯雷尔式菌为指示菌,筛选出的拮抗菌经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。黑曲霉(Aspergillus niger)作为美国食品药品监督管理局认定的安全发酵菌种,工业中用来发酵柠檬酸和葡萄糖酸[10]。近年来黑曲霉生防菌的研究报道逐渐增多,李大军等[11]从黑曲霉中提取到曲霉多糖物质,该物质对多种病原菌均有良好的抑制效果。左祥等[12]从飞龙斩血中分离到一株内生真菌黑曲霉F-001,研究发现,该菌株具有广谱抗菌性。李祝等[13]从土壤中分离得到一株Aspergillus niger(xj),其对5种常见病原真菌均具有抑制作用。唐婧红等[14]将黑曲霉制备成泡腾片对烟草青枯病进行防治,效果良好。本研究以具有自主知识产权的黑曲霉孢子粉为原料,采用天然产物分离手段从黑曲霉孢子粉中分离得到对青枯雷尔式菌具有抑菌活性化合物S5,通过测定电导率、核酸蛋白泄露、总蛋白以及活性氧(reactive oxygen species,ROS)的变化等对其抑菌活性进行初步研究,旨在为对青枯雷尔式菌的防治提供一定的理论基础和依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
黑曲霉(Aspergillus niger)xj(编号:M206021):由贵州大学真菌资源研究所分离,中国典型培养物保藏中心保藏;青枯雷尔式菌(Rastonia solanacearum)Q11-2:贵州大学微生物实验室保存。
1.1.2 化学试剂
氯化钠、丙酮、石油醚、乙酸乙酯、二甲基亚砜(dimethyl sulfoxide,DMSO)(均为分析纯)、氯霉素(分析纯):北京索莱宝科技有限公司;磷酸二氢钾、磷酸氢二钠(均为分析纯):天津科密欧化学试剂有限公司;溴酚蓝、活性氧类检测试剂盒:上海碧云天生物科技有限公司。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L。121 ℃湿热灭菌20 min。
1.2 仪器与设备
DDB303A电导率仪:上海雷磁仪器厂;BIOMATE 3S紫外分光光度计:美国Thermo Fisher公司;JY300HE电泳仪:北京君意东方电泳设备有限公司;7890A/5975C气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国Agilent Technologie公司;Allegra X-30R离心机:美国BECKMAN公司;Gel Doc XR+凝胶成像系统:美国BIORAD公司。
1.3 方法
1.3.1 黑曲霉孢子粉粗提物的制备及粗分段
黑曲霉孢子粉粗提物的制备方法参考文献[14],选用15×109 CFU/g黑曲霉干燥孢子体粉末500 g,用500 mL丙酮、60 ℃回流提取3 h,收集滤液,重复提取2次,浓缩提取液,得1.677 g浸膏粗提物。浸膏用蒸馏水悬浮,用石油醚进行3次萃取,浓缩石油醚萃取液得到0.782 g石油醚部分。经过硅胶柱层析分离,石油醚-乙酸乙酯(100∶1、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1(V/V))体系洗脱,每个梯度洗脱体积为2 L,分段收集洗脱液,通过薄层色谱硅胶板上的迁移情况将洗脱液分为九个部分,编号为S1~S9。
1.3.2 黑曲霉孢子粉粗提物洗脱液对青枯雷尔式菌的抑制
以对菌株Q11-2的活性抑制效果为评价指标,对洗脱液S1~S9进行活性筛选。将S1~S9分别用DMSO配制质量浓度为100 mg/mL的母液。接种菌株Q11-2于50 mL的牛肉膏蛋白胨液体培养基中,30 ℃振荡培养13 h。然后以10%的接种量接种菌株Q11-2到1 mL新鲜培养基中,加入S1~S9母液,使其终质量浓度为1 mg/mL,30 ℃振荡培养12 h,在波长420 nm处测定吸光度值。设置相同终浓度氯霉素为药物对照,以不加活性段母液为空白对照,每个处理3个平行。抑菌率计算公式如下:
式中:OD空白为空白处理在波长420 nm处的吸光度值;OD样品为S1~S9的处理组在波长420 nm处的吸光度值。
1.3.3 洗脱液GC-MS化学成分分析
经过洗脱液S1~S9对青枯雷尔式菌的活性筛选后,选取活性最佳洗脱液进行GC-MS分析其化学组成,并确定为目标活性段。
甲酯化条件:取100 mg 洗脱液,加入2 mL 1%硫酸-甲醇溶液,超声振荡10 min后70 ℃水浴3 min,再加入2 mL正己烷,振荡3 min后取上清,加入1 g无水硫酸钠和5 mL饱和NaCl,振荡1 min,静置5 min,取上清过0.22 μm有机滤膜,备用。进样2 μL甲酯化处理后的洗脱液,利用气相色谱-质谱(GC-MS)联用仪对样品进行分析。气相色谱(GC)条件为柱温50 ℃,保持2 min,以5 ℃/min升温至310 ℃,保持4 min,运行时间58 min;汽化室温度250 ℃;载气为高纯氦气(He)(纯度99.999%);柱前压7.06 psi,载气流量1.0 mL/min;分流比20∶1;溶剂延迟时间5 min。质谱(MS)条件:离子源为电子电离(electronic ionization,EI)源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 482 V;接口温度280 ℃;质量范围29~500 amu。
1.3.4 电导率测定
通过测定胞外电导率揭示目标活性段对菌株Q11-2细胞渗透性的影响。接种菌株Q11-2于50 mL的牛肉膏蛋白胨液体培养基中,30 ℃振荡培养13 h。参考谢丽等[15]的方法测定终质量浓度1 mg/mL的目标活性段作用1 h、2 h、3 h、4 h、5 h、6 h后菌株Q11-2 培养基的电导率。
1.3.5 核酸、蛋白质等大分子物质的测定
通过测定胞外环境中核酸和蛋白质等大分子物质的含量变化反映目标活性段对菌株Q11-2细胞膜完整性的影响。接种菌株Q11-2于50 mL的牛肉膏蛋白胨液体培养基中,30 ℃振荡培养13 h。参考洪学斌[16]的方法改动,以终质量浓度为1 mg/mL的目标活性段处理菌株Q11-2 作用3 h、6 h、9 h、12 h、15 h后,各取3 mL,4 500 r/min离心5 min,立即取上清液在波长260 nm和280 nm处测定吸光度值。
1.3.6 活性氧测定
通过测定胞内活性氧的变化来反应目标活性段对菌株Q11-2细胞内环境平衡的影响。接种菌株Q11-2 于50 mL的牛肉膏蛋白胨液体培养基中,30 ℃振荡培养13 h。测定方法参考活性氧检测试剂盒说明书,取3 mL菌液,12 000 r/min离心5 min,用磷酸盐缓冲液重悬两次菌体,然后用终质量浓度为10 μmol/L的2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)与菌体混合,37 ℃孵育30 min。接着用磷酸缓冲盐溶液(phosphate buffer saline,PBS)除去剩余DCFH-DA,与1 mg/mL的目标活性段反应30 min,对照设置同1.3.2,每反应10 min取样制片在荧光显微镜下进行观察。
1.3.7 总蛋白量的测定
参照吴海霞[17]的方法,接种菌株Q11-2 于50 mL的牛肉膏蛋白胨液体培养基中,30 ℃振荡培养13 h。将目标活性段加入菌液至终质量浓度为1 mg/mL在30 ℃条件下振荡培养12 h,每4 h取出5 mL样品,5 000 r/min离心2 min后加入100 μL 1%溴酚蓝,95 ℃煮沸10 min,以氯霉素为阳性对照,正常菌液为空白对照,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium lauryl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)之后进行考马斯亮蓝染色观察实验结果,并通过BIO-RAD凝胶成像系统进行图片处理。
1.3.8 数据处理
使用WPS 2019进行数据分析,IBM SPSS Statistics 22.0进行统计学分析,采用Duncan法对所得数据进行显著性检验。
2 结果与分析
2.1 黑曲霉孢子粉粗提物活性段对青枯雷尔式菌的影响
黑曲霉孢子粉粗提物洗脱液S1~S9对菌株Q11-2的抑制率结果见图1。由图1可知,其中洗脱液S5对于菌株Q11-2的抑制效果最好,达到90.87%,且与药物对照氯霉素的抑制率无显著差异(P<0.05)。洗脱液S4对于菌株Q11-2的抑菌率也达到67.45%,洗脱液S6、S7的抑制率都高于50%,其余部分洗脱液对菌株Q11-2的抑制效果均低于50%。因此,推测黑曲霉孢子粉中抑菌活性物质主要在粗提物组分S5中。

图1 黑曲霉孢子粉粗提物洗脱液S1~S9对菌株Q11-2的抑制率
Fig.1 Antibacterial rate of Aspergillus niger spore powder crude extract eluent S1-S9 against strain Q11-2
CAP代表氯霉素,不同小写字母代表各组数据间差异显著(P<0.05)。
2.2 活性段的GC-MS成分分析
根据活性段对菌株Q11-2的抑制率结果,选择洗脱液S5段进行GC-MS化学成分分析,总离子流色谱图见图2,洗脱液S5段组分含量分析结果见表1。通过质谱计算机数据库检索比对总离子流图中各峰,经核对美国国家标准与技术研究院2005和Wiley275标准质谱图,确定了S5的49种化学成分,鉴定出其中29种化合物。从表1可知,油酸(26.52%)含量最高,其次是亚油酸甲酯(14.46%)、油酸甲酯(11.10%)、棕榈酸(10.50%)、油酸乙酯(7.36%)、亚油酸乙酯(6.88%)。结果显示出洗脱液S5段中主要成分为亚油酸,油酸和棕榈酸等脂肪酸。张希等[18]研究发现,部分脂肪酸及其衍生物能够有效抑制大肠杆菌以及白色念珠球菌的生长繁殖;张璐[19]研究表明,碳链为18~20的双键多不饱和脂肪酸及其甘油单酯对大肠杆菌和金黄色葡萄球菌都有极强的抑制作用。
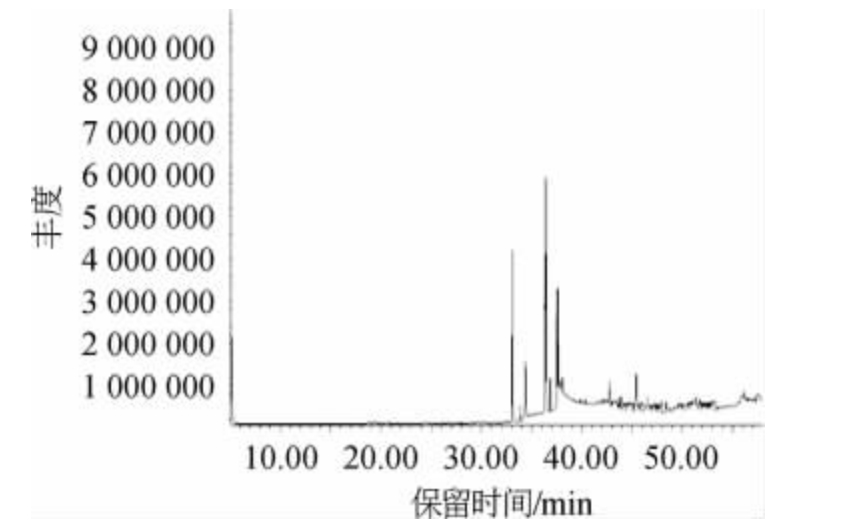
图2 粗提物洗脱液S5的化学成分GC-MS分析总离子流色谱图
Fig.2 Total ion chromatogram of chemical composition in the crude extract eluent S5 analyzed by GC-MS
表1 粗提物洗脱液S5的化学成分
Table 1 Chemical components of the crude extract eluent S5
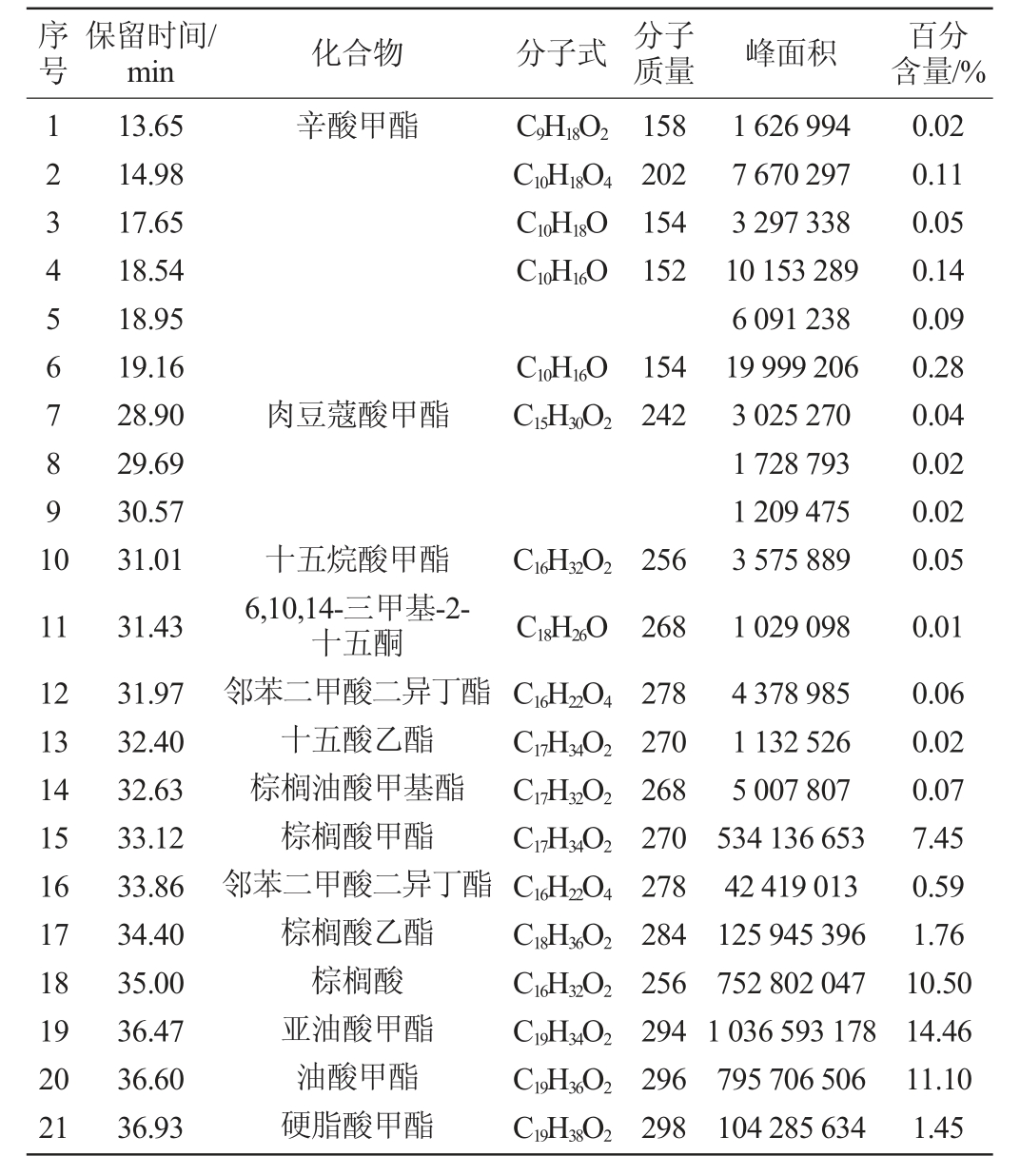
续表

2.3 粗提物洗脱液S5的抑菌机制研究
2.3.1 粗提物洗脱液S5对电导率的影响
当细菌遭受外界药物影响时,细胞膜的维持内环境稳定的能力下降,使胞内K+等电解质大量外泄,其培养液电导率的变化可以反映细胞膜渗透性的改变。黑曲霉孢子粉粗提物洗脱液S5对菌株Q11-2 的电导率影响结果见图3。

图3 粗提物洗脱液S5对菌株Q11-2电导率的影响
Fig.3 Effect of the crude extract eluent S5 on conductivity of strain Q11-2
由图3可知,洗脱液S5作用菌体过程中,上清液电导率随着时间的增加而增加。在作用6 h时洗脱液S5处理组的电导率达到最大值,较空白组增加了17.3%(P<0.05),推测洗脱液S5能够改变青枯雷尔氏菌细胞膜通透性,引起细胞离子外泄导致胞外电导率升高。
2.3.2 粗提物洗脱液S5对细胞完整性的影响
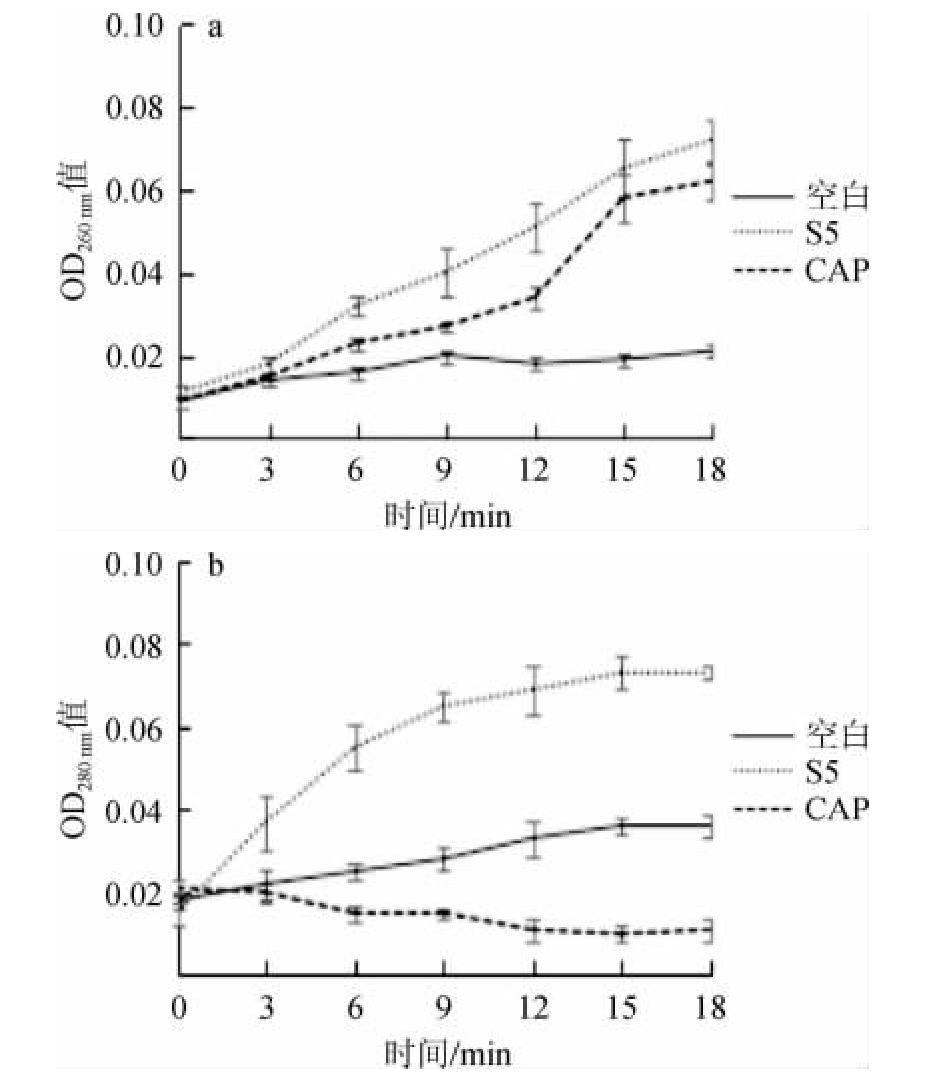
图4 粗提物洗脱液S5对菌株Q11-2细胞膜完整性的影响
Fig.4 Effect of the crude extract eluent S5 on cell integrity of strain Q11-2
由图4a可知,洗脱液S5与菌株Q11-2作用3 h后,菌株Q11-2的胞外260 nm吸光度值逐渐升高,说明菌株Q11-2在与洗脱液S5的作用过程中,胞外环境中的核酸含量不断增加。由图4b可知,可观察到细胞外液在波长280 nm处的吸光度值与时间呈正相关,在洗脱液S5作用菌株Q11-2的过程中,S5处理组的胞外环境中的蛋白质含量不断增加,而空白处理的280 nm吸光度值远低于S5处理组。可以推测洗脱液S5对菌株Q11-2的细胞膜结构造成了损伤,致使细胞膜结构不完整,导致核酸和蛋白质外泄。氯霉素组在280 nm的吸光度值明显低于空白组,据文献报道氯霉素可以与核糖体50S亚基相结合导致信使核糖核酸与核糖体结合受阻,从而抑制蛋白合成[20]。
2.3.3 粗提物洗脱液S5对细胞ROS的影响
由图5可知,对比空白的ROS荧光强度,可见洗脱液S5引起的ROS积累是十分迅速的,在50 min内的ROS检测荧光强度都与空白组的ROS荧光强度的差异极显著(P<0.01)。在30 min左右检测到洗脱液S5荧光强度达到最大,比空白组的荧光强度高出540%,推测在洗脱液S5的作用下,菌株Q11-2细胞在短时间内引起了胞内大量活性氧的产生,活性氧的大量积累导致细胞膜结构损伤,进而影响其正常细胞代谢过程。
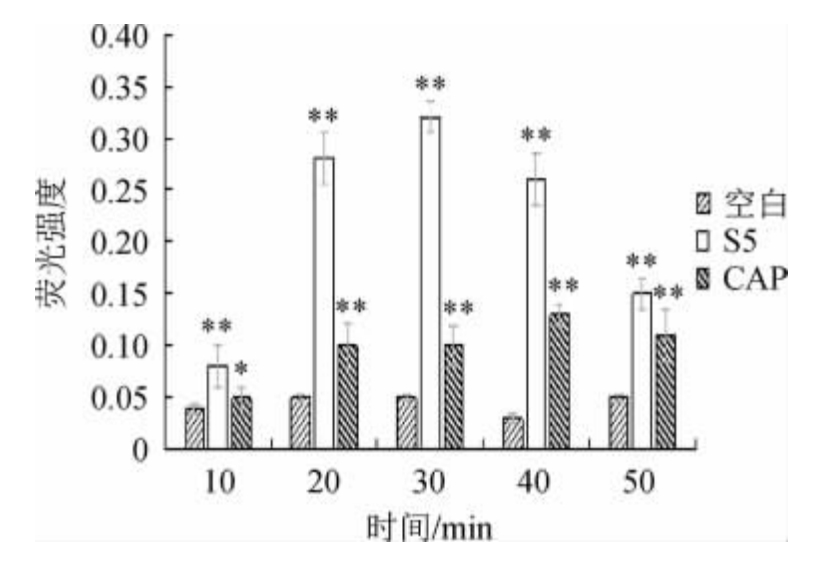
图5 粗提物洗脱液S5对Q11-2的活性氧的影响
Fig.5 Effect of the crude extract eluent S5 on reactive oxygen species of strain Q11-2
“**”表示与空白组差异极显著(P<0.01);“*”表示与空白组差异显著(P<0.01)。
2.3.4 粗提物洗脱液S5对细胞总蛋白含量的影响
由图6可知,在3 h时蛋白量变化差异不大,随着时间增加,6 h时已经可以看出洗脱液S5与氯霉素组对比空白组的蛋白含量出现变化,9 h时空白组的蛋白含量已经明显高于洗脱液S5组和氯霉素组,12 h时总蛋白差异十分明显,此实验结果观察到空白组的总蛋白含量随着时间增加而增加,符合正常代谢过程,洗脱液S5组和氯霉素组的总蛋白含量几乎保持不变,推测洗脱液S5可能抑制了菌株Q11-2的蛋白合成,并对细胞膜结构造成破坏导致蛋白质泄露胞外,造成总蛋白量相对于空白组减少。

图6 粗提物洗脱液S5对菌株Q11-2总蛋白量的影响
Fig.6 Effect of the crude extract eluent S5 on total protein contents of strain Q11-2
M:Marker;1~3分别为3 h时的空白组、S5组、氯霉素组,4~6为6 h时的空白组、S5组、氯霉素组;7~9为9 h时的空白组、S5组、氯霉素组;10~12为12 h时的空白组、S5组、氯霉素组。
3 结论
本研究通过发掘青枯病原菌的一株拮抗菌黑曲霉xj的次生代谢产物,发现其粗提物洗脱液S5对青枯病原菌Q11-2具有良好的抑菌作用,经GC-MS分析粗提物洗脱液S5得到49种化合物,其中明确结构的有29种,主要有油酸(26.52%)、亚油酸甲酯(14.46%)、油酸甲酯(11.10%)、棕榈酸(10.50%)等。研究结果显示,经过洗脱液S5作用后,对比空白组,菌液电导率增加,胞外核酸与蛋白的吸光度值增加,说明粗提物洗脱液S5对病原菌的细胞膜结构造成了影响,导致细胞内容物泄露。ROS具有很强的氧化活性,在胞内迅速积累会对细胞结构造成损伤,进而影响生物活性。S5在短时间内引起病原菌产生大量的ROS,推断其加快了细胞膜结构的损伤,进而使得细胞生长代谢被抑制甚至失去细胞活性。
[1]李林章,谢从华,柳俊.茄科雷尔氏菌(Ralstonia solanacearum)分子生物学基础及其致病机制[J].中国马铃薯,2005,2005(5):38-42.
[2]韦爱梅,王军.我国植物青枯病抗病性研究新进展[J].广东林业科技,2004(4):46-49.
[3]HUET G.Breeding for resistances to Ralstonia solancacearu[J].Front Plant Sci,2014,5:715.
[4]华丽霞,何炼,蒋秋平,等.不同产区花生青枯病菌遗传多样性的分析[J].基因组学与应用生物学,2018,37(3):1349-1355.
[5]LI S L,YU Y M,CHEN J N,et al.Evaluation of the antibacterial effects and mechanism of action of protocatechualdehyde against Ralstonia solanacearum[J].Molecules,2016,21(6):754.
[6]RAZA W,NING L,YANG L D,et al.Response of tomato wilt pathogen Ralstonia solanacearum to the volatile organic compounds produced by a biocontrol strain Bacillus amyloliquefaciens SQR-9[J].Sci Rep,2016,6:24856.
[7]JANISIEWICZ W J,KORSTEN L.Biological control of postharvest diseases of fruits[J].Annu Rev Phytopathol,2002,40(1):411-441.
[8]毛露甜,林晓霖,麦景,等.青枯病拮抗菌筛选及其生防菌剂研制[J].惠州学院学报,2019,39(6):53-57.
[9]汪汉成,王茂胜,黄艳飞,等.烟草青枯病拮抗菌株X-60 的分离鉴定及其表型组学分析[J].植物病理学报,2016,46(3):409-419.
[10]ROUKAS T.Citric and gluconic acid production from fig by Aspergillus niger,using solid-state fermentation[J].J Ind Microbiol Biot,2000,25(6):298-304.
[11]李大军,宋丹丹.曲霉多糖的提取及其抑菌活性研究[J].西南农业学报,2013,26(4):1479-1485.
[12]左祥,白现广,杨本寿,等.一株内生真菌黑曲霉的活性检测及鉴定[J].生物技术世界,2012,10(9):1-3.
[13]李祝,宋宝安,郁建平,等.根癌农杆菌拮抗真菌的筛选、鉴定及发酵条件研究[J].食品科学,2007(2):166-168.
[14]唐婧红,陈雪,代园凤,等.黑曲霉泡腾片对烟草青枯病防效及烟株生长的影响[J].中国酿造,2019,38(5):188-192.
[15]谢丽,孙瑞珠,马玉龙.应用电导率仪测定微生物生物量的研究[J].安徽农业科学,2011,39(31):19048-19050.
[16]洪学斌.樟树籽油甘油酯分离纯化及抑菌活性[D].南昌:南昌大学,2015.
[17]吴海霞.银杏种仁抑菌蛋白及其抑菌机制研究[D].南京:南京林业大学,2014.
[18]张希,杨明,宋飞,等.脂肪酸及其衍生物的抑菌活性[J].浙江大学学报(农业与生命科学版),2013,39(2):155-160.
[19]张璐.脂肪酸及其衍生物抑菌活性定量构效关系研究[D].杭州:浙江大学,2010.
[20]高林.氯霉素的不良反应及其残留检测方法研究进展[J].动物医学进展,2010,31(4):90-95.