酚类物质影响葡萄和葡萄酒的颜色和苦涩感,是评价葡萄和葡萄酒质量的重要指标,同时酚类物质具有抗氧化、抗菌、抗癌等特性,有利于人体健康[1-3]。葡萄酒中单体酚类物质可分为单体花色苷类与单体非花色苷类,单体非花色苷类主要包括酚酸、黄酮醇、黄烷醇以及芪类物质[4]。抗氧化剂主要是通过抑制氧化链反应的开始或者扩散来抑制其他分子的氧化,有利于缓解氧化性疾病(心血管疾病、癌症等)带来的伤害[5-6],葡萄酒中酚类化合物因其抗氧化特性而受到越来越多的关注[7-8]。葡萄及葡萄酒中含有大量的酚类物质,葡萄酒中酚类物质主要通过浸渍作用从葡萄中获取[9],葡萄果实中的酚类物质分布在葡萄种子和果皮中,其含量主要与葡萄品种、栽培条件、气候条件、整形方式等有关[10]。通过合理的整形方式来提高葡萄品质是一种简单易行的方式,有研究发现整形方式对葡萄品质的影响主要表现在两方面,一是叶幕形,二是果穗负载量,两者均可不同程度的改变酿酒葡萄果实生长的微环境,进而影响葡萄产量和果实品质[11]。
叶幕形是葡萄栽培管理的一项重要管理措施,合理的叶幕形有利于获得稳定的产量、提高果实品质、病虫害的防治[12]。不同的架式能形成不同的叶幕结构,从而调节叶幕冠层的光照分布,改变叶片的光合面积,调节树体营养生长与生殖生长的关系[13]。篱形架形成直立叶幕广泛应用于酿酒葡萄栽培管理中,Y形架形成V形叶幕,在鲜食葡萄的栽培中广泛被应用,有研究表明,将篱形架改造为Y形架栽培,使叶幕分开,可有效提高叶片光合效率,改变树体生长状况以及产量,有利于提高果实成熟度,减轻病虫害[14]。
对于酿酒葡萄,产量是决定葡萄成熟度的主要因素,要获得较高的可持续产量的同时并具有理想的成熟度,对葡萄植株产量的控制极为重要[15]。疏穗是管理葡萄产量的重要措施,通过对葡萄进行疏穗管理去除葡萄植株上一部分果穗,在不减少叶面积的同时限制植株产量,将植株所产生的能量集中在剩余果穗,使葡萄在较差的气候条件下也能达到生长所需成熟度[16],而葡萄果实的成熟程度不仅会影响成熟葡萄浆果中糖、酸、多酚以及香气物质含量[17],还会影响葡萄酒的颜色以及葡萄酒中化合物的成分,对于提高葡萄酒质量至关重要[18]。关于葡萄酒中酚类物质成分含量及其抗氧化性的研究越来越多[19],但在酿酒葡萄栽培过程中,关于葡萄果穗数量与叶幕形对葡萄酚类物质的组成及含量的研究相对较少。
晋中南地区是我国新兴的葡萄酒产区,赤霞珠是该地区的主栽品种,本试验通过叶幕形与果穗留量对赤霞珠干红葡萄酒中单体酚类物质的影响进行研究,并对成熟葡萄果实的单株产量、成熟度、酚类物质含量进行测量,对所酿葡萄酒的基本理化指标进行检测,分别采用高效液相色谱-质谱联用技术(high performance liquid chromatographymass spectrometry,HPLC-MS),对葡萄酒中单体酚类物质种类与含量进行检测,探讨叶幕形与果穗留量对干红葡萄酒质量的影响,以期通过合理整形修剪方式,提高晋中南地区赤霞珠葡萄酒的品质。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
试验所用葡萄植株为2012年定植的赤霞珠自根苗,南北行向,行间距为3 m,株距为1 m,单篱架,整形方式为厂字形,短枝修剪,葡萄园采用半机械化管理。田间试验于2018年进行。
1.1.2 试验地概况
试验地位于山西省临汾市襄汾县尧京酒庄(35.7~36.1°N,111.1~111.7°E),海拔500~600 m,平地,基本处平原地区。该地区属温带季风气候,暖热多雨,雨热同季。年均气温11.5 ℃,年降水量550 mm左右,无霜期185 d,气象数据均来自于中国气象数据网(http://data.cma.cn/)。
1.1.3 化学试剂
甲醇、甲酸、乙腈、4-甲基-2-戊醇、甲基纤维素、(+)-儿茶素、干没食子酸、二甲花翠素、原花色素B1、槲皮素等标品(均为色谱级):美国Sigma-Aldrich 公司;葡萄糖、氢氧化钠、甲氨基肉桂醛(4-(dimethylamino)cinnamaldehyde,DMACA)、浓盐酸、浓硫酸(均为分析纯):天津市博迪化工有限公司。
1.2 仪器与设备
LE438pH计:瑞士梅特勒-托利多公司;PAL-1数字手持折糖仪:日本爱拓公司;AUW220D电子天平:日本岛津公司;KQ-300DE型数控超声器:昆山市超声仪器公司;Aligent 1100、1200 系列高效液相色谱-质谱联用仪、Kromasil 100-5C18column色谱柱(250 mm×4.6 mm,5 μm):美国Agilent公司。
1.3 试验方法
1.3.1 试验设计
本试验于2018年春季分别对试验园原葡萄树形(篱形架直立形叶幕,厂字形,新梢留量约每米架面10个,单株果穗数为20(图1))的果穗留量与叶幕形加以改造。对果穗留量进行改造如下:新梢留量为每米架面10个,果穗留量设3个水平,即单株果穗数为10个(F1)、15个(F2),并以原单株果穗数20个为对照(CK),每处理分3小区,每个小区30株,随机区组排列。
对叶幕形进行改造情况如下:通过搭架将新梢向两边绑缚设置Y形架(图1),形成V形叶幕,开张角度为60°,叶幕倾斜长度为120 cm,叶幕厚度为30 cm,Y形架两横担距地面从下到上分别为110 cm和150 cm,对应横担上铁丝间距分别为50 cm和85 cm,并与原篱形架形成的直立叶幕进行对比,两种叶幕形下每延长1 m架面均留新梢10个,单株果穗数为20,其他栽培管理方式均一致。
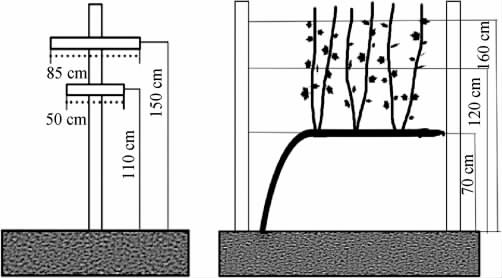
图1 Y形架与篱形架模式图
Fig.1 Pattern diagram of Y-shaped frame and vertical frame
1.3.2 果实采样与葡萄酒的酿造
各处理于9月24日采收,按照“S”形选取9株葡萄。每株葡萄分别在阴面与阳面的上、中、下部各选一穗,然后在每穗葡萄上边均匀选取5粒,共选取54穗,共计270粒葡萄,立即带回实验室,将其放置在-40 ℃条件下进行保存,储藏用于测量果实中可溶性固形物、可滴定酸、酚类物质含量及pH值。对每个小区30株树上的果穗全部进行采摘并称质量,计算单株平均产量。
1.3.3 小容器发酵
采用小容器(20 L玻璃罐),参考MULERO J等[20]改进的干红葡萄酒发酵工艺进行酿造。每个处理称取20 kg果穗,人工除梗破碎后入20 L的玻璃罐,立即加入60 mg/L的SO2搅匀,1 h后加20 mg/L果胶酶,温度控制在25 ℃,24 h后加入200 mg/L活化后的干酵母(酵母名称为LAFASE HE GRAND CRU)进行酒精发酵,使用干净的纱布盖住玻璃罐罐口,早晚各压帽一次,并测量其比重和温度,比重降至1.000时进行皮渣分离,继续发酵至比重降至0.992~0.996,并基本不变时加入60 mg/L的SO2终止发酵,并满罐密封15 d,之后装瓶并陈酿120 d。
1.3.4 葡萄和葡萄酒中基本理化指标的测定
葡萄中可溶性固形物、可滴定酸、pH值以及葡萄酒中残糖、酒度、挥发酸、总酸含量均参照王华[21]的方法。葡萄果实中总酚类物质的测定采用福林-肖卡法[22];总花色苷含量的测定采用pH示差法[23];总类黄酮含量的测定采用芦丁-甲醇显色法[24],采用p-DMACA-盐酸法测量总黄烷醇含量[25]。
1.3.5 单体酚类物质的测定
单体花色苷物质检测采用Agilent 1100 系列LC/MSD Trap-VL液相色谱-离子阱质谱联用仪,配有二极管阵列检测器(diode array detector,DAD)。流动相A:甲酸/乙腈/水=2/6/92(V/V/V),流动相B:甲酸/乙腈/水=2/54/44(V/V/V)。流动相B洗脱程序如下:1~18 min,10%~25%;18~20 min,25%;20~30 min,25%~40%;30~35 min,40%~70%;35~40min;70%~100%,流速为1.0mL/min;进样量为30μL,每个样品重复进2次。花色苷的定性研究根据中国农业大学葡萄酒中心建立的“葡萄与酒花色苷HPLC-UV-MS指纹谱库”进行[26]。花色苷定量以二甲花翠素-3-O-葡萄糖苷的含量计,其中以二甲花翠素-3-O-葡萄糖苷为外标物建立5~500 mg/L之间、9个梯度、3个重复的标准曲线,决定系数在0.999以上。
单体非花色苷酚类物质的检测采用Agilent 1200系列LC/MSD高效液相色谱-离子阱质谱联用仪,可变波长检测器,流动相A相为0.1%的乙酸水溶液,流动相B相为1%的乙酸乙腈溶液,进样量为2 μL,流速为1 mL/min,每个样品重复进2次[27]。非花色苷的定性与定量参考LIANG N N等[26]的方法进行,葡萄酒中非花色苷质量浓度单位用mg/L表示。
1.3.6 数据分析
数据分析采用Excel 2010以及SPSS Statistics 17.0软件进行分析,用Duncan法进行多重比较,P<0.05 表示差异达到显著水平,运用Origin 8.5进行作图。
2 结果与分析
2.1 叶幕形与果穗留量对葡萄单株产量及成熟度的影响
不同叶幕形和果穗留量对单株产量和成熟度的影响见表1。由表1可知,V形叶幕单株产量略低于直立形叶幕,但两者差异不显著(P>0.05),V形叶幕葡萄果实中可溶性固形物含量比直立形叶幕显著提高21.3%(P<0.05),可滴定酸含量比直立形叶幕显著降低10.9%(P<0.05),这可能是因为叶幕张开可增加葡萄叶片的光照面积,有利于葡萄果实中糖分的积累[28]。对于留穗量,随着单株果穗数量的减少,葡萄单株产量逐渐降低,但果实中可溶性固形物含量逐渐增加,这与前人研究一致[29]。果穗留量为10时,葡萄中可溶性固形物含量最高,但和果穗留量为15时无显著性区别(P>0.05),比果穗留量为20时显著高12.9%(P<0.05)。故适当的疏穗或利用V形叶幕栽培有利于提高葡萄的成熟度。
表1 不同叶幕形和果穗留量对单株产量和成熟度的影响
Table 1 Effect of different canopy shapes and cluster number per vine on the yield per plant and ripeness
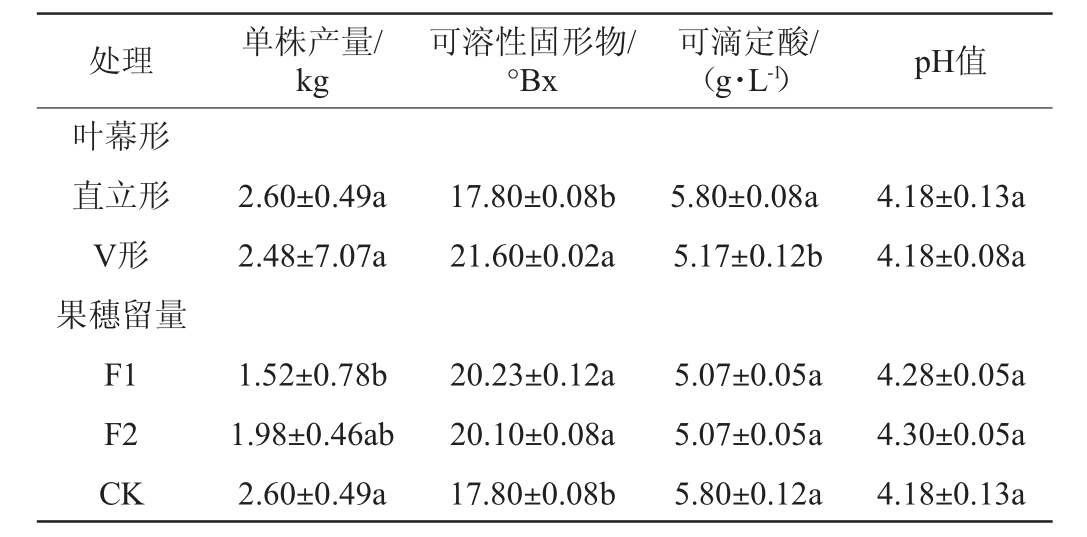
注:小写字母不同表示差异显著(P<0.05),下同。
2.2 叶幕形与果穗留量对葡萄果实酚类物质的影响
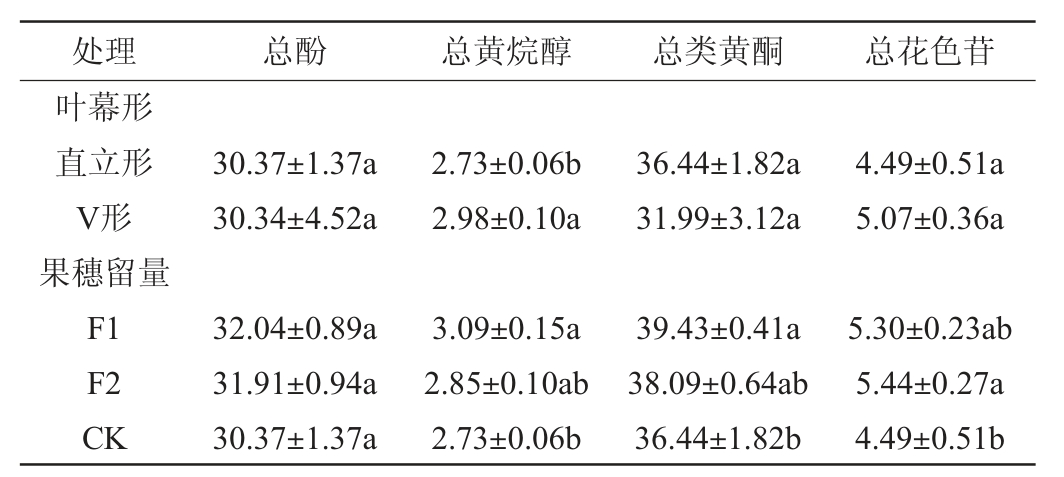
对不同处理果实中酚类物质进行检测,结果见表2。由表2可知,对于两种叶幕形,葡萄果实中总酚、总类黄酮和总花色苷含量没有显著差别(P>0.05),但V形叶幕果实中总黄烷醇物质含量比直立叶幕高9.7%,说明葡萄的叶幕张开,有利于葡萄果实中总黄烷醇物质的积累。果穗留量为10和15的成熟葡萄果实中总酚、总黄烷醇、总类黄酮和总花色苷含量均高于果穗留量为20的处理,故适当的减少葡萄植株的单株果穗数有助于提高葡萄果实中酚类物质含量,这可能是由于果穗数量的减少改善了树体的库源平衡,从而促进了风味物质的积累[30]。
表2 不同叶幕形和果穗留量对葡萄果实中酚类物质含量的影响
Table 2 Effect of different canopy shapes and cluster number per vine on phenolic contents in grape fruits mg/g
2.3 叶幕形与果穗留量对葡萄酒常规理化指标的影响
不同叶幕形与果穗留量对葡萄酒理化指标的影响见表3。由表3可知,各处理所酿葡萄酒中酒精度和残糖含量均符合国标要求。两种叶幕形下所酿造的葡萄酒中残糖、酒精度含量没有显著差别(P>0.05)。对于果穗量,果穗留量为10时葡萄酒中残糖含量比果穗留量为20和15时分别高2.1%、8.8%,但是差异并不显著(P>0.05),果穗留量为10时葡萄酒中总酸含量分别比果穗留量为15和20显著高12.6%和23.3%(P<0.05),表现为随着果穗数量的增加呈现降低趋势;果穗留量为20时酒精度分别比果穗留量为10和15显著降低5.7%和5.8%(P<0.05),这与其葡萄果实的成熟度有关,由于发酵作用可将葡萄汁中的糖转换为酒精,由于果穗留量为20时果实成熟度较低,故其酒精度较低。
表3 不同叶幕形与果穗留量对葡萄酒理化指标的影响
Table 3 Effect of different canopy shapes and cluster number per vine on physicochemical indexes of wine

2.4 叶幕形与果穗留量对葡萄酒单体酚类物质的影响
2.4.1 叶幕形和果穗留量对葡萄酒中花色苷单体酚类物质的影响
不同处理葡萄酒中单体花色苷含量以及种类比例如表4。由表4可知,两种叶幕均检测出7种花色苷单体,包括3种非酰化花色苷和4种酰化花色苷,其中二甲花翠素-3-O-葡萄糖苷及其乙酰化合物所占比重较大,V形叶幕下葡萄酒中酰化花色苷和非酰化花色苷均显著高于直立形叶幕(P<0.05),其中酰化花色苷含量(33.46 mg/L)是直立叶幕的2.8倍。V形叶幕下葡萄酒中二甲花翠素-3-O-葡萄糖苷和二甲花翠素-3-O-(6-O-乙酰)-葡萄糖苷均显著高于直立形叶幕(P<0.05),其中二甲花翠素-3-O-葡萄糖苷(72.54 mg/L)是直立叶幕(38.61 mg/L)的1.9倍。酰化花色苷有助于增加葡萄酒颜色的稳定性,甲基化含量有助于提高葡萄酒中红色色调[31],故采用V形叶幕栽培所酿造葡萄酒颜色较深且稳定性较好。
对于不同的果穗量,各处理均检测出7种花色苷单糖苷,酰化花色苷占花色苷总量的20%~30%,其中甲基花翠素-3-O-(6-O-乙酰)-葡萄糖苷在果穗留量为20的处理中含量极低。葡萄酒中单体花色苷总量表现为果穗留量为15(103.32 mg/L)>果穗数量为10(99.85 mg/L)>果穗数量为20(50.73 mg/L),当果穗数量为15时,酰化单体花色苷含量(29.52 mg/L)是果穗留量为20(11.95 mg/L)的2.50倍,但与果穗留量为10时差异不显著(29.38 mg/L)(P>0.05)。果穗留量为15的处理二甲花翠素-3-O-葡萄糖苷含量(72.01 mg/L)是果穗留量为20(38.61 mg/L)的1.90倍,比果穗留量为10时(68.76 mg/L)高4.73%,但差异不显著(P>0.05)。果穗留量为10时二甲花翠素-3-O-(6-O-乙酰)-葡萄糖苷含量(25.29 mg/L)分别是果穗留量为20(10.15 mg/L)的1.50倍,比果穗留量为15时(10.15 mg/L)显著提高8.9%(P<0.05)。这可能与疏穗增加了果穗的受光面积,提高了葡萄成熟度,从而有利于单体酚类物质的合成以及花色苷的积累有关[32]。葡萄酒中在葡萄酒酿造过程中,若葡萄具有较高的成熟度,会增大葡萄细胞壁的降解,使葡萄果皮中花色苷更容易被提取到葡萄酒中[33],果穗留量为20的处理,葡萄果实成熟度低于果穗留量为10和15的处理,不利于果皮中花色苷的提取。综上所述,减少果穗留量或采用V形叶幕栽培均有利于葡萄酒中单体花色苷含量的提高,提高葡萄酒颜色的稳定性。
表4 不同叶幕形和果穗留量对葡萄酒中单体花色苷物质的影响
Table 4 Effect of different canopy shapes and cluster number per vine on anthocyanins in wine

注:“tr”表示痕量。
2.4.2 叶幕形和果穗留量对葡萄酒中非花色苷单体酚类物质的影响
叶幕形和果穗留量对葡萄酒中单体非花色苷物质的影响见表5。由表5可知,不同处理均检测出10种非花色苷单体物质,主要包括3种黄烷醇类物质、3种酚酸类物质以及4种黄酮醇类物质,三类物质在葡萄酒中所占总量比例基本一致,其中黄烷醇类物质占非花色苷单体总量的10%左右,酚酸类物质占非花色苷单体总量的15%左右,黄酮醇类物质占非花色苷单体总量的75%左右。对于不同的叶幕形,V形叶幕非花色苷单体总含量(286.25 mg/L)是直立叶幕(194.19 mg/L)的2.18倍,黄烷醇类总量和黄酮醇类总量均表现为V形叶幕显著高于直立形叶幕(P<0.05),这与V形叶幕分开,减少了果实和内部叶片的遮蔽,从而有利于果实着色以及果实糖含量的积累有关[34]。此外,葡萄果实曝光面积的增加会增加黄酮醇与花色苷共同色素沉着现象,从而提高葡萄或葡萄酒中黄酮醇类物质含量[35]。
表5 叶幕形和果穗留量对葡萄酒中单体非花色苷物质的影响
Table 5 Effect of different canopy shapes and cluster number per vine on non-anthocyanins in wine
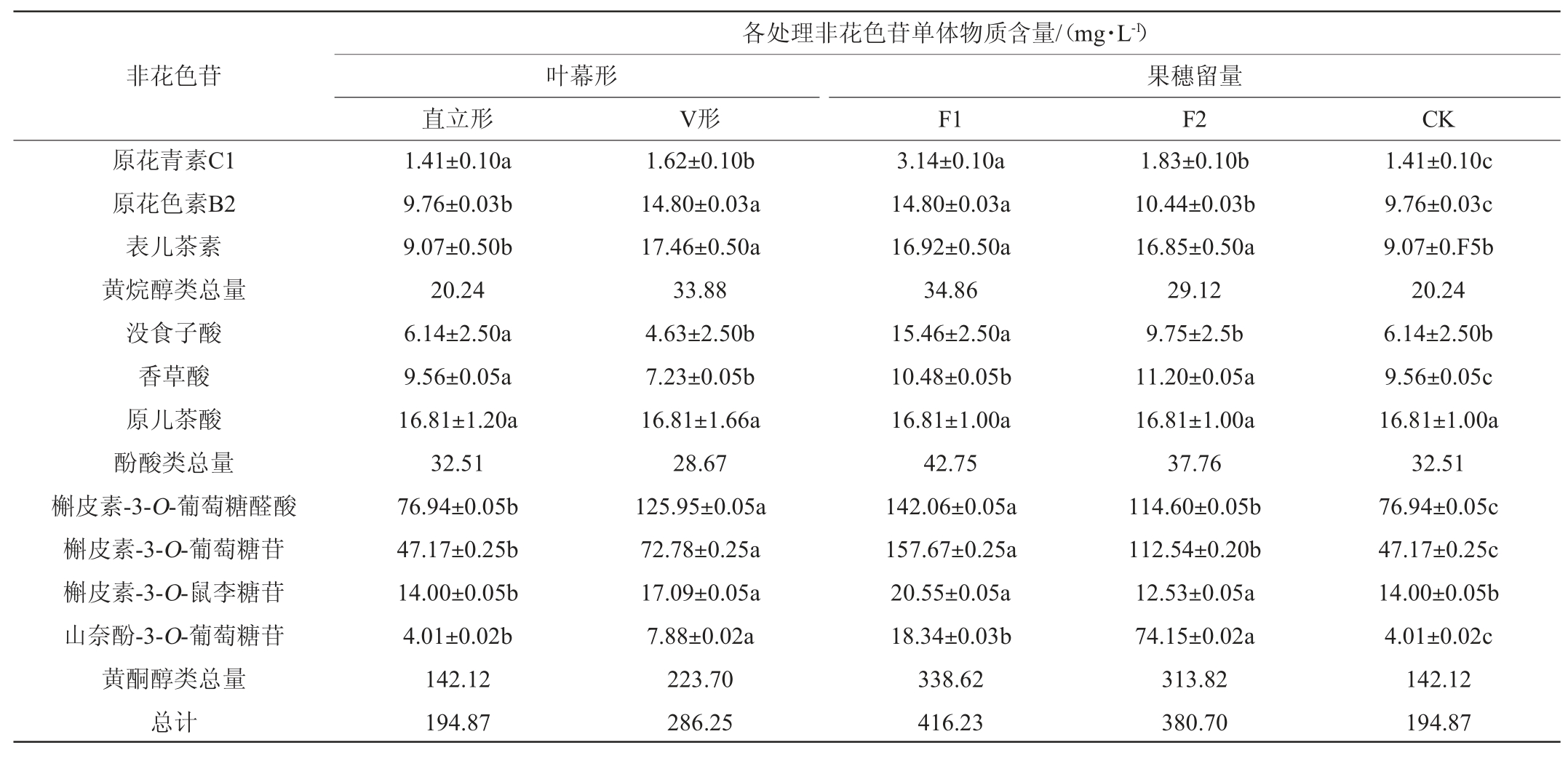
对于单株果穗数,非花色苷单体总含量随着果穗数量的增加逐渐降低,其中果穗数量为10(416.23 mg/L)和15的处理(380.70 mg/L)非花色苷总量分别是新梢留量为20(194.87mg/L)的2.10倍和1.90倍。果穗留量为10(338.44mg/L)和15(313.82 mg/L)时葡萄酒中黄酮醇类物质总量分别是果穗留量为20(142.00 mg/L)的2.38和2.21倍,果穗量为10和15时葡萄酒中黄烷醇类物质总量分别比果穗量为20时显著高72.4%和44.4%(P<0.05),故适度的减少果穗数有利于黄酮醇和黄烷醇类物质的积累。
3 结论
本试验以赤霞珠为试材,进行小容器发酵实验,主要研究叶幕形与果穗留量对葡萄酒中单体酚类物质的影响,结果表明,在V形叶幕下,葡萄果实的成熟度较好,葡萄酒中花色苷单体酚类物质与非花色苷单体酚类物质均显著高于直立形叶幕(P<0.05),其中酰化花色苷含量是直立形叶幕的2.80倍,葡萄酒呈色较好。对于篱形架栽培的葡萄,适当的减少果穗有利于提高葡萄果实的成熟度和葡萄酒中单体酚类物质含量,其中当单株果穗数为15时,葡萄酒中单体花色苷含量最高。综上所述,在山西晋中南地区,对于酿酒品种赤霞珠而言,适度的降低单株果穗留量或者改造为V形叶幕栽培,有利于提高葡萄酒中单体酚类物质含量。
[1]LANDRAULT N,POUCHERET P,RAVEL P,et al.Antioxidant capacities and phenolics levels of French wines from different varieties and vintages[J].J Agr Food Chem,2001,49(7):3341-3348.
[2]FRANKEL E,GERMAN J,KINSELLA J,et al.Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine[J].Lancet,1993,341(8843):454-457.
[3]FRANKEL E.Activity of wine and grape phenolic antioxidants in human LDL[J].Biofactors,2010,6(4):433-435.
[4]ZHAO Q,DUAN C Q,WANG J.Components of non-anthocyanin phenolic compounds in wines of Vitis amurensis and its hybrids[J].Afr J Biotechnol,2011,10(66):14767-14777.
[5]HERTOG M G,HOLLMAN P C,VAN DE PUTTE B.Content of potentially anticarcinogenic flavonoids of tea infusions,wines,and fruit juices[J].J Agr Food Chem,1993,41(8):1242-1246.
[6]WILLETT W C,SACKS F,TRICHOPOULOU A,et al.Mediterranean diet pyramid:a cultural model for healthy eating[J].Am J Clin Nutr,1995,61(6):1402-1406.
[7]HERTOG M G,FESKENS E J,KROMHOUT D,et al.Dietary antioxidant flavonoids and risk of coronary heart disease:the Zutphen Elderly Study[J].Lancet,1993,342(8878):1007-1011.
[8]ARUOMA O I,MURCIA A,BUTLER J,et al.Evaluation of the antioxidant and prooxidant actions of gallic acid and its derivatives[J].J Agr Food Chem,1993,41(11):1880-1885.
[9]DÜRING H,DAVTYAN A.Developmental changes of primary processes of photosynthesis in sun-and shade-adapted berries of two grapevine cultivars[J].Vitis,2002,41(2):63-68.
[10]HASELGROVE L,BOTTING D,VAN HEESWIJCK R,et al.Canopy microclimate and berry composition:The effect of bunch exposure on the phenolic composition of Vitis vinifera L cv.Shiraz grape berries[J].Aust J Grape Wine Res,2000,6(2):141-149.
[11]王建新,牛自勉.叶幕结构与光合作用的关系研究[J].中国农学通报,2008,24(11):302-306.
[12]许泽华,牛锐敏,沈甜,等.不同架型对玉泉营“美乐”葡萄营养生长及品质的影响[J].北方园艺,2018,(24):27-34.
[13]项殿芳,朱京涛,吴学仁,等.不同叶幕结构对赤霞珠葡萄生长发育的影响[J].河北科技师范学院学报,2004,18(2):45-50.
[14]周咏梅,韩佳宇,张劲,等.不同架式对桂葡6 号葡萄树体生长及果实品质的影响[J].中国南方果树,2018,47(1):101-103.
[15]HOWELL G S.Sustainable grape productivity and the growth-yield relationship:A review[J].Am J Enol and Viticult,2001,52(3):165-174.
[16]DAMI I,FERREE D,PRAJITNA A,et al.A five-year study on the effect of cluster thinning on yield and fruit composition of 'Chambourcin'grapevines[J].Hort Sci,2006,41(3):586-588.
[17]VALDÉS M E,MORENO D,GAMERO E,et al.Effects of cluster thinning and irrigation amount on water relations,growth,yield and fruit and wine composition of Tempranillo grapes in Extemadura(Spain)[J].OENO One,2009,43(2):67-76.
[18]OUGH C,NAGAOKA R.Effect of cluster thinning and vineyard yields on grape and wine composition and wine quality of Cabernet Sauvignon[J].Am J Enol and Viticult,1984,35(1):30-34.
[19]GONZÁLEZ-NEVES G,CHARAMELO D,BALADO J,et al.Phenolic potential of Tannat,Cabernet-Sauvignon and Merlot grapes and their correspondence with wine composition[J].Anal Chim Acta,2004,513(1):191-196.
[20]MULERO J,MARTÍNEZ G,OLIVA J,et al.Phenolic compounds and antioxidant activity of red wine made from grapes treated with different fungicides[J].Food Chem,2015,180:25-31.
[21]王华.葡萄与葡萄酒实验技术操作规范[M].西安:西安地图出版社,1999:122-132
[22]JAYAPRAKASHA G K,SINGH R P,SAKARIAH K K.Antioxidant activity of grape seed(Vitis vinifera)extracts on peroxidation models in vitro[J].Food Chem,2001,73(3):285-290.
[23]ORAK H H.Total antioxidant activities,phenolics,anthocyanins,polyphenol oxidase activities of selected red grape cultivars and their correlations[J].Sci Horticulturae,2007,111(3):235-241.
[24]PEINADO J,LOPEZ DE LERMA N,MORENO J,et al.Antioxidant activity of different phenolics fractions isolated in must from Pedro Ximenez grapes at different stages of the off-vine drying process[J].Food Chem,2009,114(3):1050-1055.
[25]LI Y G,TANNER G,LARKIN P.The DMACA-HCl protocol and the threshold proanthocyanidin content for bloat safety in forage legumes[J].J Sci Food Agr,1996,70(1):89-101.
[26]LIANG N N,PAN Q H,HE F,et al.Phenolic profiles of Vitis davidii and Vitis quinquangularis species native to China[J].J Agr Food Chem,2013,61(25):6016-6027.
[27]JIN Z M,BI H Q,LIANG N N,et al.An extraction method for obtaining the maximum non-anthocyanin phenolics from grape berry skins[J].Anal Lett,2010,43(5):776-785.
[28]史祥宾,刘凤之,程存刚,等.不同叶幕形对设施葡萄叶幕微环境、叶片质量及果实品质的影响[J].应用生态学报,2015,26(12):3730-3736.
[29]KELLER M,MILLS L J,WAMPLE R L,et al.Cluster thinning effects on three deficit-irrigated Vitis vinifera cultivars[J].Am J Enol Viticult,2005,56(2):91-103.
[30]GUIDONI S,ALLARA P,SCHUBERT A.Effect of cluster thinning on berry skin anthocyanin composition of Vitis vinifera cv.Nebbiolo[J].Am J Enol Viticult,2002,53(3):224-226.
[31]GAMERO E,MORENO D,TALAVERANO I,et al.Effects of irrigation and cluster thinning on Tempranillo grape and wine composition[J].South Afr J Enol Viticult,2014,35(2):196-204.
[32]SOMERS T C.Pigment profiles of grapes and of wines[J].Vitis,1968,7:303-320.
[33]DE GAULEJAC N S C,GLORIES Y,VIVAS N.Free radical scavenging effect of anthocyanins in red wines[J].Food Res Int,1999,32(5):327-333.
[34]MACAULAY L,MORRIS J.Influence of cluster exposure and winemaking processes on monoterpenes and wine olfactory evaluation of Golden Muscat[J].Am J Enol Viticult,1993,44(2):198-204.
[35]PRICE S,BREEN P,VALLADAO M,et al.Cluster sun exposure and quercetin in Pinot Noir grapes and wine[J].Am J Enol Viticult,1995,46(2):187-194.