膳食纤维被称作人体“第七大营养素”,可以有效缓解和治疗因脂肪、糖类摄入过量而膳食纤维摄入过少所导致的肥胖病、心血管病、糖尿病等“文明病”、“富贵病”,是维持人类健康不可缺少的物质[1-2]。膳食纤维作为一种人体必需的功能性营养成分,可以降低血糖、调节血脂,改善人体肠道菌群组成、促进肠道蠕动等功效[3-5]。根据膳食纤维溶解度的不同,可以分为水溶性膳食纤维和水不溶性膳食纤维两大类[6]。抗性糊精是淀粉深加工的重要产物之一,是一种低分子水溶性膳食纤维[7-8]。由于抗性糊精甜度低、溶解性高、无异味、黏度低等特性,在乳制品、面制品、肉制品、婴儿食品、保健品、饮料业中都有广泛的应用前景[9-14]。抗性糊精现已应用于清凉饮料、果汁饮料、调味料、果子酱等的生产[15-16]。
BARCZYNSKA R等[17]以马铃薯淀粉为原料分析柠檬酸催化剂对抗性糊精含量、纯度等的影响,并对其进行发酵,在发酵过程中对其进行色谱分析;JOCHYM K等[18]用高温热解马铃薯淀粉不同时间制备抗性糊精,然后对其红外结构、水溶性、链长分布、分子质量分布等进行研究。而我国在20世纪90年代才开始研究抗性糊精,徐佩琳[19]以玉米淀粉为原料经高温酸解和α-淀粉酶及糖化酶的酶解制备抗性糊精。刘宗利等[20]将干淀粉经过两次的糊精化,并与酶解反应相结合,通过控制反应条件,显著提高了抗性糊精的纯度,膳食纤维含量达到了90%以上。马梦垚等[21]利用一种特殊装置制备抗性糊精,制得的产品颜色浅,含量达到了80%以上。
本研究以食用玉米淀粉为原料,主要针对酶法制抗性糊精时的酶解工艺进行研究,在单因素试验的基础上,利用响应面设计优化酶解工艺,为抗性糊精的综合开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
食用玉米淀粉:滨州金汇玉米开发有限公司;耐高温α-淀粉酶(8 000 U/g)、转苷酶(6 000 U/g):诺维信(中国)生物技术有限公司。
1.2 仪器与设备
NBD-9023AW型鼓风干燥箱:诺巴迪材料科技有限公司;UB-7型pH计:丹佛仪器(北京)有限公司;HH-6型数显恒温水浴锅:国华电器有限公司。
1.3 实验方法
1.3.1 焦糊精的制备及抗性糊精产率计算
将玉米淀粉置于烘箱中,110 ℃烘干至水分含量5%以下,酸化,每10 g淀粉加入5 mL 1%的盐酸,混匀后酸浸1 h,抽滤,置于恒温干燥箱中,110 ℃烘干至恒质量,170 ℃酸解90 min,即得到焦糊精样品。
取10 g左右焦糊精样品(精确至0.01 g),加入3倍体积水,振荡摇匀,酶解(先用α-淀粉酶断开淀粉分子中的α-1,4糖苷键,将淀粉降解成小分子链,然后再用转苷酶将这些小分子以α-1,6糖苷键连接到直链淀粉上)。加入4倍体积乙醇,振荡摇匀,静置,将沉淀物置于烘箱中,105 ℃烘干。抗性糊精产率计算公式如下:
1.3.2 酶解工艺优化单因素试验(1)α-淀粉酶作用温度
设置α-淀粉酶作用温度93 ℃、94 ℃、95 ℃、96 ℃、97 ℃,α-淀粉酶添加量0.5%,α-淀粉酶作用时间2.0 h,转苷酶作用温度55 ℃,转苷酶添加量0.3%,转苷酶作用时间16 h,酶解,考察酶作用温度对抗性糊精产率的影响。
(2)α-淀粉酶添加量
设置α-淀粉酶添加量0.3%、0.4%、0.5%、0.6%、0.7%,α-淀粉酶作用温度94 ℃,α-淀粉酶作用时间2.0 h,转苷酶作用温度55 ℃,转苷酶添加量0.3%,转苷酶作用时间16 h,酶解,考察α-淀粉酶添加量对抗性糊精产率的影响。
(3)α-淀粉酶作用时间
设置α-淀粉酶作用时间1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,α-淀粉酶作用温度94 ℃,α-淀粉酶添加量0.4%,转苷酶作用温度55 ℃,转苷酶添加量0.3%,转苷酶作用时间16 h,酶解,考察α-淀粉酶作用时间对抗性糊精产率的影响。
(4)转苷酶作用温度
设置转苷酶作用温度53 ℃、54 ℃、55 ℃、56 ℃、57 ℃,α-淀粉酶作用温度94 ℃,α-淀粉酶添加量0.4%,α-淀粉酶作用时间2.0 h,转苷酶添加量为0.3%,转苷酶作用时间为16 h,酶解,计算抗性糊精产率的影响。
(5)转苷酶添加量
设置转苷酶添加量为0.1%、0.2%、0.3%、0.4%、0.5%,α-淀粉酶作用温度94 ℃,α-淀粉酶添加量0.4%,α-淀粉酶作用时间2.0 h,转苷酶作用温度56 ℃,转苷酶作用时间16 h,酶解,考察转苷酶添加量对抗性糊精产率的影响。
(6)转苷酶作用时间
设置转苷酶作用时间12 h、14 h、16 h、18 h、20 h,α-淀粉酶作用温度94 ℃,α-淀粉酶添加量0.4%,α-淀粉酶作用时间2.0 h,转苷酶作用温度56 ℃,转苷酶添加量0.3%,酶解,考察转苷酶作用时间对抗性糊精产率的影响。
1.3.3 Box-Behnken中心组合试验设计
在单因素试验的基础上,以α-淀粉酶作用温度(A)、α-淀粉酶添加量(B)、转苷酶作用温度(C)、转苷酶添加量(D)进行响应面Box-Behnken试验设计,以抗性糊精产率(Y)为响应值,进行酶解工艺的优化。Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments

2 结果与分析
2.1 酶解工艺优化单因素试验
2.1.1 α-淀粉酶作用温度对抗性糊精产率的影响
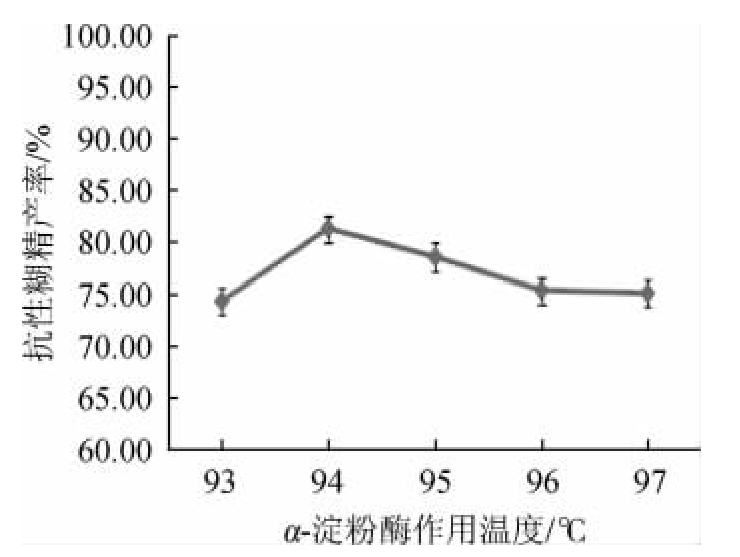
图1 α-淀粉酶作用温度对抗性糊精产率的影响
Fig.1 Effect of reaction temperature of α-amylase on resistant dextrin yield
由图1可知,随着α-淀粉酶的作用温度在93~94 ℃范围提高,抗性糊精产率呈上升趋势;当α-淀粉酶作用温度为94℃时,所得抗性糊精产率最高,达到81.33%;在α-淀粉酶作用温度>94℃之后,抗性糊精产率逐渐降低。可能是由于温度过高,影响了α-淀粉酶活性,导致抗性糊精产率下降。因此,选择最适α-淀粉酶作用温度为94 ℃。
2.1.2 α-淀粉酶添加量对抗性糊精产率的影响
由图2可知,在加入α-淀粉酶含量为0.3%~0.4%时,随着α-淀粉酶添加量增加,抗性糊精产率加大;当α-淀粉酶添加量为0.4%时,抗性糊精产率达到最大值,为80.10%;α-淀粉酶添加量>0.4%之后,抗性糊精产率稍有下降。综合考虑,选择最佳α-淀粉酶添加量为0.4%。
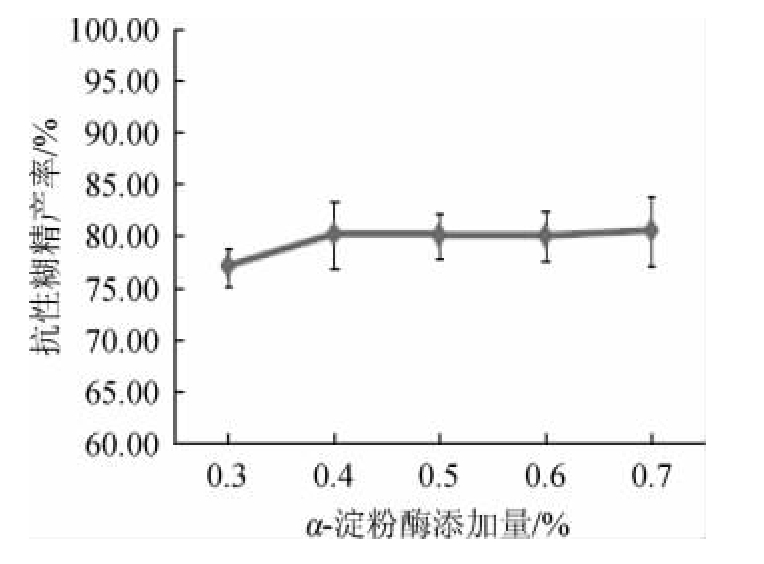
图2 α-淀粉酶添加量对抗性糊精产率的影响
Fig.2 Effect of α-amylase addition on resistant dextrin yield
2.1.3 α-淀粉酶作用时间对抗性糊精产率的影响
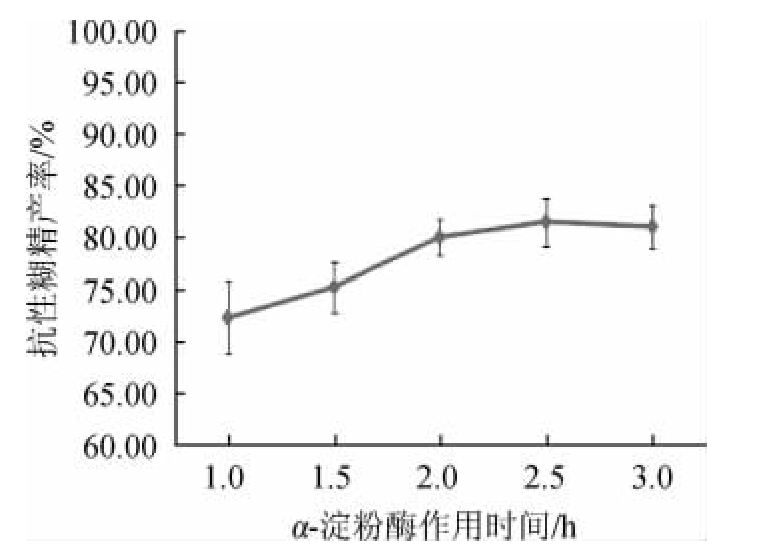
图3 α-淀粉酶作用时间对抗性糊精产率的影响
Fig.3 Effect of reaction time of α-amylase on resistant dextrin yield
由图3可知,α-淀粉酶作用时间在1.0~2.5 h时,随着酶解时间的延长,抗性糊精产率也逐渐上升;当酶解时间为2.5 h,抗性糊精产率达到最大值,为81.43%;当酶解时间>2.5 h之后,随着α-淀粉酶作用时间的延长,抗性糊精产率稍有下降。因此,选择最适α-淀粉酶作用时间为2.5 h。
2.1.4 转苷酶作用温度对抗性糊精产率的影响
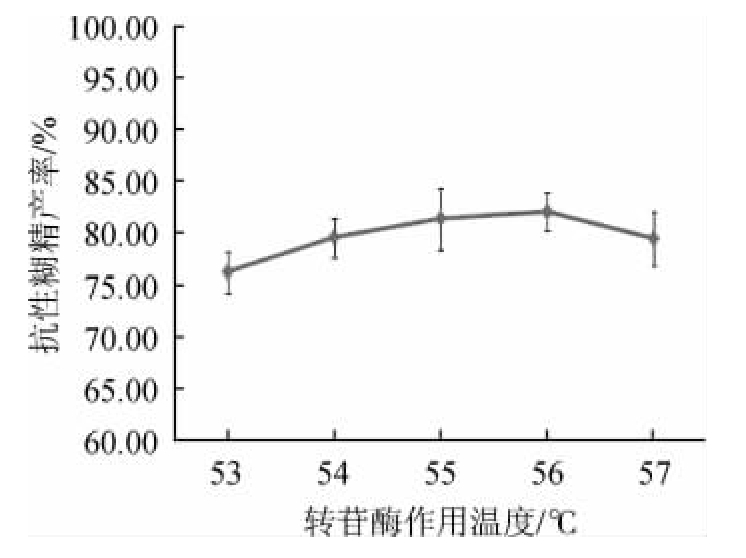
图4 转苷酶作用温度对抗性糊精产率的影响
Fig.4 Effect of reaction temperature of trans-glycosidase on resistant dextrin yield
由图4可知,随着转苷酶作用温度在53~56 ℃范围内的上升,抗性糊精产率不断增加;当转苷酶作用温度为56 ℃时,抗性糊精产率达到最大值,为81.91%;当转苷酶作用温度>56 ℃之后,抗性糊精含量减少,可能是由于作用温度的升高,超过了最佳酶解温度,导致酶活性减弱,抗性糊精产率下降。因此,选择最适转苷酶作用温度为56 ℃。
2.1.5 转苷酶添加量对抗性糊精产率的影响

图5 转苷酶添加量对抗性糊精产率的影响
Fig.5 Effect of trans-glycosidase addition on resistant dextrin yield
由图5可知,随着转苷酶添加量在0.1%~0.3%范围内增加,抗性糊精产率随之逐渐增大,当转苷酶添加量达到0.3%时,抗性糊精产率达到最大值,为81.20%;当转苷酶添加量>0.3%之后,抗性糊精的产率不再有明显增加,因此,选择最适转苷酶添加量为0.3%。
2.1.6 转苷酶作用时间对抗性糊精产率的影响

图6 转苷酶作用时间对抗性糊精产率的影响
Fig.6 Effect of reaction time of trans-glycosidase on resistant dextrin yield
由图6可知,随着转苷酶作用时间在12~18 h范围内延长,抗性糊精的产率随之增加;当转苷酶作用时间为18 h时,抗性糊精产率达到最大值,为82.92%;当转苷酶作用时间>18 h之后,抗性糊精含量稍有下降,因此,选择最适转苷酶作用时间为18 h。
2.2 酶解工艺优化响应面试验[22-23]
根据单因素试验结果,以抗性糊精产率(Y)为响应值,选取α-淀粉酶作用温度(A)、α-淀粉酶添加量(B)、转苷酶作用温度(C)、转苷酶添加量(D)进行4因素3水平的Box-Behnken试验优化设计。试验设计与结果见表2,方差分析见表3。
表2 Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments

利用软件Design-Expert 8.0.6对数据结果进行回归分析,对数据进行多元回归拟合,获得关于α-淀粉酶作用温度、α-淀粉酶添加量、转苷酶作用温度、转苷酶添加量的二次回归方程:Y=83.75+0.46A-0.27B-0.18C+0.13D+0.25AB-0.34AC+0.43AD-0.082BC-1.12BD-0.49CD-6.00A2-1.49B2-2.77C2-1.84D2
由表3可知,该回归模型的P<0.000 1,表明该方程模型达到极显著(P<0.01),证明实验方法可行;失拟项P>0.05,表明不显著;该模型决定系数R2=0.995 5,调整决定系数R2Adj=0.991 0,表明拟合程度良好,实验误差较小。因此该回归模型成立,可以利用此模型对抗性糊精的酶解工艺进行分析及预测。影响抗性糊精产率的因素顺序为α-淀粉酶作用温度>α-淀粉酶添加量>转苷酶作用温度>转苷酶添加量,其中α-淀粉酶作用温度和α-淀粉酶添加量对结果的影响极显著(P<0.01),α-淀粉酶作用温度和转苷酶作用温度的交互作用、α-淀粉酶作用温度和转苷酶添加量的交互作用对结果的影响显著(P<0.05),α-淀粉酶添加量和转苷酶添加量的交互作用、转苷酶作用温度和转苷酶添加量的交互作用对结果的影响极显著(P<0.01)。
表3 回归模型方差分析
Table 3 Variance analysis of the regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01),下同。
根据回归方程得到α-淀粉酶作用温度、α-淀粉酶添加量、转苷酶作用温度和转苷酶添加量之间的交互作用对抗性糊精产率影响的响应面及等高线见图7。由图7可知,各交互因素的最佳作用点基本都落在试验范围内,经过软件Design-Expert 8.0.6优化,得到抗性糊精产率最大值时的最佳工艺条件为:α-淀粉酶作用温度94.04 ℃,α-淀粉酶添加量0.39%,转苷酶作用温度55.96 ℃,转苷酶添加量0.31%,该工艺下抗性糊精产率理论值为83.78%。
2.3 验证试验
考虑实际需要对上述工艺条件进行调整,即α-淀粉酶作用温度94℃,α-淀粉酶添加量0.4%,转苷酶作用温度56 ℃,转苷酶添加量0.3%。进行3次验证试验,得到抗性糊精产率实际值为82.56%,与预测值相对误差为1.46%,结果表明,经过响应回归方程拟合出的理论值与实际值偏差较小,表明得到的该模型有一定的实践指导意义。

图7 各因素交互作用对抗性糊精产率影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction of various factors on resistant dextrin yield
3 结论
采用单因素及响应面试验,建立了抗性糊精产率的二次多项拟合方程及三维响应面图,确定影响抗性糊精产率的因素顺序为α-淀粉酶作用温度>α-淀粉酶添加量>转苷酶作用温度>转苷酶添加量。由该模型得到优化的酶解工艺条件为α-淀粉酶作用温度94 ℃,α-淀粉酶添加量0.4%,转苷酶作用温度56 ℃,转苷酶添加量0.3%。进行3次验证试验,得到抗性糊精产率为82.56%。
[1]叶秋萍,曾新萍,郑晓倩.膳食纤维的制备技术及理化性能的研究进展[J].食品研究与开发,2019,49(17):212-217.
[2]朱静,蒋金鑫.膳食纤维生理功能的研究进展[J].粮食流通技术,2016,9(18):4-6.
[3]何书励,马方,刘鹏举,等.多种膳食纤维对2 型糖尿病患者胰岛素抵抗的影响[J].中国医刊,2019,54(4):435-438.
[4]张松,苏永平,李涛,等.膳食纤维的功能特性及其在食品领域的研究进展[J].食品研究与开发,2018,39(17):214-218.
[5]SCHMIELE M,NUCCI MASCARENHAS M C C,CARLA D S B A,et al.Dietary fiber as fat substitute in emulsified and cooked meat model system[J].LWT-Food Sci Technol,2015,61(1):105-111.
[6]徐洪宇,刘欢,张亚旗,等.响应面法优化金针菇中水溶性膳食纤维的提取工艺[J].中国酿造,2017,36(6):137-141.
[7]曲鹏宇,李丹,李志江,等.膳食纤维功能、提取工艺及应用研究进展[J].食品研究与开发,2018,39(19):219-224.
[8]黄政,孙江文,徐勇,等.抗性糊精的研究与应用进展[J].海南师范大学学报,2018,31(4):418-427.
[9]朱洁.抗性糊精的工艺及特性研究[D].天津:天津科技大学,2010.
[10]苏会波,林海龙.难消化糊精的研究进展[J].食品与生物技术学报,2014,33(1):1-7.
[11]LEFRANC-MILLOT C,GUÉRIN-DEREMAUX L,WILS D,et al.Impactof a resistant dextrin on intestinal ecology:how altering the digestive ecosystem with NUTRIOSE,a soluble fibre with prebiotic properties,may be beneficial for health[J].J Int Med Res,2012,40(1):211-214.
[12]陈晓霞,陆利霞,林丽军,等.抗性糊精对凝固型酸奶品质的影响[J].食品与发酵工业,2016,42(9):91-97.
[13]JUNICHI M,YUTA T,MICHIKO Y,et al.Effects of resistant dextrin for weight loss in overweight adults:a systematic review with a meta-analysis of randomized controlled trials[J].J Pharmaceut Health Care Sci,2017,3(15):1-7.
[14]徐仰丽,刘亚伟,任伟豪,等.抗性糊精的研究进展[J].河南工业大学学报,2008,29(4):67-71.
[15]马梦垚,徐勇.抗性糊精低糖饮料的复配优化[J].农产品加工,2018(4):16-18.
[16]徐佩琳,罗水忠,潘丽华,等.山药抗性糊精的微波预处理-酶解制备及其性质研究[J].农产品加工,2018(9):1-5.
[17]BARCZYNSKA R,JOCHYM K,SLIZEWSKA K,et al.The effect of citric acid-modified enzyme-resistant dextrin on growth and metabolism of selected strains of probiotic and other intestinal bacteria[J].J Funct Food,2010,2(2):126-133.
[18]JOCHYM K,KAPUSNIAK J,BARCZYNSKA R,et al.New starch preparations resistant to enzymatic digestion[J].J Sci Food Agr,2012,92(4):886-891.
[19]徐佩琳.酸热法和微波预处理-酶法制备山药抗性糊精及其特性研究[D].合肥:合肥工业大学,2017.
[20]刘宗利,刘峰,李克文,等.一种抗性糊精的制备方法:中国,CN201611065295.6[P].2017-05-31.
[21]马梦垚,徐勇,侯乐贵,等.一种抗性糊精的制备方法:中国,CN201711313446.X[P].2018-05-08.
[22]高晨哲,姜帆,王艳菲,等.响应面法优化红薯美酒发酵工艺[J].中国酿造,2016,35(12):108-112.
[23]姚萌萌,刘姗,康嘉伟,等.响应面法优化红枣起泡酒二次发酵工艺[J].中国酿造,2019,38(9):112-116.