猕猴桃(Actinidia chinensis Planch)属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)的植物果实,含有大量的糖、多酚、有机酸、酯类、多种维生素及人类所需的氨基酸等物质,被称为“水果之王”[1]。近年,猕猴桃栽培面积飞速增长,猕猴桃精深加工越发重要,因其果肉多汁,营养丰富,加工成果酒产品成为一大方向,但目前产品还存在采用葡萄酒商业酵母酿造、猕猴桃果酒典型性不强、果香不突出、风味偏单薄、酸度过高等问题[2],制约了猕猴桃果酒产业的发展。
筛选培育优良的发酵菌种是酿制优质猕猴桃酒的首要保证。目前猕猴桃果酒专用酵母的筛选通常是从掩埋猕猴桃后的土壤、猕猴桃果表皮或猕猴桃带皮果实进行无菌采样,用纯净水、麦芽汁、猕猴桃汁或无机盐加富[3-8]等液体培养,采用WL营养琼脂培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基分离,结合菌落形态、镜检、杜氏小管产气等多级筛选[3,5,7-13],再测定所得野生菌株的各项发酵性能,从而筛选出一株综合性能最优的发酵菌株[2,14-16]。整个筛选过程工作量大,随机性较强,不利于猕猴桃果酒专用酵母筛选工作的推进。因此,探索猕猴桃果酒专用酵母的高效筛选方法具有重要的意义。
本研究探索以高糖启动猕猴桃酒精发酵,从发酵完成的酒液中筛选猕猴桃果酒专用酵母,对猕猴桃自然发酵筛选菌种和高糖发酵筛选菌种进行了发酵性能对比和菌株鉴定,探讨该方法的可行性和优越性,以期简化猕猴桃果酒专用菌种筛选流程,提高筛选效率。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
红阳猕猴桃:雅安市雨城区多营镇;优质白砂糖(纯度≥99.6%):雅安市吉选超市;体积分数95%乙醇、氢氧化钠、无水硫酸铜、酒石酸钾钠(均为分析纯):成都市科龙化工试剂厂;一水合柠檬酸、偏重亚硫酸钾(均为分析纯)、葡萄糖(生化试剂):天津市致远化学试剂有限公司;浓盐酸(体积分数≥36.0%):四川西陇化工有限公司。
1.1.2 培养基
沙氏琼脂培养基[17]:青岛高科园海博生物技术有限公司。
猕猴桃清汁培养基[2]:成熟红阳猕猴桃去皮破碎榨汁,按20 mg/kg比例加入果胶酶于40 ℃酶解2 h,加入白砂糖调整糖度至170 g/L,115 ℃高压灭菌15 min。
1.2 仪器与设备
MJ-250-Ⅰ型霉菌培养箱:上海一恒科学仪器有限公司;ZWYR-2012C型气浴恒温振荡器:上海智城分析仪器制造有限公司;VAL-3N型酒精比重计:杭州汇尔仪器设备有限公司;LB32T型手持糖度折光仪:广州市速为电子科技有限公司;ME204E/02电子天平:梅特勒-托利多仪器(上海)有限公司;UV-1601型分光光度计:北京瑞利分析仪器;雷磁DZ-2型自动电位滴定仪:上海仪电科学仪器股份有限公司;WITEK MS型全自动微生物质谱检测系统:法国Biomerieux SA公司。
1.3 试验方法
1.3.1 菌种的富集与分离
取无病害、表皮无皱缩、软化八成熟的红阳猕猴桃200 g两份,分别放入500 mL无菌三角瓶中,用无菌工具捣碎,一组为自然糖度[14],此次样品自然糖度为150 g/L;另一组加入白砂糖调节糖度为350 g/L,塞好棉塞,均于28 ℃,恒温静置培养7 d[14]。7 d后分别取两种发酵液以连续划线法涂抹于沙氏培养基平板,每种发酵液划线两个平行样,于28 ℃恒温倒置培养48 h。挑选疑似酵母菌落进行镜检,符合酵母菌落及形态特征的在沙氏培养基平板上进行分离纯化2次,转入沙氏培养基固体斜面,4 ℃冰箱保藏备用。
1.3.2 菌种扩培
将分离纯化得到的菌株转至无菌猕猴桃清汁培养基,装液量150 mL/250 mL,于28 ℃、120 r/min条件下气浴恒温振荡培养[8],每24 h镜检监测菌种生长情况,至菌种形态饱满,出芽旺盛,菌数无明显增长时停止培养,作为发酵种子液。
1.3.3 菌种发酵性能测定
发酵力的测定:按5%(V/V)的接种量将发酵种子液接种于猕猴桃清汁培养基[2],装液量150 mL/250 mL,于培养箱22 ℃静置恒温发酵,每12 h测定发酵液质量损失,至相隔2次质量损失<0.2 g[2];每12 h用直尺测量发酵液起泡高度;发酵结束时测定酒液的酒精度[18]、残糖量[19]、总酸含量[19],并进行感官评价[20-21],发酵结束比较各株野生酵母的发酵力。
耐酒精度测定:因12%vol的果酒在市面上最为常见,本试验以体积分数为95%的乙醇将猕猴桃清汁培养基酒精度调整为12%vol,按5%(V/V)的接种量接种不同发酵种子液,装液量为150 mL/250 mL,于培养箱22 ℃静置恒温发酵,每12 h观测产气情况,并取发酵液适当稀释,用紫外分光光度计于波长580 nm处测定OD580nm值[2]。
耐SO2测定:SO2在果酒生产中具有选择性杀菌、抑菌、澄清、抗氧化、增酸、溶解等作用,几乎是果酒酿造中不可缺少的添加剂[22],参考罗秦等[23-24]的研究,本试验使用偏重亚硫酸钾将猕猴桃清汁培养基中SO2含量调整为150 mg/L,按5%(V/V)的接种量接种不同发酵种子液,装液量为150 mL/250 mL,于22 ℃培养箱静置恒温发酵,每12 h观测产气情况,并取发酵液适当稀释,用紫外分光光度计于波长580 nm处测定OD580nm值。
耐酸性测定:因猕猴桃果酒自然酸度较高,前期预实验测得发酵液pH值接近3.0,本试验以0.1%柠檬酸溶液将猕猴桃清汁培养基的pH值调整为3.0。按5%(V/V)的接种量接种不同发酵种子液,装液量为150 mL/250 mL,于22 ℃培养箱静置恒温发酵,每12 h观测产气情况,并取发酵液适当稀释,用紫外分光光度计于波长580 nm处测定OD580nm值。
1.3.4 菌株鉴定
将筛选得到的菌株送至雅安市人民医院检验科进行微生物质谱检测[25],鉴定菌株种属。
2 结果与分析
2.1 菌种富集与分离
从划线分离的沙氏平板上挑选菌落较大、白色、光滑、不透明的单个菌落进行镜检,符合圆形、卵圆形、椭圆形细胞特征且多端出芽生殖的单细胞菌株在沙氏平板上进行两次纯化[14],从两种发酵液中分别获得3株,共6株野生菌种,从自然发酵液中分离的菌株编号为ZR-1、ZR-2、ZR-3,高糖发酵液中分离的菌株编号为GT-1、GT-2、GT-3,6株菌株的菌落形态见图1。

图1 分离菌株的菌落形态
Fig.1 Colony morphology of isolated strains
2.2 菌种扩培
气浴恒温振荡96 h后,6株分离菌株的镜检结果见图2。

图2 分离菌株的细胞形态
Fig.2 Cell morphology of isolated strains
由图2可知,6株菌株经气浴恒温振荡96 h后,细胞形态均饱满,出芽旺盛,无杂菌污染,停止培养,作为发酵种子液。
2.3 菌种发酵性能测定
2.3.1 发酵力的测定
各发酵液的起泡高度是一定时间内菌株发酵剧烈程度的反应,质量减少主要是酒精发酵产生CO2逸出三角瓶所致,所以两者可作为菌株发酵力指标。6株分离菌株发酵液的起泡高度及质量减少情况分别见图3、图4。
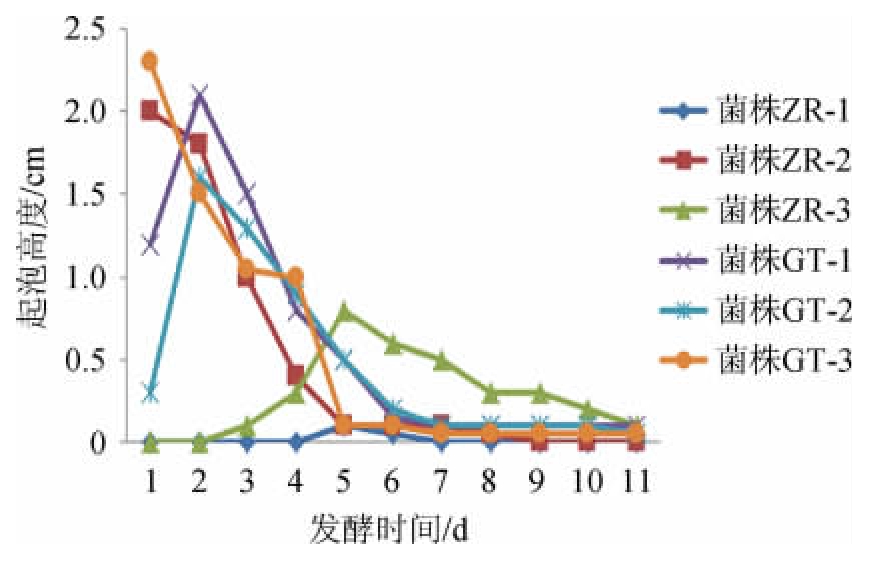
图3 不同菌株的起泡曲线
Fig.3 Foaming curves of different strains

图4 不同菌株发酵液质量损失曲线
Fig.4 Mass loss curves of fermentation broth of different strains
由图3和图4可知,自然发酵液中筛选出的3株菌株差异性较大,菌株ZR-1的发酵液几乎没有起泡,发酵力十分微弱,发酵1 d后质量下降,可能是高压灭菌时棉塞吸收水分蒸发所致;菌株ZR-2起酵迅速,发酵1~2 d后起泡高度和质量减少就达到高峰,同时发酵力回落也较快;菌株ZR-3在发酵3 d后才开始明显起酵,发酵强度不大,但持续发酵能力较强。高糖发酵液筛选出的菌株GT-1、GT-2、GT-3总体发酵性能具有相似性,发酵1 d后均起酵,菌株GT-1发酵力居中;菌株GT-2发酵高峰后发酵力持续更长久;菌株GT-3发酵强度最大,但是回落迅速。综合比较,来自高糖发酵液筛选的菌株GT-2更符合工业发酵菌种要求,具有较高发酵峰值和较持久的发酵能力。
6株菌株发酵后原酒的理化指标及感官评分分别见表1、表2。
表1 原酒的理化指标
Table 1 Physical and chemical indicators of original wine

表2 原酒的感官评分
Table 2 Sensory evaluation score of original wine

由表1可知,菌株ZR-1发酵后原酒的残糖量最高,为15 g/L,酒精发酵程度最低,酒精度为3%vol;菌株ZR-3发酵后原酒的残糖量为13 g/L,酒精度也较低(3.8%vol);其余4株菌株发酵后原酒的残糖量及酒精度差别不大,分别在6.0~7.2 g/L、9.0%vol~9.5%vol之间,其中菌株GT-2发酵后原酒的酒精度最高,达到9.5%vol,说明菌株GT-2的产酒精能力最强;由表2可知,菌株ZR-2、GT-1、GT-2、GT-3发酵后的原酒均有猕猴桃果酒风格,且菌株GT-1发酵后的原酒总体风味最为纯正典型。
2.3.2 耐酒精度测定
对6株菌株进行耐酒精度测定,起酵情况及生长情况见图5。

图5 不同菌株在酒精度12%vol条件下的起泡曲线(a)及生长曲线(b)
Fig.5 Foaming curves (a) and growth curve (b) of different strains under alcohol content 12%vol
由图5a可知,菌株ZR-2、GT-1、GT-2、GT-3发酵液的起泡曲线趋势相同,在发酵1 d后明显起酵,第3天达到发酵峰值,在发酵6~7 d后液面不再明显起泡;而菌株ZR-1、ZR-3被酒精抑制,发酵9 d后才出现明显起酵现象。由图5b可知,菌株ZR-2、GT-1、GT-2、GT-3的生长曲线趋势相似,短暂的延滞期后,在发酵2~5 d内达到生长高峰,随后菌数降低。其中菌株ZR-2发酵2 d后最先达到生长高峰,随后菌数缓慢降低,发酵8 d后趋于平稳,表现出较好的耐酒精性能;其中菌株GT-1显示出最好的耐受酒精性能,菌数持续增加到第5天到达峰值,且菌数高于其他各菌株,随后趋于下降;菌株GT-2和GT-3在前4 d也是持续生长,随后缓慢降低趋于平稳,对酒精耐受性弱于菌株GT-1。菌株ZR-1和ZR-3在酒精中生长情况相似,菌数缓慢增加,在发酵第9天达到较高数量。综上可知,12%vol酒精环境会延迟各菌株起酵时间,降低发酵强度,其中高糖发酵液中筛选到的菌株GT-1酒精耐受性最好,高糖发酵液中筛选到的菌株整体耐受性优于自然发酵液中筛选到的菌株。
2.3.3 耐SO2测定
对6株菌株进行耐SO2测定,起酵情况及生长情况见图6。
由图6a可知,菌株GT-1和GT-3在观察时间内微弱起酵,起酵强度较低、持续时间很短;其他菌株均未起酵。由图6b可知,菌株ZR-2、GT-1、GT-2、GT-3的生长趋势相似,培养1 d后缓慢增长,发酵2~5 d内达到生长高峰,随后缓慢降低,以菌株GT-2生长最旺盛。菌株ZR-1和ZR-3的生长趋势相似,在发酵1~6 d内生长受抑制,在培养6 d后,快速生长,且菌株ZR-1生长强于ZR-3。说明150 mg/L SO2对6株菌株的生长和酒精发酵均有明显的抑制作用,菌株GT-2有最好的生长耐受性,菌株GT-1和GT-3在该条件下起酵能力较好。
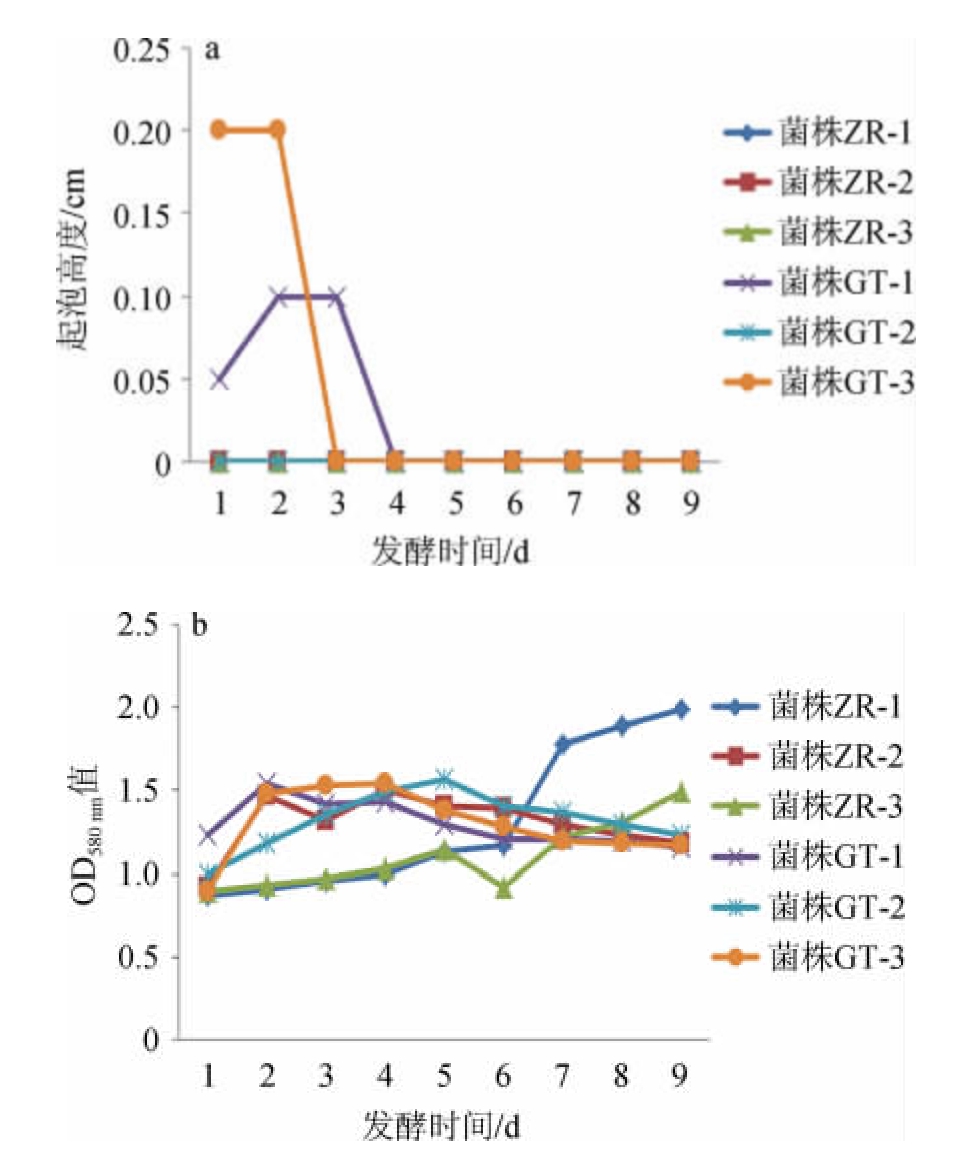
图6 不同菌株在150 mg/L的SO2条件下的起泡曲线(a)及生长曲线(b)
Fig.6 Foaming curves (a) and growth curves (b) of different strains under 150 mg/L SO2
2.3.4 耐酸性测定
对6株菌株进行耐酸性测定,起酵情况及生长情况见图7。
由图7a可知,菌株ZR-1和ZR-3一直没有起酵;菌株ZR-2、GT-1、GT-2、GT-3在第4天开始起酵,但总体起泡高度都很低,发酵微弱;菌株GT-2、GT-3起泡最高值相当。说明pH值为3.0的酸性环境抑制了各菌株发酵,延迟各菌株起酵时间和发酵峰值。由图7b可知,发酵1 d后各菌株的OD580nm值均增大,菌株ZR-2、GT-1、GT-2、GT-3均呈现先增长到峰值再降低的趋势,但达到峰值的时间不同,其中菌株GT-3的生长速率最高,在发酵第4天就达到生长量峰值,随后菌数降低,菌株ZR-2、GT-2在发酵第5天达到峰值,其中菌株GT-2的生长量在各菌株中最高,菌株GT-1比其他3株菌生长缓慢,在发酵第5天达到峰值,菌数也最低;菌株ZR-1和ZR-3在观察期内一直处于生长状态,且菌株ZR-3生长速率高于菌株ZR-1。说明pH值为3.0的酸性环境下各菌株仍然能生长,但对比图2发现酸性条件下生长速度和变化趋势均放缓,其中菌株GT-2耐酸性能最好,表现出最高的生长峰值和起泡高度。
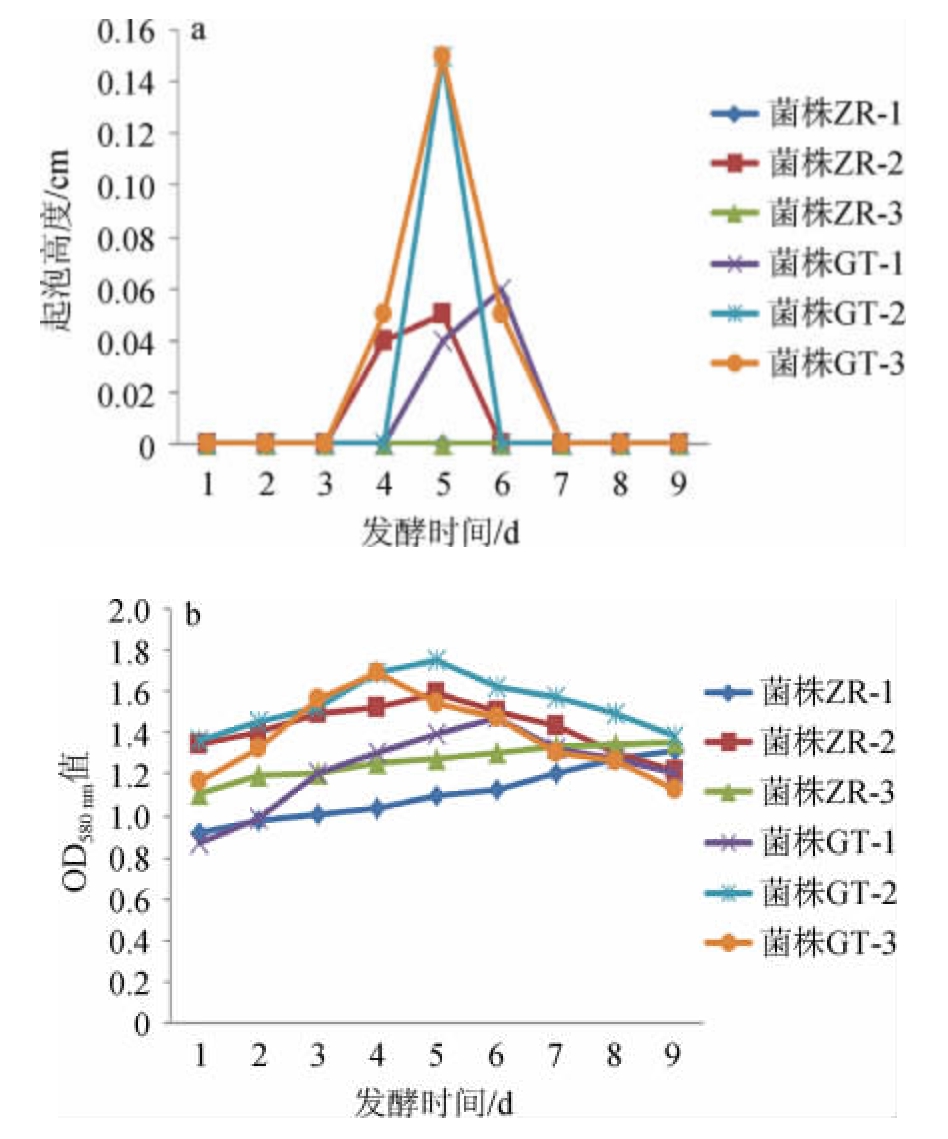
图7 不同菌株在pH=3.0条件下的起泡曲线(a)及生长曲线(b)
Fig.7 Foaming curves (a) and growth curves (b) of different strains under pH=3.0
2.4 菌株鉴定
采用基质辅助激光解析电离飞行时间质谱技术获取质量图谱,并通过VITEK MS数据库对其进行分析,从而完成微生物鉴定。结果显示,6株菌株中菌株ZR-1及ZR-3被鉴定为柠檬形克勒克酵母(Kloechera apiculate),其他菌株均被鉴定为酿酒酵母(Saccharomyces cerevisiae)。
3 结论
从自然糖度(150g/L)和添加白砂糖达到高糖度(350g/L)的两组猕猴桃汁发酵液中分别筛选出3株酵母菌,自然糖度组编号为ZR-1、ZR-2、ZR-3,高糖度组编号为GT-1、GT-2、GT-3。其中菌株ZR-1及ZR-3被鉴定为柠檬形克勒克酵母(Kloechera apiculate),其余菌株被鉴定为酿酒酵母(Saccharomyces cerevisiae)。通过发酵性能的测定发现,从产酒精能力、对SO2和pH为3.0酸性条件的耐受性上看,菌株GT-2最佳;从原酒感官和对酒精耐受性上看,菌株GT-1最佳;两株菌株均来自高糖猕猴桃汁发酵液,说明高糖发酵液筛选到发酵性能优良的酿酒酵母的几率更大。该方法简化了筛选流程,节省了筛选时间。综合来看,以高糖启动自然发酵,从发酵完成后的酒液中筛选菌株可以作为猕猴桃果酒专用酵母筛选更高效的方法。
[1]董世鹏,李然红,陈鑫.狗枣猕猴桃发酵啤酒工艺的研究[J].园艺与种苗,2019,39(6):11-12,60.
[2]张方艳.猕猴桃果酒酿酒酵母的优选及降酸研究[D].雅安:四川农业大学,2016.
[3]徐清萍,朱广存.野生猕猴桃果酒酵母的筛选鉴定及耐受性的研究[J].中国酿造,2011,30(7):120-123.
[4]伍强,彭娟娟,余有贵,等.大湘西野生猕猴桃果肉中酵母茵的分离鉴定及其耐受性研究[J].中国酿造,2018,37(9):83-87.
[5]罗安伟,刘兴华,寇莉苹,等.猕猴桃酒用酵母的选育研究[J].中国食品学报,2005,5(3):57-60.
[6]LOPANDIC k,ZELGER S,BANSZKY L K,et al.Identification of yeasts associated with milk products using traditional and molecular techniques[J].Food Microbiol,2006,23(4):341-350.
[7]王燕,刘娟.人工栽培猕猴桃酿酒酵母筛选研究[J].中国酿造,2015,34(9):84-86.
[8]王国平.宁夏御马葡萄酒厂酵母菌的鉴定及发酵动态变化研究[J].杨凌:西北农林科技大学,2019.
[9]蒋成,张旭,刘孝平,等.猕猴桃酒专用酵母的筛选[J].基因组学与应用生物学,2019,38(4):1689-1696.
[10]LURTON L,SNAKKERS G,ROULLAND C,et al.Influence of the fermentation yeast strain on the composition of wine spirits[J].Emirat J Food Agr,2010,67(4):485-491.
[11]TOWANTAKAVANITK,YONG S P,GORINSTEIN S.Quality properties of wine from Korean kiwifruit new cultivars[J].Food Res Int,2011,44(5):1364-1372.
[12]ORLIC S,REDZEPOVIC S,JEROMEL A,et al.Influence of indigenous Saccharomyces paradouxs strains on Chardonnay wine fermentation aroma[J].Int J Food Sci Tech,2010,42(1):95-101.
[13]蒋成,魏妙宏,刘路,等.猕猴桃果酒专用酵母的筛选与鉴定[J].食品与机械,2018,34(6):202-207.
[14]周元,张强,傅虹飞.猕猴桃果酒酵母的筛选及发酵工艺优化[J].西北农林科技大学学报(自然科学版),2014,42(12):151-160.
[15]REDZEPOVIC S,ORLIC S,MAJDAK A,et al.Differential malic acid degradation by selected strains of Saccharomyces during alcoholic fermentation[J].Int J Food Microbiol,2003,83(1):49-61.
[16]ATTFIELD P V.Stress tolerance:the key to effective strains of industrial baker's yeast[J].Nat Biotechnol,1997,15(13):1351-1357.
[17]郑悦康,叶志英,刘洪波.5 种培养基对酵母菌培养效果的比较[J].华南预防医学,2013,39(2):99-100.
[18]中华人民共和国国家卫生与计生委员会.GB 5009.225—2016 食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[19]中华人民共和国国家质量监督总局,国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[20]中华人民共和国轻工业部.QB/T 2027—1994 猕猴桃酒[S].北京:中国轻工业出版社,1994.
[21]中华人民共和国农业部.NYT 1508—2017 绿色食品果酒[S].北京:中国农业出版社,2017.
[22]徐凌.食品发酵酿造[M].北京:化学工业出版社,2011:89-100.
[23]罗秦,孙强,叶欣,等.红心猕猴桃果酒酿造工艺探究[J].食品工业,2014,35(5):144-147.
[24]刘琨毅,王琪,辜义洪,等.二氧化硫在猕猴桃酒中应用效果研究[J].酿酒,2016,43(6):84-87.
[25]CROWLEY E.Mass spectrometry in food microbiology:Identifying microbial isolates within minutes[J].New Food,2018,21(6):50-53.