果胶主要由杂多糖构成,是植物组织结构的重要组成部分。其主碳链骨架结构以1,4-糖苷键将α-D-半乳糖醛酸聚合而成[1]。果胶酶是已获重要工农业应用的酶,其使用量约占商业酶产量的25%。这些酶在食品工业中有多种应用,如果汁的澄清、植物油的提取、咖啡和可可的固化、植物纤维的精制和无果胶淀粉的制造[2-4]。果胶酶由复杂多样的果胶降解复合酶系组成,可通过不同的反应机制和作用模式水解或裂解果胶。它们可分为果胶酯酶和解聚酶,前者将果胶链的酯化部分皂化,而后者作用为裂解和水解果胶链。在复合酶系中,聚半乳糖醛酸酶是起水解作用的主要酶,可催化半乳糖醛酸α-1,4-糖苷键的水解断裂[5]。聚半乳糖醛酸酶的最适pH值通常在酸性范围内,适用于果汁、蔬菜汁和葡萄酒等的浸渍、液化、提取、澄清[6-7],而受到广泛关注。
果胶酶广泛存在于高等植物中,参与某些果实成熟过程果胶物质的修饰。虽然果胶酶可从植物、动物等多种来源获得,但只有微生物来源的果胶酶才能满足工业化生产需求。但由于果胶酶生产成本高(培养基成本占总成本的30%~40%),而限制了它的应用。因此,探索利用特定微生物转化廉价底物发酵合成胞外果胶酶成为一种有意义的尝试[8]。许多研究表明,丝状真菌是产生聚半乳糖醛酸酶的主要微生物,如黑曲霉(Aspergillus niger)[4]、烟曲霉菌(Aspergillus fumigatus)[9]、扩展青霉(Penicillium expansum)[10]等。
现今,人们更加关注固态发酵方式在聚半乳糖醛酸酶生产中应用。与深层发酵相比,固态发酵具有需水量少、所需溶剂少、真菌生长条件好、产液量少、浓度高、产酶量大等优点。这些优势在生物质和农工业剩余物丰富的产业中获得了特殊的经济利益[11]。ZHENG Z等[6]研究以苹果渣、蔓越橘渣和草莓渣作为底物对香菇(Lentinus edodes)CY-35合成聚半乳糖醛酸酶的影响,结果表明草莓渣有利于聚半乳糖醛酸的合成。BOTELLA C等[12]研究发现,葡萄渣可作为唯一营养物质以固态发酵方式合成聚半乳糖醛酸酶,结果表明聚半乳糖醛酸外切酶活性在发酵早期快速增长,随培养时间延长而逐步降低,而聚半乳糖醛酸内切酶活性恰与之相反,且后者活性受培养基中还原糖分解代谢阻遏调节。MACIEL M等[13]以橙皮为支持物对黑曲霉URM 5162进行固定,探索用固定床反应器筛选聚半乳糖醛酸酶产生菌的方法。为提高聚半乳糖醛酸酶合成量,SOLIS-PEREIRA S等[14]研究黑曲霉采用固态发酵和液态深层发酵方式下,不同的碳源及各个碳源的不同浓度对聚半乳糖醛酸酶合成的影响,结果表明以果胶或聚半乳糖醛酸为诱导剂,可以促进聚半乳糖醛酸酶的合成,而较高浓度的葡萄糖会抑制聚半乳糖醛酸酶。
本研究的目的是确定黑曲霉18-23以固态发酵方式转化不同食品加工废弃物(葡萄渣、苹果渣和柑橘渣)合成聚半乳糖醛酸的潜力,探索可溶性碳源对该酶的诱导作用,并测定温度和pH值对该酶活性的影响。研究表明,具有工业应用潜力的聚半乳糖醛酸酶必须具备特定条件下的结构稳定性。这有助于酶高效稳定的发挥催化作用,扩大其应用领域。因此,本研究将为食品加工、酶工业及微生物学领域提供有益的参考信息。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑曲霉(A.niger)18-23:保存于江西农业大学应用微生物研究所;葡萄渣、苹果渣、柑橘渣:从当地市场购买3种水果,经破碎榨汁后获得。果渣在干燥箱中80 ℃烘至恒质量,粉碎机粉碎,过20目筛,备用。
1.1.2 化学试剂
葡萄糖、乳糖、半乳糖、硫酸铵、柠檬酸、硝酸、柠檬酸钠、磷酸二氢钠、磷酸氢二钠、氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):国药集团化学试剂有限公司;槐糖(纯度≥98%):上海阿拉丁生化科技股份有限公司;聚半乳糖醛酸(纯度≥90%)、半乳糖醛酸(纯度≥95%):美国Sigma-Aldrich公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:按照文献[15]配制。
矿物质溶液:硫酸铵0.1%,硫酸镁0.5%,磷酸二氢钾0.5%,硫酸亚铁0.000 5%,pH 5。
1.2 仪器与设备
DHG-9030A鼓风干燥箱:上海一恒科学仪器有限公司;FW-200高速万能粉碎机:常州市华怡仪器制造有限公司;UV-1800紫外可见光分光光度计:日本岛津公司;雷磁PHSJ-4A型pH计:上海梅颖浦仪器仪表制造有限公司;H2500R-2高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;HWS-12水浴锅:上海五相仪器仪表有限公司;LC-1260Ⅱ高效液相色谱仪:美国安捷伦公司;YSD-8-13马弗炉:上海姚氏仪器设备厂;LRH-250恒温培养箱:广东省医疗器械厂;LHS-250SC数显恒温恒湿培养箱:常州梅香仪器有限公司;BS-4G数显振荡培养箱:常州市国旺仪器制造有限公司。
1.3 方法
1.3.1 原料化学分析检测
为了解果渣中相关成分的组成及含量,将葡萄渣、苹果渣、柑橘渣粉碎烘干后进行以下测定:
灰分、木质素含量:按照文献[16]的方法测定;粗蛋白含量:按照文献[17]的方法测定;果胶含量:按照文献[18]的方法测定;纤维素和半纤维素含量:按照文献[19]的方法测定;聚半乳糖醛酸酶活性:按照文献[20]的方法测定。
1.3.2 种子液制备
黑曲霉孢子悬浮液制备:将黑曲霉18-23孢子以涂布方式接种到PDA培养基平板上,30 ℃避光培养7 d,用无菌水洗脱黑曲霉孢子,无菌脱脂棉过滤,收集滤液,将滤液收集在无菌离心管中,黑曲霉孢子浓度调整至1×107~2×107个/mL,4 ℃保存。
1.3.3 固态发酵
将粉碎烘干后的葡萄渣、苹果渣、柑橘渣分别装入不同的500 mL三角瓶中,20 g/瓶,用矿物质溶液将果渣含水量调节至60%,121 ℃灭菌30 min。待培养基冷却至室温后,接种黑曲霉18-23孢子悬浮液,接种量为80 mL/kg,搅拌均匀,置于恒温恒湿培养箱30 ℃培养10 d,相对湿度维持在70%。每天搅拌1次,并取样测定聚半乳糖醛酸酶的酶活力。
1.3.4 粗酶的提取及酶活力测定
在固态发酵培养物中取1 g样品,加入25 mL 100 mmol/L pH4.8柠檬酸盐缓冲溶液,室温条件下200 r/min振荡浸提1 h,浸提液真空抽滤,滤液4 ℃、9 000×g离心20 min,上清液4 ℃保存,用于聚半乳糖醛酸酶的酶活力测定。
聚半乳糖酸酶酶活定义:在测试条件下,每分钟产生1 μmol半乳糖醛酸所需酶的数量为1个酶活力单位(U/mL)。固态发酵酶活力用每克干培养基中的U表示(U/g)。相对酶活性定义为聚半乳糖醛酸酶经过不同温度或pH缓冲液处理后酶活力与最适条件酶活力比值×100%。
1.3.5 半乳糖醛酸标准曲线的绘制
用半乳糖醛酸配制标准溶液,按DNS法[21]测定各个标准溶液在波长540 nm处的吸光度值,分别以半乳糖醛酸含量(x)为横坐标,吸光度值(y)为纵坐标绘制半乳糖醛酸标准曲线。
1.3.6 添加不同可溶性碳源对聚半乳糖醛酸酶合成影响
为测定不同可溶性碳源对聚半乳糖醛酸酶合成的影响,将葡萄糖、半乳糖、乳糖、槐糖4种可溶性碳源分别添加到柑橘渣固态基质中。其中低浓度组的添加量为0.5%,高浓度组的添加量为1.0%,以不添加可溶性碳源固态基质为对照(CK)。用矿物质溶液将果渣含水量调节至60%,121 ℃灭菌30 min。冷却后,按80 mL/kg接种黑曲霉18-23孢子悬浮液,搅拌均匀,置于30 ℃固态发酵8 d,相对湿度维持在70%左右。每天搅拌1次,并取样测定聚半乳糖醛酸酶的酶活力。
1.3.7 温度对聚半乳糖醛酸酶活力和稳定性的影响
分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃温度条件下,保温酶液与1%聚半乳糖醛酸底物反应混合物(pH 4.8)20 min,测定聚半乳糖醛酸酶活力,确定聚半乳糖醛酸酶的最适温度。粗酶液在40 ℃、45 ℃、50 ℃、55 ℃、60 ℃温度条件下,水浴保温30 min和60 min后,测定聚半乳糖醛酸酶粗酶液热稳定性,并计算相对酶活。
1.3.8 pH值对聚半乳糖醛酸酶活力和稳定性的影响
测定pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0条件下聚半乳糖醛酸酶活力,确定聚半乳糖醛酸酶的最适pH。粗酶液在不同pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)的缓冲液于30 ℃水浴保温2 h,测定聚半乳糖醛酸酶pH稳定性并计算相对酶活。
1.3.9 数据处理
所有样品一式3份,结果用均数±标准差表示。采用单因素方差分析(analysis of variance,ANOVA),并在5%的显著水平上进行Tukey检验,采用Origin8.5作图。
2 结果与分析
2.1 原料化学成分分析
三种果渣化学成分检测结果见表1。
表1 3种果渣化学成分分析结果
Table 1 Analysis results of chemical compositions of three kinds of pomaces

注:同行数据不同字母表示差异显著(P<0.05)。
由表1可知,葡萄渣、苹果渣和柑橘渣的化学组成中,灰分、粗蛋白、果胶、木质素、纤维素、半纤维素含量差异显著(P<0.05)。葡萄渣的粗蛋白含量为(11.1±0.1)g/100 g,显著高于苹果渣(4.6±0.3)g/100 g和柑橘渣(8.1±0.2)g/100 g(P<0.05);而苹果渣和柑橘渣的纤维素含量接近,分别为(15.3±0.2)g/100 g和(16.9±0.4)g/100 g,显著高于葡萄渣(P<0.05)。葡萄渣木质素含量最高为(38.7±0.4)g/100 g,其次为苹果渣(15.2±0.3)g/100 g,而柑橘渣最低(1.1±0.1)g/100 g。柑橘渣的半纤维素含量最高为(12.4±0.2)g/100 g,而葡萄渣和苹果渣含量接近,分别为(4.5±0.2)g/100 g和(4.7±0.1)g/100 g。果渣中的纤维素、半纤维素可为微生物的生长提供良好的碳源,而木质素含量高会阻碍微生物接触纤维素和半纤维素,影响诱导水解酶的分泌而导致微生物生长缓慢[22]。从原料分析结果来看,柑橘渣的果胶、纤维素和半纤维含量最高,有利于促进微生物的生长及果胶酶的产生。
2.2 固态发酵底物对聚半乳糖醛酸酶合成的影响
黑曲霉18-23能够在葡萄渣、苹果渣、柑橘渣培养基中生长,在葡萄渣、苹果渣、柑橘渣培养基上,黑曲霉18-23固态发酵过程中产胞外聚半乳糖醛酸酶情况见图1。由图1可知,酶活性随着培养时间的延长不断增加,增速初期较缓,中后期增速较快,发酵8 d时达到最高,继续培养,酶活力下降。三种培养基中的聚半乳糖醛酸酶产量不同,柑橘渣中酶产量最高,其次是苹果渣。与柑橘渣和苹果渣相比,葡萄渣不适合聚半乳糖醛酸酶的合成。以柑橘渣和苹果渣为发酵培养基所产酶活力分别为56.9U/g和42.1 U/g,分别是以葡萄渣为培养基所得酶活力的2.3倍和1.7倍。三种果渣中,柑橘渣和苹果渣的果胶相对含量较高(见表1),在发酵过程中能够诱导更多的果胶酶的产生。因此,后续选择柑橘渣培养基发酵产聚半乳糖醛酸酶。

图1 不同果渣底物对黑曲霉18-23产聚半乳糖醛酸酶的影响
Fig.1 Effect of different pomace substrates on polygalacturonase production by Aspergillus niger 18-23
2.3 可溶性碳源对聚半乳糖醛酸酶合成的影响
在柑橘渣中添加不同浓度、不同种类碳源,接种黑曲霉固态发酵8 d,所产聚半乳糖醛酸酶活力结果见图2。由图2可知,葡萄糖对聚半乳糖醛酸酶的形成起到显著抑制作用,随着葡萄糖浓度从0.5%提高到1.0%,聚半乳糖醛酸酶活力从16.2 U/g降低到10.3 U/g,均显著低于对照酶活力(53.6 U/g)(P<0.05)。与之相反,柑橘渣培养基中添加1.0%乳糖后,聚半乳糖醛酸酶酶活力达到66.6 U/g,比对照显著增加(P<0.05)。而添加半乳糖或槐糖对聚半乳糖醛酸酶的合成并没有促进作用。乳糖由一个半乳糖和一个葡萄糖构成,葡萄糖是单糖,极易被微生物细胞利用,它的进入会抑制细胞中诱导酶基因的表达,进而降低相应蛋白酶的合成。葡萄糖或半乳糖的添加量与聚半乳糖醛酸酶合成呈负相关,乳糖主要发挥诱导作用导致聚半乳糖醛酸酶酶活力增加,而槐糖无诱导作用。
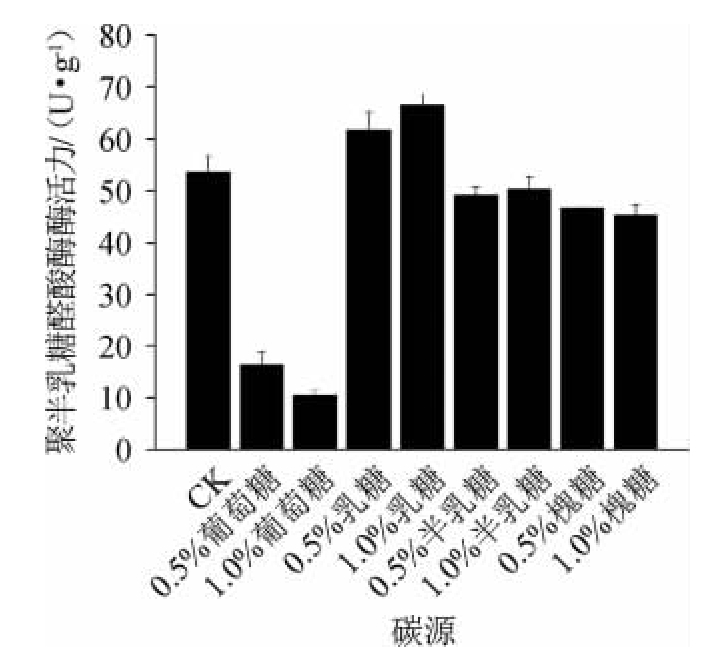
图2 不同碳源添加量对黑曲霉18-23发酵柑橘渣产聚半乳糖醛酸酶的影响
Fig.2 Effect of different carbon source addition on polygalacturonase production from citrus pomace by Aspergillus niger 18-23
2.4 温度对聚半乳糖醛酸酶活力和稳定性的影响
温度对黑曲霉18-23以柑橘渣固态发酵所得的聚半乳糖醛酸酶酶活及热稳定性的影响结果见图3。
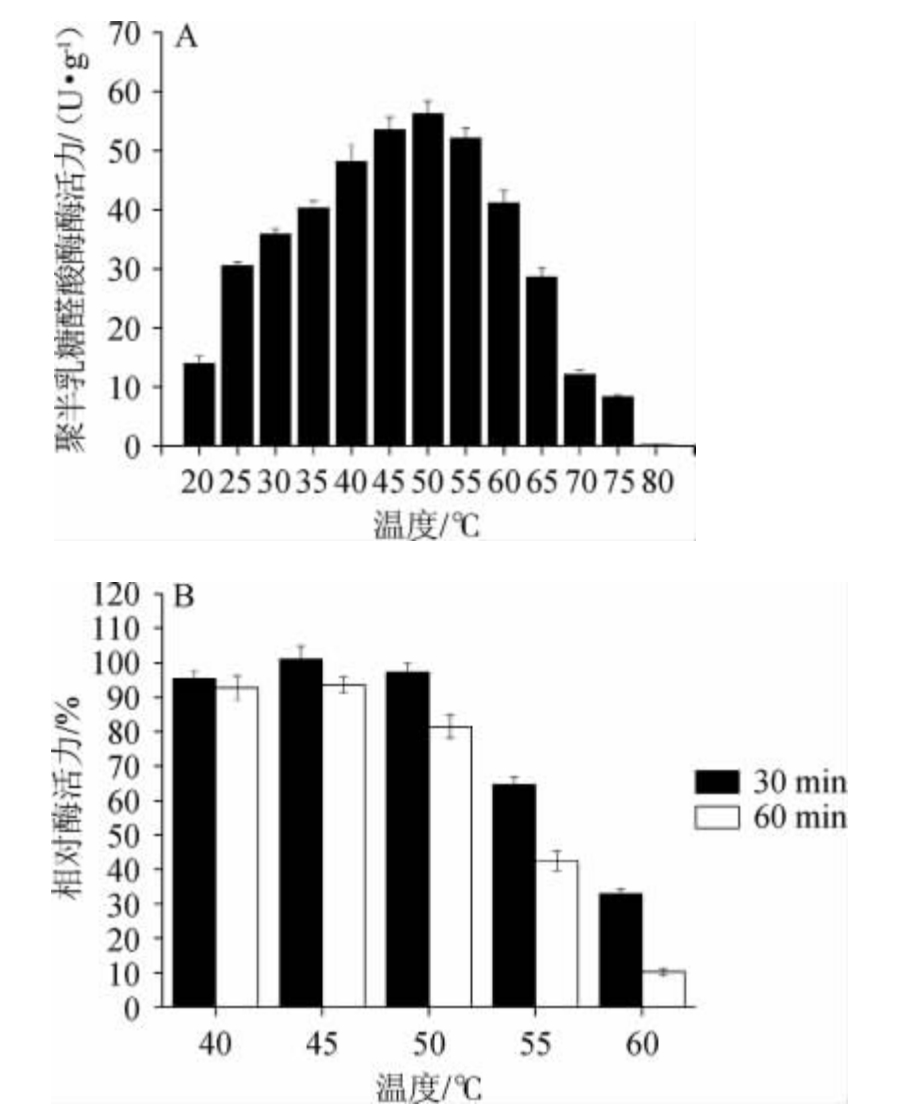
图3 温度对黑曲霉18-23所产聚半乳糖醛酸酶的酶活(A)及热稳定性(B)的影响
Fig.3 Effect of temperature on the enzyme activity (A) and thermal stability (B) of polygalacturonase produced by Aspergillus niger 18-23
由图3A可知,当温度在20~50 ℃范围内升高,聚半乳糖醛酸酶粗酶酶活力随之增大;当温度为50 ℃,酶活最大,为56.3 U/g;当温度达到60 ℃时,酶活力为41.2 U/g,仍然保持73%的酶活力;当温度超过60 ℃之后,酶活力大幅下降,当温度为80 ℃时,聚半乳糖醛酸酶粗酶丧失酶活性。因此,聚半乳糖醛酸酶最适温度为50 ℃。
由图3B可知,聚半乳糖醛酸酶在40℃和45℃保温30 min和60 min都具有良好的稳定性,相对酶活力均>92%。在酶活最适温度50 ℃条件下保温30 min,聚半乳糖醛酸酶的热稳定性良好,酶的残留活性为97%,而当保温60 min时,相对酶活力降低约20%。55 ℃条件下保温30 min和60 min,残留活性分别为64%和42%。而当温度超过60 ℃之后,酶的残留活性急剧降低,保温60 min后,相对酶活力仅为10%。因此,聚半乳糖醛酸酶在温度40~50 ℃范围热稳定性良好。
2.5 pH对聚半乳糖醛酸酶活力和稳定性的影响
pH值对黑曲霉18-23所产聚半乳糖醛酸酶酶活及pH稳定性影响结果见图4。

图4 pH值对黑曲霉18-23所产聚半乳糖醛酸酶的酶活(A)及pH稳定性(B)的影响
Fig.4 Effect of pH value on the enzyme activity (A) and pH stability(B)of polygalacturonase produced by Aspergillus niger 18-23
由图4A可知,聚半乳糖醛酸酶在酸性范围能够维持较好的酶活力,当pH值在4.0~6.0范围内,酶活力高于39.3 U/g;当pH值为5.5时,酶活力最大,为52.3 U/g;当pH值从4.0降至3.0时,酶活力有所降低;而当pH值>6.5之后,酶活力显著降低(P<0.05)。因此,聚半乳糖醛酸酶最适pH值为5.5。
由图4B可知,聚半乳糖醛酸酶在pH 4.0~5.5范围之间,相对酶活力在95%以上;在pH 3.5和6.0,相对酶活力分别为80.5%和73.8%;当pH值>7.0之后,相对酶活力丧失50%以上。因此,聚半乳糖醛酸酶在pH4.0~5.5范围稳定性良好。
3 结论
黑曲霉18-23具有以葡萄渣、苹果渣和柑橘渣为底物固态发酵生产聚半乳糖醛酸酶的潜力,固态发酵可降低该酶的生产成本。3种底物中柑橘渣为最适底物,其酶活力达到56.9 U/g,为葡萄渣所产酶活力的2.3倍。
乳糖能够诱导聚半乳糖醛酸酶的产生,酶活力达到66.6 U/g,比对照约提高24%,而槐糖、半乳糖对该酶产生无显著作用,葡萄糖能够抑制该酶的合成。
黑曲霉18-23所产聚半乳糖醛酸酶的粗酶最适温度为50 ℃,最适pH值为5.5,且在温度40~50 ℃、pH 4.0~5.5稳定性良好,具有广阔的推广应用前景。
[1]张学杰,郭科,苏艳玲.果胶研究新进展[J].中国食品学报,2010,10(1):167-174.
[2]李祖明,张洪勋,白志辉,等.微生物果胶酶研究进展[J].生物技术通报,2010(3):42-49.
[3]胡惠仁,赵晶.聚半乳糖醛酸酶的发酵条件优化及对造纸白水DCS 的控制[J].天津科技大学学报,2008,23(4):1-5.
[4]GARG G,SINGH A,KAUR A,et al.Microbial pectinases:an ecofriendly tool of nature for industries[J].3 Biotech,2016,6(1):47.
[5]FREITAS P M D,MARTIN N,SILVA D,et al.Production and partial characterization of polygalacturonases produced by thermophilic Monascus sp.N8 and by thermotolerant Aspergillus sp.N12 on solid-state fermentation[J].Braz J Microbiol,2006,37(3):302-306.
[6]ZHENG Z,SHETTY K.Solid state production of polygalacturonase by Lentinus edodes using fruit processing wastes[J].Process Biochem,2000,35(8):825-830.
[7]TARI C,DOGAN N,GOGUS N.Biochemical and thermal characterization of crude exo-polygalacturonase produced by Aspergillus sojae[J].Food Chem,2008,111(4):824-829.
[8]PALANIYAPPAN M,VIJAYAGOPAL V,VISWANATHAN R,et al.Screening of natural substrates and optimization of operating variables on the production of pectinase by submerged fermentation using Aspergillus niger MTCC 281[J].Afr J Biotechnol,2009,8(4):682-686.
[9]WONG L Y,SAAD W Z,MOHAMAD R,et al.Optimization of cultural conditions for polygalacturonase production by a newly isolated Aspergillusfumigatus R6 capable of retting kenaf[J].Ind Crop Prod,2017,97:175-183.
[10]ZHU M,HE H,FAN M,et al.Application and optimization of solid-state fermentation process for enhancing polygalacturonase production by Penicillium expansum[J].Int J Agr Biol Eng,2018,11(6):187-194.
[11]ZASLONA H,TRUSEK-HOLOWNIA A.Enhanced production of polygalacturonase in solid-state fermentation:selection of the process conditions,isolation and partial characterization ofthe enzyme[J].Acta Biochem Pol,2015,62(4):651-657.
[12]BOTELLA C,DE ORY I,WEBB C,et al.Hydrolytic enzyme production by Aspergillus awamori on grape pomace[J].Biochem Eng J,2005,26(2-3):100-106.
[13]MACIEL M,OTTONI C,SANTOS C,et al.Production of polygalacturonases by Aspergillus section Nigri strains in a fixed bed reactor[J].Molecules,2013,18(2):1660-1671.
[14]SOLIS-PEREIRA S,FAVELA-TORRES E,VINIEGRA-GONZ L G,et al.Effects of different carbon sources on the synthesis of pectinase by Aspergillus niger in submerged and solid state fermentations[J].Appl Microbiol Biot,1993,39(1):36-41.
[15]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:215.
[16]AHMED I,ZIA M A,HUSSAIN M A,et al.Bioprocessing of citrus waste peel for induced pectinase production by Aspergillus niger; its purification and characterization[J].J Radiat Res Appl Sci,2016,9(2):148-154.
[17]REAGENT F P.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193:265-275.
[18]WANG Y C,CHUANG Y C,HSU H W.The flavonoid,carotenoid and pectin content in peels of citrus cultivated in Taiwan[J].Food Chem,2008,106(1):277-284.
[19]GOTTSCHALK L M F,TONON R V.Use of grape pomace for the production of hydrolytic enzymes by solid-state fermentation and recovery of its bioactive compounds[J].Food Res Int,2019,120:441-448.
[20]DEMIR H,TARI C.Bioconversion of wheat bran for polygalacturonase production by Aspergillus sojae in tray type solid-state fermentation[J].Int Biodeter Biodegr,2016,106:60-66.
[21]李瑜,樊明涛,袁晖,等.聚半乳糖醛酸酶高产菌的筛选及产酶条件研究[J].中国酿造,2009,28(2):56-59.
[22]BOTELLA C,DIAZ A,DE ORY I,et al.Xylanase and pectinase production by Aspergillus awamori on grape pomace in solid state fermentation[J].Process Biochem,2007,42(1):98-101.
[23]ORTEGA N,DE DIEGO S,PEREZ-MATEOS M,et al.Kinetic properties and thermal behaviour of polygalacturonase used in fruit juice clarification[J].Food Chem,2004,88(2):209-217.