乳酸菌是一类能利用可发酵碳水化合物产生大量乳酸的细菌的通称[1]。乳酸菌具有改善胃肠道、降低胆固醇、增强免疫力以及抗氧化等多种生理功能,已广泛应用于食品工业,是公认的益生菌[2]。益生菌发酵果蔬汁是近年来功能性食品研究的热点之一。益生菌发酵不仅能够增加果蔬汁有机酸、香气物质的种类,改善风味,而且还能够提高降血糖、抗氧化等保健功效。任婷婷等[3]用混合乳酸菌发酵苹果浆,发现发酵后酯类、醇类和酮类挥发性风味物质含量增加,苹果浆风味显著改善。FILANNINO P等[4]用乳酸菌发酵樱桃汁,研究发酵前后酚类物质的变化,发现一些大分子的酚类物质被分解转化为小分子的酚类物质,提高了生物利用度。ANKOLEKAR C等[5]研究发现,通过乳酸菌发酵可提高梨汁的降血糖和降血压性能。
树莓(Rubus corchorifolius L.)又名山抛子、覆盆子和托盘等,为蔷薇科悬钩子属灌木型植物。树莓果实甘爽多汁,含有丰富的鞣花酸、黄酮和水杨酸等多种生物活性成分[6]。树莓成熟后极易腐烂,不耐贮运,目前大部分树莓果实都用于加工树莓汁、树莓酱、树莓酒等食品[7]。随着人们生活水平的提高和保健意识的增强,非常有必要进一步开发功能性树莓加工产品。常曼曼等[8]采用保加利亚乳杆菌(Lactobacillus bulgaricus)发酵红树莓汁,发现乳酸菌发酵能产生愉悦的风味物质,使口感柔和爽口,但总酚含量和总黄酮含量显著下降。树莓汁的乳酸菌发酵研究的总体相对较少,目前尚没有适于树莓汁发酵的专用乳酸菌菌种。影响果蔬汁乳酸发酵质量的因素包括果蔬品种、成熟度、发酵菌种、发酵工艺等,选择能适应果蔬汁发酵条件且风味优良的乳酸菌种尤为关键。
本研究从抗氧化活性、胃肠道环境耐受性、抑菌性能及菌体生长能力四个方面对12株乳酸菌进行评价筛选,从中筛选出优良乳酸菌株;并采用优选菌株发酵红树莓汁,以期为功能性发酵树莓汁饮料的产业化开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及原材料
短杆菌(Lactobacillus brevis)S1、鼠李糖乳杆菌(Lactobacillus rhamnosus)W1、SL、LGG、干酪乳杆菌(Lactobacillus casei)YSHM3、嗜酸乳杆菌(Lactobacillus acidophilus)W3、副干酪乳杆菌(Lactobacillus paracasei)YN4、YJ1、YJ4、YJ10、植物乳杆菌(Lactobacillus plantarum)T34、Lactobacillus acidipiscis(YJ5):浙江大学食品营养健康益生菌菌种保藏库;冷冻红树莓(品种:哈瑞太兹):上海禅莲生物科技有限公司;人工胃液:北京索莱宝科技有限公司;人工小肠液:上海源叶生物科技有限公司;。
1.1.2 化学试剂
总抗氧化能力检测试剂盒((2,2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS))、总抗氧化能力检测试剂盒((铁离子还原/抗氧化能力(Ferric ion reducing antioxidant power,FRAP)):碧云天生物技术研究所;果胶酶(酶活50 000 U/g):宁夏和氏璧生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国Sigma公司;1,10-邻菲罗啉(纯度>98%):阿拉丁试剂(上海)有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
MRS、LB培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
L18-Y928S破壁机:九阳股份有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;M200PRO酶标仪:瑞士Tecan公司;LRH-25OF生化培养箱:上海一恒科学仪器有限公司;PHSJ-4F pH计:上海仪电科学仪器股份有限公司;FS-250超声处理器:上海生析超声仪器有限公司。1100型高效液相色谱仪:美国安捷伦公司。
1.3 试验方法
1.3.1 发酵红树莓汁的加工工艺及操作要点
冷冻树莓→解冻→打浆→酶解→调糖→灭菌→接种→发酵→发酵红树莓汁
操作要点:
解冻、打浆:冷冻红树莓果实在室温条件下自然解冻,用破壁机打浆。
酶解:红树莓打浆后加入2%果胶酶,40 ℃水浴中酶解3 h,2层纱布过滤,得到红树莓汁。
成分调整:加入白砂糖调节其糖度至16.5°Bx。
灭菌:85 ℃条件下灭菌20 min,保存备用。
乳酸菌的活化:将保存的乳酸菌株接种于MRS液体培养基,37 ℃厌氧培养24 h。活化后的乳酸菌置于4 ℃冰箱保存备用。
接种:按4%的接种量接入活化后的乳酸菌。
发酵:在37 ℃条件下进行厌氧发酵,定时取样测定活菌数,当活菌数不再增加时,终止发酵。
1.3.2 无菌体发酵液和菌悬液的制备
将乳酸菌活化后接种于MRS液体培养基,37 ℃厌氧培养48 h,培养液在8 000 r/min条件下离心5 min,将菌体和上清液分离。收集的菌体用无菌磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤2次,然后再将菌体用无菌PBS制成菌悬液,并调整菌悬液OD600nm值=1。上清液用0.22 μm的无菌滤膜过滤,即得无菌体发酵液,置于-80 ℃冰箱保存备用。
1.3.3 抗氧化活性测定
(1)清除DPPH自由基能力的测定[9]
吸取0.5 mL样品,加入0.5 mmol/L的DPPH-乙醇溶液0.5 mL,室温避光条件下静置反应30 min后,5 000 r/min离心10 min,取上清液在波长517 nm处,测其吸光度值。对照组将样品换为无菌PBS溶液,空白组将DPPH-乙醇溶液换为乙醇溶液。DPPH自由基清除率的计算公式如下:
式中:A为样品组吸光度值;Ai为空白组吸光度值;A0为对照组的吸光度值。
(2)清除羟基自由基能力的测定[10]
吸取0.5 mL 2.5 mmol/L的1,10-邻菲罗啉加入1.0 mL的PBS缓冲液中,混匀,向混合液中加入0.5 mL 2.5 mmol/L的硫酸亚铁,混匀,加入0.5 mL 2.5 mmol/L的过氧化氢,混匀,最后加入0.5 mmol/L的处理后的样品,混匀后置于37 ℃条件下,反应2 h。其中对照组将样品换成等量的蒸馏水,空白组将过氧化氢和样品都换成等量的蒸馏水。反应完成后,8 000 r/min离心10 min,取上清液,在波长536 nm条件下测定OD536nm值。羟基自由基清除率的计算公式如下:
(3)ABTS法测定总抗氧化能力
按照试剂盒要求配制ABTS工作液和测定操作。利用试剂盒中的Trolox标准品得到标准曲线,根据标准曲线回归方程计算出样品的ABTS 总抗氧化能力。
(4)FRAP法测定总抗氧化能力
按照试剂盒要求配制FRAP工作液和测定操作。利用试剂盒中的FeSO4标准品得到标准曲线,根据标准曲线回归方程计算出样品的FRAP总抗氧化能力。
1.3.4 胃肠道环境耐受性的测定
参考赵芳等[11]的方法,采用模拟胃肠道环境测定乳酸菌株的耐受性。将活化好的乳酸菌在8 000 r/min条件下离心5 min,弃上清液,用无菌PBS洗涤菌体2次,再用PBS重悬菌体至原来体积。取0.5 mL菌悬液加入4.5 mL人工胃液,于37 ℃厌氧培养,分别在0 h、3 h时,取样采用平板稀释法[12]测定其活菌数。然后,吸取0.5 mL处理3 h的含菌人工胃液与4.5 mL人工肠液混合,继续于37 ℃厌氧静置培养,在8 h时取样测定其活菌数,计算存活率。
1.3.5 抑菌性能的测定
使用琼脂孔扩散法测定乳酸菌株的抑菌性能[13]。取20 mL灭菌冷却至45 ℃的LB固体培养基分别与1 mL大肠杆菌(Escherichia coli)、金色葡萄球菌菌液(Staphylococcus aureus)(105~106 CFU/mL)一起倒入平板混匀,待凝固后于平板上打孔,孔径为8 mm。将已制备好的无菌上清液(将培养好的乳酸菌液离心,上清液用0.22 μm的微孔滤膜过滤除菌,置于-80 ℃保存)100 μL加入孔中,以等体积已灭菌的MRS培养基为对照,置于4 ℃冰箱中扩散12 h,取出放入37 ℃生化培养箱培养24 h,测量其抑菌圈直径。
1.3.6 分析检测
总黄酮的测定采用NaNO2-Al(NO2)3-NaOH比色法[14]、总酚含量的测定采用福林酚法[15]、总酸的测定采用酸碱滴定法[16]、有机酸的测定采用高效液相色谱法[17]。
1.3.7 统计分析
每个试验重复3 次,采用SPSS 17.0 统计软件对数据进行处理,试验结果以均值±标准偏差(Mean+SD)表示。
2 结果与分析
2.1 优良乳酸菌株的筛选
2.1.1 不同菌株菌悬液及发酵液的抗氧化活性
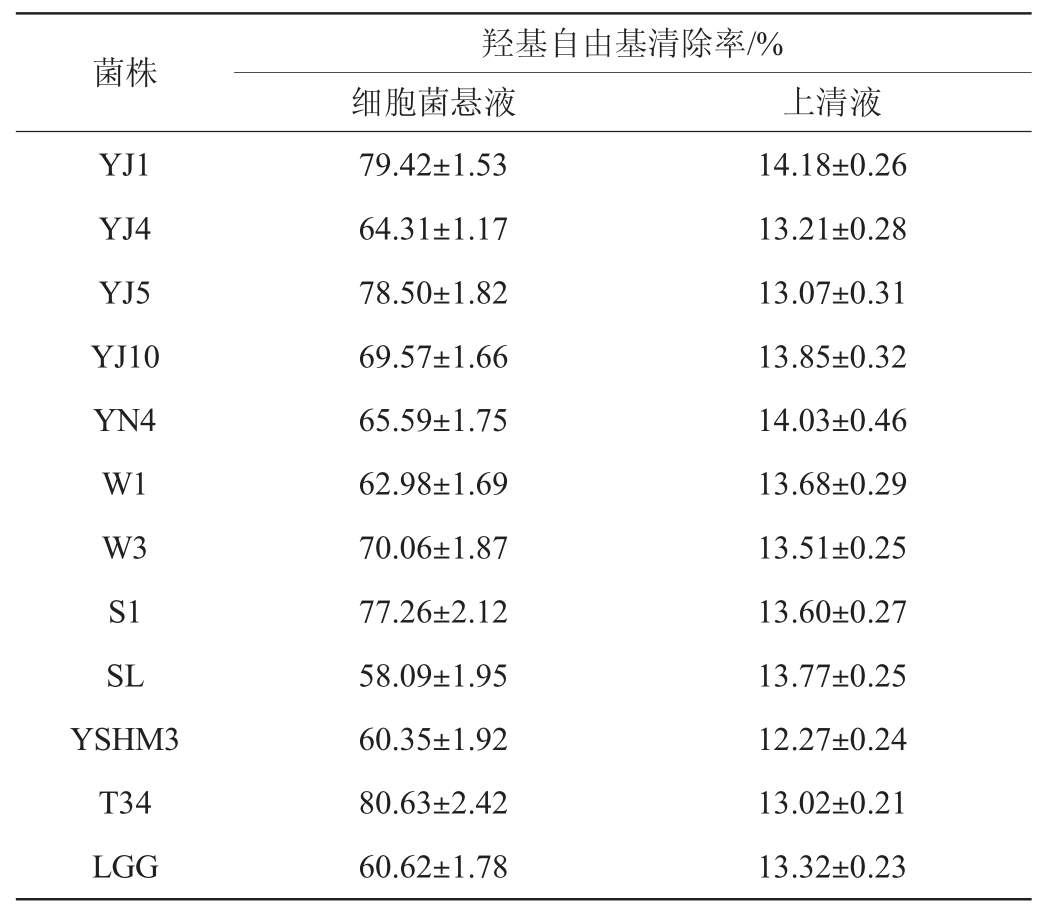
乳酸菌具有抗氧化作用,但菌株之间的抗氧化活性具有较大的差异[18-19]。由表1可知,同一株菌的不同组分的DPPH自由基清除能力不同,无菌体发酵液的DPPH自由基清除能力优于细胞菌悬液,这一结果与林祥娜等[19]的研究结果一致。12株乳酸菌无菌体发酵液均具有较好的清除DPPH自由基能力,其清除能力在59.98%~71.23%之间,其中清除能力较强的依次为菌株YJ5>菌株YJ1>菌株SL,而菌株YN4的清除能力最弱;12株乳酸菌细胞菌悬液的清除DPPH自由基能力较弱,其清除能力在9.02%~13.53%之间,其中清除能力较强的依次为菌株YJ1>菌株YN4>菌株W3,而菌株W1的清除能力最弱。
由表2可知,细胞菌悬液的羟基自由基清除能力强于无菌体发酵液。12株乳酸菌的细胞菌悬液均具有较强的清除羟基自由基能力,但菌株之间的清除能力有显著的差异。细胞菌悬液羟基自由基清除能力最强的为菌株T34,其次是菌株YJ1和菌株YJ5,而菌株SL清除能力最弱;12株乳酸菌无菌体发酵液的清除羟基自由基能力较弱,且菌株之间的差异较小,其中清除能力较强的依次为菌株YJ1>菌株YN4>菌株YJ10。
表1 不同乳酸菌菌株菌悬液及发酵液的DPPH自由基清除能力
Table 1 DPPH free radical scavenging capacity of suspension and fermentation broth of different lactic acid bacteria

表2 不同乳酸菌菌株菌悬液及发酵液的羟基自由基清除能力
Table 2 Hydroxyl free radical scavenging capacity of suspension and fermentation broth of different lactic acid bacteria
2.1.2 模拟胃肠道环境耐受性
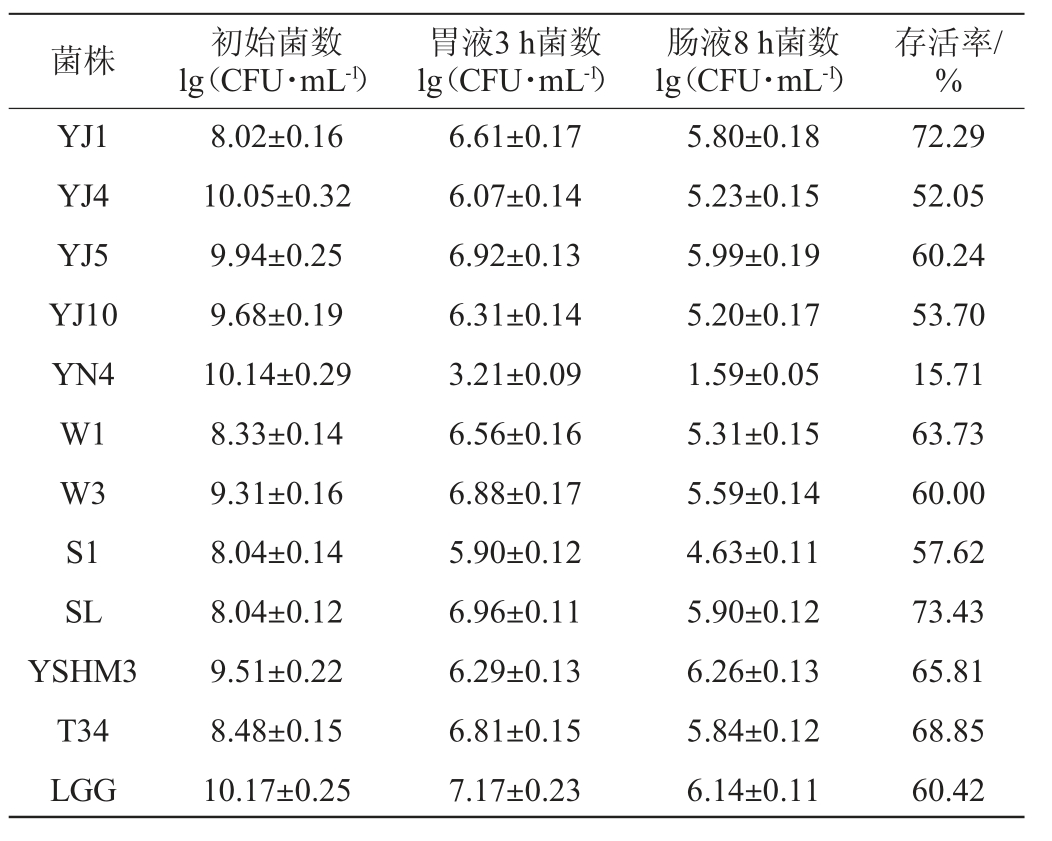
益生菌被摄入人体后,在人体肠道中存活和定殖能力的强弱直接决定着其是否能发挥益生作用,因此耐胃酸、肠液等特性是优良乳酸菌作为益生菌的一个重要指标[11]。由表3可知,不同乳酸菌株对人工胃液、人工肠液的耐受性有很大的差异。菌株SL对胃肠道环境具有良好的耐受性,经过胃肠液处理后其细胞存活率达73.43%,而菌株YN4对胃肠道环境耐受性很差,其细胞存活率仅为15.71%。在所试验的12株乳酸菌中,对胃肠道环境耐受性最好的三株菌依次是SL、YJ1和T34。
表3 不同乳酸菌菌株模拟胃肠道环境耐受性
Table 3 Tolerance of different lactic acid bacteria to simulated gastrointestinal environment
2.1.3 抑菌性能
由表4可知,12株乳酸菌均对大肠杆菌、金色葡萄球菌具有显著的抑制作用(P<0.05),其中对金色葡萄球菌的抑菌性能好于对大肠杆菌,同一菌株对金色葡萄球菌的抑菌圈直径均大于对大肠杆菌的抑菌圈直径。对于抑制大肠杆菌而言,抑菌性能最好的依次为菌株YJ10>菌株YJ1>菌株SL,而对于抑制金色葡萄球菌而言,菌株YJ1的抑菌圈直径最大(26.85 mm),其次是菌株W1(25.57 mm)和菌株YN4(25.44 mm)。菌株YJ1对大肠杆菌和金色葡萄球菌均表现出良好的抑菌性能,其抑菌圈直径分别达到17.46 mm和26.85 mm。
表4 不同乳酸菌菌株的抑菌活性
Table 4 Antibacterial activity of different lactic acid bacteria
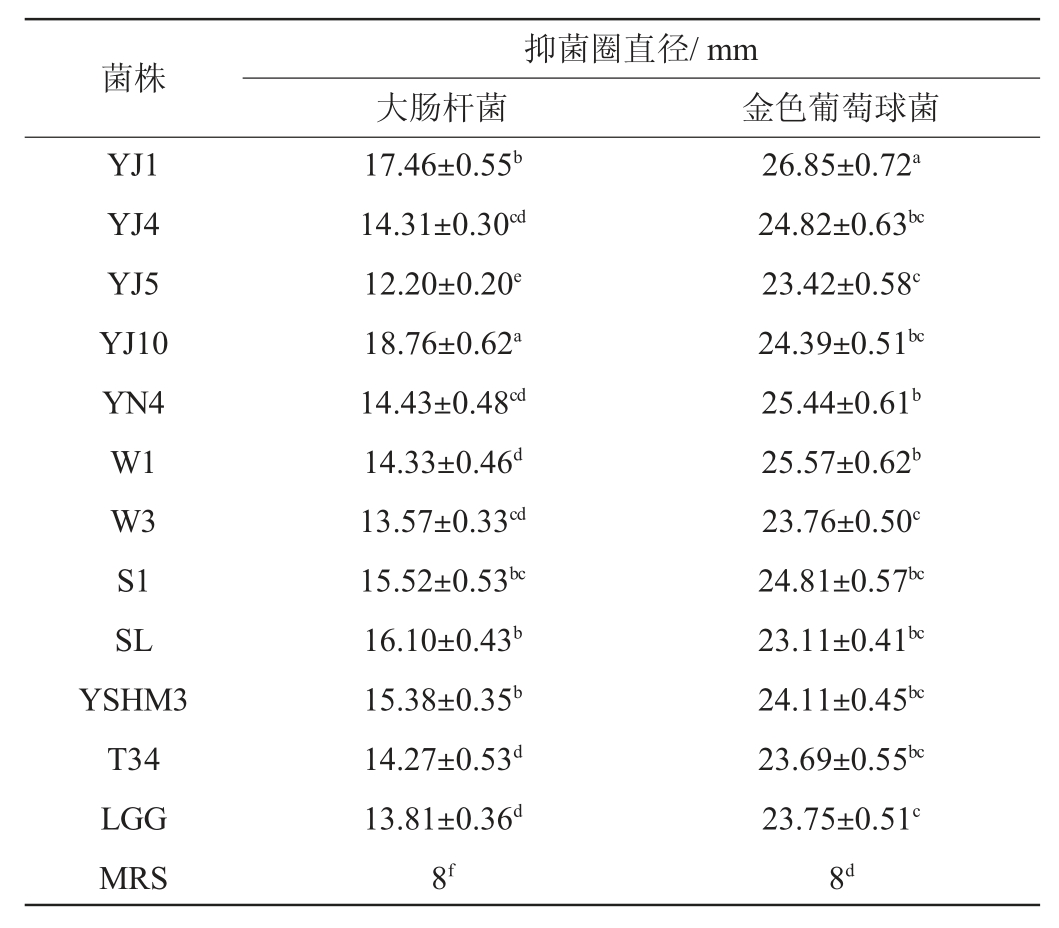
注:同一列中不同字母表示差异显著(P<0.05)。
2.1.4 树莓汁中的生长能力
根据上述试验结果,从抗氧化活性、胃肠道环境耐受性和抑菌性能三个指标综合考虑,12株乳酸菌中综合性能最好的为菌株YJ1,菌株SL、YJ5、YJ10 和T34综合性能也较好。除了具有良好的抗氧化活性、胃肠道环境耐受性和抑菌性能外,在发酵红树莓汁时,还要求乳酸菌能在高酸度的红树莓汁中良好生长。由图1可知,菌株YJ1、SL、T34、YJ5和YJ10均可在红树莓汁中良好生长,其中生长最好的是菌株YJ1,发酵36 h时活菌数达到最大值,9.45 lg CFU/mL;YJ10生长得相对较差,发酵48 h时活菌数达到最大值,8.55 lg CFU/mL。综合上述试验结果,选择副干酪乳杆菌YJ1为最佳的红树莓汁乳酸菌发酵菌株。
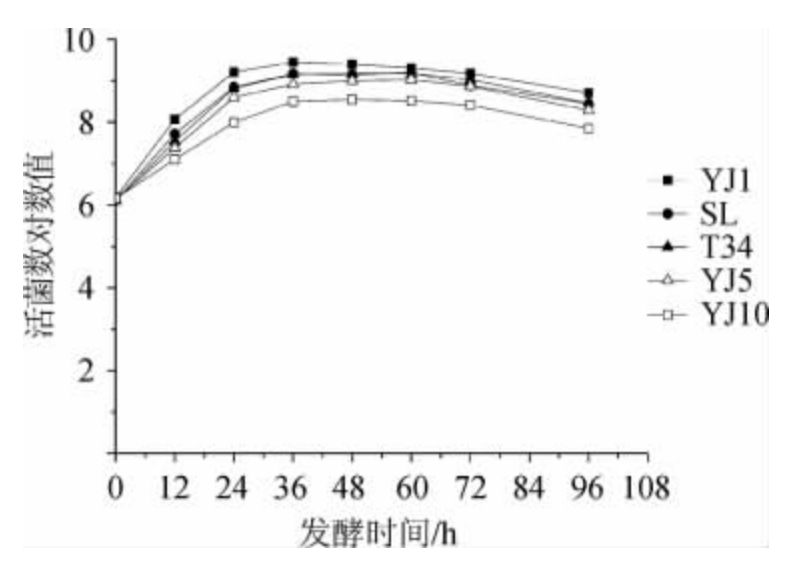
图1 不同乳酸菌株在红树莓汁中的生长能力
Fig.1 Growth capacity of lactic acid bacteria in red raspberry juice
2.2 发酵前后红树莓汁成分的变化
按4%接种量将副干酪乳杆菌YJ1接入红树莓汁中,37℃厌氧发酵60 h。发酵结束后,测定发酵红树莓汁的总黄酮、总酚、可滴定酸和有机酸含量,结果见表5。
由表5可知,经过乳酸菌发酵,树莓汁中总黄酮和总酚含量都有了极显著的增加(P<0.01),其中总黄酮含量增加了23%,总酚含量增加了18.58%,这与冉玉兵等[20]的结果一致,其原因可能与发酵过程中乳酸菌的生物降解作用或酸水解反应将聚合酚类物质转化成更多简单酚类物质有关,或可能由于发酵过程中产生的微生物酶类(如葡糖甘酶、淀粉酶),分解植物细胞壁或淀粉,进而促进了多酚类物质的释放;然而,常曼曼等[8]发现,与红树莓原汁相比,乳酸菌发酵后的树莓汁总酚含量和总黄酮含量显著下降,其原因可能与使用的原料及乳酸菌种有关。从表5还可发现,与发酵前的红树莓原汁相比,发酵后的树莓汁总酸极显著增加(P<0.01),这是由于乳酸菌在树莓汁中生长产酸的缘故。红树莓果实的主要有机酸为柠檬酸、苹果酸、富马酸等。经过乳酸菌发酵,柠檬酸和苹果酸含量减少,特别是柠檬酸含量降低了35.54%,而乳酸、乙酸、酒石酸和富马酸含量增加,其中乳酸含量的增加量最大,达到了27.04 g/L。乳酸的酸味柔和,有后酸味,乳酸含量的增加使得红树莓汁口感更加柔和。
表5 发酵前后红树莓汁成分对比
Table 5 Comparison of components in red raspberry juice before and after fermentation

注:“-”表示未检出。“**”表示差异极显著(P<0.01)。下同。
2.3 发酵红树莓汁的抗氧化活性
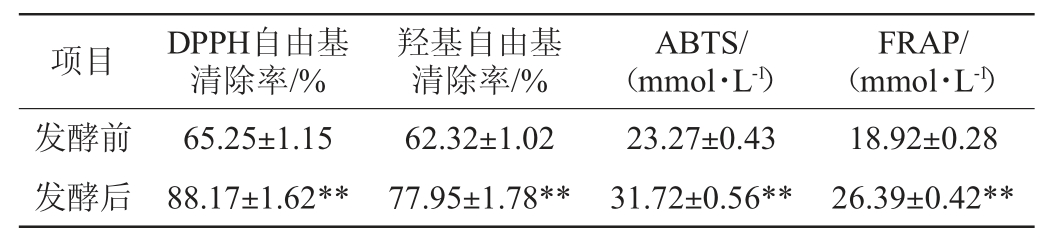
将副干酪乳杆菌YJ1接入红树莓汁中,37 ℃厌氧发酵60 h,发酵结束后测定红树莓汁的抗氧化活性,结果见表6。由表6可知,与未发酵的红树莓汁相比,发酵后红树莓汁清除DPPH、羟基自由基的能力有了明显改善,其DPPH清除能力提高了22.92%,羟基自由基清除能力提高了15.63%。发酵后红树莓汁ABTS总抗氧化能力从23.27 mmol/L增加至31.72 mmol/L,增加了36.31%;发酵后红树莓汁FRAP总抗氧化能力从18.92 mmol/L增加至26.39 mmol/L,增加了39.48%。结果表明,乳酸菌发酵提高了红树莓汁的抗氧化活性。造成这种结果的原因,可能与乳酸菌发酵后树莓汁中总黄酮和总酚含量显著增加(见表5)有关。
表6 发酵红树莓汁的抗氧化活性
Table 6 Antioxidant activity of fermented red raspberry juice
3 结论
从抗氧化活性、胃肠道环境耐受性、抑菌性能及红树莓汁中生长能力四个方面对12株乳酸菌进行了综合评价筛选,从中筛选出1株优良乳酸菌株,即副干酪乳杆菌(Lactobacillus paracasei)YJ1。采用副干酪乳杆菌YJ1发酵红树莓汁,发现经过乳酸菌发酵的红树莓汁中总黄酮、总酚含量分别增加了23%、18.58%。发酵后红树莓汁总酸也极显著增加(P<0.01),其中增加的有机酸主要是乳酸。与未发酵的红树莓原汁相比,发酵后的红树莓汁体外抗氧化活性显著提高(P<0.01),其DPPH和羟基自由基清除能力分别提高了22.92%、15.63%;ABTS和FRAP总抗氧化能力分别增加了36.31%、39.48%。结果表明,乳酸菌发酵红树莓汁具有一定的抗氧化活性。
[1]云月英,徐娟,张小利.4 株乳酸菌对模拟胃肠环境的耐受性及生长特性研究[J].中国酿造,2018,37(3):53-56.
[2]赖婷,刘汉伟,张名位,等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展[J].中国酿造,2015,34(3):1-4.
[3]任婷婷,岳田利,魏欣,等.益生菌发酵苹果浆工艺优化及发酵前后挥发性风味成分分析[J].食品科学,2019,40(8):87-93.
[4]FILANNINO P,BAI Y,CAGNO R D,et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherry juice and broccoli puree[J].Food Microbial,2015,46(4):272-279.
[5]ANKOLEKAR C,PINTO M,GREENE D,et al. In vitro bioassay based screening of antihyperglycemia and antihypertensive activities of Lactobacillus acidophilus fermented pear juice[J].Innov Food Sci and Emerg,2012,13(1):221-230.
[6]崔珊珊,毕凯媛,吴杰,等.响应面法优化树莓鞣花酸提取工艺及其体外抗氧化活性[J].食品工业科技,2019,40(1):149-155.
[7]旷慧,王金玲,姚丽敏,等.6 种东北地区红树莓果渣提取物的抗氧化活性差异[J].食品科学,2016,37(1):63-68.
[8]常曼曼,李颖,阴芳冉,等.保加利亚乳杆菌LB-DR 发酵红树莓汁的特性及代谢产物研究[J].林业与生态科学,2018,33(4):408-414.
[9]李晓军,马跃英,龚虹,等.具高抗氧化能力乳酸菌菌株的筛选与鉴定[J].中国微生态学杂志,2018,30(6):663-666.
[10]陈漪汶,方若楠,朱剑锋,等.5 种乳酸菌及其灭活态体外抗氧化能力的比较研究[J].食品工业科技,2019,40(11):85-90.
[11]赵芳,李艳琴,李彬春.模拟人体胃肠道环境筛选益生乳杆菌[J].微生物学通报,2016,43(6):1396-1403.
[12]中华人民共和国卫生部.GB 4789.2—2010 食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2010.
[13]李杨.植物乳杆菌对低剂量单甘油月桂酸酯诱导的小鼠增重的缓解作用及机理研究[D].杭州:浙江大学,2019.
[14]刘艳芳,杨焱,贾薇,等.药用真菌桑黄总黄酮测定方法研究[J].食用菌学报,2006,13(2):45-48.
[15]胡君萍,杨建华,王新玲,等.新疆沙枣果实不同部位总酚的含量测定[J].食品科学,2010,31(6):220-222.
[16]中华人民共和国国家质量监督检验检疫总局.GB/T 12456—2008 食品中总酸的测定[S].北京:中国标准出版社,2009.
[17]旷慧,李亮亮,吕长山,等.RP-HPLC 法测定东北地区6 种红树莓果实中有机酸组成[J].食品科学,2016,37(22):126-130.
[18]DEVASAGAYAM T P A,TILAK J C,BOLOOR K K,et al.Free radicals and antioxidants in human health:current status and future prospects[J].Assoc Physicians India,2004,52(10):794-803.
[19]林祥娜,夏永军,王光强,等.抗氧化活性乳酸菌的筛选[J].中国食品学报,2017,17(6):103-109.
[20]冉玉兵,刘磊,张名位,等.乳酸菌发酵对龙眼果浆中糖和酚类物质的影响[J].现代食品科技,2017,33(8):116-122.