白酒发酵是一个独特复杂的边糖化和边发酵过程,而酒曲是白酒酿造必不可少的糖化、发酵和生香剂[1]。传统的酒曲制作是一种在开放环境中自然固态发酵过程,可以从环境和原料中富集、网络各种微生物形成复杂的微生物菌群,同时产生重要的酶类(如淀粉酶、糖化酶、蛋白酶等),并且酒曲中所网罗的菌种丰度、协调性及在制曲过程形成的风味前驱物质,是酒体质量和产量的重要保障[2-5]。因此,酒曲成为酿酒品控的核心指标之一。酒曲根据培养达到的顶温可分为低温酒曲(40~50 ℃)、中温酒曲(50~60 ℃)和高温酒曲(60~70 ℃);根据产酒的风味主要分为清香、浓香和酱香型酒曲;根据形状可分为大曲、小曲和麸曲[6]。绿衣观音土曲(简介土曲)又名“绿衣小曲”、“绿曲”、“南曲”,是清香型白酒小曲曲种之一,被广泛应用在湖北、湖南、江西等地[7]。绿衣观音土曲是以观音土、米粉、米糠为主要原料,接入曲种通过加水拌料,制成坯,入箱进行微生物培育,开箱后转入培养室进行一至七烧共7轮培养,然后烘干而成。
近几年,关于酒曲微生物多样性、风味特征方面的研究较多。YAN S B等[8]研究发现,浓香型酒曲中含有14个种属的酵母和43种风味物质,且优势菌为库德里阿兹威毕赤酵母(Pichia kudriavzevii)和Saturnispora silvae;ZOU W等[9]综述了浓香型酒曲微生物多样性,阐明了细菌类芽孢菌属(Bacillus)、乳杆菌属(Lactobacillus)和高温放线菌属(Thermoactinomyces)是优势菌,酵母菌主要有酵母属(Saccharomyces)、复膜孢酵母属(Saccharomycopsis)、毕赤酵母属(Pichia)、威克汉姆酵母属(Wickerhamomyces)、有孢汉逊酵母属(Hanseniaspora)、伊萨酵母属(Issatchenkia)、丝孢酵母属(Trichosporon)、德巴利酵母属(Debaryomyces)和锁掷酵母属(Sporidiobolus),霉菌主要有曲霉属(Aspergillus)、横梗霉属(Lichtheimia)、嗜热真菌属(Thermomyces)、热子囊菌属(Thermoascus)、犁头霉属(Absidia)和地霉属(Geotrichum);JIN Y等[10]研究发现,酱香型大曲中芽孢杆菌目(Bacillales)、肠杆菌目(Enterobacteriales)和乳杆菌目(Lactobacillales)是优势细菌,而真菌中假丝酵母属(Candida)、木霉属(Trichoderma)、曲霉属(Aspergillus)、丝孢酵母属(Trichosporon)和嗜热真菌属(Thermomyces)占主导地位,且建立了酱香型酒曲微生物代谢图谱;FAN G S等[11]研究发现,老化有助于丰富和稳定清香型大曲中的微生物种群,使微生物之间的相互作用重新平衡,对提高大曲质量和确保其稳定性具有重要意义;LIU J J等[6]研究表明,中低温大曲如浓香型和清香型酒曲中淀粉酶活性和多样性最高,蛋白酶在高温大曲如酱香型酒曲中起主导作用,而酯酶对浓香酒曲和酱香酒曲风味的贡献度相似;申孟林等[12]概述了大曲微生物分类以及大曲中主要酶系的功能及作用。
目前的研究主要集中于对大曲微生物、酶活、风味物质的研究,而对清香型小曲研究较少,特别是对制曲过程中微生物及酶活的动态变化研究甚少。本研究选取8个批次观音土曲培养过程为研究对象,了解制曲过程中(包括从曲种到成品曲出库)微生物的种类、数量、消长变化及相关酶活(糖化酶、α-淀粉酶和酸性蛋白酶)变化,为监控观音土曲质量、减少酒曲质量的波动,提供更深层次、更本质的指标。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
绿衣观音土曲样品由劲牌有限公司传统模式制曲车间提供,分别于2018年9月、10月和11月对绿衣观音土曲培养过程中(曲种、入箱、一烧、二烧、三烧、四烧、五烧、六烧和七烧)样品进行采集,共采集8个批次,分别为0921、0927、1011、1019、1027、1103、1111、1122批次。
1.1.2 主要试剂
蛋白胨、酵母粉、葡萄糖、琼脂粉(均为生化试剂)、吐温20、磷酸二氢钾、七水硫酸镁、柠檬酸二胺、乙二胺四乙酸、乙酸、三羟甲基氨基甲烷(均为分析纯):国药集团化学试剂有限公司;琼脂糖(分析纯):北京索莱宝科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)Mixer:赛默飞世尔科技(中国)有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母粉10 g/L,琼脂粉20 g/L,pH自然,115 ℃灭菌15 min。
改良马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[7]:在原有PDA培养基中添加牛肉膏2 g/L,酵母粉2 g/L,磷酸二氢钾2.5 g/L,吐温20 1.5 g/L,121 ℃灭菌20 min。
WL营养琼脂培养基[7]:储液A(磷酸二氢钾5.5 g,氯化钾4.25 g,氯化钙1.25 g,硫酸镁1.25 g,蒸馏水定容至400 mL)40 mL/L、储液B(氯化铁0.25 g,硫酸锰0.25 g,蒸馏水定容至100 mL)1 mL/L、储液C(0.44 g溴甲酚绿溶于10 mL蒸馏水和10 mL酒精中)1 mL/L、酵母浸粉40 g/L,蛋白胨50 g/L,葡萄糖50 g/L,琼脂2 g/L,pH 6.5,115 ℃灭菌15 min。
MRS培养基:蛋白胨10g/L,牛肉浸膏10g/L,酵母粉5g/L,葡萄糖5 g/L,乙酸钠5 g/L,柠檬酸二胺2 g/L,吐温80 1 g/L,七水硫酸镁0.2 g/L,七水硫酸锰0.05 g/L,磷酸氢二钾2 g/L,琼脂20 g/L,pH 6.8,121 ℃灭菌20 min。
牛肉膏蛋白胨培养基:牛肉浸膏3.0 g/L,蛋白胨10 g/L,NaCl 5.0 g/L,琼脂20 g/L,pH自然,121 ℃灭菌20 min。
孟加拉红培养基:蛋白胨5 g/L,葡萄糖10 g/L,磷酸二氢钾1 g/L,七水硫酸镁0.5 g/L,孟加拉红0.033 g/L,琼脂20 g/L,氯霉素0.1 g/L,121 ℃灭菌20 min。
察氏培养基:硝酸钠3 g/L,磷酸氢二钾1 g/L,七水硫酸镁0.5 g/L,氯化钾0.5 g/L,硫酸亚铁0.01 g/L,蔗糖30 g/L,琼脂20 g/L,121 ℃灭菌20 min。
其中YPD培养基、改良PDA培养基和WL营养琼脂培养基分别添加5‰的青霉素,MRS培养基和牛肉膏蛋白胨培养基添加15‰链霉素。
1.2 仪器与设备
JJ1000电子天平:常熟双杰测试仪器厂;QYC-200全温空气摇床:上海福玛实验设备有限公司;SFG-02B电热恒温鼓风干燥箱:上海精宏实验设备仪器厂;AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;SPX-100B-Z生化培养箱:上海博讯实业有限公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;Nikon ECLIPSE E200LED MV Series显微镜:日本Nikon公司;2720聚合酶链式反应(polymerase chain reaction,PCR)仪:美国赛默飞公司;DYY-L电泳仪:北京六一生物科技有限公司;ZF-288全自动凝胶成像分析系统:上海嘉鹏科技有限公司。
1.3 实验方法
1.3.1 观音土曲制作过程中微生物平板计数及分离纯化
分别称取观音土曲培养过程中(曲种、入箱、一烧~七烧)样品10 g于装有100 mL无菌水的三角瓶中,150 r/min振荡30 min后,吸取1 mL作梯度稀释,选取合适的稀释悬液涂布于计数培养基中,酵母总数计数采用YPD培养基,霉菌采用改良PDA培养基,细菌采用MRS培养基。涂布完毕后酵母和霉菌置于30 ℃培养箱中倒置培养3~5 d,细菌置于37 ℃培养箱中倒置培养2~3 d。采用菌落记号方式对培养基上长出的单菌落进行统计,根据菌落形态不同将平板上长出的单菌落划线接种于新的培养基中培养,经过2~3次平板划线后得到纯化的菌落转入相应的试管斜面于冰箱中保存。
1.3.2 菌株的鉴定
菌株的形态观察和分子生物学鉴定方法见参考文献[13]。
1.3.3 观音土曲制作过程中酶活的测定
酸性蛋白酶酶活测定采用福林-酚法,具体方法见SB/T 10317—1999《蛋白酶活力测定法》;糖化酶酶活采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[14];α-淀粉酶酶活采用Yoo改良法,具体见文献[15]。
2 结果与分析
2.1 观音土曲制作过程中微生物变化情况
2.1.1 酵母菌
观音土曲制作过程中酵母菌菌落总数的变化见图1。由图1可知,观音土曲制作过程中酵母菌落总数呈逐步上升趋势,三烧过后酵母总数上升较快。经过富集培养,酵母总数由开始曲种的107 CFU/g上升至四烧后的108 CFU/g,且在五烧~七烧时数量达到峰值。不同批次四烧前酵母数量差别不明显,四烧过后,11月份制作的观音土曲中酵母总数高于9、10月份制作的观音土曲。通过观察酵母形态发现,曲种时以酿酒酵母(Saccharomyces cerevisiae)为主,随着酒曲的培养,从环境和原料中网罗和富集越来越多的非酿酒酵母(non-Saccharomyces),培养至二烧时非酿酒酵母的数量高于酿酒酵母。
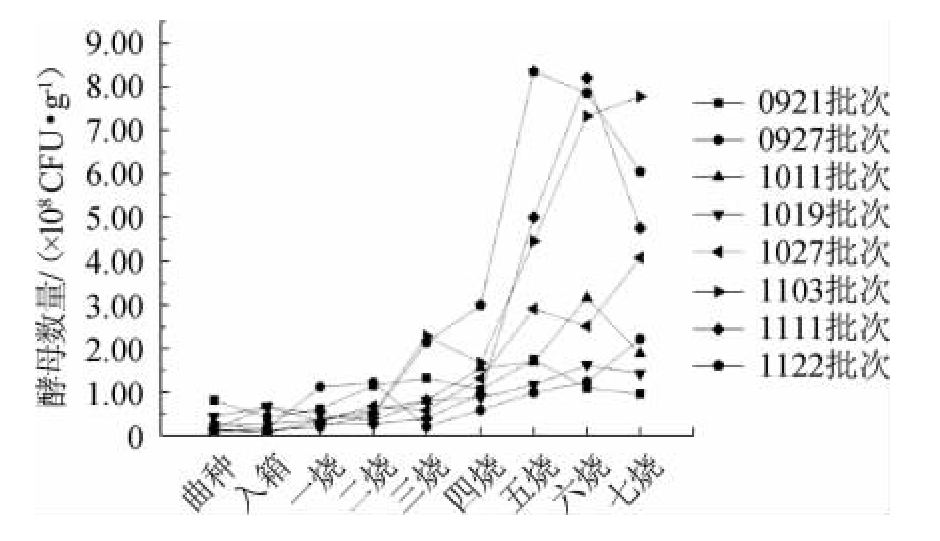
图1 不同批次绿衣观音土曲制作过程中酵母菌总数的动态变化
Fig.1 Dynamic change of total yeast count in the cultivation of different batches of Green-covering Guanyin Tuqu
采用不同的培养基(①YPD培养基;②盐酸调YPD培养基pH至3.5,不灭菌,添加7%乙醇;③乳酸调YPD培养基pH至3.5,不灭菌;④WL营养琼脂培养基)筛选观音土曲制备过程中的酵母菌,根据菌落形态和颜色不同,共分离出8种不同种类的酵母,其菌落形态及描述见图2及表1。

图2 8株酵母菌的菌落形态
Fig.2 Colony morphology of 8 strains of yeast
表1 8株酵母菌的菌落及细胞形态特征的描述
Table 1 Description of colony and cell morphology characteristics of 8 strains of yeast

由图2及表1可知,大部分酵母菌菌落呈圆形突起且颜色为白色,少数扁平,且表面不光滑的较多,有几株酵母菌落较大。
8株分离的酵母菌株的系统发育树见图3,鉴定结果见表2。

图3 基于18S rRNA序列8株酵母菌的系统发育树
Fig.3 Phylogenetic tree of 8 strains of yeast based on 18S rRNA sequences
表2 8株酵母菌的鉴定结果
Table 2 Identification results of 8 strains of yeast

由图3及表2可知,分离的酵母菌主要是酿酒微生物,如酿酒酵母、异常威克汉姆酵母、库德里阿兹威毕赤酵母等,这些是主要的酿酒酵母和生香酵母[16-18],其中库德里阿兹威毕赤酵母酿酒中的生香酵母,广泛应用于发酵食品中,具有作为益生菌和代谢产生物乙醇的潜力[19-20]。溶磷白地霉广泛应用于乳制品和酒精饮料行业中,同时也具有生物降解功能,也在酱香型白酒酒醅中分离过[21-22]。阿氏丝孢酵母普遍存在于低温曲中,与酿酒酵母在高糖环境下混合发酵可有效降低酒中挥发性酸和乙醛的含量,同时该菌具有发酵产酯和产β-葡萄糖苷酶功能[20,23]。伯顿丝孢毕赤酵母则于高温大曲中比较常见,具有淀粉酶活力和产香功能[24]。扣囊复膜孢酵母是大曲上霉的主要微生物,除高温大曲中未发现外,均存在其余酒曲中,能够表达生淀粉液化酶和糖化酶,被认为是产生淀粉分解酶类的最好的子囊酵母菌之一,同时具有产酯能力[1,25]。
2.1.2 霉菌
采用改良PDA培养基跟踪绿衣观音土曲制备过程中霉菌总数的变化见图4。
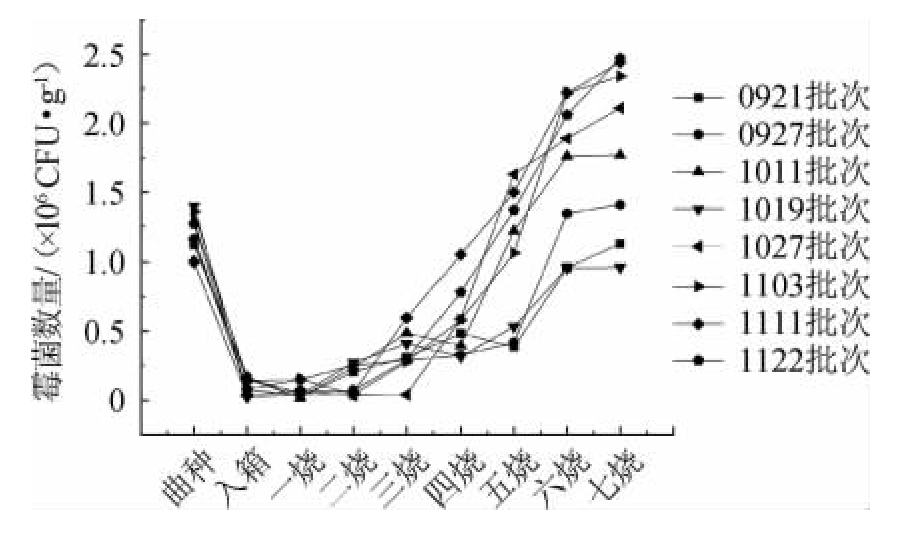
图4 不同批次绿衣观音土曲制作过程中霉母菌总数的动态变化
Fig.4 Dynamic change of total mold count in the cultivation of different batches of Green-covering Guanyin Tuqu
由图4可知,霉菌的数量低于酵母和细菌,变化趋势与酵母相近,不同批次三烧前霉母数量差别不明显,三烧过后霉菌开始迅速增长,且11月份制作的观音土曲中霉菌总数高于9、10月份制作的观音土曲。通过形态观察发现,米根霉在一烧和二烧时未检测到,三烧过后数量明显增加,曲种和七烧时米根霉数量为106 CFU/g;曲霉在二烧时开始出现,数量在六烧或七烧时数量最多,为106 CFU/g。
在改良PDA培养基分离的基础上,进一步采用了YPD琼脂培养基、孟加拉红琼脂培养基和察式培养基对绿衣观音土曲制备过程中霉菌进行了分离纯化,并根据霉菌菌落形态和颜色区别,共分离出7种不同种属霉菌,其菌落形态及描述见图5和表3,系统发育树见图6,鉴定结果见表3。

图5 7株霉菌的菌落形态
Fig.5 Colony morphology of 7 strains of mold
表3 7株霉菌菌落及细胞形态特征的描述
Table 3 Description of colony and cell morphology characteristics of 7 strains of mold

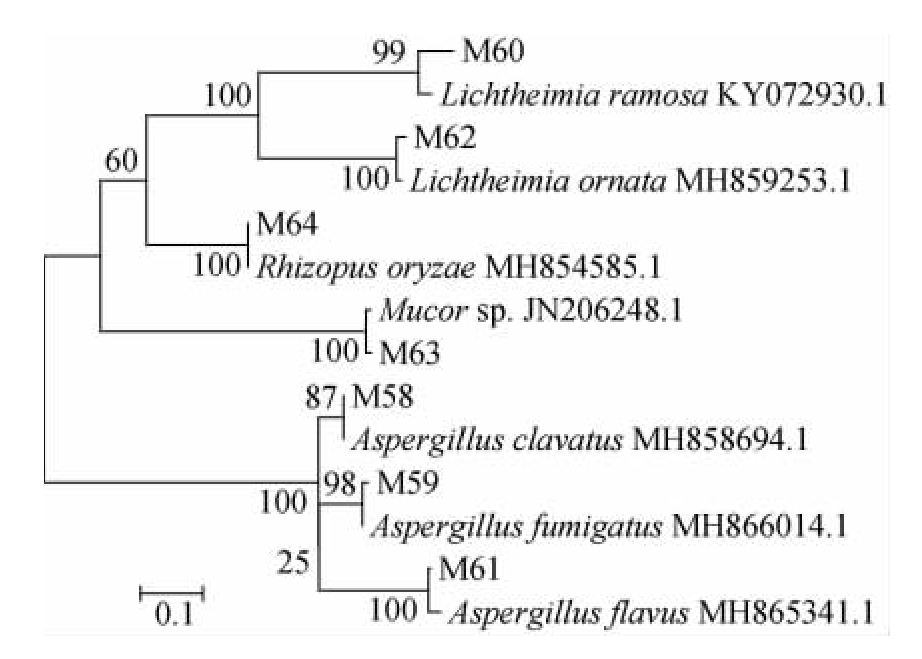
图6 基于ITS rRNA序列7株霉菌的系统发育树
Fig.6 Phylogenetic tree of 7 strains of mold based on ITS rRNA sequences
表4 7株霉菌的鉴定结果
Table 4 Identification results of 7 strains of mold

由图5、图6及表3、表4可知,从绿衣观音土曲中分离出的霉菌有曲霉属、根霉属、毛霉属和横梗霉属,大多数种属霉菌在其他香型白酒中均报道过[26-28]。其中,米根霉和棒曲霉是清香型小曲白酒优势霉菌[7]。米根霉是主要的糖化微生物,具有较高的糖化力和液化力,能糖化淀粉、转化蔗糖,产生乳酸、反丁烯二酸及微量酒精,产L(+)-乳酸能力强[7,13],对白酒风味有贡献作用[29]。棒曲霉同样也具有一定的糖化酶和蛋白酶活性[7]。多枝横梗霉具有高产酯酶活性,是中低温大曲的优势菌[30-31]。黄曲霉具有较强的液化力和蛋白分解力,可用于产生淀粉酶、蛋白酶和磷酸二酯酶等,也是酿造工业中的常见菌种[30]。烟曲霉是自然界中广泛分布的人类条件致病菌,是导致侵染性曲霉病的主要原因,且产果胶酶分解纤维素等[32]。毛霉属常出现在酒曲中,能糖化淀粉并能生成少量乙醇,产生蛋白酶,有分解大豆蛋白的能力,我国多用来做豆腐乳、豆豉[33]。
2.1.3 细菌
绿衣观音土曲制作过程中细菌总数的变化见图7。
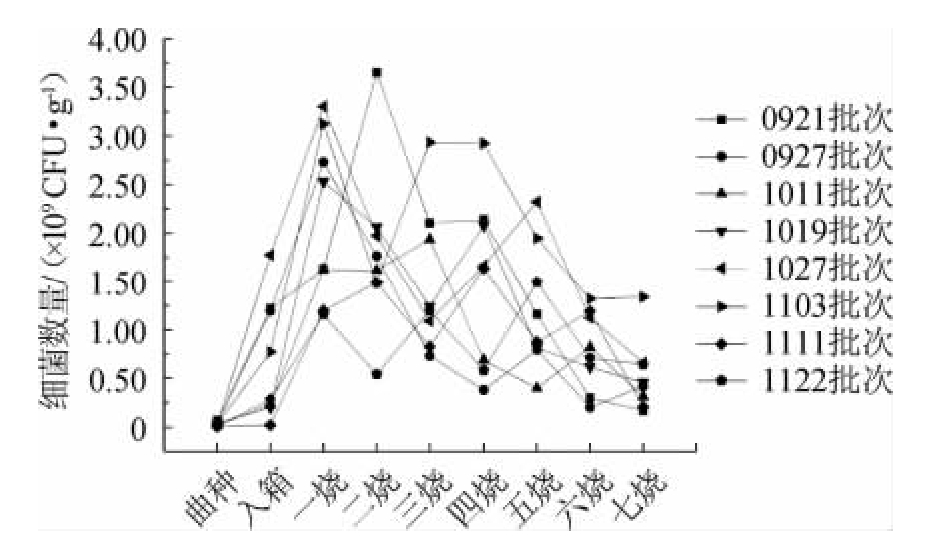
图7 不同批次绿衣观音土曲制作过程中细菌总数的动态变化
Fig.7 Dynamic change of total bacteria count in the cultivation of different batches of Green-covering Guanyin Tuqu
由图7可知,绿衣观音土曲中的细菌总数呈先上升后下降的趋势,峰值在一烧至三烧时出现,细菌数量为109CFU/g,七烧时细菌数量降至108 CFU/g。入箱至三烧时数量增加最快,而此时期酵母数量变化缓慢。三烧过后,细菌数量下降,酵母数量开始明显增加,这是由于两大类微生物对营养物质的竞争所导致的。
采用牛肉膏蛋白胨培养基和MRS培养基从绿衣观音土曲制备过程中分离纯化出好氧细菌9株和乳酸菌5种,具体菌落形态及描述见图8和表5,系统发育树见图9,鉴定结果见表6。

图8 细菌的菌落形态
Fig.8 Colony morphology of bacteria
表5 14株细菌菌落及细胞形态特征的描述
Table 5 Description of colony and cell morphology characteristics of 14 strains of bacteria
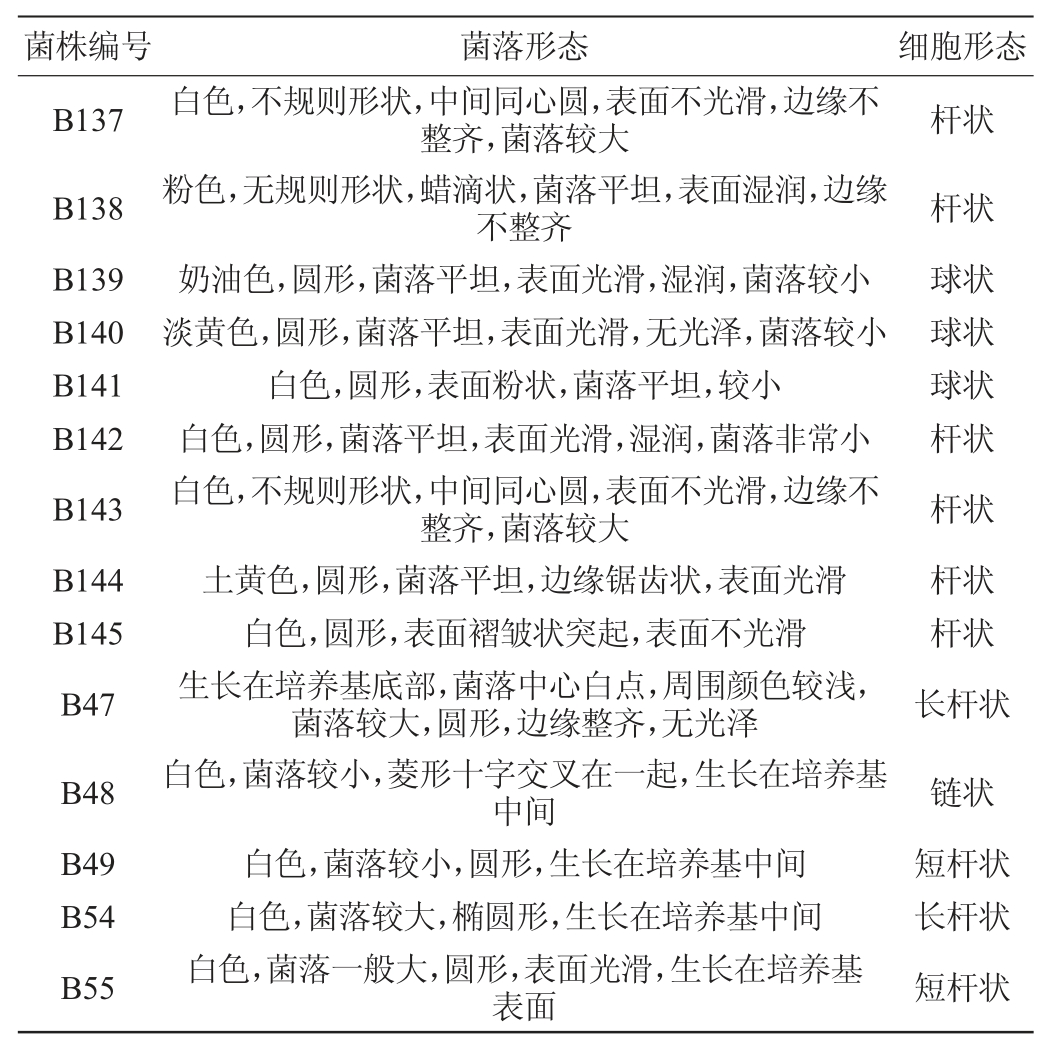
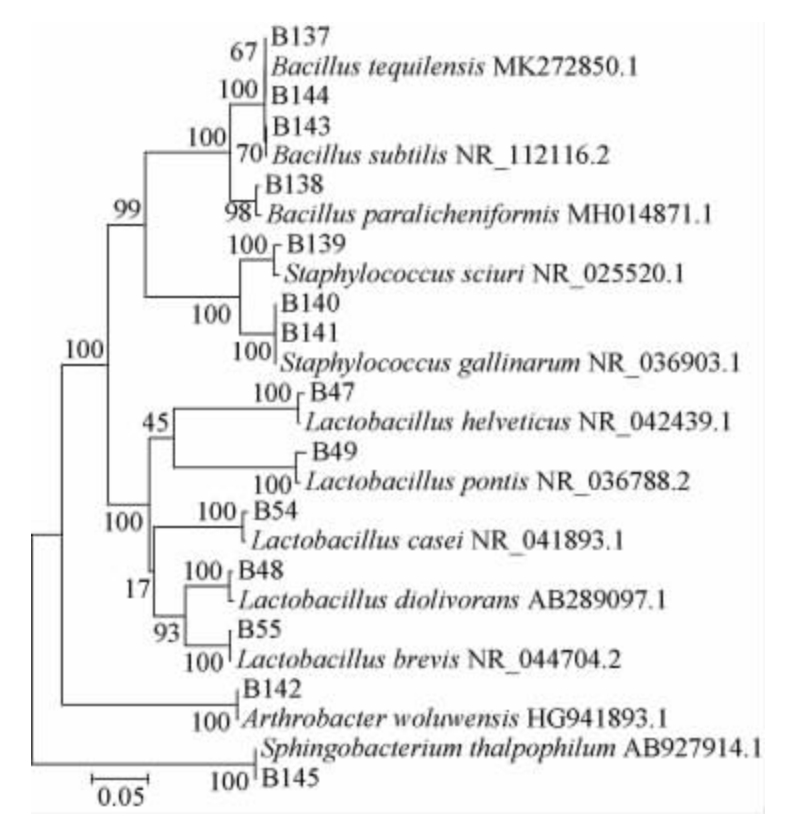
图9 基于16S rRNA序列细菌的系统发育树
Fig.9 Phylogenetic tree of bacteria based on 16S rRNA sequences
表6 14株细菌的鉴定结果
Table 6 Identification results of 14 strains of bacteria

由图8、图9及表5、表6可知,分离获得的细菌以芽孢杆菌和乳杆菌为主,其中芽孢杆菌是我国白酒酿造重要功能微生物,可水解蛋白质和淀粉等大分子物质,产丁酸及己酸等有机酸,有的还代谢产生吡嗪类等芳香物质,该属细菌为白酒发酵过程中重要的产酸和产香菌。如地衣芽孢杆菌和枯草芽孢杆菌是酱香大曲重要的产酱香的功能细菌,可以产蛋白酶和风味物质[33-34]。而特基拉芽孢杆菌产蛋白酶,产β-1,3-1,4-葡聚糖酶[35-36]。类地衣芽孢杆菌产抗性活性物质,酿酒中产风味物质;可以分解氨基甲酸乙酯[37-38]。乳酸菌几乎存在于所有的酒曲中,是白酒发酵中的主要生酸微生物,乳酸和乳酸乙酯是各种种类和香型的白酒必不可少的风味成分。同时有些种属乳酸菌还可以代谢产生苹果酸、双乙酰等副产物,对白酒风格形成也有一定影响。因此,传统研究认为乳酸菌是白酒酿造必不可缺少的微生物。其中瑞士乳杆菌具有较强的蛋白水解活性,其发酵乳制品中多肽含量较高,因此具有潜在产生生物活性肽的能力;具有缓解高血压、维持肠道菌群平衡、促进钙吸收、改善睡眠等功能,被用作保健品制成微生态制剂[39]。干酪乳杆菌作为益生菌之一被用作牛奶、酸乳、豆奶、奶油和干酪等乳制品的发酵剂及辅助发酵剂[39],短乳杆菌具有高产酸能力和解毒、抑菌、提高机体免疫力等多种功能特性,广泛应用于食品和医药行业[39]。还有些一些细菌,并没有发现在酿造过程中的作用,可能是杂菌,如松鼠葡萄球菌和节杆菌是致病菌[40-43],而鸡葡萄球菌则属于非致病菌[44]。嗜温鞘氨醇杆菌产絮凝剂,降解石油[45-46],可能这些菌来自环境中。
2.2 观音土曲制作过程中酶活变化情况
在酒曲的制作以及贮存的过程中,大曲中的微生物会代谢产生一系列的水解酶,如酸性蛋白酶、糖化酶、纤维素酶等。这些水解酶会将原料中大分子物质降解成为小分子物质供微生物生长利用,从而产生一些代谢产物是白酒中香味物质或者为香味物质提供前体物质[47-48]。有研究表明,α-淀粉酶和蛋白酶主要是由细菌和霉菌产生,而糖化酶主要是由根霉、黑曲霉等霉菌产生[49-51]。绿衣观音土曲制作过程中酶活变化情况见图10。

图10 不同批次绿衣观音土曲制作过程中糖化酶(a)、α-淀粉酶(b)及酸性蛋白酶(c)酶活变化
Fig.10 Changes of saccharifying enzyme (a),α-amylase (b) and acid proteinase activity (c) in the cultivation of different batches of Green-covering Guanyin Tuqu
由图10可知,曲种糖化酶活力和α-淀粉酶活力最高,分别为3 000~6 000 U/g、300~600 U/g。分析原因可能是曲种作为绿衣观音土曲生产的种子,其中含有一定比例强化的纯种根霉。入箱培养后,糖化酶和α-淀粉酶呈逐渐上升的趋势,均在五烧至七烧时酶活最高,七烧时糖化酶酶活为300~1 000 U/g,α-淀粉酶酶活为100~200 U/g。从微生物跟踪检测结果来看,曲种时米根霉数量最多,其次是五烧至七烧阶段,而米根霉是产生糖化酶的主要微生物,这也是曲种的糖化酶酶活最高,五烧至七烧糖化酶酶活其次的原因。
相比糖化酶和α-淀粉酶,绿衣观音土曲中酸性蛋白酶酶活较低,最高不超过50 U/g。曲种时酸性蛋白酶酶活最高,为10~50 U/g;入箱培养后,酸性蛋白酶酶活呈上升趋势,六烧或七烧时酶活达到峰值,为5~50 U/g。有文献报道,酱香型酒曲蛋白酶酶活最高,其次是浓香型酒曲,清香型酒曲酸性蛋白酶酶活最低[6],说明酸性蛋白酶不是绿衣观音土曲中主要的酶。
3 结论
绿衣观音土曲制作培养过程中酵母总数呈逐步上升趋势,三烧后酵母总数上升较快,且在五烧至七烧时数量达到峰值;细菌总数呈先上升和下降的趋势,峰值在一烧至三烧时出现,数量为109 CFU/g,七烧时细菌数量降至108 CFU/g;霉菌的数量低于酵母和细菌。不同批次三烧前霉母数量差别不明显,三烧过后霉菌开始迅速增长,在七烧时候达到最大(106 CFU/g),且11月份制作的观音土曲中霉菌总数高于9、10月份制作的观音土曲。
通过形态观察,共分离出8种酵母,经鉴定分别为酿酒酵母(Saccharomyces cerevisiae)、异常威克汉姆酵母(Wickerhamomyces anomalus)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、阿氏丝孢酵母(Trichosporon asahii)、Apiotrichum loubieri、伯顿丝孢毕赤酵母(Hyphopichia burtonii)扣囊复膜孢酵母(Saccharomycopsis fibuligera)和溶磷白地霉(Galactomyces geotrichum);7种霉菌主要为曲霉属(Aspergillus)、米根霉(Rhizopus oryzae)、毛霉(Mucor)和横梗霉属(Lichtheimia),其中米根霉是主要的糖化菌株;9种好氧细菌和5种乳酸菌,以芽孢杆菌和乳杆菌为主,分别是枯草芽孢杆菌(Bacillus subtilis)、特基拉芽孢杆菌(Bacillus tequilensis)、类地衣芽孢杆菌(Bacillus paralicheniformis)、鸡葡萄球菌(Staphylococcus gallinarum)和瑞士乳杆菌(Lactobacillus helveticus)、短乳杆菌(Lactobacillus brevis)等。
绿衣观音土曲培养过程中糖化酶酶活最高,其次是α-淀粉酶,酸性蛋白酶酶活最低,且曲种中3种酶活力最高,入箱培养后3种酶活均呈整体上升趋势。
本研究揭示了绿衣观音土曲微生物及酶活的动态变化,为微生物及观音土曲在白酒酿造中的功能作用解析及定向调控提供技术支撑,对提升清香型小曲白酒生产品质具有重要意义。
[1]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[2]SOCCOL C R,COSTA E S F,LETTI L A J,et al.Recent developments and innovations in solid state fermentation[J].Biotechnol Res Innovat,2017,1(1):52-71.
[3]DU H,WANG X S,ZHANG Y H,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[4]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[5]ZHENG X W,HAN B Z.Baijiu,Chinese liquor:History,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[6]LIU J J,CHEN J Y,FAN Y,et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Soc Chem Ind,2018,98(1):113-121.
[7]李锐利,方尚玲,陈茂彬.等.绿衣观音土曲中霉菌糖化酶活力的研究[J].中国酿造,2010,29(1):50-52.
[8]YAN S B,TONG Q Q,GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2019,106:57-63.
[9]ZOU W,ZHAO C Q,LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Front Microbiol,2018,9:671.
[10]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[11]FAN G S,FU Z L,SUN B G,et al.Roles of aging in the production of light-flavored Daqu[J].J Biosci Bioeng,2019,127(3):309-317.
[12]申孟林,张超,王玉霞.等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[13]陈申习,唐洁,张龙.等.清香型小曲白酒机械化生产中微生物动态变化研究[J].中国酿造,2018,37(6):68-72.
[14]郝萍萍,吴发萍,张文学,等.三种米曲霉糖化酶活及其红薯酒质量指标分析[J].中国酿造,2012,31(5):35-37.
[15]YOO Y T,HONG J,HATCH R T.Comparson of α-amylase activitie from different assay methods[J].Biotechnol Bioeng,1987,30:147-151.
[16]PASSONTH V,FREDLUND E,DRUVEFORS U Ä,et al.Biotechnology,physiology and genetics of the yeast Pichia anomala[J].Fems Yeast Res,2006,6(1):3-13.
[17]WALKER G M.Pichia anomala:cell physiology and biotechnology relative to other yeasts[J].Anton Leeuw Int J G,2011,99(1):25-34.
[18]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学报,2012,39(7):921-930.
[19]ALEXANDER P D,BENJAMIN O,STEPHANIE B G,et al.Population genomics shows no distinction between pathogenic Candida krusei and environmental Pichia kudriavzevii:One species,four names[J].Plos Pathogens,2018,14(7):e1007138.
[20]NAOTO I,HIROKA H,ATSUKO U,et al.A comparative study of ethanol production by Issatchenkia orientalis strains under stress conditions[J].J Biosci Bioeng,2012,13(1):76-78.
[21]GRYGIER A,MYSZKA K,RUDZINSHA M.Galactomyces geotrichummoulds from dairy products with high biotechnological potential[J].Acta Sci Pol Technol Aliment,2017,16(1):5-16.
[22]邵明凯,王海燕,徐岩.等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[23]王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[24]王晓丹,陈美竹,班世栋.等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[25]CHI Z M,CHI Z,LIU G L,et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnol Adv,2009,27:423-431.
[26]徐佳,邱树毅,胡宝东.等.酱香型白酒酿造过程中霉菌的功能性研究[J].酿酒,2015,42(5):32-38.
[27]管健,廖蓓,李兆飞.等.白酒功能菌的功能特性及应用研究[J].中国酿造,2017,36(8):1-5.
[28]高传强,阳飞,张华山.芝麻香型白酒微生物菌群及风味物质研究进展[J].微生物学通报,2017,44(4):940-948.
[29]LONDOÑO-HERNÁNDEZ L,RAMÍREZ-TORO C,RUIZ H A,et al.Rhizopus oryzae-ancient microbial resource with importance in modern food industry[J].Int J Food Microbiol,2017,257:110-127.
[30]ZHENG X W,YAN Z,NOUT M J.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microbiol Biotechnol,2015,31(1):199-208.
[31]应静,游玲,邱树毅,等.温度对浓香型白酒发酵的影响[J].中国酿造,2018,37(8):75-81.
[32]SANDRIA I G,FONTANAB R C,SILVERIA M M.Influence of pH and temperature on the production of polygalacturonases by Aspergillus fumigatus[J].LWT-Food Sci Technol,2015,61:430-436.
[33]闫杨,刘月静,陈芳.枯草芽孢杆菌的应用现状概述[J].生物学教学,2019,44(2):2-3.
[34]王群.芝麻香型白酒用枯草芽孢杆菌脱水菌剂研究[D].济南:齐鲁工业大学,2016.
[35]刘晓玲,王金晶,李永仙.等.特基拉芽孢杆菌来源β-1,3-1,4-葡聚糖酶重组菌发酵培养基的优化[J].食品与发酵工业,2013,39(2):80-85.
[36]ABID Y,AZABOU S,CASILLO A,et al.Isolation and structural characterization of a levan produced by probiotic Bacillus tequilensis-GM from Tunisian fermented goat milk[J].Int J Biol Macromol,2019,133:DOI:10.1016/j.ijbiomac.2019.04.130.
[37]王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.
[38]JEONG D W,LEE B,LEE H,et al.Urease characteristics and phyloge-netic status of Bacillus paralicheniformis[J].J Microbiol Biotechn,2018,28(12):1992-1998.
[39]姚粟,于学健,白飞荣.等.中国传统发酵食品用微生物菌种名单的研究[J].食品与发酵工业,2017,43(9):238-258.
[40]王果帅,王鹏勇,陈革.等.3 株松鼠葡萄球菌的鉴定及耐药性分析[J].黑龙江畜牧兽医,2019(4):96-97,101.
[41]张琦琳,林胜利,聂小华.传统鱼制品中优良葡萄球菌的筛选与鉴定[J].食品工业科技,2012,33(13):178-180.
[42]潘明,侯华,王世宽.浓香型大曲中细菌的分类统计分析[J].酿酒科技,2012(11):28-30.
[43]BERNASCONI E,VALSANGIACOMO C,PEDUZZI R,et al.Arthrobacter woluwensis subacute infective endocarditis:case report and review of the literature[J].Clin Infect Dis,2004,38:27-31.
[44]余道军,陈岳明,俞少勇.等.鸡葡萄球菌的生物学特性及快速鉴定[J].中国微生态学杂志,2008(2):122-125.
[45]林晓燕,牟仁祥,曹赵云.等.镉胁迫下嗜温鞘氨醇杆菌降解丁草胺的蛋白质组学研究[J].农业环境科学学报,2018,37(12):2738-2745.
[46]RAVICHANDRAN R,HEMAASRI S,CAMEOTRA S S,et al.Purification and characterization of an extracellular uricase from a new isolate of Sphingobacterium thalpophilum (VITPCB5)[J].Protein Expres Purif,2015,114:136-142.
[47]孟晓蕾,唐悦,齐向辉.等.Lactobacillus diolivorans 二醇脱水酶激活因子基因的克隆、测序与功能鉴定[J].生物化学与生物物理进展,2007(1):87-92.
[48]MULLER M R A,EHRMANN M A,VOGEL R F.Multiplex PCR for the detection of Lactobacillus pontis and two related species in a sourdough fermentation[J].Appl Environ Microbiol,2000,66(5):2113-2116.
[49]CHEN B,WU Q,XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2014,179:80-84.
[50]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[51]刘晓昆,陈文浩,刘洋.芝麻香型白酒高温大曲制曲过程中产酶细菌的分离与鉴定[J].食品与发酵工业,2019,45(17):54-59.