泡辣椒是我国传统发酵食品中极具特色的一种,以新鲜辣椒为原料,加入食盐,在密封坛子中发酵而成[1]。在发酵过程中,乳酸菌和真菌活跃的代谢活动为泡辣椒中天然有机酸等风味物质的积累创造了适宜条件,赋予了产品酸香爽脆的感官特色[2]。但是活跃的微生物代谢活动也会破坏原料蔬菜组织细胞的完整性,使得组织机械强度下降,造成产品质构劣化[3-4]。
发酵蔬菜的质构主要与组织细胞壁的完整性有关,果胶是维持蔬菜组织细胞壁机械强度的关键组成成分。在泡辣椒发酵过程中,随着有机酸的积累,体系的pH、离子强度等理化性质逐渐变化,随之改变的还有细胞壁中水分的存在状态,且微生物也代谢产生并分泌果胶降解酶系至体系中,这一系列内外部因素都将影响组织细胞壁中果胶的稳定性及存在状态,因而也是影响发酵蔬菜产品质构品质的主要因素[4-7]。食盐作为泡辣椒生产中重要的配料,能够抑制腐败微生物的生长,为乳酸菌和真菌的增殖提供优势环境,通过调节微生物的生长代谢活动间接影响发酵蔬菜的质构品质[8]。更进一步地,食盐在发酵体系中的离子效应也将直接影响植物组织细胞壁中果胶的带电状态以及水分结合形式,进而直接决定发酵蔬菜的质构形成过程[9]。在传统工艺中,泡辣椒食盐含量大多高于10%,大量食盐的添加有利于产品保存,但不利于人体健康。随着大健康时代的来临,泡辣椒减盐化发酵理论逐渐受到关注[10]。一般来说,食盐含量低于8%的泡辣椒称为低盐泡辣椒[11]。由于食盐含量对泡辣椒发酵进程中质构品质的形成具有重要作用,泡辣椒减盐化操作也将引起产品质构特性的改变,目前有关食盐含量对泡辣椒在发酵过程中质构形成机制的影响还不明确。
本研究通过考察不同食盐含量下泡辣椒发酵过程中质构劣化进程与微生物数量、pH、水分存在状态和总果胶酶活力变化之间的关系,研究食盐含量对泡辣椒质构品质形成的影响机制。以期为低盐化发酵食品质构调控技术的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜红辣椒:购于襄阳市农贸市场;食盐:中盐上海市盐业有限公司;氢氧化钠(分析纯):国药集团化学试剂有限公司;MRS培养基、孟加拉红培养基:青岛海博生物技术有限公司;果胶酶活性检测试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
ME3002E型电子天平、SevenCompact S210型pH计、HE53型水分测定仪:梅特勒-托利多国际贸易(上海)有限公司;TA.XTPlus型物性分析仪:英国Stable Micro System有限公司;NMI20-025V-I核磁共振分析仪:上海纽迈电子科技有限公司。
1.3 方法
1.3.1 发酵辣椒制备
配制食盐含量为0、2%、4%、6%、8%的盐水各1 800 mL,并分别加入400 g鲜辣椒,盐含量按辣椒与水的总质量计算,将泡菜坛水封后放入25 ℃培养箱进行发酵,7 d后取样用于指标测定。
1.3.2 水分含量和水分活度测定[12]
将3 g样品捣碎后放入测量盒中,水分含量和水分活度由水分测定仪测定。
1.3.3 水分分布分析[12]
采用低场核磁共振仪分析泡辣椒中不同结合态水分的组成。测定条件设置为:等待时间3 000 ms,回波时间0.8 ms,前置放大倍数1,回波个数10 000,累加次数8。采用PQ001分析软件及Q-CPMG 序列进行T2信号采集。
1.3.4 质构剖面分析[1]
参数设置:探头型号P2,测前速度1 mm/s,测试速度1 mm/s,测后速度2 mm/s,穿刺距离15 mm。选择尺寸相近辣椒样品的中部位置进行质构测定。
1.3.5 pH值[11]
用pH计测定泡辣椒卤水pH值。
1.3.6 微生物指标[11]
取5 g样品捣碎后加入5倍体积无菌生理盐水混合后均匀,经梯度稀释后,分别涂布于MRS平板,厌氧条件下37 ℃经72 h培养后计数乳酸菌含量,采用孟加拉红平板,30 ℃条件下培养72 h后计数真菌数量。
1.3.7 果胶酶活力测定
取1 g样品与10 mL试剂盒提取液混合后均质,10 000×g离心10 min,取上清置于冰上待测,然后根据说明书进行果胶酶活力测定,酶活力单位为U/g样品[13]。
1.3.8 数据分析
除质构采用8组平行外,其余指标均采用3组平行,数据表示为平均值±标准差。采用SPSS 20.0软件分析数据之间的差异显著性,显著性分析水平选取P<0.05。
2 结果与分析
2.1 食盐含量对泡辣椒水分含量的影响
食盐可通过改变体系离子强度而影响辣椒细胞中水分存在状态,而细胞水分存在状态是决定泡辣椒质构的重要因素。如图1可知,泡辣椒水分含量随食盐含量增加而逐渐下降。这可能是因为食盐含量越高,环境渗透压越高,辣椒表皮组织细胞中水分渗出量越大[14],致使样品水分含量降低。当食盐含量升至4%~8%时,样品的水分含量比对照组低4.00%~4.80%。
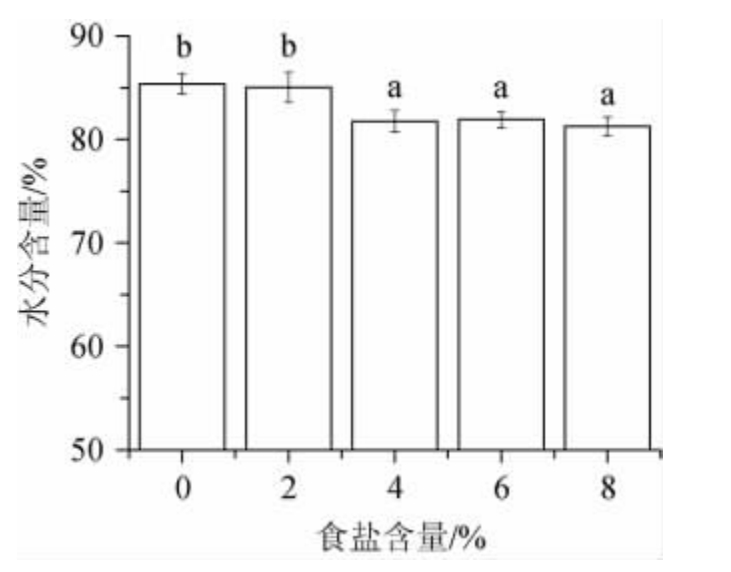
图1 不同食盐含量的泡辣椒在发酵7 d后的水分含量
Fig.1 Water contents of pickled pepper with different salt contents after fermentation for 7 d
不同小写字母代表差异显著(P<0.05)。下同。
2.2 食盐含量对泡辣椒质构的影响
硬度、脆性和咀嚼性是反映泡辣椒质构的主要指标。如图2所示,在不同食盐含量下,泡辣椒的硬度、脆性和咀嚼性均有较大差异。当不添加食盐时,样品硬度和咀嚼性均在各处理组中最低,但脆性最高。食盐含量4%~6%样品的咀嚼性和硬度最高,在食盐含量为4%和6%时,样品硬度分别较对照组高16.46%和34.41%,当食盐含量为4%和6%时,样品咀嚼性分别比对照组高43.98%和32.48%。这与水分含量结果相对应,当食盐含量>4%时,水分含量明显降低(图1),因而胞液浓缩效应引起硬度和咀嚼性增加。当食盐含量进一步升至8%时,辣椒细胞失水导致组织萎缩变形,对应的是该组样品的硬度和咀嚼性显著低于4%和6%食盐含量组,且与0和2%食盐含量组样品的硬度无显著差异(P>0.05),而咀嚼性明显高于0和2%食盐含量组,这可能时由于高盐条件下的细胞萎缩,使得细胞结构压缩,导致咀嚼性相对较高。相较于2%和8%食盐处理组,食盐含量为4%~6%时样品脆性有所提升。辣椒的脆性与细胞膨压有关,由于辣椒细胞在高盐环境下失水,导致细胞膨压降低,因此相较于对照组,添加食盐组样品的脆性有所下降。因此,综合分析硬度、脆性和咀嚼性这三个指标结果,食盐含量4%~6%时样品的质构较好。

图2 不同食盐含量的泡辣椒在发酵过程中硬度(A)、脆性(B)和咀嚼性(C)变化
Fig.2 Changes of the hardness (A),crispness (B) and chewiness (C) of pickled pepper with different salt contents during fermentation process
2.3 食盐含量对泡辣椒pH的影响
环境pH可通过改变细胞表面大分子的带电状态,影响泡辣椒组织机械结构;此外,果胶酶的活性受pH影响,进而改变细胞壁果胶成分的降解程度。由图3可知,泡辣椒发酵过程中pH呈现不断下降的趋势。当食盐含量≤6%时,泡辣椒发酵7 d内pH下降至4.10左右,且与对照组无显著性差异。当食盐含量为8%时,样品pH缓慢下降,产品最终pH在4.50以上。这说明食盐含量≤6%可在抑制杂菌的同时为乳酸菌提供适宜环境,促进发酵进行,而食盐含量为8%时,乳酸菌受到抑制而发酵进程受阻。

图3 不同食盐含量的泡辣椒在发酵过程中pH变化
Fig.3 Changes of pH of pickled pepper with different salt contents during fermentation process
2.4 食盐含量对泡辣椒发酵过程中乳酸菌和真菌总数的影响
微生物是泡辣椒发酵过程的主要参与者,微生物产生的果胶酶可直接影响泡辣椒质构特性。在发酵过程中,食盐对微生物增殖过程的影响也将引起泡辣椒质构的差异。泡辣椒发酵产酸过程中的优势菌种为乳酸菌,不同食盐含量的泡辣椒在发酵过程中的乳酸菌总数和真菌总数变化见图4。如图4(a)所示,乳酸菌在发酵1 d内迅速繁殖,各组样品的乳酸菌均增长了4~5个数量级,而后逐渐趋于平稳,低于6%食盐处理组的最终乳酸菌数量与对照组无显著性差异。而8%食盐样品中乳酸菌增长缓慢且明显低于对照组。
泡辣椒中的真菌所占比例低于乳酸菌,但其因丰富的果胶降解酶系而对泡辣椒质构的形成具有重要贡献。由图4(b)可知,在各组样品中,真菌的数量均呈现先增加而后下降至消失的趋势。当食盐含量为0和2%时,初始真菌含量分别为3.89和3.78,而当食盐数量对数值进一步增加至4%以上时,未检出初始真菌,这可能是由于高盐含量(>4%)对真菌具有较强抑制作用。随着样品盐含量的增加,发酵1 d时的真菌数量逐渐下降,这表明相较于乳酸菌,食盐对真菌的抑制作用更为明显,这与现有报道一致[15]。食盐对微生物的抑制作用在一定程度上减缓了代谢活动造成的辣椒组织的破坏,进而有助于提升辣椒质构。
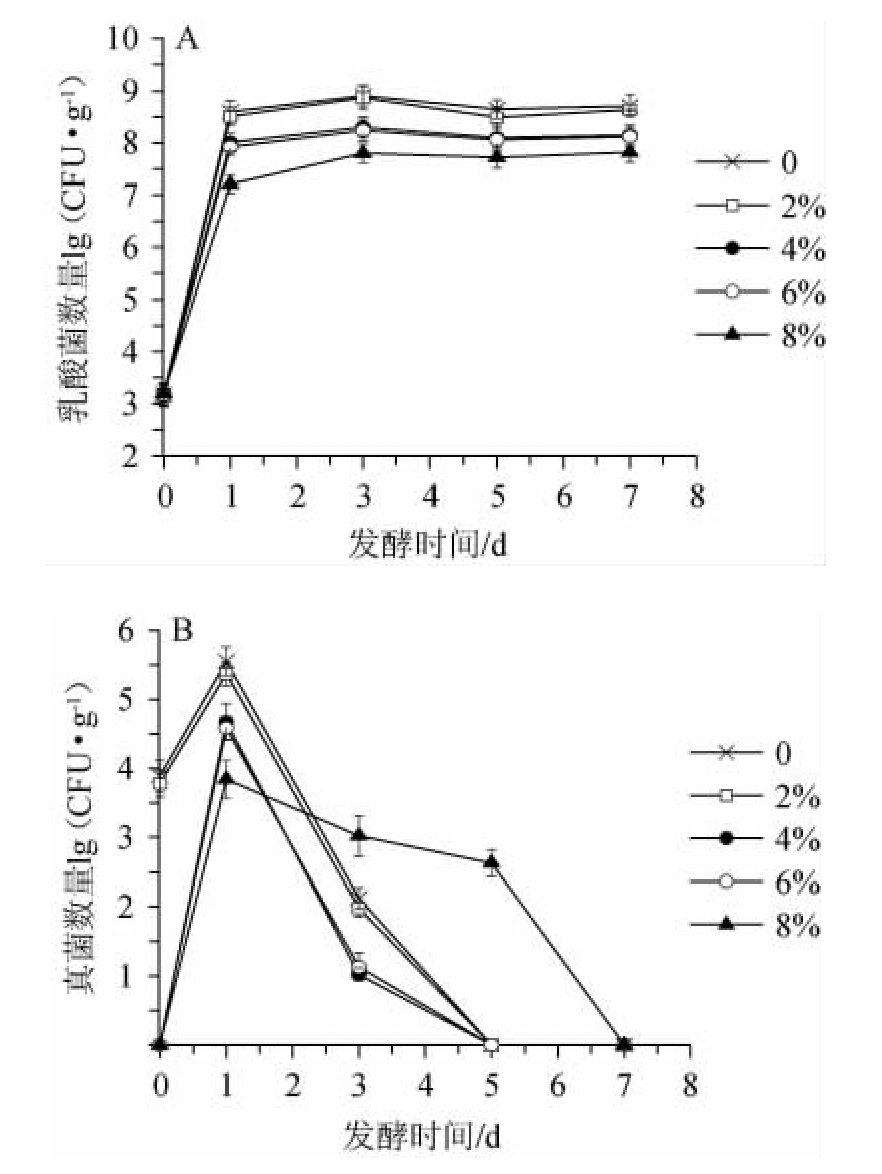
图4 不同食盐含量的泡辣椒在发酵过程中乳酸菌(A)和真菌(B)总数变化
Fig.4 Changes of the total counts of lactic acid bacteria (A) and fungi (B) in pickled pepper with different salt contents during fermentation process
2.5 食盐含量对泡辣椒水分活度和水分分布的影响
水分活度是表征食品内水分结合状态的指标。一方面,在高渗环境中,泡辣椒组织失水导致自由水减少;另一方面,食盐可改变细胞表面蛋白质、多糖等大分子的电荷状态,从而束缚住更多水分,使得结合水比例增加[16]。因此食盐具有促进辣椒中水分由游离状态向结合状态转化的作用,这与实验结果中食盐含量的增加显著降低了样品水分活度相对应(见图5a),当食盐含量≤2%时,样品的水分活度与对照组无显著性差异(P>0.05),当食盐含量增加至4%~8%时,水分活度比对照组低了2.31%~2.80%(P<0.05)。
不同盐含量样品的水分分布情况见图5b。由图5b可知,泡辣椒中的水分可分为三部分,结合水主要与细胞大分子中的极性基团紧密结合[12];不易流动水主要位于细胞内部;自由水主要游离于细胞间隙中[17]。对照组的自由水比例以及水分含量均最高,该条件下植物细胞处于膨胀状态,这与该组样品脆性最高相对应(图2)。随着食盐含量增加,不易流动水的增加趋势相较于其他水组分更为明显,且结合水所占比例也略有增加,说明食盐含量的增加使得泡辣椒中水分的流动性和自由度逐渐降低[18]。这与样品的水分含量下降而水分活度增加相对应(图1和图5a),进一步证明在食盐作用下,泡辣椒主要失去了自由水[19]。食盐含量≥4%时,细胞水合作用的增强可在一定程度上增加组织机械强度,因而样品硬度和咀嚼性显著高于对照组(见图2)。
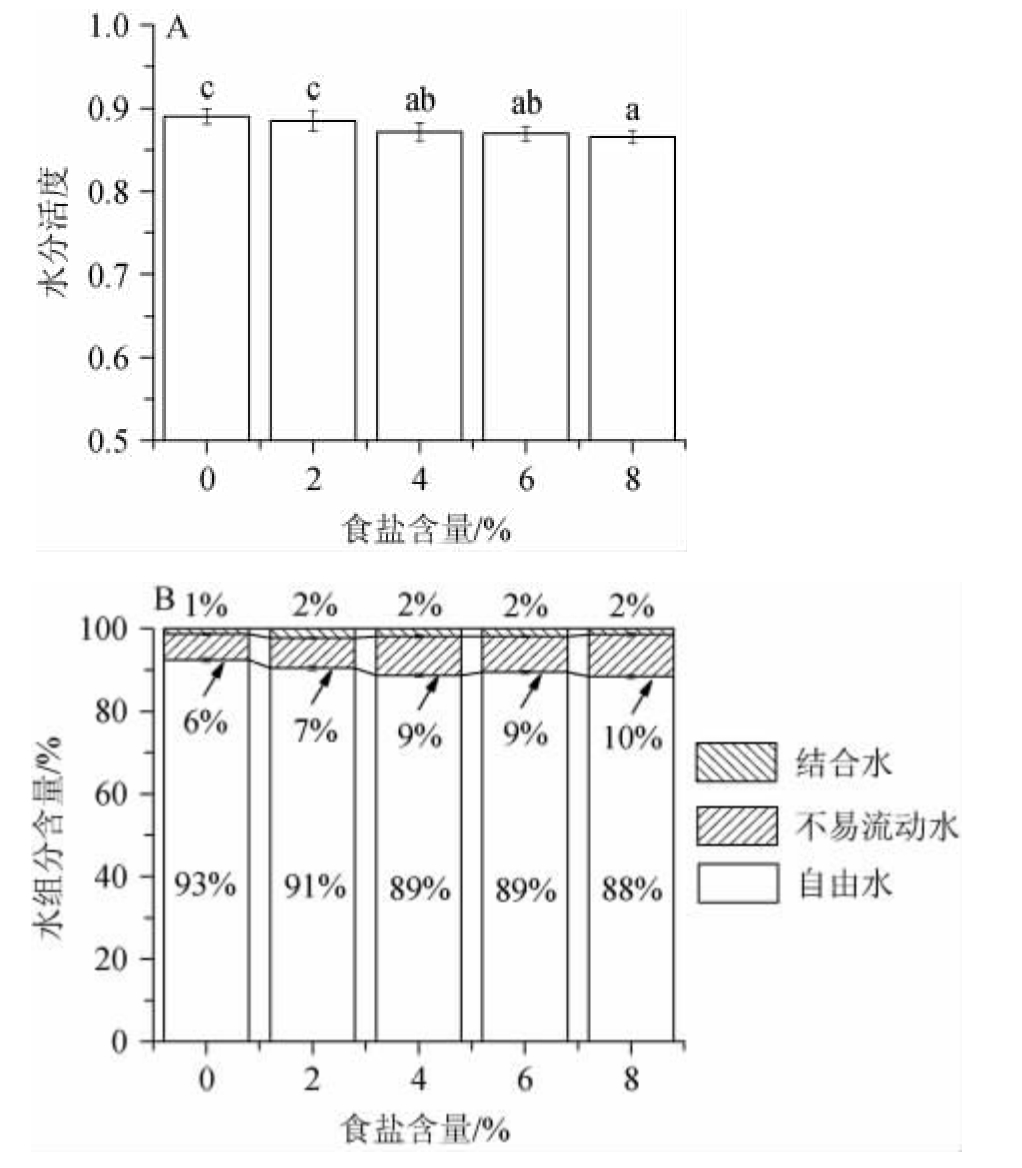
图5 不同食盐含量的泡辣椒在发酵7 d后的水分活度(A)和水分分布(B)
Fig.5 Water activity (A) and water distribution (B) of pickled pepper with different salt contents after fermentation for 7 d
2.6 果胶酶活性
果胶是决定辣椒组织机械特性的重要组分[4]。在发酵过程中,辣椒中的内源果胶酶和微生物代谢酶系均可降解果胶[20-21],导致泡辣椒质构劣化,食盐具有抑制果胶酶活性的作用[22]。如图6所示,当食盐含量≤2%时,食盐对果胶酶的活性无显著影响(P>0.05),当食盐含量增至4%、6%和8%后,果胶酶活性分别较对照组低67.42%、75.43%和78.11%,差异显著(P<0.05),食盐对果胶酶的抑制可能与高离子强度和酸环境下果胶酶分子结构的变化有关[22]。
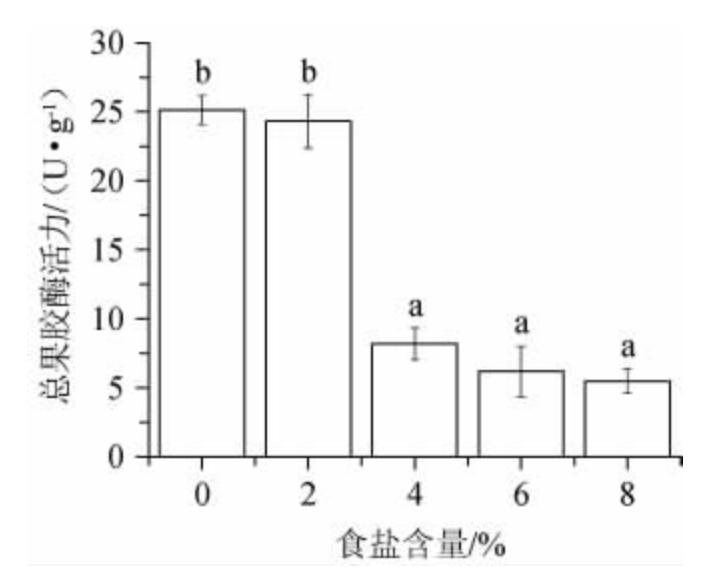
图6 不同食盐含量的泡辣椒在发酵7 d后的总果胶酶活性
Fig.6 Total pectinase activity of pickled pepper with different salt contents after fermentation for 7 d
2.7 不同食盐含量下泡辣椒质构形成与理化性质之间的关系
泡辣椒的质构特性受环境pH、离子强度、微生物代谢活动、组织水分存在状态以及果胶酶活性等因素影响。当食盐含量≤2%时,发酵体系中果胶酶活力高,造成组织结构稳定性下降,因而辣椒硬度和咀嚼性降低。当食盐含量升至4%~6%时,高渗环境下细胞中自由水或被释放或转化为不易移动水,水分活度下降,细胞水合作用增强使得样品脆性升高,进而增加了机械强度;同时,高离子强度和低pH环境均可抑制果胶酶活力,进而改善质构。因此,该食盐含量可显著提高泡辣椒硬度、脆性和咀嚼性。当食盐含量进一步升至8%时,辣椒组织失水过多导致细胞萎缩,对应的是硬度、脆性和咀嚼性的下降。
3 结论
在不同食盐含量中,4%~6%食盐可抑制泡辣椒质构劣化。在此条件下,泡辣椒形成低酸性体系,在高渗作用下辣椒细胞的水合作用增强而水分活度下降,有助于保持脆性,且果胶酶活性受到显著抑制,易于保持完整细胞壁结构,从而减缓泡辣椒硬度、咀嚼性和脆性的劣化。
[1]朱海霞,王金菊,李超,等.乳酸菌发酵辣椒泡菜工艺的研究[J].中国酿造,2013,32(8):10-14.
[2]赵玲艳.自然发酵辣椒微生物多样性及其宏转录组研究[D].长沙:湖南农业大学,2017.
[3]张海燕,康三江,张芳,等.干装苹果罐头贮藏过程中质地与细胞壁组分的变化[J].中国酿造,2017,36(12):139-143.
[4]WANG D,YEATS T H,ULUISIK S,et al.Fruit softening:revisiting the role of pectin[J].Trend Plant Sci,2018,23(4):302-310.
[5]YANG H,WU Q,NG L Y,et al.Effects of vacuum impregnation with calcium lactate and pectin methylesterase on quality attributes and chelatesoluble pectin morphology of fresh-cut papayas[J].Food Bioproc Technol,2017,10(5):901-913.
[6]PENG J,SONG Y,ZHANG X,et al.Calcium absorption in asparagus during thermal processing:Different forms of calcium ion and cell integrity in relation to texture[J].LWT-Food Sci Technol,2019,111:889-895.
[7]WANG J,MUJUMDAR A S,DENG L Z,et al.High-humidity hot air impingement blanching alters texture,cell-wall polysaccharides,water status and distribution of seedless grape[J].Carbohydr Polym,2018,194:9-17.
[8]于新颖,刘文丽,殷杰,等.不同食盐浓度下白菜泡菜的乳酸菌数及理化指标变化[J].食品与发酵工业,2015,41(10):119-124.
[9]ZÖRB C,MÜHLING K H,KUTSCHERA U,et al.Salinity stiffens the epidermal cell walls of salt-stressed maize leaves:is the epidermis growthrestricting?[J].Plos One,2015,10(3):e0118406-e0118406.
[10]李晓,王文亮,王月明,等.低盐酱腌菜保脆技术的研究进展[J].中国食物与营养,2018,24(12):23-27.
[11]LIU X,KUDA T,TAKAHASHI H,et al.Bacterial and fungal microbiota of spontaneously fermented Chinese products,Rubing milk cake and Yancai vegetable pickles[J].Food Microbiol,2018,72:106-111.
[12]颜娜,李华佳,徐星烨,等.不同渗糖方式对徐香猕猴桃果脯品质的影响[J].食品研究与开发,2019,40(21):71-75,131.
[13]HONG M,LI J,CHEN Y.Characterization of tolerance and multi-enzyme activities in non-Saccharomyces yeasts isolated from Vidal blanc icewine fermentation[J].J Food Biochem,2019,43(11):e13027.
[14]郭秀兰,唐仁勇,刘达玉,等.盐分腌制对大头菜滋味、质构和挥发性成分的影响[J].食品与发酵工业,2015,41(1):51-54.
[15]GUAN Q,ZHENG W,HUANG T,et al.Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Res Int,2020,128:108755.
[16]CHANDRA S,KUMARI D.Recent development in osmotic dehydration of fruit and vegetables:a review[J].Crit Rev Food Sci Nutr,2015,55(4):552-561.
[17]石芳,廖霞,李福香,等.基于低场核磁共振技术研究冻融过程中松茸品质的变化[J].食品与发酵工业,2018,44(7):89-95.
[18]SANTAGAPITA P,LAGHI L,PANARESE V,et al.Modification of transverse NMR relaxation times and water diffusion coefficients of kiwifruit pericarp tissue subjected to osmotic dehydration[J].Food Bioproc Technol,2013,6(6):1434-1443.
[19]KUSNADI C,SASTRY S K.Effect of moderate electric fields on salt diffusion into vegetable tissue[J].J Food Eng,2012,110(3):329-336.
[20]CHEN H,CAO S,FANG X,et al.Changes in fruit firmness,cell wall composition and cell wall degrading enzymes in postharvest blueberries during storage[J].Sci Hortic-Amsterdam,2015,188:44-48.
[21]ZHANG F,TANG Y,REN Y,et al.Microbial composition of spoiled industrial-scale Sichuan paocai and characteristics of the microorganisms responsibleforpaocaispoilage[J].Int J Food Microbiol,2018,275:32-38.
[22]REHMAN H U,AMAN A,NAWAZ M A,et al.Characterization of pectin degrading polygalacturonase produced by Bacillus licheniformis KIBGE-IB21[J].Food Hydrocolloid,2015,43:819-824.