啤酒是一种历史悠久的酿造酒,以麦芽、水为原料,添加酒花及其他辅料,经啤酒酵母酿制而成。啤酒营养丰富,酒精含量低,故有“液体面包”之称[1]。啤酒高浓酿造技术是采用高浓麦汁(麦汁浓度>16°P)进行发酵,再以富含CO2的脱氧水稀释至规定酒精度[2],具有提高设备利用率,提高啤酒产量,降低生产成本以及节约能源和劳动力,提高啤酒生物及非生物稳定性,提高辅料利用率,增加每单位可发酵物的乙醇产量等优点[2-3]。但是,啤酒高浓酿造也面临着一些问题,如发酵时间长导致酵母细胞压力增大,泡沫稳定性降低,风味变差以及酒花利用率降低等[2]。除此之外,在啤酒高浓酿造过程中,酵母还面临着更为严苛的环境条件,如发酵前期的高渗透压和发酵后期的高乙醇毒性等。研究表明,乙醇对酵母细胞生长具有强烈的抑制作用[4]。乙醇可干扰酵母细胞膜脂组织,扰乱膜转运蛋白的构象和功能,增加质膜通透性[5-6];高浓度的乙醇会干扰酵母细胞壁的正常功能,抑制细胞的生长及乙醇的进一步生成[7-8]。游离氨基氮(free amino nitrogen,FAN),是能够被酵母同化利用的含氮物质,包括游离氨基酸、铵离子与小分子肽等[9]。FAN的缺乏是啤酒高浓酿造中导致酵母适应环境胁迫能力变差的主要原因,氮源严重缺乏甚至会导致发酵停滞[10]。为了解决这些问题,前人已经提出了多种方法,如补充氨基酸与肽[11],添加大豆活性肽[12]、小麦面筋水解物[13],或添加蛋白酶以增加麦汁中FAN水平[2]。在高浓麦汁中添加氮源被证明是一种有效的方法。
由于碱性氨基酸与支链氨基酸是酵母细胞生长所必需的氨基酸,细胞无法自身合成,只能靠从外界环境中摄取,而氮源缺乏是高浓麦汁的主要缺陷。因此,为了探究这六种氨基酸对啤酒高浓酿造过程中酵母生理特性和发酵性能的影响,本研究通过在高浓麦汁中分别添加六种氨基酸:精氨酸(Arg)、赖氨酸(Lys)、组氨酸(His)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile),研究其对酵母生长和活细胞率、麦汁发酵度和乙醇产量、啤酒风味物质形成的影响,为啤酒高浓酿造工业生产中氮源的选择提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与原料
Lager啤酒酵母(Saccharomyces pastorianus):安琪酵母股份有限公司;大麦芽:厦门市老啤匠贸易有限公司;酒花颗粒:西安雪花啤酒有限公司;麦芽糖浆:江苏先卓食品科技股份有限公司。
1.1.2 化学试剂
精氨酸(Arg)、赖氨酸(Lys)、组氨酸(His)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile):北京索莱宝科技有限公司;亚甲基蓝:天津博迪化工股份有限公司;KH2PO4、Na2HPO4·12H2O:广东光华科技股份有限公司;2-辛醇:范德(北京)生物科技有限公司。实验所用试剂均为分析纯。
1.2 仪器与设备
LRN-250CL低温培养箱:上海一恒科学仪器有限公司;PAL-1数字手持袖珍折射仪:日本ATAGO(爱宕)公司;SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;GL-10MD大容量高速冷冻离心机:湘仪离心机仪器有限公司;E100LED MV生物显微镜:日本尼康公司;DMA 35安东帕便携式密度计:奥地利安东帕有限公司;UV1780紫外-可见分光光度计:日本岛津公司;QP2010 Ultra气相色谱-质谱联用仪:日本岛津公司。
1.3 方法
1.3.1 高浓麦汁制备
在任璐等[14]的方法上调整原麦汁制备工艺参数。麦芽经粉碎后,以1∶4(g∶mL)的料液比,加入45 ℃蒸馏水进行搅拌、糖化,糖化条件:45 ℃,30 min;63 ℃,60 min;72 ℃,10 min;78 ℃,10 min,以1 ℃/min的速率升温。糖化结束后,将原麦汁冷却至约45 ℃过滤,将滤液煮沸并保持沸腾状态90 min。在麦汁沸腾过程中添加所用麦芽质量0.2%的酒花颗粒,采用三次添加法[15]进行酒花颗粒添加:煮沸10 min时添加酒花总量的10%,35 min时添加55%,煮沸结束前10min加入剩余35%酒花。煮沸结束后趁热过滤,加入蒸馏水将原麦汁浓度调整至12°P,再加入麦芽糖浆,调整至24°P,形成高浓麦汁。装瓶,进行高压蒸汽灭菌(121 ℃,15 min)。
1.3.2 啤酒发酵
接种酵母前,在无菌条件下,向高浓麦汁中分别添加六种氨基酸:Arg、His、Lys、Val、Leu、Ile,添加量为400 mg/L。对照组中不添加任何氨基酸(对照组中三种碱性氨基酸Arg、Lys、His的含量分别为406 mg/L、134 mg/L、213 mg/L,三种支链氨基酸Val、Leu、Ile的含量分别为343mg/L、471mg/L、209 mg/L)。活性干酵母经活化后,加入高浓麦汁中,接种量为2 g/L。于12 ℃条件下进行发酵,每日摇瓶称质量。发酵结束后,离心(6 000 r/min,4 ℃,10 min),分别取酵母泥与上清液。上清液保存于4 ℃冰箱备用。
1.3.3 酵母计数和活细胞率
将离心所得酵母泥称质量,再用血球计数板对酵母进行计数以及活细胞率的测定:将酵母泥用生理盐水(0.9%NaCl溶液)以1∶100的比例进行稀释后,在0.1 mL的细胞悬浮液中加入0.9 mL磷酸亚甲基蓝溶液(pH=4.6),振荡混匀,静置染色10 min后,在显微镜下通过血球计数板对活细胞和死细胞进行计数,其中,死亡的细胞会被亚甲基蓝染成蓝色。活细胞率计算公式如下:
1.3.4 麦汁发酵度
使用附温比重瓶法测定发酵前后麦汁浓度:将上清液缓慢倒入25 mL附温比重瓶中,插入温度计,避免产生气泡,准确称量其在20 ℃条件下的质量,同样方法测出蒸馏水在20 ℃条件下的质量。根据二者比值,查比重和浸出物质量百分含量对照表得出麦汁在20 ℃条件下浸出物含量,以°P表示。麦汁发酵度计算公式如下:
1.3.5 酒精度测定
取上清液与蒸馏水各50 mL,一并加入蒸馏烧瓶中进行蒸馏,用容量瓶准确收集50 mL馏出液。再用安东帕便携式密度计直接测定读取酒精度,以体积分数表示%vol。
1.3.6 风味物质测定
使用气相色谱质谱联用仪测定啤酒中的风味物质,采用与常婷婷[16]相同的条件进行分析:在20 mL顶空瓶中加入6 mL样品和1.5 g NaCl,以及20 mg/mL的2-辛醇标准溶液20 μL,此时样品中2-辛醇实际质量浓度为66.7 μg/mL,加盖密封后进行测定分析。未知化合物经计算机检索同时与美国国家标准与技术研究院(national institute of standards and technology,NIST)和Wileylibrary数据库相匹配,保留SI>85的结果,所得风味物质为相对于内标的含量。
气相色谱条件:色谱柱为DB-1 ms 毛细管柱(60 m×0.25 mm×0.25 μm);起始柱温:40 ℃;进样口温度230 ℃;程序升温:40 ℃保持3 min,然后以4 ℃/min 速度升到120 ℃,再以6 ℃/min 升到240 ℃,保持9 min;载气为氦气(He),流速1.0 mL/min;不分流进样。
质谱条件:离子源温度为230 ℃,电子电离(electronic ionization,EI)源,电子能量70eV,质量扫描范围35~400amu。
1.3.7 数据分析
每组实验重复3次,采用Minitab 18(Minitab Inc.)进行数据分析,采用Fisher最小显著差别(least significant difference,LSD)法进行显著性分析。其中,P<0.05为差异显著,P<0.01为差异极显著。使用Excel作图。
2 结果与分析
2.1 添加不同氨基酸对啤酒高浓酿造过程中CO2失质量的影响
由图1可知,发酵开始的第1天,各组CO2失质量均较低,发酵非常缓慢,是细胞适应环境的过程。从第2天开始,CO2失质量增加,曲线斜率增大。由于麦汁中营养物质充足,酵母细胞得以快速繁殖,参与发酵的酵母数量急剧增加,无氧发酵活跃。各组CO2失质量在第3天为最大,其中Val组高达17.2 g/L。随后,总CO2失质量趋于稳定,酵母细胞进入稳定期,在此期间,代谢产物逐渐积累增多,当CO2失质量趋于平稳时,乙醇的产量也趋于稳定,因此,在细胞进入衰亡期前、总CO2失质量趋于稳定时,终止发酵。
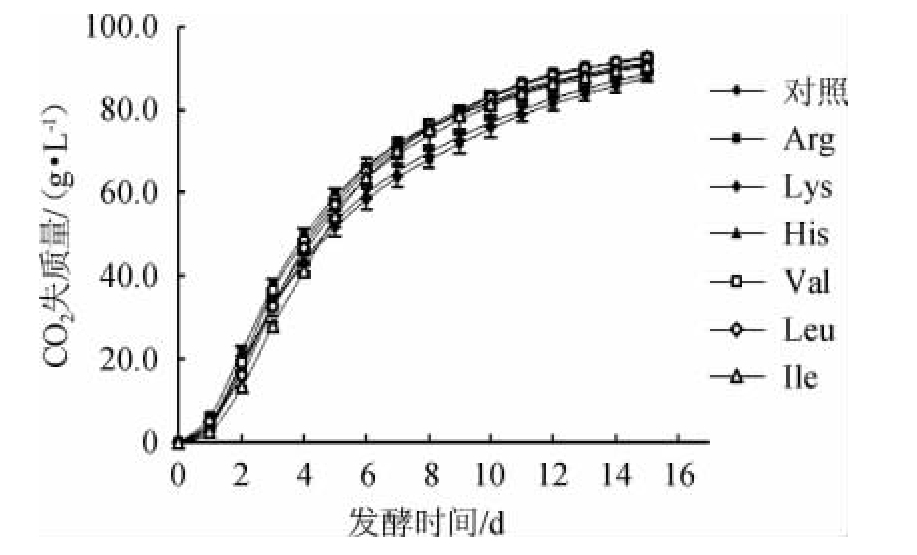
图1 发酵期间各组CO2质量损失
Fig.1 CO2 mass loss of each group during fermentation
发酵开始至第5天,各组间CO2失质量差异显著(P<0.05),直至发酵结束,对照组CO2失质量(87.7 g/L)低于所有添加氨基酸的实验组。Arg组发酵前5 d CO2失质量一直高于其他组。从第6天开始至发酵结束,添加Val、Leu与Arg的实验组CO2失质量始终高于其他组,分别为92.4 g/L、92.7 g/L与91.2 g/L。结果表明,高浓麦汁中添加碱性氨基酸及支链氨基酸可显著提高Lager酵母的发酵速率及发酵活力(P<0.05)。其中,Arg、Val以及Leu效果优于其他3种氨基酸。
2.2 添加不同氨基酸对酵母细胞生长和活细胞率的影响
啤酒高浓酿造过程中添加大豆蛋白酶解物,可增强酵母的乙醇耐受性、渗透压耐受性,改善细胞的代谢环境,提高酵母净增长量[12]。由图2可知,Arg的添加对酵母细胞的生长促进效果最好,达1.64×108 cells/mL,显著高于对照组(1.33×108 cells/mL)(P<0.05)。CHENG Y等[17]的研究表明,Arg具有保护酵母细胞免受乙醇胁迫的作用,可以促进细胞在乙醇胁迫下的生长。其他氨基酸的添加对酵母细胞的生长无显著影响。
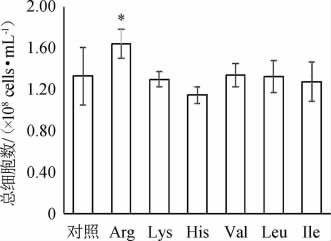
图2 发酵结束时各组酵母总细胞数
Fig.2 Total yeast cells number of each group at the end of fermentation
“*”表示与对照组差异显著(P<0.05)。下同。
由图3可知,His添加组的活细胞率显著高于对照组(P<0.05),达82.69%,而对照组仅为76.77%。明明[18]研究表明,在培养基中添加乙醇,对酵母菌的细胞生长有抑制作用,尤其在高浓度时的抑制作用更强。其余各氨基酸添加组的活细胞率与对照组无显著差异(P>0.05),但是,由于各组乙醇产量均显著高于对照组乙醇产量(P<0.05),因此,各组在发酵结束时面临更严峻的环境胁迫。而添加各氨基酸的实验组能在乙醇产量较对照组更高的情况下,保持酵母总细胞数以及活细胞率与对照组相当的水平,甚至更优(Arg、His添加组),表明在高浓酿造中添加这六种氨基酸可以显著增强酵母细胞对乙醇的耐受性,保证酵母细胞的生长繁殖及存活率。在实际工业生产中,更高的酵母总细胞数及活细胞率,有利于酵母的重复利用。
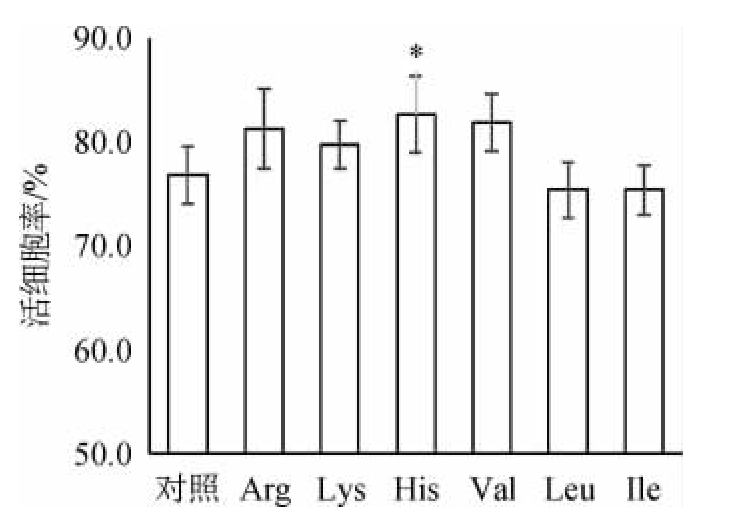
图3 发酵结束时各组酵母活细胞率
Fig.3 Yeast cell viability of each group at the end of fermentation
2.3 添加不同氨基酸对麦汁发酵度和乙醇产量的影响
由图4可知,发酵结束时,各实验组发酵度从高到低依次为:Val>Leu>Arg>Ile>Lys>His>对照组。高浓麦汁中由于加入了大量几乎不含氮的麦芽糖浆,导致其中FAN水平降低。低水平的FAN会导致酵母增殖缓慢,使发酵滞缓甚至停滞[19-20]。对照组发酵度最低,为79.29%。麦汁中充足的FAN可以确保酵母细胞快速增殖,从而保证良好的发酵性能,在常浓酿造过程中,FAN水平与酵母生长成正比,在高浓酿造中,则需要更高水平的FAN以保证发酵能正常进行。因此,各添加氨基酸的实验组,发酵度均极显著高于未添加任何氮源物质的对照组(P<0.01),其中Val组发酵度最高,为83.65%,其次为添加Leu和Arg的实验组,分别为82.95%、82.93%。这与YANG H等[11]的实验结果一致。

图4 添加不同氨基酸对各组麦汁发酵度的影响
Fig.4 Effect of different amino acids supplementations on wort fermentation degree of each group
“**”表示与对照组差异极显著(P<0.05)。下同。
高浓麦汁中可发酵糖含量高,因此在发酵后期会产生更多的乙醇。然而,酒精作为酵母细胞的代谢产物,反过来会抑制乙醇的生成,这种抑制效果较常浓酿造时的抑制效果更为强烈。TANO M等[21]实验表明,外源添加乙醇会导致甘蔗汁发酵的乙醇产量降低。此外,某些氨基酸缺陷型菌株(即自身不能合成相应的氨基酸)对乙醇更为敏感:与色氨酸、酪氨酸及苯丙氨酸代谢相关基因的缺失菌株对8%乙醇敏感[22]。若能够提高酵母细胞对乙醇的耐受性,则有利于缓解乙醇对酵母的抑制作用:一些氨基酸积累型突变菌株则对外界的环境胁迫,包括乙醇胁迫等,表现出更强的耐受性[23-25]。
由图5可知,添加六种氨基酸的实验组,在发酵结束时,乙醇产量均极显著高于对照组(P<0.01),其中添加Val、Leu、Arg的实验组乙醇产量最高,分别为11.97%(V/V)、11.90%(V/V)及11.83%(V/V),且三者之间无显著差异(P>0.05),对照组乙醇产量最低,仅为11.30%。乙醇产量与发酵度呈现出相同的趋势,这表明酵母发酵利用麦汁中糖的程度,与产生乙醇的能力呈正相关性,即发酵度越高,对糖的消耗利用越充分,相应产生乙醇的量就越多。发酵度和乙醇产量的提高,对于实际生产具有重要的意义:在使用相同原料量的情况下,添加氨基酸可促进酵母对原料的充分利用,避免浪费,并且可以提高乙醇产量,增加产能。
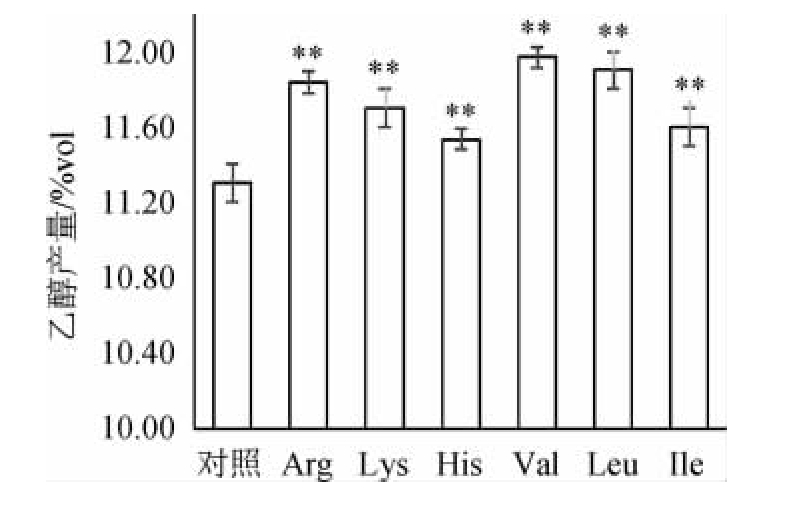
图5 添加不同氨基酸对各组乙醇产量的影响
Fig.5 Effect of different amino acids supplementations on ethanol yield of each group
2.4 添加不同氨基酸对啤酒风味物质的影响
表1 添加不同氨基酸对各组啤酒风味物质组成的影响
Table 1 Effect of different amino acids supplementations on the composition of beer flavor of each group

注:高浓酿造风味物质含量统一换算成在5%vol条件下所对应的数值;“-”表示未检出。
由表1可知,Leu组乙酸异戊酯的含量大幅升高,导致其总酯的含量也大幅升高,Val组的总酯含量有所降低,其他各氨基酸添加组的酯类含量与对照组无显著差异(P>0.05),但是对高级醇的含量却有较大影响:Lys添加组的总高级醇含量较对照组有所较低,仅为129.60 mg/L,此外,碱性氨基酸对啤酒的风味物质并无太大影响。氨基酸在酵母细胞内进行分解代谢,通过Ehrlich途径生成少一个碳原子的高级醇,即Val、Leu、Ile分别是异丁醇、异戊醇及活性戊醇的前体物质。三种支链氨基酸对高级醇含量影响最为明显:Val组异丁醇含量较其他组明显升高,高达21.53 mg/L。甄会英等[26-27]研究结果均表明,添加Val会显著提升葡萄酒或山楂酒中异丁醇的含量,与本实验结果一致。Leu组异戊醇含量远高于其他实验组,为196.62 mg/L,由于异戊醇含量的提高,导致乙酸异戊酯含量也有明显的提高,达92.93 mg/L。醇酯比是指酒中高级醇与酯类含量的比例,能够反映啤酒风味的协调程度,过高或者过低均对风味有不良影响,醇酯比在4左右时,啤酒的风味比较协调,且不易导致“上头”[28-29]。因此,添加His、Val与Leu可提高醇酯比,对啤酒的风味有积极作用。
3 结论
在高浓酿造过程中添加Arg、Lys、His三种碱性氨基酸及Val、Leu、Ile三种支链氨基酸,可有效提高酵母发酵速率、酵母总细胞数及活细胞率。与对照组相比,添加该六种氨基酸,均能显著提高麦汁发酵度,提高乙醇产量,其中,Val、Leu、Arg三种氨基酸效果最好。除Leu外其他五种氨基酸对酯类的含量无显著影响,Lys可降低总高级醇含量,而Val、Leu、Ile三种支链氨基酸则分别大幅度增加了异丁醇、异戊醇及活性戊醇等高级醇的含量,Leu还极大地增加了乙酸异戊酯的含量。因此,在实际生产中,这六种氨基酸的添加可提高发酵速度,缩短生产周期,有利于酵母的重复使用,改善啤酒风味。本研究为啤酒高浓酿造工业生产中氮源的优化提供了有力的理论支持。碱性氨基酸和支链氨基酸在细胞及分子水平上对酵母发酵性能的具体影响仍有待进一步研究。
[1]吕进玉.市场下滑竞争激烈啤酒行业持续低迷[J].中国食品,2017(8):74-75.
[2]雷宏杰.高浓麦汁氮源组成对酵母氨基酸同化及发酵调控影响的研究[D].广州:华南理工大学,2014.
[3]郭璇.啤酒酵母对高浓酿造条件的耐受性研究[D].大连:大连工业大学,2016.
[4]BAI F,CHEN L,ZHANG Z,et al.Continuous ethanol production and evaluation of yeast cell lysis and viability loss under very high gravity medium conditions[J].J Biotechnol,2004,110(3):287-293.
[5]FERNANDA R M,SS′-CORREIA I.Intracellular acidification does not account for inhibition of Saccharomyces cerevisiae growth in the presence of ethanol[J].Fems Microbiol Lett,2010,135(2-3):271-274.
[6]TEIXEIRA M,RAPOSO L,MIRA N,et al.Genome-wide identification of Saccharomyces cerevisiae genes required for maximal tolerance to ethanol[J].Appl Environ Microbiol,2009,75(18):5761-5772.
[7]郝学密.氧化还原电位对酵母细胞胁迫响应的影响[D].大连:大连理工大学,2016.
[8]易晨峰.酿酒酵母不同生长周期细胞对乙醇胁迫的响应[D].北京:北京化工大学,2015.
[9]罗军侠,陆健.麦汁中的含氮化合物在酵母发酵中的作用[J].啤酒科技,2007(8):64-68.
[10]GIBSON B,LAWRENCE S,LECLAIRE J C,et al.Yeast responses to stresses associated with industrial brewery handling[J].Fems Microbiol Rev,2010,31(5):535-569.
[11]YANG H,ZONG X,CUI C,et al.Peptide (Lys-Leu) and amino acids(Lys and Leu) supplementations improve physiological activity and fermentation performance of brewer's yeast during very high-gravity(VHG)wort fermentation[J].Biotechnol Appl Bioc,2018,65(4):630-638.
[12]万春艳.大豆活性肽对酵母增殖代谢及啤酒发酵的影响研究[D].广州:华南理工大学,2012.
[13]ZHOU Y,YANG H,ZONG X,et al.Effects of wheat gluten hydrolysates fractionated by different methods on the growth and fermentation performances of brewer's yeast under high gravity fermentation[J].Int J Food Sci Tech,2018,53(3):812-818.
[14]任璐,王莹钰,杨沫,等.啤酒高浓酿造中氨基酸对酵母发酵性能和啤酒色值的影响[J].食品科学,2018,39(14):119-124.
[15]石玉军.啤酒花的使用综述[J].啤酒科技,2014(1):50-51.
[16]常婷婷.柿果实多酚的提取测定及混菌发酵对柿子酒品质的影响[D].杨凌:西北农林科技大学,2018.
[17]CHENG Y,DU Z,ZHU H,et al.Protective effects of arginine on Saccharomyces cerevisiae against ethanol stress[J].Sci Rep,2016,6:31311.
[18]明明.基于GC-MS 代谢组学方法的建立及对酿酒酵母乙醇耐受性机制研究[D].吉林:吉林化工学院,2019.
[19]李小凤,赵培静,谢万勇,等.黑啤生产工艺研究[J].广东化工,2019,46(10):46-47.
[20]PIDDOCKE M,KREISZ S,HELDT-HANSEN H,et al.Physiological characterization of brewer's yeast in high-gravity beer fermentations with glucose or maltose syrups as adjuncts[J].Appl Microbiol Biot,2009,84(3):453-464.
[21]TANO M,BUZATO J.Effect of the presence of initial ethanol on ethanol production in sugar cane juice fermented by Zymomonas mobilis[J].Braz J Microbiol,2003,34(3):242-244.
[22]YOSHIKAWA K,TANAKA T,FURUSAWA C,et al.Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae[J].Fems Yeast Res,2010,9(1):32-44.
[23]吕红芳,王浩,徐宁,等.外源精氨酸对谷氨酸棒杆菌在高葡萄糖胁迫下生长和发酵特性的影响[J].微生物学通报,2017,44(11):2539-2546.
[24]SHIMA J,SAKATATSUDA Y,SUZUKI Y,et al.Disruption of the CAR1 gene encoding arginase enhances freeze tolerance of the commercial baker's yeast Saccharomyces cerevisiae[J].Appl Environ Microbiol,2003,69(1):715-718.
[25]TAKAGI H.Proline as a stress protectant in yeast:physiological functions,metabolic regulations,and biotechnological applications[J].Appl Microbiol Biot,2008,81(2):211-223.
[26]甄会英.葡萄酒中高级醇的测定方法与调控技术研究[D].保定:河北农业大学,2005.
[27]张文叶,吴庆伟,吴刚,等.氨基酸种类与添加量对山楂酒中主要高级醇生成量的影响[J].轻工学报,2017,32(3):1-7.
[28]王超.帝国世涛啤酒酿造及其橡木陈贮工艺的研究[D].济南:齐鲁工业大学,2019.
[29]吕卫娟.淡爽型啤酒风味协调性控制[J].化工设计通讯,2017,43(11):203-204.