闽南地区陈年腌制的萝卜干又称老菜脯,是将白萝卜切条后,经过日晒和盐腌后藏于老坛中发酵多年而成,年份越久,颜色越黑,风味越独特,具有清热生津、增进食欲、促进消化、降低胆固醇等作用,还含有抗癌和抑菌活性成分[1-3]。由于闽南陈年萝卜干腌制发酵时间较长,阻碍了其商品化进程。如何能加速其发酵过程,同时又不影响其食用价值,是目前迫切需要解决的问题。由于乳酸菌制剂发酵蔬菜可以缩短发酵周期,提高产品安全性和品质而备受研究者的关注[4-5]。
当前大多数对传统发酵食品发酵剂的研究都是在传统微生物技术的基础上,通过从环境中筛选符合预期的菌种来对其发酵过程进行研究,此方法并不能将环境中所有的微生物进行分离、纯化和培养,也不能说明各菌种之间的相互交叉作用,不能全面的解释各微生物在食品发酵过程中所起的作用[6]。高通量测序技术(high-throughput sequencing,HTS)又称下一代测序技术(next-generation sequencing technology,NGS)在当今的食品质量和安全性研究中,它已变得越来越重要。NGS可以在一次运行中产生数百万个序列,并部分避免了依赖培养物的方法中的某些固有偏差。根据序列信息,可以鉴定出不同的微生物分类群,包括无法培养和难以通过培养方法检测到的微生物,都能更大程度地了解发酵食品及其微生物之间的关系[7]。高通量测序技术已广泛应用于传统发酵食品中微生物多样性及动态演替规律的研究[8-13]。
目前,国内外未见对闽南陈年腌制萝卜干中细菌组成结构的研究报道。本研究以闽南地区的萝卜干为研究对象,运用高通量测序技术研究不同年份闽南陈年腌制萝卜发酵过程中细菌群落结构组成,考察陈年腌制萝卜发酵过程中细菌群落的多样性和菌群结构的演替规律。采用下一代测序(NGS)技术对不同年份萝卜干进行测序,初步探索了萝卜干发酵过程中细菌群落结构组成,发酵过程中细菌群落的多样性和菌群结构的变化规律,并采用聚类分析(cluster analysis,CA)和主成分分析(principal component analysis,PCA)分析不同年份闽南腌制萝卜干细菌菌群差异,为后续缩短闽南陈年腌制萝卜发酵时间提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
2018年05月到08月在福建漳浦县农贸市场家庭式工坊供货户采购腌制于密封老坛中的发酵年份为3年(编号LL03)、5年(编号LL05)、10年(编号LL10)、15年(编号LL15)、20年(编号LL20)的萝卜干,储存于实验室-20 ℃冰箱保存。5种样品均呈长条状,质软带韧性,气浓香、味咸,其中LL03表面和断面呈浅棕色;LL05表面和断面呈棕褐色;LL10表面和断面呈黑褐色、易折断;LL15表面和断面呈黑褐色、易折断;LL20表面和断面呈乌黑色、易折断。
1.1.2 化学试剂
E.Z.N.ATM Mag-Bind Soil 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;Qubit3.0 DNA检测试剂盒:美国Life公司;2×Taq Master Mix:南京诺唯赞生物科技有限公司;MagicPure Size Selection DNA Beads:北京全式金生物技术有限公司。
1.2 仪器与设备
Pico-21台式离心机:美国Thermo Fisher公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C电泳仪:北京市六一仪器厂;T100TM Thermal Cyeler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIORAD公司。
1.3 方法
1.3.1 DNA提取、PCR扩增及Illumina Miseq测序
用液氮研磨不同年份的萝卜干样本后,参照E.Z.N.ATM Mag-Bind Soil DNA试剂盒的使用说明书进行DNA提取,利用1%琼脂糖凝胶电泳检测DNA提取质量。利用Qubit3.0 DNA检测试剂盒精确定量基因组DNA,以融合了Miseq测序平台的16S rRNA V3-V4通用引物341F和805R进行聚合酶链式反应扩增。利用Qubit3.0 DNA检测试剂盒从2%琼脂糖凝胶回收DNA,精确定量后在Illumina公司的Miseq 2×300 bp平台进行测序。
1.3.2 数据分析
利用Cutadapt软件、Pear软件、Prinseq软件、Usearch软件和uchime软件进行序列的质量筛选和优化[14-15]。以97%的相似度对样本序列进行操作分类单元(operational taxonomic unit,OTU)聚类,利用Alpha分析物种多样性和丰富度;PCA分析样本物种组成相似度[16];利用RDP classifier及Silva数据库分析样本中不同分类水平上的细菌群落结构及组成[17]。按照生物学样品处理基本要求,所有样品均有3个生物学重复样品。
2 结果与分析
2.1 样本16S rRNA基因序列质量评估及Alpha多样性[18]
5个样本质控后共产生247 538条有效序列,平均序列长度为416 bp,使用97%相似度的OTU,总共聚成480个OTU,利用Mothur1.30.1做Alpha多样性分析,结果见表1。由表1可以看出,LL20样本的Chao指数最大,说明LL20样本的细菌丰富度最高。细菌群落的多样性可以用Shannon指数以及Simpson指数衡量[19]。
表1 Alpha多样性指数统计
Table 1 Statistics of Alpha diversity indexes

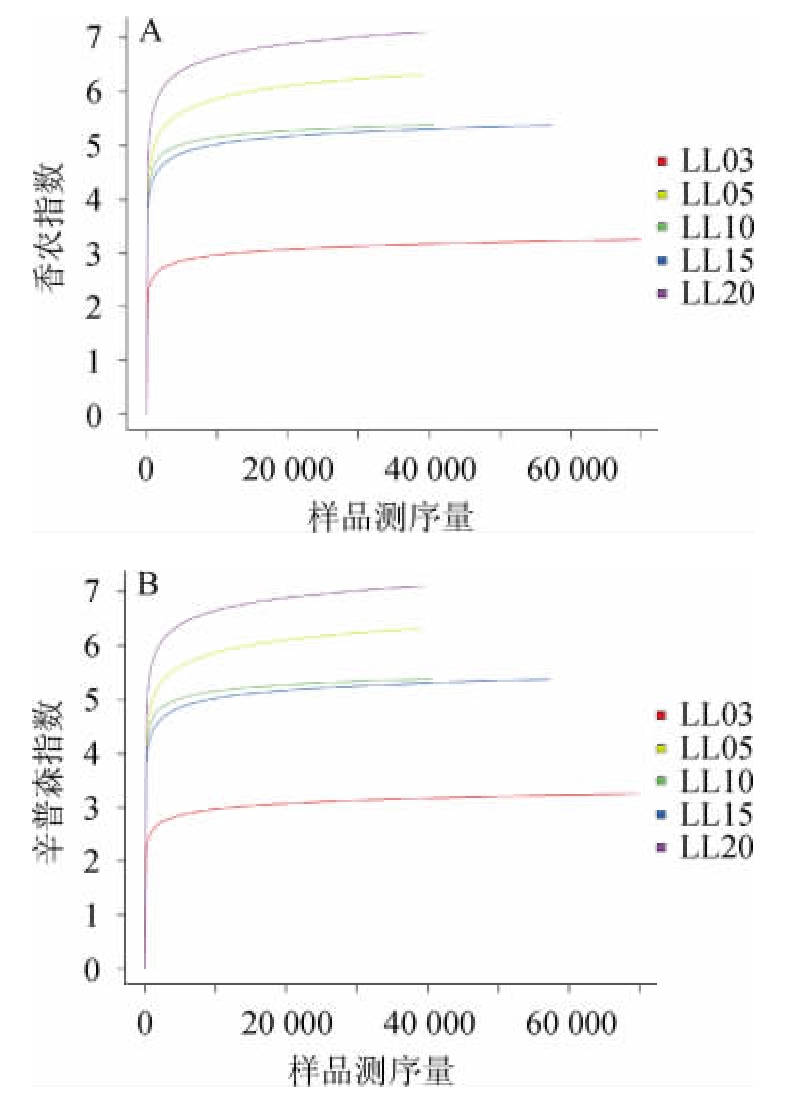
图1 香农指数(A)辛普森指数(B)多样性曲线
Fig.1 Diversity curves of Shannon index (A) and Simpson index (B)
由表1可以看出,样本LL03的Shannon指数最小,Simpson指数值最大,说明LL03样本细菌多样性最低,样本LL20的Shannon指数最大,Simpson指数值最小,说明LL20样本细菌多样性最高。利用R软件(3.2)制作稀释性曲线图见图1。由图1可知,Shannon指数及Simpson指数曲线均随着测序量增大趋于饱和状态,这说明此测序深度水平下,可以反映样品中绝大多数的细菌群落信息[20]。
通过对不同年份的萝卜干样品细菌多样性(Shannon指数)分析可知,细菌多样性随着年份的增加而增加。细菌多样性变化趋势与发酵年份较长的白酒窑泥一致[12]。随着发酵时间的延长,萝卜干中的化学成分发生了改变[1]。有机物含量和种类的变化可能是导致细菌多样性增加的主要原因。
2.2 不同发酵年份萝卜干样本中细菌群落结构聚类分析和主成分分析
基于OTU的样本聚类分析和主成分分析,样本间的距离越小说明样本间的细菌群落越相似。样本聚类树分析结果见图2A。由图2A可知,样品LL03在单独的一个分枝上,样品LL05、LL10、LL15、LL20在另一个大分枝上。由此可知,在发酵5年以上的样本细菌群落系统进化的差异较小。
利用主成分分析(PCA)萝卜干样本细菌群落结构的相似性和差异程度,结果见图2B。由图2B可知,5个不同年份的样本可聚为2个大类,样品LL03单独一簇,样品LL05、LL10、LL15、LL20聚为一簇,其中样品LL20处于边缘位置,这与聚类树分析结果基本一致。因此,可以在细菌群落组成上将萝卜干的发酵过程分为两个阶段,3年和5年以上的萝卜干细菌群落组成差异大。
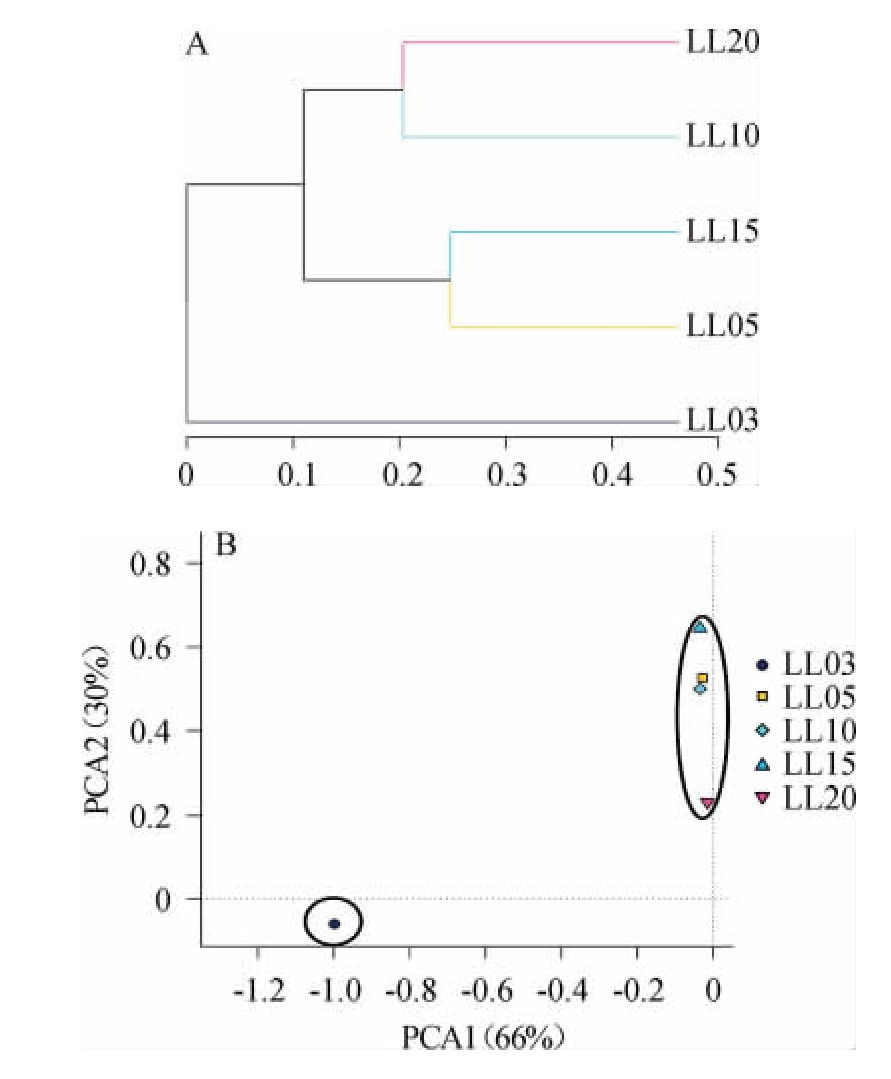
图2 基于OUT水平的样本聚类分析(A)主成分分析(B)
Fig.2 Cluster analysis (A) and principal component analysis (B) of samples based on OUT level
2.3 门水平上的细菌群落结构差异分析
在门、科、属分类单位上对5个不同年份的样本中的细菌群落结构组成进行分析[21],不同样本中细菌在分类门水平上的分布情况见图3。由图3可知,5个不同年份的样本共鉴定出21个细菌门,其中变形菌门在全部萝卜干样本中都占据优势,所占的比例达到41%以上,是样本中的优势菌门。样品LL03的优势菌门为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),所占的比例分别为49.8%和49.1%。而5年以上萝卜干的优势菌门除了变形菌门(Proteobacteria)所占的比例保持在41.2%以上外;拟杆菌门(Bacteroidetes)相对丰度显著下降;厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)相对丰度呈现逐渐增加趋势,3年和5年以上的萝卜干在门水平上细菌群落结构差异较大,年份越久,细菌群落越均匀。
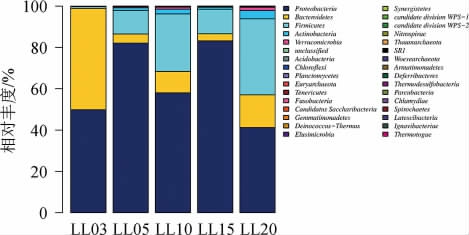
图3 基于门水平样本群落结构
Fig.3 Bacteria community structure of samples based on phylum level
研究发现,不同腌制发酵年份的萝卜干的细菌多样性、群落组成各不相同。在门水平上,3年萝卜干优势门为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),而其他年份萝卜干的优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)。5年以上萝卜干厚壁菌门(Firmicutes)相对组成丰度的增加,这也表明萝卜干中细菌多样性随着发酵年份的增加而增加。
2.4 属水平上的细菌群落结构差异分析
不同年份萝卜干样本中细菌群落结构差异在属水平上的分布情况见图4。由图4可知,在5个不同年份的萝卜干样本中相对丰度>1%的属有26个。样品LL03中的主要优势菌属有鞘氨醇杆菌属(Sphingobacterium),所占的比例为46.7%;藤黄单胞菌(Luteimonas),所占的比例为29.1%。样品LL05中的优势菌属为不动杆菌(Acinetobacter),所占的比例为39.6%;短波单胞菌属(Brevundimonas)所占的比例为8.1%。样品LL10中的优势菌属为不动杆菌(Acinetobacter),所占的比例为24.6%;苯基杆菌属(Phenylobacterium)所占的比例为12.4%。样品LL15中的优势菌属为不动杆菌(Acinetobacter),所占的比例为38.4%;马赛菌属(Massilia)所占的比例为10.2%。样品LL20样本中的优势菌属为不动杆菌(Acinetobacter),所占的比例为16.4%;乳杆菌属(Lac-tobacillus)所占的比例为8.17%。3年和5年以上的萝卜干在属水平上优势菌属差异较大。
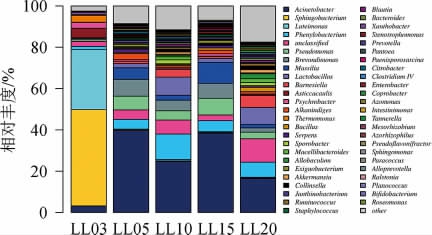
图4 基于属水平样本群落结构
Fig.4 Bacteria community structure of samples based on genus level
3年的萝卜干中的优势菌属为鞘氨醇杆菌属(Sphingobacterium),鞘氨醇杆菌广泛分布于各种复杂的极端环境,多为严格好氧型或兼性厌氧型。能够利用的底物宽泛,从石油、氯乙烷等高聚物到简单无机物都能利用,这都是它们能在贫营养的自养环境中生长和繁殖的原因。鞘氨醇杆菌能够降解纤维素等有机物[22],萝卜富含碳水化合物,鞘氨醇杆菌属可能在发酵前期起重要作用。
不动杆菌(Acinetobacter)能通过酸化环境和产生生物表面活性剂来抑制其他微生物的生长,而且对亚硝酸盐有较好的降解效果,能够在干燥的环境下长期存活,并具有保持环境干燥的能力[23]。闽南萝卜干是通过传统的日晒与盐腌脱水方式制成,萝卜干的含水量低[24],这也可能是5年以上的萝卜干的优势菌属是不动杆菌的原因。不动杆菌属的细菌多为条件致病菌,含有较高丰度的不动杆菌的萝卜干也存在一定的安全隐患[25]。
3 结论
本研究首次分析了不同年份闽南陈年腌制萝卜微生物群落结构,结果发现3年的萝卜干中的优势菌属为鞘氨醇杆菌属(Sphingobacterium)、藤黄单胞菌(Luteimonas),5年以上的萝卜干中的优势菌属为不动杆菌(Acinetobacter)。3年的萝卜样本与5年以上的萝卜干在微生物群落组成上存在较大差异,年份越久,细菌群落越均匀,细菌多样性越高。不动杆菌(Acinetobacter)在腌制萝卜干后期占主导地位,可能在发酵过程中起着特殊作用,这为食品微生物的研究提供了新方向。
[1]熊丽霞,苏国成,江锋,等.不同腌制年份闽南“老菜脯”化学成分初步分析与分离纯化[J].现代食品科技,2016,32(5):309-314.
[2]黄红宣,王小平,陈育青,等.微波消解-原子吸收法测定闽南陈年老萝卜干中金属元素含量[J].中国中医药现代远程教育,2019,17(8):83-85.
[3]赵雪,卢珍华,曾荣急,等.不同产地腌渍萝卜化学成分分析及抑菌活性比较[J].中国酿造,2019,38(5):141-145.
[4]FILANNINO P,CARDINALI G,RIZZELLO C G,et al.Metabolic responses of Lactobacillus plantarum strains during fermentation and storageof vegetable and fruit juices[J].Appl Environ Microbiol,2014,80(7):2206-2215.
[5]刘宗敏,谭兴和,周红丽,等.植物乳杆菌发酵萝卜干品质变化分析[J].食品科学,2018,39(2):198-202.
[6]黄郑朝,宋莲军,黄现青,等.基于高通量测序对中国不同区域传统发酵香肠细菌多样性的研究[J].食品与发酵工业,2019,45(18):15-21.
[7]HE G,LIU T,SADIQ F A,et al.Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J].J Zhejiang U-Sci B,2017,18(4):289-302.
[8]石聪,李世瑞,李跑,等.基于高通量测序浏阳豆豉不同发酵阶段微生物多样性分析[J].食品与发酵工业,2018,44(2):27-32,39.
[9]余丹,毛娉,宋颀,等.基于高通量测序的传统甜面酱自然发酵过程中的微生物群落结构及其动态演替[J].微生物学通报,2018,45(5):1061-1072.
[10]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
[11]张颖,乌日娜,孙慧君,等.豆酱不同发酵阶段细菌群落多样性及动态变化分析[J].食品科学,2017,38(14):30-35.
[12]覃荣周,王琪林,任朝琴,等.Illumina 高通量测序技术分析中周羌稞养生酒窖泥细菌多样性[J].中国酿造,2017,36(1):138-141.
[13]郭倩倩,卢彪.基于高通量测序不同生产工艺晴隆酸菜细菌多样性分析[J].中国酿造,2019,38(8):73-76.
[14]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[15]SCHMIEDER R,EDWARDS R.Quality control and preprocessing of metagenomic datasets[J].Bioinformatics,2011,27(6):863-864.
[16]吴进菊,李宇昂,王梓杭,等.襄阳大头菜发酵过程中细菌多样性的研究[J].食品科学,2020,31(4):112-117.
[17]QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:improved data processing and web-based tools[J].Nucleic Acids Res,2013,41(D1):D590-D596.
[18]李欣蔚,丛敏,武俊瑞,等.基于16S rRNA 基因V3-V4 区高通量测序分析东北自然发酵酸菜中细菌群落结构[J].现代食品科技,2017,33(2):69-75.
[19]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[20]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[21]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[22]蔡训辉,王如意,胡胜男,等.鞘氨醇杆菌的研究进展[J/OL].基因组学与应用生物学:1-9[2019-11-26].http://kns.cnki.net/kcms/detail/45.1369.Q.20190110.1330.004.html.
[23]AL ATROUNI A,JOLY-GUILLOU M,HAMZE M,et al.Reservoirs of non-baumannii Acinetobacter species[J].Front Microbiol,2016,7:49.
[24]刘宗敏,谭兴和,周红丽,等.萝卜干腌制技术研究进展[J].中国酿造,2017,36(6):19-22.
[25]田建军,张开屏,杨明阳,等.应用Illumina MiSeq 测序技术比较风干肉中细菌多样性和微生物安全性[J].食品科学,2019,40(8):33-40.