β-葡萄糖苷酶(EC3.2.1.21)又称β-D-葡萄糖苷水解酶,首次于1837年由LIEBIG和WOHLER在苦杏仁中发现[1],其主要水解化合物末端的非还原性β-D-葡萄糖苷键,从而释放出β-D-葡萄糖和配基[2]。β-葡萄糖苷酶有非常广泛的工业应用,可用于降解纤维素生产生物乙醇、改善食品风味、转化大豆异黄酮糖苷化合物、制备低聚龙胆糖、防治病虫害等,具有巨大的生物技术应用前景[3]。尤其是作为香气改良或提升的关键酶,近几年有关其在食品增香中的研究倍受关注[4]。
β-葡萄糖苷酶在酒类(葡萄酒、果酒、白酒等)生产过程中可增加酒的香气[5-6]。目前,所用β-葡萄糖苷酶酶制剂大多来自于曲霉的固态发酵[7],该酶的加入虽然能改善酒的香气,但同时也给酿酒造成蛋白不稳定隐患[8]。因此,筛选具有β-葡萄糖苷酶活性的酿造酵母,已成为酿酒行业的瓶颈之一。
广东客家娘酒作为我国古老的酒种之一,已有5 000多年的历史,是客家古文化和酒文化相结合的精华,是东南及华南沿海一带(俗称岭南一带),如江苏、浙江、上海、福建、广东等省市客家人独有的民间传统发酵型黄酒[9]。本研究以其为原料,从中筛选产β-葡萄糖苷酶的酿造酵母,采用分子生物学技术对其进行鉴定,并研究其所产的β-葡萄糖苷酶的酶学性质,为筛选具有地区特色产β-葡萄糖苷酶野生酵母提供理论基础,同时,为本地区客家娘酒酿造酵母资源库的建设提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
广东客家娘酒酒糟:广东省梅州市某客家娘酒厂,于-80 ℃保存。
1.1.2 试剂
对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-Dglucopyranoside,p-NPGlc)、对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,p-NPGal)、对硝基苯基-β-D-纤维二糖苷(4-nitrophenyl-β-D-cellobioside,p-NPCel)、对硝基苯基-β-D-木糖苷(4-nitrophenyl-β-D-xylopyranoside,p-NPXyl)(均为色谱纯),七叶皂苷(分析纯):北京索莱宝科技有限公司;酵母基因组提取试剂盒:日本TaKaRa公司;酵母浸粉、胰蛋白胨(均为分析纯):广东环凯微生物科技有限公司;对硝基苯酚、葡萄糖、NaCl、MgSO4·7H2O、KH2PO4(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L,酵母浸膏10 g/L,121 ℃高压灭菌20 min。
筛选培养基[10]:柠檬酸铁0.5 g/L,酵母膏2 g/L,蛋白胨0.5g/L,琼脂20g/L,七叶苷1g/L,121℃高压蒸汽灭菌20min。
发酵培养基[11]:蛋白胨20 g/L,葡萄糖20 g/L,酵母浸膏10 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
722N型可见分光光度计:上海精密科学仪器有限公司;SW-CJ-IF超净工作台:苏州苏洁净化设备有限公司;JY96-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;H3018DR高速冷冻离心机:上海知信实验仪器技术有限公司;SPX-100B-Z生化培养箱:上海博迅医疗生物仪器股份有限公司。
1.3 方法
1.3.1 产β-葡萄糖苷酶酵母菌株的筛选
初筛:采用七叶苷功能筛选法进行初筛[12]。称取一定质量的酒曲,用无菌生理盐水稀释至适当梯度后,涂布于筛选培养基,28 ℃条件下培养72 h,挑取黑色圈明显的菌株为目标菌株进行复筛。
复筛:将初筛菌株接种于发酵培养基,28 ℃、200 r/min条件下培养72 h,测定β-葡萄糖苷酶活性,从中筛选酶活力较高的菌株[13]。
1.3.2 β-葡萄糖苷酶活性的测定
取发酵液20 mL,5 000 r/min离心5 min,弃上清,收集菌体。将菌体悬浮于10 mL磷酸缓冲盐(phosphate buffer saline,PBS)溶液(pH7.0)中,采用超声波破碎细胞(250 W超声破碎1 min,间歇30 s,破碎30次),4 ℃、10 000 r/min离心,取上清液,即为β-葡萄糖苷酶粗酶液。参考文献[14]并作修改测定β-葡萄糖苷酶活力,具体方法:取0.1 mL适当稀释的粗酶液,加入0.9 mL 5.0 mmol/L p-NPGlc(pH 6.0的Britton-Robinson缓冲液配制),50 ℃恒温水浴反应10 min,加入1 mL 1 mol/L的Na2CO3终止反应,静置5 min,显色,于波长400 nm处测定吸光度值。同时,以加热失活的酶液作为空白对照。
β-葡萄糖苷酶活力单位定义:在pH 6.0、50 ℃反应条件下,每分钟催化水解1 μmol p-NPGlc所需要的酶量为1个酶活力单位(IU)。
1.3.3 产β-葡萄糖苷酶菌株的分子生物学鉴定
采用酵母基因组提取试剂盒提取筛选菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,参考文献[15]对菌株的26S rDNA D1/D2区序列进行PCR扩增。将PCR扩增产物送至上海生工生物工程有限公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)网站的GenBank数据库中进行BLAST搜索比对,分析序列同源性。选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,采用MEGA X10软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 β-葡萄糖苷酶酶学性质研究
底物特异性[16]:以p-NPGlc、p-NPGal、p-NPCel和p-NPXyl为底物,测定β-葡萄糖苷酶活力,以最高酶活力为100%,计算相对酶活力。
最适反应温度:在25~70 ℃条件下测定β-葡萄糖苷酶活力,以最高酶活力为100%,计算相对酶活力。
温度稳定性:将粗酶液分别置于25~70 ℃条件下恒温水浴120 min,迅速冷却至室温,测定β-葡萄糖苷酶活力,以最高酶活力为100%,计算相对酶活力。
最适反应pH值:在pH值为3.0~8.0条件下测定β-葡萄糖苷酶活力,以最高酶活力为100%,计算相对酶活力。
pH稳定性:将粗酶液分别在pH值为3.0~8.0条件下室温静置1 h,测定β-葡萄糖苷酶活力,以最高酶活力为100%,计算相对酶活力。
金属离子对酶活性的影响:在反应体系中添加1 mmol/L或100 mmol/L的金属离子(Ca2+、Mn2+、Mg2+、Co2+、Zn2+、Fe2+、Ni+、K+、Al3+、Cu2+),测定β-葡萄糖苷酶的活力,以不含金属离子的酶活力为100%,计算相对酶活力。
1.3.5 数据处理
所有数据用SPSS24.0软件进行分析。
2 结果与分析
2.1 产β-葡萄糖苷酶酵母菌株的筛选
以广东客家娘酒发酵过程中的酒糟为分离源,通过七叶苷功能筛选法,初步筛选出β-葡萄糖苷酶活力较高的酵母18株,部分菌株的筛选结果见图1。
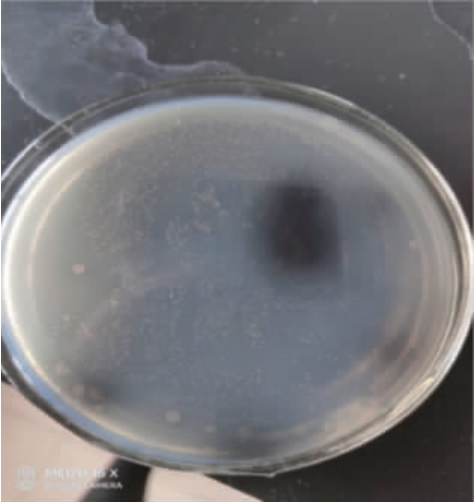
图1 产β-葡萄糖苷酶菌株的筛选结果
Fig.1 Screening results of β-glucosidase producing strain
由图1可知,具有β-葡萄糖苷酶活力的菌株会呈现黑色,黑色圈越大或出现越早则意味着菌株酶活力较高。然后通过复筛,得到β-葡萄糖苷酶活力最高的菌株,命名为kj_312,酶活力达到56.2 IU/L。因此,以该菌株作为试验菌株进行下一步的研究。
2.2 26S rDNA D1/D2区基因序列分析
将菌株kj_312的26S rDNA D1/D2区基因序列与Gen-Bank数据库中已鉴定的酵母的26S rDNA D1/D2区序列进行同源性比对,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,采用MEGA X10软件中的NJ法构建系统发育树,结果见图2。

图2 基于26S rDNA D1/D2区序列的产β-葡萄糖苷酶菌株的系统发育树
Fig.2 Phylogenetic tree of β-glucosidase producing strains based on 26S rDNA D1/D2 domain sequence
由图2可知,菌株kj_312与假丝酵母Candida apicola AN16聚于一支,亲缘关系最近。因此,初步鉴定该菌株为假丝酵母Candida apicola。
2.3 β-葡萄糖苷酶酶学性质
2.3.1 底物特异性
由图3可知,该β-葡萄糖苷酶可以水解p-NPGlc、p-NPCel、p-NPGal和p-NPXyl,其中以p-NPGlc为底物时,相对酶活力最高,其次为p-NPCel和p-NPGal。表明假丝酵母kj_312所产的β-葡萄糖苷酶具有较宽的底物特异性,能够水解多种底物,属于多功能酶[17-18],且其最适底物为p-NPGlc。
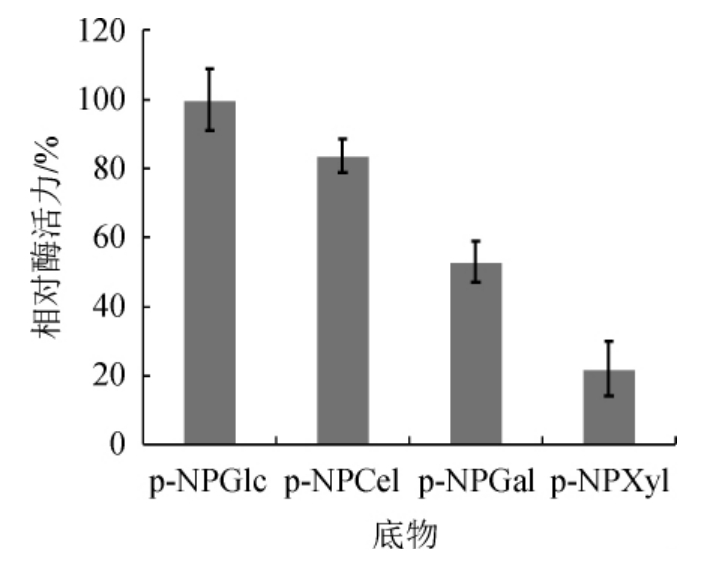
图3 菌株kj_312所产β-葡萄糖苷酶的底物特异性
Fig.3 Substrate specificity of β-glucosidase produced by strain kj_312
2.3.2 最适反应温度及温度稳定性
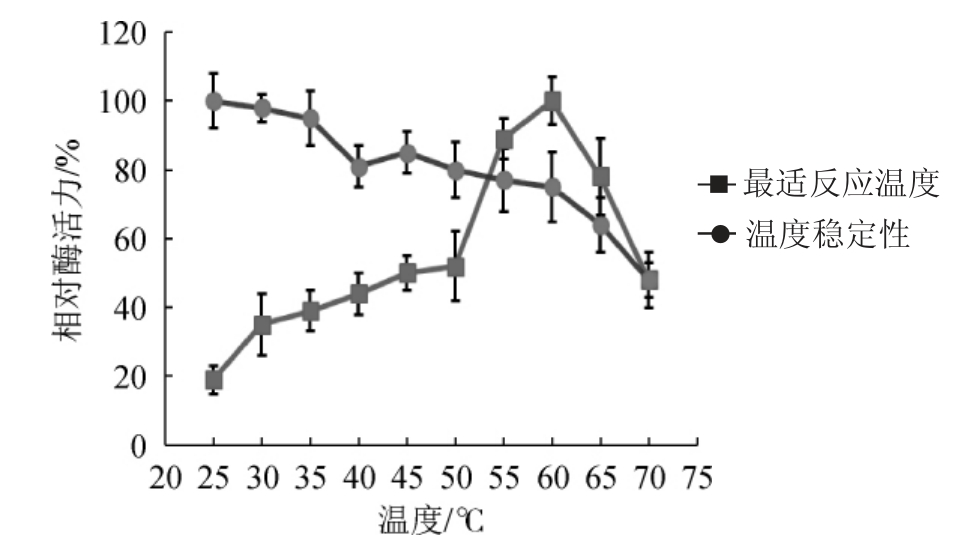
图4 菌株kj_312所产β-葡萄糖苷酶的最适反应温度及温度稳定性
Fig.4 Optimal reaction temperature and temperature stability of β-glucosidase produced by strain kj_312
由图4可知,在反应温度25~60 ℃范围内,β-葡萄糖苷酶活力随着温度的升高而升高;当反应温度为60 ℃时,酶活性达到最高;当温度高于60 ℃之后,酶活力呈现缓慢下降趋势。因此,确定β-葡萄糖苷酶的最适反应温度为60 ℃。当粗酶液在温度25~75 ℃范围内恒温水浴120 min,酶活力随着处理温度的升高逐渐下降,当处理温度为65 ℃时,相对酶活性为64%;当处理温度高于65 ℃之后,相对酶活力<50%,说明β-葡萄糖苷酶在25~65 ℃具有较好的稳定性。与其他酵母来源的β-葡萄糖苷酶[8,19]比较,本研究假丝酵母kj_312所产的β-葡萄糖苷酶具有较广的温度适应性。
2.3.3 最适反应pH值及pH稳定性
目前很多研究表明,绝大多数β-葡萄糖苷酶的最适pH值在3.5~5.5范围内,适宜于酿酒环境介质中应用[8,20]。由图5可知,假丝酵母kj_312所产的β-葡萄糖苷酶的最适反应pH值为4.5,并且在pH值4.0~7.0酸性范围内相对酶活力>80%,表现出较高的pH稳定性。结果表明,该β-葡萄糖苷酶能极大地满足在酿酒期间的pH要求,为该菌株在酿酒中的应用提供了依据。
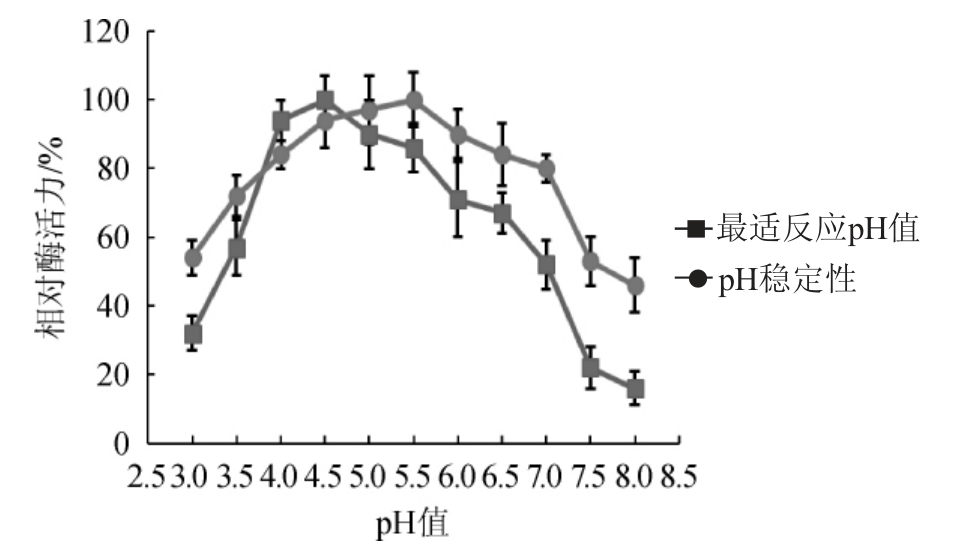
图5 菌株kj_312所产β-葡萄糖苷酶的最适反应pH值及pH稳定性
Fig.5 Optimal reaction pH and pH stability of β-glucosidase produced by strain kj_312
2.3.4 金属离子对β-葡萄糖苷酶活性的影响
表1 不同金属离子对β-葡萄糖苷酶活性的影响
Table 1 Effect of metal ions on β-glucosidase activity
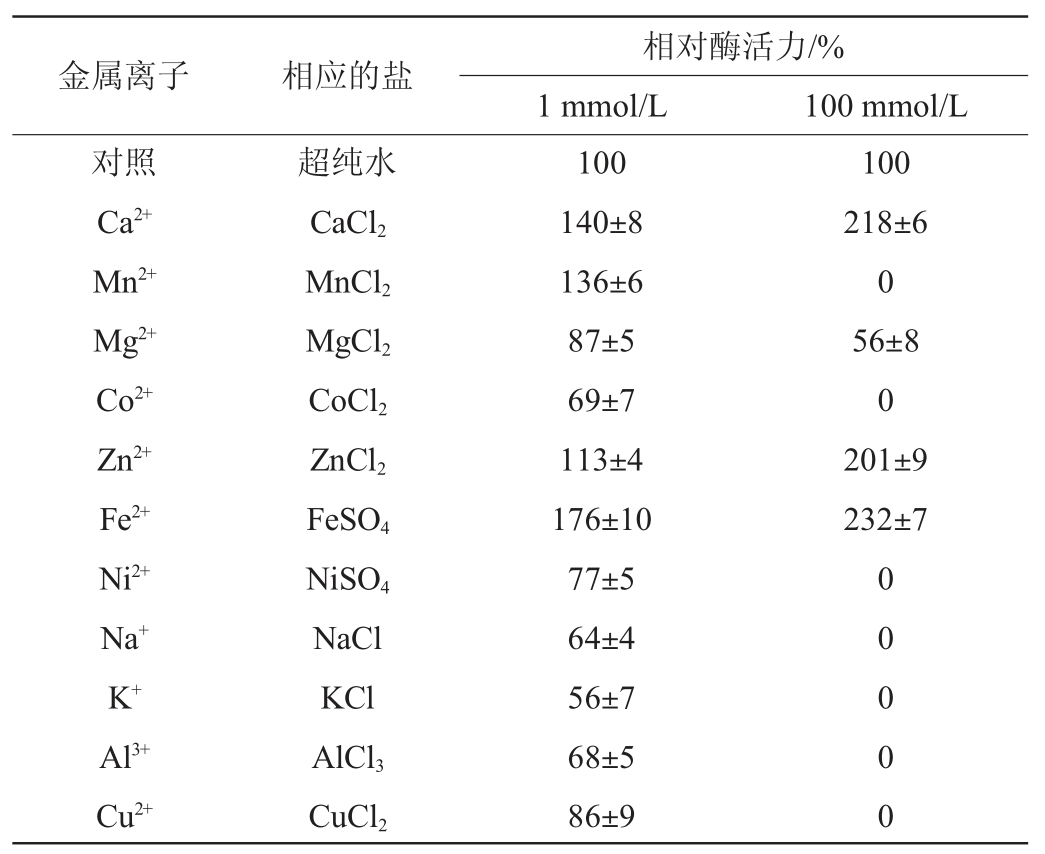
由表1可知,金属离子种类及浓度对酶活性的影响不同。在1 mmol/L浓度下,Ca2+、Mn2+、Zn2+和Fe2+使相对酶活力分别提高至140%、136%、113%和176%,其余金属离子则使相对酶活力降至56%~87%;而在100 mmol/L浓度下,Ca2+、Zn2+和Fe2+使相对酶活力提高至218%、201%和232%,Mg2+使相对酶活力降低至56%,Mn+、Co2+、Ni2+、Na+、K+、Al3+和Cu2+则使β-葡萄糖苷酶完全失活。
3 结论
从广东客家娘酒发酵过程中的酒糟中筛选得到1株产β-葡萄糖苷酶活力较高的酵母菌,命名为kj_312,经26srDNA D1/D2区基因序列分析,鉴定其为假丝酵母Candida apicola。酶学性质研究表明,该酵母所产的β-葡萄糖苷酶具有较宽的底物特异性,对多种底物较具有高的催化活性,最适底物为对硝基苯基-β-D-吡喃葡萄糖苷;最适反应温度为60 ℃,在25~65 ℃范围内相对酶活力>50%;最适pH值为4.5,在pH 4.0~7.0酸性范围内相对酶活力>80%;1 mol/L的Ca2+、Mn2+、Zn2+和Fe2+及100 mol/L的Ca2+、Zn2+和Fe2+能显著提高酶活力。
[1]王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[2]OLIVEIRA R P,SANTOS B V,COSTA L,et al.Xylanase and β-glucosidase production by Aspergillus fumigatus using commercial and lignocellulosic substrates submitted to chemical pre-treatments[J].Ind Crop Prod,2017,95(2):453-459.
[3]邓发军,潘宇,常飞,等.β-葡萄糖苷酶与透明颤菌血红蛋白在大肠杆菌中的共表达[J].生物工程学报,2018,34(3):379-388.
[4]姚瑶,刘庆,刘福,等.β-葡萄糖苷酶的性质及其在食品加工中的应用研究进展[J].贵州农业科学,2018,46(2):132-135.
[5]李洁,曾钰,张明明,等.破坏细胞壁蛋白CWP2 基因提高重组酿酒酵母β-葡萄糖苷酶胞外酶活[J].微生物学通报,2020,47(3):681-690.
[6]GUEGUEN Y,CHEMARDIN P,JANBON G,et al.A very efficient β-glucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices[J].J Agr Food Chem,1996,44(8):2336-2340.
[7]王彩肖,武伟伟,李艳.产β-D-葡萄糖苷酶酵母菌的筛选及产酶性质研究[J].酿酒科技,2014(10):14-19.
[8]曾林,谭霄,袁春红,等.白酒黄水中纤维素降解菌的分离鉴定及产酶活性研究[J].中国酿造,2016,35(11):59-63.
[9]沈棚,黄敏欣,白卫东,等.客家娘酒中氨基甲酸乙酯回归分析[J].中国酿造,2013,32(5):153-156.
[10]王佳,胡兰兰,张军翔,等.高产β-葡萄糖苷酶野生酵母的筛选及产酶能力差异性分析[J].中国酿造,2018,37(2):50-53.
[11]张方方,江璐,刘延琳.酿酒条件对两株商业酿酒酵母β-葡萄糖苷酶的影响[J].食品科学,2014,35(3):148-152.
[12]马得草,游灵,李爱华,等.高产β-葡萄糖苷酶野生酵母的快速筛选及其糖苷酶酿造适应性研究[J].西北农林科技大学学报(自然科学版),2018,46(1):129-135.
[13]侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[14]张敏,李佳益,倪永清,等.产β-葡萄糖苷酶非酿酒酵母的筛选及酶学特性研究[J].中国酿造,2016,35(5):97-101.
[15]陈杰,赵雨薇,倪永清,等.新疆石河子地区酵母菌的生物多样性及系统发育研究[J].中国酿造,2012,31(11):102-105.
[16]华承伟,于江傲,李兰,等.拟青霉FLH30 胞内β-葡萄糖苷酶特性研究[J].食品工业科技,2014,35(24):152-156.
[17]刘晓静,钱昌丽,周志华,等.白蚁肠道元基因组来源高温β-葡萄糖苷酶Bgl17 的酶学性质[J].微生物学通报,2015,42(12):2337-2344.
[18]GRUNINGER R J,GONG X,FORSTER R J,et al.Biochemical and kinetic characterization of the multifunctional β-glucosidase/β-xylosidase/α-arabinosidase,Bgxa1[J].Appl Microbiol Biotechn,2014,98(7):3003-3012.
[19]徐亚男,史学伟,安洋洋,等.产β-葡萄糖苷酶酵母菌的分离鉴定及酶学特性[J].食品与生物技术学报,2016,35(10):1100-1105.
[20]唐乐丽,王晓萌,吴秀玲.宏基因组文库新型β-葡萄糖苷酶的筛选、克隆及酶学性质分析[J].食品科学,2018,39(4):118-124.