淀粉广泛存在于谷物类饲料中,是大多数畜禽所需能量的主要来源之一[1]。淀粉酶是催化淀粉水解成葡萄糖、麦芽糖及糊精一类酶的总称[2]。在动物生产行业中,淀粉酶主要作为饲料添加剂被添加到动物饲料中,以弥补动物体内淀粉酶的不足,从而提高饲料利用率,降低养殖成本,减少养殖环境的污染[3-4]。但是淀粉酶作为蛋白质类生物大分子,易受饲料加工制粒、贮藏等因素影响而失活[3-4]。
乳酸菌是一群革兰氏阳性、能够发酵碳水化合物、以乳酸为主要代谢产物的各类细菌统称,是人与大多数动物肠道内的常见优势菌群,被公认为安全级微生物[5-8]。乳酸菌是使用得最广泛的一类益生菌。此外,虽然与其他原核表达系统(如大肠杆菌(Escherichia coli)表达系统、枯草芽孢杆菌(Bacillus subtilis)表达系统等)相比,乳酸菌表达系统的研究和开发较晚,但是随着人们对乳酸菌各类表达调控元件的不断研究,陆续研发出了适用于乳酸菌的多种载体,如克隆载体、表达载体(分泌型表达载体、组成型表达载体)、整合载体等,使得乳酸菌工程菌的构建成为了目前研究的热点[9-13]。乳酸菌表达系统的优点在于乳酸菌安全、无内毒素,表达的外源蛋白无需经过纯化可以直接连同菌体一起使用。外源蛋白质在乳酸菌表达系统中的分泌表达依赖于信号肽的引导[14]。已有研究表明,乳酸菌表达系统中不同信号肽对同一种外源蛋白质的引导分泌效率可能相差较大,即信号肽与外源蛋白质之间存在适配性[15]。因此,针对特定的外源蛋白质需要选择合适的信号肽来实现其在乳酸菌表达系统中的有效分泌表达。
来源于高温烷烃地芽孢杆菌(Geobacillus thermoleovorans)的α-淀粉酶Gt-amy属于嗜热酸性生淀粉α-淀粉酶,可有效降解玉米淀粉,其最适反应pH值为5.0,Gt-amy是目前文献报道的玉米淀粉降解率最高的嗜热酸性生淀粉α-淀粉酶[16]。为了提高嗜热酸性生淀粉α-淀粉酶Gt-amy在饲料工业中的应用可行性,该研究以实验室前期从健康仔猪肠道黏膜上分离纯化得到的具有优良益生特性的粪肠球菌(Enterococcus faecalis)EXW27[17]为宿主菌,以大肠杆菌-乳酸菌穿梭质粒pSIP401为表达载体,对来源于粪肠球菌的8种信号肽进行筛选,旨在获得引导Gt-amy在粪肠球菌EXW27中高效分泌表达的信号肽,从而构建组成型分泌表达生淀粉α-淀粉酶Gt-amy的重组粪肠球菌,以期构建既具有益生特性又具有生淀粉α-淀粉酶活性的转基因粪肠球菌,为生淀粉α-淀粉酶Gt-amy在饲料工业的应用提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)JM109、粪肠球菌(Entercoccus faecalis)EXW27、重组质粒pSTOP1622-gtamyhds[18]、大肠杆菌-乳酸菌穿梭质粒pSIP401[19]:实验室保存。
1.1.2 试剂
KOD-Plus-neo脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:日本Toyobo公司;DNA限制性内切酶、T4DNA连接酶、DNA Marker、蛋白质Marker:美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒:美国Omega Bio-tek公司;Chelating SepharoseTM Fast Flow:美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)引物、红霉素(均为分析纯):上海生工生物工程股份有限公司。
1.1.3 培养基
LB固体培养基:胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,琼脂2%。121 ℃高压蒸汽灭菌20 min。
MRS液体培养基:胰蛋白胨1%,酵母提取物0.5%,牛肉膏1%,葡萄糖2%,磷酸氢二钾0.2%,柠檬酸氢二铵0.2%,乙酸钠0.4%,硫酸镁0.058%,硫酸锰0.025%,吐温0.1%,pH 6.2。115 ℃高压蒸汽灭菌20 min。MRS固体培养基中加入20 g/L琼脂。
1.2 仪器与设备
MastercyclergradientPCR仪:美国Eppendorf公司;TY04S-3C型凝胶成像系统:北京君意东方电泳设备有限公司;SCIENTZ-ⅡD型超声波细胞破碎仪:宁波新芝生物科技股份有限公司;SP-752PC型紫外可见分光光度计:上海光谱仪器有限公司。
1.3 方法
1.3.1 重组质粒pSIP401Z-gtamyhds的构建与鉴定
基于生淀粉α-淀粉酶Gt-amy的基因gtamy的碱基序列,设计引物P1和P2(见表1)。以重组质粒pSTOP1622-gtamyhds为模板,PCR扩增基因gtamy中不含信号肽的结构基因gtamyhds。PCR扩增体系:10×buffer I 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)5 μL,MgSO4 5 μL,引物P1和P2各2 μL,模板1 μL,KOD-Plus-neo DNA聚合酶2 μL,双蒸水(ddH2O)28 μL。PCR扩增条件:98 ℃预变性5 min;98 ℃变性20 s,60 ℃退火20 s,74 ℃延伸2 min,30个循环;74 ℃再延伸10 min。PCR扩增产物经Xho I和Hind III双酶切,连接至经相同双酶切处理的载体pSIP401,构建重组质粒pSIP401-gtamyhds。将连接产物转化至E.coli JM109感受态细胞,并涂布于含200 μg/mL红霉素的LB固体平板上,37 ℃过夜培养。挑取LB固体平板上的转化子,提取重组质粒,采用Xho I和Hind III进行双酶切,鉴定阳性重组子。
表1 构建重组质粒所用引物序列
Table 1 Primer sequences for the construction of recombinant plasmids
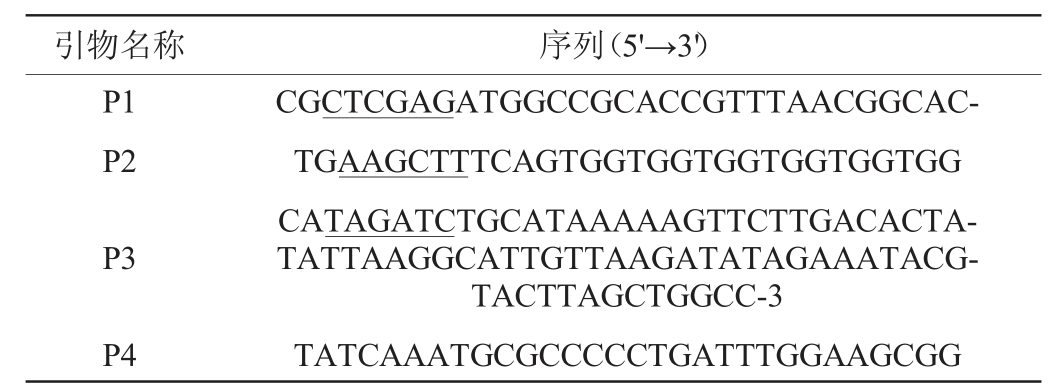
注:下划线标注的部分为限制性酶切位点。下同。
在重组质粒pSIP401-gtamyhds的基础上,参照文献[20]中人工启动子文库构建方法,根据质粒pSIP401和基因gtamy的碱基序列设计引物P3和P4,将重组质粒pSIP401-gtamyhds中启动子替换为本实验室前期研究工作筛选得到的粪肠球菌中组成型高表达的启动子p10[21],构建重组质粒pSIP401Zgtamyhds。组成型高表达启动子p10的碱基序列为5'-AGATCTGCATAAAAAGTTCTTGACACTATATTAAGGCATTGTTAAGATATAGAAATAGCG-3'。具体步骤如下:以重组质粒pSIP401-gtamyhds为模板,采用引物P3和P4进行PCR扩增。PCR扩增体系:10×buffer I 5 μL,dNTP 5 μL,MgSO4 5 μL,引物P3和P4各2 μL,模板1 μL,KOD-Plus-neo DNA聚合酶2 μL,ddH2O 28 μL。PCR扩增条件:98 ℃预变性5 min;98 ℃变性20 s,60 ℃退火20 s,74 ℃延伸10 s,30个循环;74 ℃再延伸5 min。PCR扩增产物经Bgl II和Nco I双酶切,连接至经相同双酶切处理的载体pSIP401-gtamyhds,构建重组质粒pSIP401Z-gtamyhds。将连接产物转化E.coli JM109感受态细胞,并涂布于含200 μg/mL红霉素的LB固体平板上,37 ℃过夜培养。挑取LB固体平板上转化子,提取重组质粒。将重组质粒送至上海生工生物工程股份有限公司进行测序,并与对应基因序列进行BLAST比对确认。
1.3.2 信号肽筛选质粒的构建与鉴定
根据文献[22]提供的粪肠球菌来源的信号肽(s1~s8)的基因序号,在美国国立生物技术信息中心(national center for biotechnology information,NCBI)中找出粪肠球菌中信号肽的氨基酸序列和对应的基因序列,其中氨基酸序列的具体信息见表2。采用化学全合成方法[18]合成包含限制性酶切位点Nco I和Xho I以及信号肽碱基序列的DNA片段:5'-AGCCATGG(Nco I)-信号肽碱基序列-CTCGAG(Xho I)TG-3'。所合成的DNA片段经Nco I和Xho I双酶切,连接至经相同双酶切处理的载体pSIP401Z-gtamyhds,构建信号肽筛选质粒pSIP401Z-(s1~s8)-gtamyhds。将连接产物转化至E.coli JM109感受态细胞,并涂布于含200 μg/mL红霉素的LB固体平板上,37 ℃过夜培养。挑取LB固体平板上转化子,提取重组质粒。将重组质粒送至上海生工生物工程股份有限公司进行测序,并与对应基因序列进行BLAST比对确认。
表2 粪肠球菌来源的信号肽
Table 2 Signal peptides from Entercoccus faecalis

1.3.3 重组粪肠球菌的构建
参照文献[19]将信号肽筛选质粒pSIP401Z-(s1~s8)-gtamyhds电击转化至E.faecalis EXW27,并涂布于含10μg/mL红霉素的MRS固体平板上,37℃培养24h,获得重组E.faecalis EXW27/pSIP401Z-(s1~s8)-gtamyhds(S1~S8)。
1.3.4 重组粪肠球菌中嗜热酸性生淀粉α-淀粉酶Gt-amy的组成型分泌表达和纯化
将重组粪肠球菌涂布于含10 μg/mL红霉素的100 mL MRS液体培养基中,37 ℃条件下静置培养24 h。然后转接于含10 μg/mL红霉素的100 mL MRS液体培养基中,接种量为3%(V/V),37 ℃条件下静置培养36 h。发酵液在4 ℃条件下经8 000×g离心5 min,分别收集菌体沉淀和发酵上清液。采用50 mmol/L 2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)(pH 5.0)缓冲液重悬菌体沉淀,置于冰上用超声波破碎细胞。超声波细胞破碎条件:超声波功率250 W,超声波破碎时间3 s,间歇6 s。超声波处理菌体细胞至菌体悬液变为均一的溶液,12 000×g离心5 min后收集上清,即为重组粪肠球菌胞内成分。分别测定发酵上清液和重组粪肠球菌胞内的α-淀粉酶酶活,并采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测发酵上清液和重组粪肠球菌胞内重组嗜热酸性生淀粉α-淀粉酶的表达情况。以转化了质粒pSIP401的重组粪肠球菌为阴性对照(C1),以转化了重组载体pSIP401Z-gtamyhds的重组粪肠球菌为阴性对照(C2),筛选最优信号肽。
采用Ni2+亲和层析柱对发酵上清液中的嗜热酸性生淀粉α-淀粉酶Gt-amy进行纯化,用250 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的嗜热酸性生淀粉α-淀粉酶Gt-amy。利用SDS-PAGE检测嗜热酸性生淀粉α-淀粉酶Gt-amy的纯度,并采用Bradford法[23]测定其浓度。
1.3.5 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的酶学性质分析
参照文献[24]测定重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适反应pH值、pH稳定性、最适反应温度、80 ℃热稳定性以及玉米淀粉降解率。
1.3.6 检测方法
嗜热酸性生淀粉α-淀粉酶Gt-amy分子质量:参照文献[25],采用SDS-PAGE检测。
嗜热酸性生淀粉α-淀粉酶Gt-amy对可溶性淀粉的酶活力测定:将10μL酶液与490μL含1%可溶性淀粉的50 mmol/L MES(pH 5.0)缓冲液混合,80 ℃条件下反应30 min,迅速冰浴,终止反应,然后采用3,5-二硝基水杨酸(3,5-dinitros alicylic acid,DNS)法[26]测定反应体系中还原糖量。酶活力单位定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.3.7 数据处理
运用软件SigmaPlot 12.5对试验数据进行统计分析并作图,结果均以“平均值±标准偏差”表示。
2 结果与分析
2.1 信号肽的筛选
重组E.faecalis EXW27/pSIP401Z-(s1~s8)-gtamyhds(S1~S8)发酵上清液和胞内嗜热酸性生淀粉α-淀粉酶Gt-amy活性测定结果见图1。
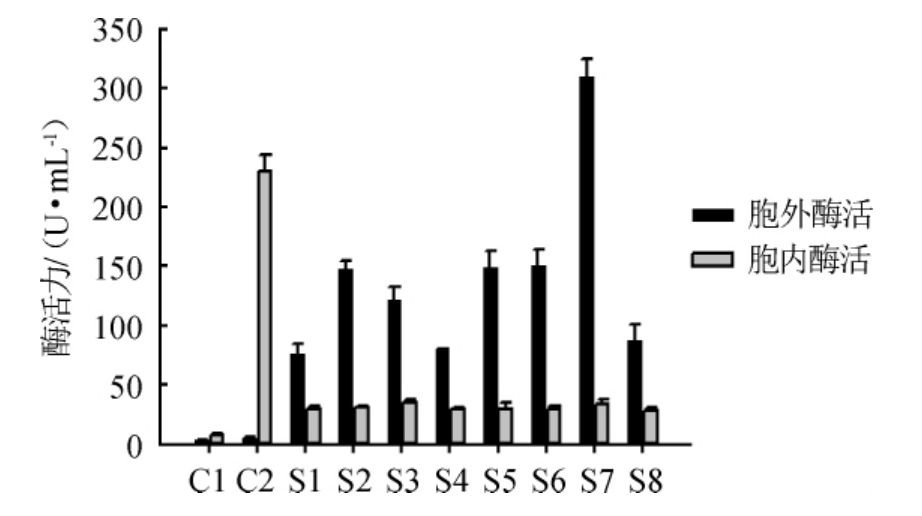
图1 不同信号肽对嗜热酸性生淀粉α-淀粉酶Gt-amy活性的影响
Fig.1 Effect of different signal peptides on thermoacidiphilic raw starch α-amylase Gt-amy activity
由图1可知,阴性对照C1和C2发酵上清液中的Gt-amy活性较低,胞内Gt-amy活性较高,8种信号肽均能引导Gt-amy分泌至发酵上清液中,其中重组菌S7发酵上清液中的Gt-amy活力最高,为310 U/mL。结果表明,信号肽s7有利于嗜热酸性生淀粉α-淀粉酶Gt-amy分泌至胞外,可实现Gt-amy在粪肠球菌中的高效分泌表达。
重组E.faecalis EXW27/pSIP401Z-(s1~s8)-gtamyhds(S1~S8)发酵上清液和细胞裂解液的SDS-PAGE检测结果见图2。由图2可知,转化了不同信号肽筛选载体的重组粪肠球菌的发酵上清液中均有一条分子质量约为56 kDa的蛋白质条带,而阴性对照C1和C2的发酵上清液中未见明显的蛋白质条带。且使用信号肽s7后,重组粪肠球菌发酵上清液中嗜热酸性生淀粉α-淀粉酶Gt-amy的表达量明显提高,这与α-淀粉酶活性测定结果一致。由图2B可知,阴性对照C2的发酵菌体中能观察到约56 kDa的蛋白质条带,而阴性对照C1以及其他重组粪肠球菌的发酵菌体中未能明显观察到大小相同的蛋白质条带。
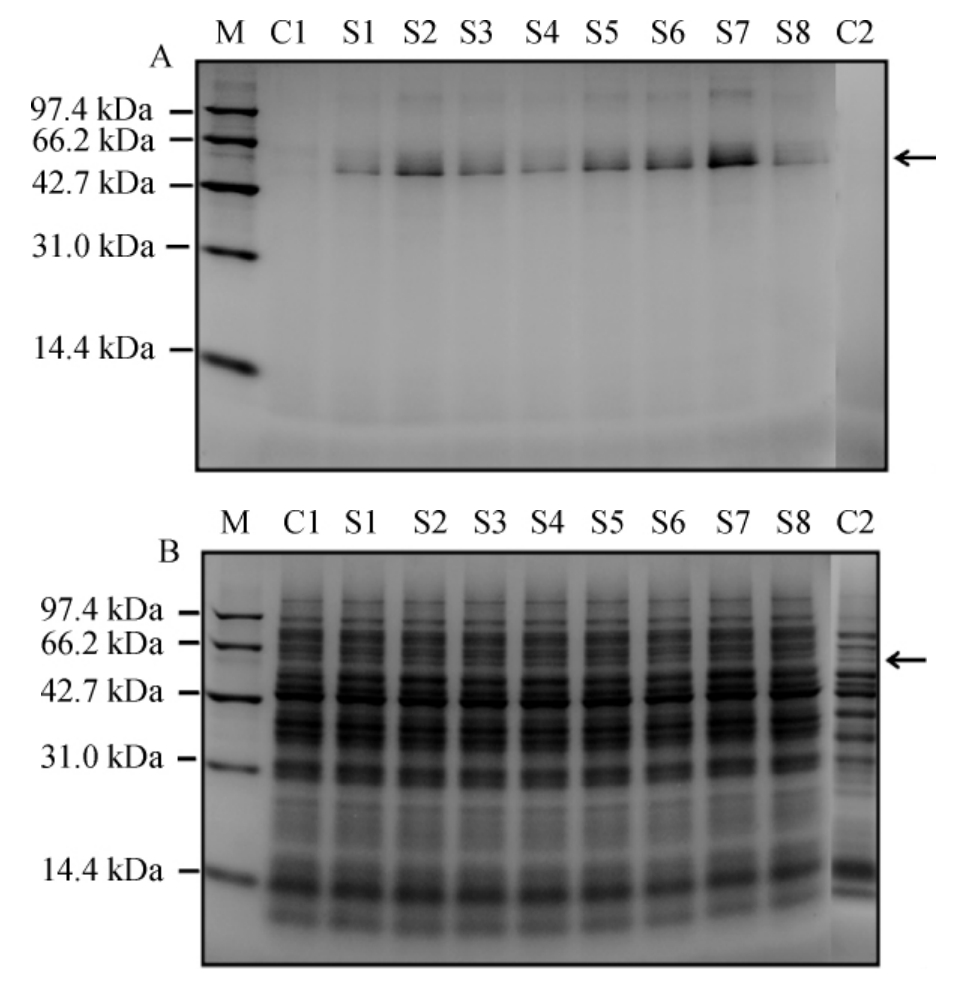
图2 重组粪肠球菌上清液(A)及细胞裂解液(B)的SDS-PAGE结果
Fig.2 SDS-PAGE results of fermentation supernatant(A)and cell lysis solution(B)of recombinant Entercoccus faecalis
M为蛋白质Marker;图中箭头指示目的蛋白。下同。
以上研究结果表明,信号肽s7能够引导嗜热酸性生淀粉α-淀粉酶Gt-amy在粪肠球菌EXW27中分泌表达,据文献报道,信号肽s7为脂蛋白(EF0071)的信号肽[22]。
2.2 重组粪肠球菌中嗜热酸性生淀粉α-淀粉酶Gt-amy的纯化
重组粪肠球菌S7中嗜热酸性生淀粉α-淀粉酶Gt-amy纯化后的SDS-PAGE检测结果见图3。由图3可知,重组粪肠球菌S7中嗜热酸性生淀粉α-淀粉酶Gt-amy的分子质量约为56 kDa,与理论值基本一致。
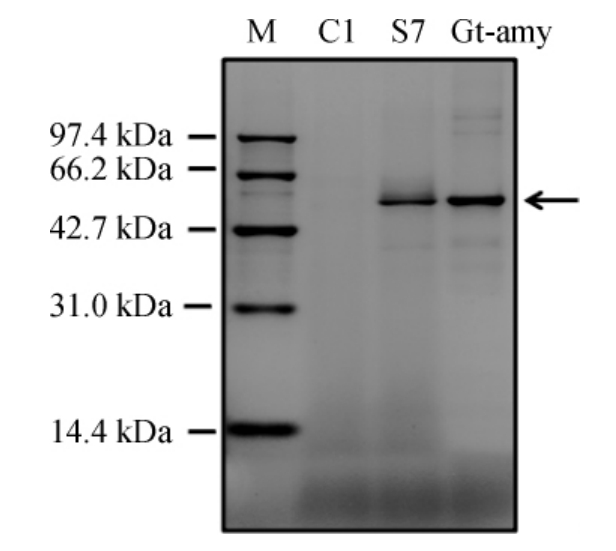
图3 纯化后嗜热酸性生淀粉α-淀粉酶Gt-amy的SDS-PAGE结果
Fig.3 SDS-PAGE results of thermoacidiphilic raw starch α-amylase Gt-amy after purification
Gt-amy为纯化后的蛋白质。
2.3 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的酶学性质
2.3.1 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适作用pH值和pH稳定性
pH值对重组嗜热酸性生淀粉α-淀粉酶Gt-amy活力的影响见图4。由图4A可知,重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适反应pH值为5.0,且其在pH值4.5~7.0范围内具有50%以上相对酶活。由图4B可知,其在pH 4.0~8.0范围内具有50%以上的相对酶活。重组粪肠球菌表达的重组Gt-amy的最适反应pH值和pH稳定性与野生型Gt-amy[16]基本一致。

图4 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适作用pH值(A)及pH稳定性(B)
Fig.4 Optimal reaction pH(A)and pH stability(B)of recombination thermoacidiphilic raw starch α-amylase Gt-amy
2.3.2 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适作用温度和热稳定性
温度对重组嗜热酸性生淀粉α-淀粉酶Gt-amy活力的影响见图5。由图5A可知,重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适反应温度为80 ℃。由图5B可知,其于80 ℃的半衰期约为3 h。重组粪肠球菌表达的重组Gt-amy的最适反应温度和于80 ℃条件下的热稳定性与野生型Gt-amy[16]基本一致。

图5 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的最适作用温度(A)及80 ℃条件下热稳定性(B)
Fig.5 Optimal reaction temperature(A)and thermal stability(B)at 80 ℃of recombination thermoacidiphilic raw starch α-amylase Gt-amy
2.3.3 嗜热酸性生淀粉α-淀粉酶Gt-amy对玉米淀粉的降解
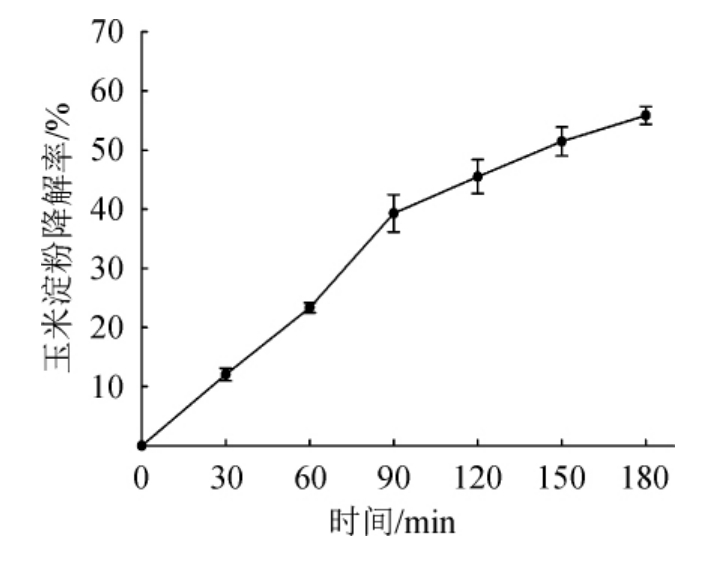
图6 重组嗜热酸性生淀粉α-淀粉酶Gt-amy的玉米淀粉降解率
Fig.6 Corn starch hydrolysis rate of recombinant thermoacidiphilic raw starch α-amylase Gt-amy
由图6可知,在40 ℃条件下,重组嗜热酸性生淀粉α-淀粉酶Gt-amy对30%玉米淀粉的降解率随着时间的延长而提高。当反应时间达到3 h,重组嗜热酸性生淀粉Gt-amy对玉米淀粉的降解率达到55.8%。结果表明,重组粪肠球菌所表达的重组嗜热酸性生淀粉Gt-amy可降解玉米淀粉,这为重组嗜热酸性生淀粉Gt-amy在饲料工业中的提供了理论依据。
3 结论
以诱导型大肠杆菌-乳酸菌穿梭载体pSIP401为表达载体,首先采用本实验室前期研究工作筛选得到的高效组成型启动子P10替换pSIP401-gtamyhds中诱导型启动子,然后分别引入粪肠球菌来源的8种信号肽,构建嗜热酸性生淀粉α-淀粉酶Gt-amy在粪肠球菌EXW27中组成型分泌表达的信号肽筛选载体。采用电击转化方法将信号肽筛选载体转入具有优良益生特性的粪肠球菌EXW27来构建重组粪肠球菌。通过比较重组粪肠球菌的发酵上清液中α-淀粉酶活性,确定信号肽s7能够最高效引导重组Gt-amy分泌至重组粪肠球菌胞外,发酵上清液中重组Gt-amy活性达到310 U/mL。重组Gt-amy的最适反应pH值为5.0,在pH 4.0~8.0范围内具有较好的稳定性,最适反应温度为80 ℃,于80 ℃的半衰期为3 h,在40 ℃条件下反应3 h,对玉米淀粉的降解率达到55.8%。本研究构建了既具有益生特性又具有嗜热酸性生淀粉α-淀粉酶活性的转基因粪肠球菌,这为嗜热酸性生淀粉α-淀粉酶Gt-amy在饲料工业的应用提供了新思路,也为研制新型转基因微生态制剂奠定了基础。
[1]AI Y,JANE J.Gelatinization and rheological properties of starch[J].Starch-Stärke,2015,67(3-4):213-224.
[2]JUJJAVARAPU S E,DHAGAT S.Evolutionary trends in industrial production of α-amylase[J].Recent Pat Biotechnol,2019,13(1):4-18.
[3]RANA N,WALIA A,GAUR A.α-Amylases from microbial sources and its potential applications in various industries[J].Natl Acad Sci Lett,2013,36(1):9-17.
[4]ZHANG Q,HAN Y,XIAO H.Microbial α-amylase:a biomolecular overview[J].Process Biochem,2017,53:88-101.
[5]WANG C,SHI C,ZHANG Y,et al.Microbiota in fermented feed and swine gut[J].Appl Microbiol Biotechnol,2018,102(7):2941-2948.
[6]MOKOENA M P.Lactic acid bacteria and their bacteriocins:classification,biosynthesis and applications against uropathogens:A mini-review[J].Molecules,2017,22(8):1255.
[7]KLEEREBEZEM M,KUIPERS O P,SMID E J.Lactic acid bacteria-a continuing journey in science and application[J]. FEMS Microbiol Rev,2017,41(Supp_1):S1-S2.
[8]KLAENHAMMER T R.Get cultured:eat bacteria[J]. Annu Rev Food Sci Technol,2019,10:1-20.
[9]PETERBAUER C,MAISCHBERGER T,HALTRICH D.Food-grade gene expression in lactic acid bacteria[J].Biotechnol J,2011,6(9):1147-1161.
[10]LANDETE J M.A review of food-grade vectors in lactic acid bacteria:from the laboratory to their application[J]. Crit Rev Biotechnol,2017,37(3):296-308.
[11]DUONG T,MILLER M J,BARRANGOU R,et al.Construction of vectors for inducible and constitutive gene expression in Lactobacillus[J].Microb Biotechnol,2011,4(3):357-367.
[12]亓秀晔,刘乃芝,程福亮,等.乳酸菌用作口服疫苗表达载体的应用研究进展[J].中国酿造,2019,38(6):18-23.
[13]NGUYEN H M,PHAM M L,STELZER E M,et al.Constitutive expression and cell-surface display of a bacterial β-mannanase in Lactobacillus plantarum[J].Microb Cell Fact,2019,18(1):76.
[14]MATHIESEN G,SVEEN A,PIARD J C,et al.Heterologous protein secretion by Lactobacillus plantarum using homologous signal peptides[J].J Appl Microbiol,2008,105(1):215-226.
[15]PENG C,SHI C,CAO X,et al.Factors influencing recombinant protein secretion efficiency in gram-positive bacteria:signal peptide and beyond[J].Front Bioeng Biotech,2019,7:139.
[16]MEHTA D,SATYANARAYANA T.Biochemical and molecular characterization of recombinant acidic and thermostable raw-starch hydrolysing α-amylase from an extreme thermophile Geobacillus thermoleovorans[J].J Mol Catal B:Enzym,2013,85:229-238.
[17]郭建军,熊大维,曾静,等.饲用粪肠球菌EXW27 培养条件的响应面优化[J].中国饲料,2019(23):46-51.
[18]曾静,郭建军,涂熠坤,等.嗜热酸性生淀粉α-淀粉酶Gt-amy 中结构域C 的环化重排及其对Gt-amy 催化性能的影响[J].食品科学,2019,40(20):144-151.
[19]RUIZ-CRUZ S,SOLANO-COLLADO V,ESPINOSA M,et al.Novel plasmid-based genetic tools for the study of promoters and terminators in Streptococcus pneumoniae and Enterococcus faecalis[J].J Microbiol Methods,2010,83(2):156-163.
[20]RUD I,JENSEN P R,NATERSTAD K,et al.A synthetic promoter library for constitutive gene expression in Lactobacillus plantarum[J].Microbiology,2006,152(Pt 4):1011-1019.
[21]袁林,曾静,郭建军,等.植酸酶YiAPPA 在粪肠球菌中的高效组成型表达研究[J/OL].食品工业科技:[2020-02-18].http://kns.cnki.net/kcms/detail/11.1759.TS.20191216.1319.004.html.
[22]BENACHOUR A,MORIN T,HÉBERT L,et al.Identification of secreted and surface proteins from Enterococcus faecalis[J].Can J Microbiol,2009,55(8):967-974.
[23]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[24]曾静,郭建军,袁林.D407A/D430A 双位点突变对嗜热酸性生淀粉α-淀粉酶GTamy 酶学性质的影响[J].食品工业科技,2018,39(14):103-109.
[25]GREEN M R,SAMBROOK J.Molecular cloning:a laboratory manual[M].New York:Cold Spring Harbor Laboratory Press,2012.
[26]BERNFELD P.Amylases α and β[J].Method Enzymol,1955,1:149-158.