双歧杆菌(Bifidobacterium)是人体和动物肠道内的重要菌群,对宿主具有积极的健康益处[1-2],如促进人体对营养物质的吸收[3],调节肠道菌群平衡,治疗腹泻,降低胆固醇[4-5]等,因此近年来被广泛应用在功能性食品中。菌粉产品相比于液态益生菌产品,具有便于运输、耐储藏和活菌数高的优点,从工业角度更有利于开发益生菌制剂产品。
生物膜是细菌自身与其分泌的多糖、蛋白、脂类化合物和核酸等胞外聚合物基质进行有序地包裹,并形成具有一定结构的微生物群落[6]。研究发现自然界中的99%细菌基本上都是以生物膜的形式存在的[7]。生物膜细菌在不利环境条件下,会通过自身分泌的胞外多糖聚合在固体表面,阻止了细菌与有害物质的直接接触,提高对恶劣环境的耐受性[8]。近年来,对生物膜的研究主要集中在污水处理和医学领域,研究方向主要为抑制病原菌生物膜[9]的产生,特别是如何消除铜绿假单胞菌和金黄色葡萄球菌的生物膜[10-11]。同样的,益生菌也可以通过生成生物膜增强自身对外界不利环境的抵御能力。GROSSOVA M等[12]研究发现,益生菌生物膜比病原微生物生物膜对低pH值和胆盐具有更高的抗性,CHEOW W S 等[13]验证形成生物膜后的鼠李糖乳杆菌微胶囊,冷冻干燥能力提高了将近40倍。
生物膜的形成在很大程度上受到环境的影响,且生物膜的结构很大程度上取决于环境,环境会影响细胞的基因表达,第二信使环磷酸腺苷(cyclicadenosinemonophosphate,cAMP)和环二鸟苷酸(bis-(3'-5')-cyclic diguanosine monophosphate,c-di-GMP)是控制生物膜形成的主要调控因子,调控生物膜表面蛋白、胞外多糖(exopolysaccharide,EPS)的合成[14]。LIU J等[15]通过控制碳源(甘油)和氮源(谷氨酸)研究枯草芽孢杆菌生物膜中菌群面对营养物质缺乏时的反应,发现是谷氨酸饥饿(而不是甘油)引起了生物膜生长速率振荡,说明碳源和氮源对生物膜的影响不同。生物膜细菌多发生在潮湿环境下,以固相基质为载体形成微生物群落。生物膜的产生离不开成膜基质,目前研究人员常用的成膜载体主要为微孔板[16],在实际工业生产中的指导意义较小。USHAKOVA N A等[17]研究发现,乳杆菌在麦麸基质上成膜后具有更高的生物活性。OLSON J K等[18]研究发现,罗伊氏乳杆菌在生物相容微球上生成生物膜后,可通过宿主的胃肠道(包括低pH值、宿主免疫系统的效应因子以及与共生菌的竞争)保持更高的存活力。本试验通过建立基于非水溶性膳食纤维的成膜体系,探究培养基碳源、氮源,培养温度、初始pH值和NaCl添加量对双歧杆菌基于非水溶性膳食纤维的生物膜成膜的影响,通过单因素试验和响应曲面分析试验对基于非水溶性膳食纤维的双歧杆菌成膜条件进行了优化,为进一步提高双歧杆菌的生物膜量,实现工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
双歧杆菌(Bifidobacterium)JSWX26-7:江南大学食品生物技术中心菌种保藏库。
1.1.2 化学试剂
低聚半乳糖、低聚果糖、胰蛋白胨、大豆蛋白胨、酪蛋白胨、鱼粉蛋白胨、牛肉膏、葡萄糖、磷酸氢二钾、无水乙酸钠、七水硫酸镁、一水硫酸锰、柠檬酸氢二铵、吐温-80、氯化钠、半胱氨酸盐酸盐、三水合磷酸氢二钾:国药集团化学试剂有限公司;酵母粉:英国Oxoid公司;黄豆粉:市售。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基:牛肉膏10.0 g/L,胰蛋白胨10.0 g/L,酵母粉5.0 g/L,无水葡萄糖20.0 g/L,无水乙酸钠2.0 g/L,三水合磷酸氢二钾2.6 g/L,七水合硫酸镁0.5 g/L,一水硫酸锰0.25 g/L,柠檬酸氢二铵2.0 g/L,L-半胱氨酸盐酸盐0.5 g/L,吐温-80 1.0 mL/L,调整pH=6.8,于115 ℃灭菌20 min。
MRS固体培养基:MRS液体培养基加入2.0%琼脂。115 ℃灭菌20 min。
1.2 仪器与设备
ME3002E台式电子天平、FE-20 pH计:梅特勒-托利多仪器(上海)有限公司;LAB DANCER 漩涡振荡器:德国IKA公司;GR60DA 立式自动压力灭菌锅:南京庚辰仪器有限公司;DG250 厌氧工作站:英国Don Whitley Scientific公司;KQ-700E 超声破碎机:昆山市超声仪器有限公司;TG16AWS 台式高速离心机:上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 菌株的活化和动态生物膜培养
取保藏于-80 ℃甘油管中的双歧杆菌,用接种环在MRS平板上进行三区划线,37℃厌氧培养48h,挑取单菌落于5mL的MRS液体培养基[19],37 ℃厌氧培养24 h,再按2%(V/V)接种量接种于5 mL液体MRS培养基中,活化3代后备用。
取活化三代后的双歧杆菌1 mL于装有50 mL MRS液体培养基(黄豆粉添加量10 g/L)的锥形瓶中,并将其固定于乐扣盒中,放入厌氧袋,密封。将乐扣盒固定于摇床上,设定转速为100 r/min,使大豆纤维悬浮在培养基中而不沉降,让菌体充分黏附于基质上形成生物膜。使培养基在摇动状态下培养24 h。
1.3.2 平板计数法测定成膜活菌数[17-20]
取出培养液充分振荡混合均匀,吸取菌液1 mL于2 mL EP管中,同一试验组需要做两份,一份于离心机中以100 r/min离心3 min(经预实验证明此转速离心时菌体未离心下来,以黄豆粉为载体基质的成膜菌可离心下来)取上清液进行平板菌落计数,计数结果为游离活菌数;另外一份于超声清洗机中,以700 W的功率超声处理20 min[21],计数结果为总活菌数。
成膜活菌数=总活菌数-游离活菌数
1.3.3 双歧杆菌成膜条件优化单因素试验
通过改变培养基中使用的碳源(葡萄糖、低聚半乳糖、低聚果糖)、氮源(胰蛋白胨、大豆蛋白胨、酪蛋白胨、鱼粉蛋白胨),培养温度(31 ℃、34 ℃、37 ℃、40 ℃、43 ℃)、初始pH值(5.8、6.3、6.8、7.3、7.8)、培养基中NaCl添加量(0、0.5%、1.0%、1.5%、2.0%),探究不同培养基碳源、氮源,培养温度、初始pH值和NaCl添加量对双歧杆菌基于非水溶性膳食纤维的生物膜成膜的影响。
1.3.4 双歧杆菌成膜条件优化响应面试验设计
在单因素试验的基础上,选取对双歧杆菌成膜活菌数(Y)影响显著的3个因素初始pH值(X1),培养温度(X2)和NaCl添加量(X3),根据Box-Behnken试验[22]设计原理,利用Design-Expert软件进行3因素3水平响应面优化[23]。
1.3.5 数据处理
实验数据为重复3次所得,以平均值±标准偏差表示。采用MicrosoftExcel2016进行数据处理,运用方差分析(analysis of variance,ANOVA)进行统计学分析,两组数据的差异分析采用T检验进行判断,P<0.05则认为差异显著。采用Design-ExpertV8.0.6进行响应面分析和作图。采用Graphpad Prism 7.0进行作图。
2 结果与分析
2.1 双歧杆菌成膜条件优化单因素试验
2.1.1 不同碳源对生物膜成膜情况的影响
由图1可知,葡萄糖为碳源时成膜活菌数达到最大,为9.30×108 CFU/mL。而以低聚半乳糖、低聚果糖为碳源时生物膜活菌数普遍较低。SLIZOVA M等[24]研究结果显示,不同碳源对生物膜的影响不同,葡萄糖存在下检测到大量生物膜的形成,与本研究试验结果基本一致。故选择葡萄糖为最佳碳源。
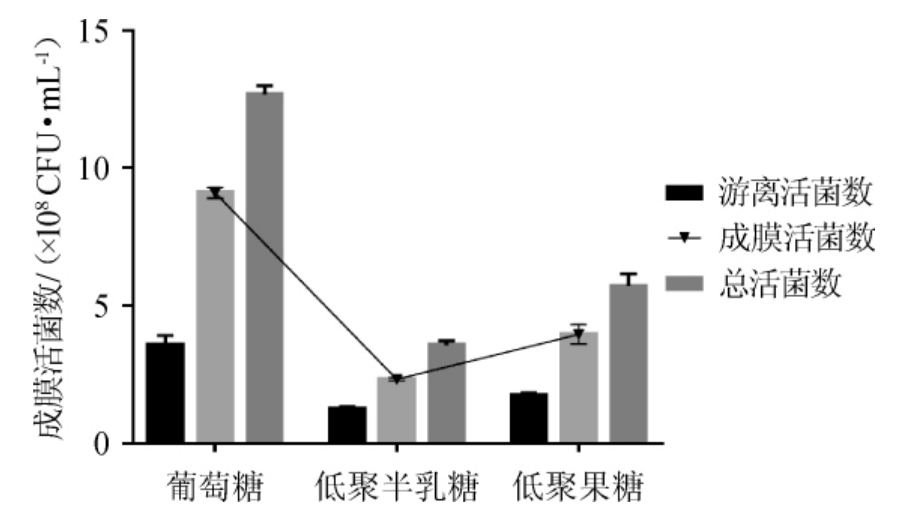
图1 培养基碳源对双歧杆菌成膜的影响
Fig.1 Effect of carbon source on biofilm formation of Bifidobacterium
2.1.2 不同氮源对生物膜成膜情况的影响
由图2可知,当选用鱼粉蛋白胨或胰蛋白胨为主要氮源时,成膜活菌数最大,为1.24×109 CFU/mL,而以酪蛋白和大豆蛋白胨为主要氮源时,其成膜能力明显下降,最低成膜活菌数仅为5.8×108 CFU/mL。结果表明,不同氮源对生物膜的成膜影响不同。为实现工业化应用,有效减低成本,故选择胰蛋白胨为最佳氮源。
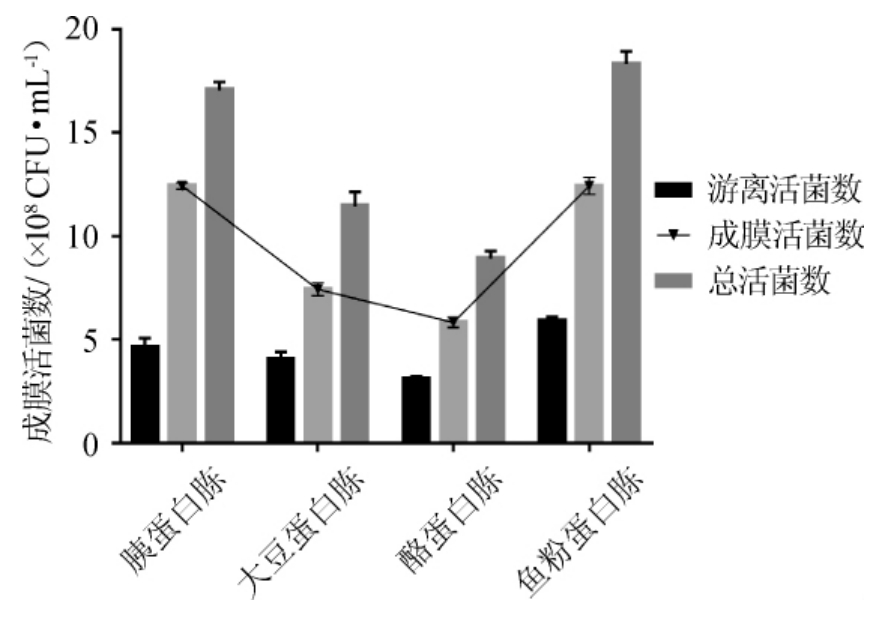
图2 培养基氮源对双歧杆菌成膜的影响
Fig.2 Effect of nitrogen source on biofilm formation of Bifidobacterium
2.1.3 不同培养温度对生物膜成膜情况的影响
由图3可知,随着培养温度的提高,成膜活菌数呈现先升高再降低的趋势。培养温度为37 ℃时,成膜活菌数最高,为9.46×108 CFU/mL,当温度低于或高于37 ℃时,不利于双歧杆菌的生长,细菌密度较低,无法达到生物膜初期黏附,造成生物膜形成能力的下降,其成膜活菌数普遍低于最适生长温度。故选择培养温度为37 ℃。
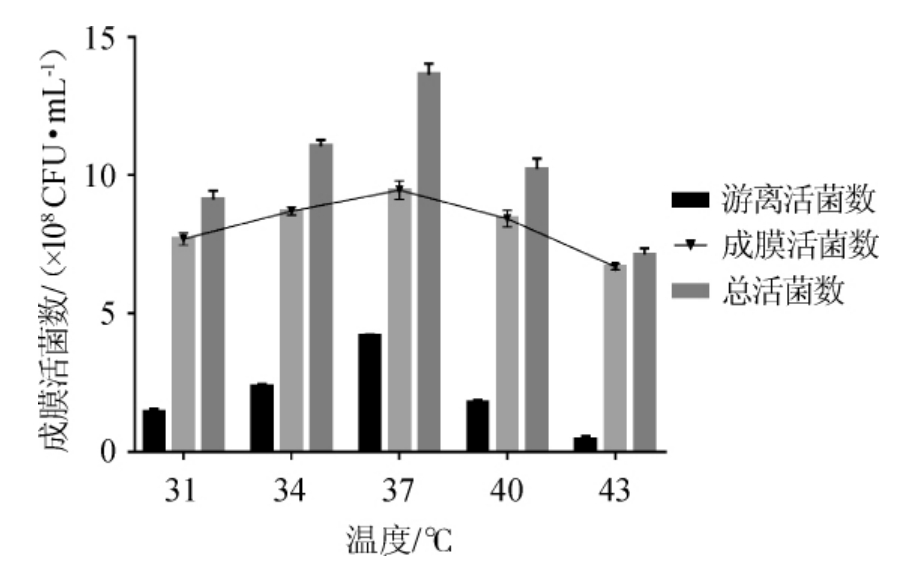
图3 培养温度对双歧杆菌成膜的影响
Fig.3 Effect of culture temperature on biofilm formation of Bifidobacterium
2.1.4 初始pH值对生物膜成膜情况的影响
由图4可知,随着培养基初始pH值的增加,游离菌数、成膜菌数和总菌数均呈现先升高再降低的趋势。培养前初始pH=6.8时,成膜菌、总菌均最多,分别为1.15×109 CFU/mL和1.49×109 CFU/mL。在一定范围内,当低于或高于最适pH值范围时,并不利于双歧杆菌的生长,导致其成膜菌数和总菌数的下降。当初始pH值过高时(pH=7.8),游离菌、成膜菌、总菌均最少,双歧杆菌基本不能生长。故选择初始pH值为6.8。
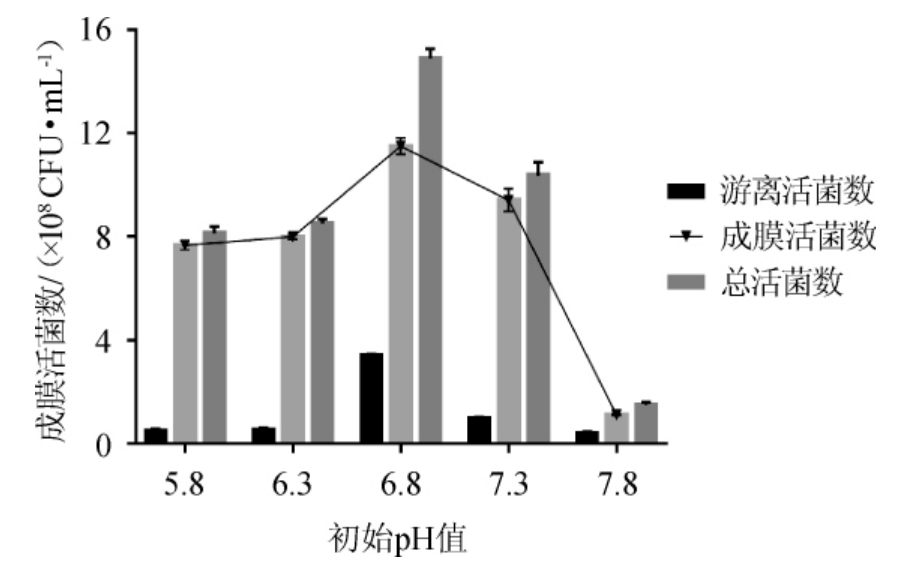
图4 初始pH值对双歧杆菌成膜的影响
Fig.4 Effect of initial pH on biofilm formation of Bifidobacterium
2.1.5 不同NaCl添加量对生物膜成膜情况的影响
由图5可知,当NaCl添加量为0~0.5%时,双歧杆菌成膜菌数不断升高;当NaCl的添加量为0.5%时,双歧杆菌成膜菌数达到最高,为1.06×109 CFU/mL;当NaCl添加量>0.5%时,游离菌数、成膜菌数和总菌数均呈现下降的趋势。YAN J等[25]研究发现渗透压力驱动下能够促进霍乱弧菌对周围营养物质的利用,有利于生物膜的形成。故选择NaCl添加量为0.5%。
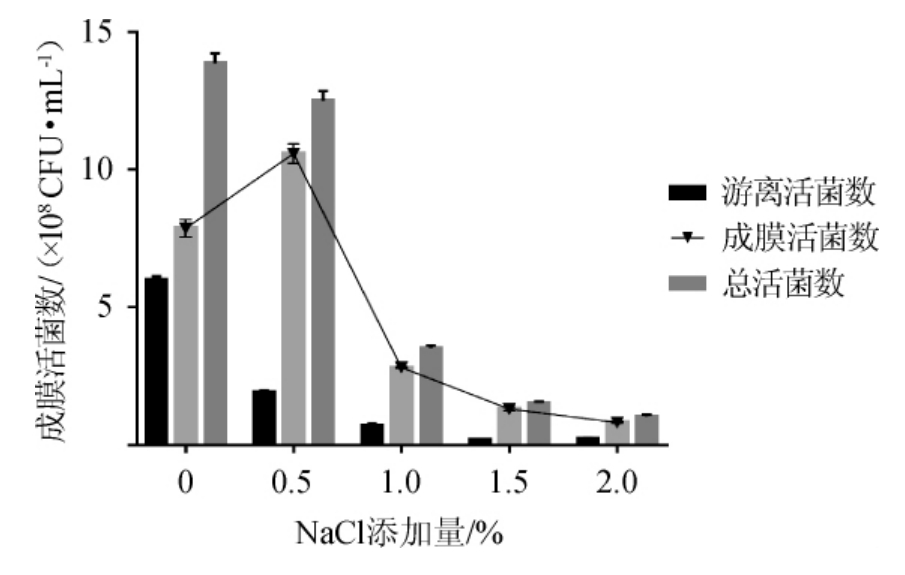
图5 NaCl添加量对双歧杆菌成膜情况的影响
Fig.5 Effect of NaCl addition on biofilm formation of Bifidobacterium
2.2 双歧杆菌成膜条件优化响应面试验结果与分析
2.2.1 模型的建立及显著性检验
在单因素试验的基础上,以成膜活菌数(Y)为响应值,以初始pH值(X1)、培养温度(X2)和NaCl添加量(X3)为考察因素进行响应面优化试验,Box-Behnken试验结果与分析见表1,方差分析见表2。
表1 双歧杆菌成膜条件优化Box-Behnken试验结果与分析
Table 1 Results and analysis of Box-Behnken experiments for biofilm formation condition optimization of Bifidobacterium
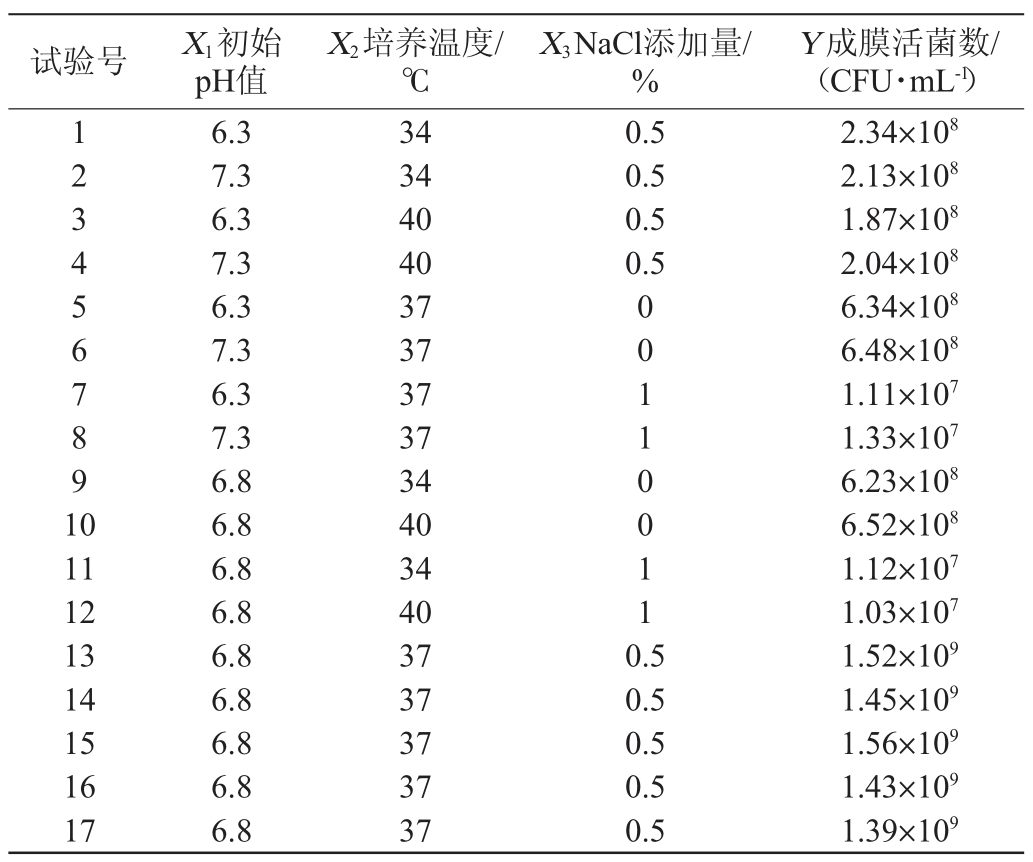
表2 响应面回归模型方差分析
Table 2 Variance analysis of response surface quadratic model
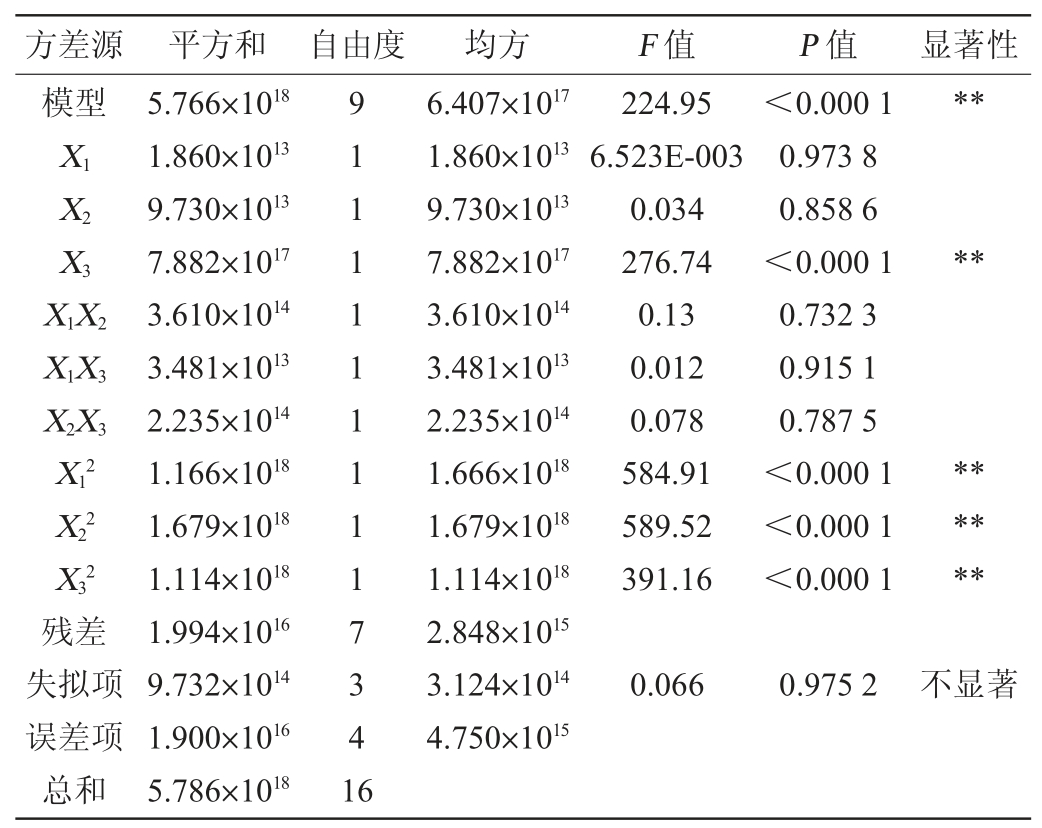
注:“**”表示对结果影响极显著(P<0.01)。
运用Design Expert V8.0.6软件对表1结果进行拟合,得回归方程:
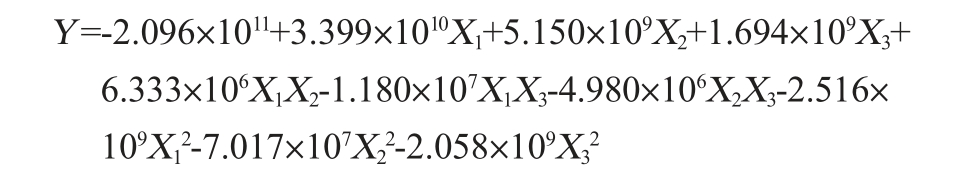
由表2可知,所建立模型的P<0.000 1,极显著;失拟项P>0.05,不显著,表明该回归模型具有较高可靠性;另外,模型的决定系数R2为0.996,说明拟合程度很好,校正决定系数R2Adj为0.992,指出预测值与实际值具有高度的相关性。经回归模型方差分析,一次项X3和二次项X12、X22、X32对基于非水溶性膳食纤维的双歧杆菌成膜活菌数影响达到极显著水平(P<0.01),而一次项X1、X2、交互项X1X2、X1X3、X2X3均无显著影响(P>0.05)。经Design Expert V8.0.6软件对回归模型进行优化分析得到最佳条件:初始pH值为7.11,培养温度为37.01℃,NaCl添加量为0.35%。在此优化成膜条件下,预测得到的生物膜活菌数最大理论值为1.28×109 CFU/mL。根据回归方程,得到各因素交互作用对双歧杆菌成膜影响的响应面及等高线,结果见图6。
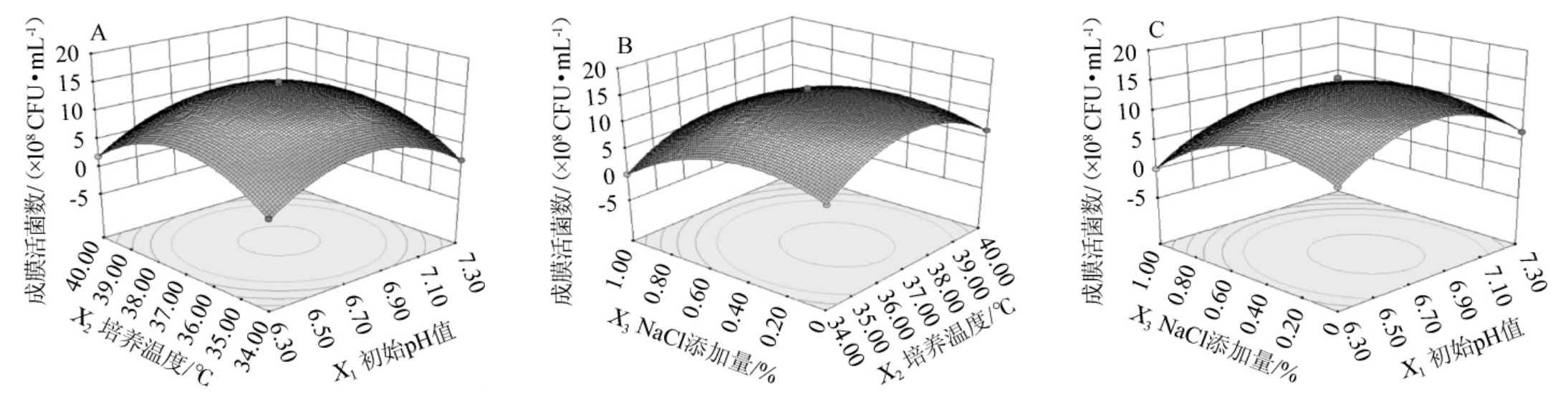
图6 初始pH值、培养温度和NaCl添加量交互作用对双歧杆菌成膜影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between initial pH,culture temperature and NaCl addition on biofilm formation of Bifidobacterium
由图6可知,随着3个因素水平的逐渐升高,双歧杆菌成膜活菌数呈现先增后降的趋势,交互作用的3个响应面均出现极大值。等高线图显示X1X2(初始pH值、培养温度)、X2X3(培养温度、NaCl添加量)、X1X3(初始pH值、NaCl添加量)的交互作用相对较弱,这与响应面二次模型方差分析结果一致。
2.2.2 验证试验
根据以上得出的最优发酵条件初始pH值为7.11,培养温度为37.01 ℃,NaCl添加量为0.35%。根据实际操作条件调整为初始pH值7.0、培养温度为37℃、NaCl添加量为0.35%,此条件下培养双歧杆菌,进行3次平行的验证试验,得到基于非水溶性膳食纤维的双歧杆菌成膜活菌数平均实际值为1.22×109 CFU/mL,所得结果与预测值基本一致,验证了模型的可靠性。
3 结论
本试验通过单因素试验、Box-Behnken响应面分析试验对双歧杆菌动态成膜情况因素的影响进行了探究,结果表明基于非水溶性膳食纤维的双歧杆菌动态成膜的最优工艺参数:培养基碳源为葡萄糖、氮源为胰蛋白胨、额外添加0.35%NaCl,培养温度37℃、初始pH值7.0。在此最优成膜条件下,制备的双歧杆菌成膜活菌数最多为1.22×109CFU/mL,为实现双歧杆菌生物膜的可控成膜,特别是为工业规模的发酵制备提供了理论基础和试验依据。
[1]O'CALLAGHAN A,VAN SINDEREN D.Bifidobacteria and their role as members of the human gut microbiota[J].Front Microbiol,2016,7:925.
[2]PICARD C,FIORAMONTI J,FRANCOIS A,et al.Review article:bifidobacteria as probiotic agents-physiological effects and clinical benefits[J].Aliment Pharmacol Therap,2005,22(6):495-512.
[3]CORCORAN BM S C,FITZGERALD G,ROSS R P.life under stress the probiotics stress response and how it may be manipulated[J].Curr Pharmaceut Design,2008,14(14):1382-1399.
[4]PINTO A C,MELO-BARBOSA H P,MIYOSHI A,et al.Application of RNA-seq to reveal the transcript profile in bacteria[J]. Genet Mol Res,2011,10(3):1707-1718.
[5]朱啟会,何腊平,张玲,等.降胆固醇双歧杆菌BZ11 的筛选及其耐受性评价[J].中国酿造,2017,36(3):54-58.
[6]AZEREDO J,AZEVEDO N F,BRIANDET R,et al.Critical review on biofilm methods[J].Crit Rev Microbiol,2017,43(3):313-351.
[7]CHICUREL M.Bacterial biofilms and infections.Slimebusters[J].Nature,2000,408(6810):284-286.
[8]DAVEY M E,O'TOOLE G A.Microbial biofilms:from ecology to molecular genetics[J].Microbiol Mol Biol Rev,2000,64(4):847-867.
[9]JAMAL M,AHMAD W,ANDLEEB S,et al.Bacterial biofilm and associated infections[J].J Chinese Med Associat,2018,81(1):7-11.
[10]ROY R,TIWARI M,DONELLI G,et al.Strategies for combating bacterial biofilms:A focus on anti-biofilm agents and their mechanisms of action[J].Virulence,2018,9(1):522-554.
[11]WOLSKA K I,GRUDNIAK A M,RUDNICKA Z,et al.Genetic control of bacterial biofilms[J].J Appl Genet,2016,57(2):225-238.
[12]GROSSOVA M,RYSAVKA P,MAROVA I.Probiotic biofilm on carrier surface:A novel promising application for food industry[J]. Acta Alimentaria,2017,46(4):439-448.
[13]CHEOW W S,HADINOTO K.Biofilm-like Lactobacillus rhamnosus probiotics encapsulated in alginate and carrageenan microcapsules exhibiting enhanced thermotolerance and freeze-drying resistance[J].Biomacromolecules,2013,14(9):3214-3222.
[14]TOYOFUKU M,INABA T,KIYOKAWA T,et al.Environmental factors that shape biofilm formation[J].Biosci Biot Biochem,2016,80(1):7-12.
[15]LIU J,MARTINEZ-CORRAL R,PRINDLE A,et al.Coupling between distant biofilms and emergence of nutrient time-sharing[J].Science,2017,356(6338):638-642.
[16]CRUZ C D,SHAH S,TAMMELA P.Defining conditions for biofilm inhibition and eradication assays for Gram-positive clinical reference strains[J].BMC Microbiol,2018,18(1):173.
[17]USHAKOVA N A,ABRAMOV V M,KHLEBNIKOV V S,et al.Properties of the probiotic strain Lactobacillus plantarum 8-RA-3 grown in a biofilm by solid substrate cultivation method[J]. Probiot Antimicrob Prot,2012,4(3):180-186.
[18]OLSON J K,RAGER T M,NAVARRO J B,et al.Harvesting the benefits of biofilms:A novel probiotic delivery system for the prevention of necrotizing enterocolitis[J].J Pediat Surg,2016,51(6):936-941.
[19]徐文生,张艳艳,黄漫青,等.环境因素对长双歧杆菌CICC6069 生物膜生成的影响[J].中国食品学报,2012,12(4):36-42.
[20]LEMOS JUNIOR W J F,GUERRA A F,TARRAH A,et al.Safety and stability of two potentially probiotic lactobacillus strains after in vitro gastrointestinal transit[J].Probiotics Antimicrobial Proteins,2019:https://doi.org/10.1007/s12602-019-09565-2.
[21]VYAS N,MANMI K,WANG Q,et al.Which parameters affect biofilm removal with acoustic cavitation?A review[J]. Ultrasound Med Biol,2019,45(5):1044-1055.
[22]SOUZA A S,SANTOS W N L D,FERREIRA S L C.Application of Box-Behnken design in the optimisation of an on-line pre-concentration system using knotted reactor for cadmium determination by flame atomic absorption spectrometry[J].Atomic Spectr,2005,60(5):737-742.
[23]SHU G,BAO C,CHEN H,et al.Fermentation optimization of goat milk with Lactobacillus acidophilus and Bifidobacterium bifidum by Box-Behnken design[J].Acta Sci Pol Technol Aliment,2016,15(2):151-159.
[24]SLIZOVA M,NEMCOVA R,MAD'AR M,et al.Analysis of biofilm formation by intestinal lactobacilli[J].Canad J Microbiol,2015,61(6):437-446.
[25]YAN J,NADELL C D,STONE H A,et al.Extracellular-matrix-mediated osmotic pressure drives Vibrio cholerae biofilm expansion and cheater exclusion[J].Nat Communicat,2017,8(1):327.