葡萄酒的风味主要是源自于葡萄浆果中的呈香物质,它以游离态和结合态两种形式存在。游离态的呈香物质可以在常温状态下挥发出来被嗅觉器官感知;而结合态香气前体不具有香气,只有通过分解作用才能释放出游离态呈香物质,进而被感知[1]。研究发现[2],以结合态形式存在的风味前体物质的含量要比游离态形式存在的呈香物质要丰富得多。LÓPEZ M C等[3]从非酿酒酵母菌中筛选出高β-葡萄糖苷酶活性的菌株,能使葡萄酒中萜烯类香气化合物含量增加1.1~1.3倍。由于大部分呈香物质以糖苷结合态的形式存在,不具有香气,不能被感知,所以要增强和改善葡萄酒的香气,必须将葡萄中的结合态香气前体物质转化成游离态的呈香物质,而β-葡萄糖苷酶是结合态香气释放的关键酶[4-5]。
葡萄酒酿造过程中,添加具有β-葡萄糖苷酶活性的酶制剂,可加速糖苷类芳香前体物质的水解,但由于许多具有葡萄糖苷酶活性的商业酶制剂的酯酶活性较高,对葡萄酒品质亦产生不容忽视的负面影响[6]。从近年来的研究来看,虽然产β-葡萄糖苷酶的菌种属比较多,但能适应葡萄醪或葡萄酒特殊环境且发挥作用的却并不多。大部分β-葡萄糖苷酶在葡萄醪高糖低pH这个特殊环境中,酶活力受到高糖抑制、低pH(3.5左右)失活或者对红葡萄酒颜色产生不利影响等,从而严重限制了优质高档葡萄酒品质的提升和独特风格的体现[7]。
因此,分离筛选既能适用于葡萄酒酿造的高糖低pH条件、又能有效水解风味前体物且不产生不良风味,同时又对葡萄酒颜色没有或者影响很小的β-葡萄糖苷酶,成为目前葡萄酒风味研究与实践生产中急需解决的问题。本文对产β-葡萄糖苷酶的酵母菌种类、产酶部位、产酶工程菌的构建、产酶酵母菌的选育方法以及酿造过程中酶解产香机制等方面的研究成果进行了总结、归纳,以期为葡萄酒酿造过程中香气品质的提升提供参考。
1 产酶酵母种类
我国幅员辽阔,各地生态条件差异很大,野生酵母种属资源丰富,且在不同酿酒环境中也蕴含着大量适宜酿酒的酵母菌资源,为高活性β-葡萄糖苷酶的筛选提供了丰富的资源。据研究显示,β-葡萄糖苷酶广泛存在于酵母菌中,特别是酿酒酵母(Saccharomyces cerevisiae)和酒香酵母(Brettanomyces),不同菌种的酶活大小差异显著,非酿酒酵母通常表现出比酿酒酵母更高的酶活性[8]。
DAENEN L等[9]比较分析了酿酒酵母属和酒香酵母属中58株菌的β-葡萄糖苷酶活性,研究显示,酶活最高的是酒香酵母属中的一株卡斯特酒香酵母菌(Brettanomyces custersii),相对于酿酒酵母来说,酒香酵母能更有效地水解糖苷结合态的香气化合物。RODRÍGUEZ M E等[10]对巴塔哥尼亚产区产的酵母菌进行了研究,从中筛选出了45株具有β-葡萄糖苷酶活性的酵母菌:其中11株具有较高β-糖苷酶活性,8株具有中等β-葡萄糖苷酶活性,26株具低β-葡萄糖苷酶活性。通过脱氧核糖核酸(deoxyribonucleic acid,DNA)鉴定,这些菌株大部分属于季也蒙假丝酵母(Candida guilliermondii)、铁红假丝酵母(Candida pulcherrima)和柠檬型克勒克酵母(Kloeckera apiculata),只有1株属于酿酒酵母,其中酶活最高的是假丝酵母属的酵母菌。
菌株产酶情况受培养基的种类、pH值、培养温度等影响显著,即使是同属的菌株产酶量及酶活也有差异。王凤梅等[11]以从4个不同葡萄品种的浆果表面分离得到的分属6个属7个种的340株酵母为出发菌株,通过初步筛查,分离出66株具有产β-葡萄糖苷酶性能的菌株。其中,异常毕赤酵母(Pichia anomala)、星形假丝酵母(Candida stellata)及葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)中β-葡萄糖苷酶活性菌株检出率较高,分别为100%、33.3%及26.8%;而酿酒酵母及浅黄隐球酵母(Cryptococcus flavescens)中β-葡萄糖苷酶活性检出率较低,分别为16.7%及3.0%;19株东方伊萨酵母(Issatchenkia orientalis)及49株克鲁维毕赤酵母(Pichia kluyveri)都没有β-葡萄糖苷酶活性。马得草等[12]以从宜宾白酒酒窖中分离的133株野生酵母为研究对象,只检测到19株酵母菌具有β-葡萄糖苷酶活性,最终筛选出2株β-葡萄糖苷酶活性较高且稳定的酵母菌株,经鉴定为发酵毕赤酵母(Pichia fermentans)。
此外,梅奇酵母属(Metschnikowia)、德巴利氏酵母属(Debaryomyces)、有孢圆酵母属(Torulaspora)和汉逊酵母属(Hansenula)等也具有β-葡萄糖苷酶活性。FERNÁNDEZ M等[13]从西班牙原产地拉曼查的葡萄醪和发酵液中分离出182株非酿酒酵母菌,其中只有14株酵母菌具有β-葡萄糖苷酶活性,通过DNA鉴定,这些菌株都属于关极梅奇酵母菌(Metschnikowia pulcherrima)。后来FERNÁNDEZGONZÁLEZ M等[14]又收集了分离自葡萄和葡萄酒中的10株酵母菌,对其水解糖苷的活性进行了研究,结果显示:葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)β-糖苷酶活性最高,其次是莫氏假丝酵母(Candida molischiana),而克鲁维毕赤酵母(Pichia kluyveri)不具备β-糖苷酶活性,其余7株酵母包括关极梅奇酵母(Metschnikowia pulcherrima)、汉逊德巴利酵母(Debaryomyces hansenii)、耐热克鲁维酵母(Kluyveromyces thermotolerans)和酿酒酵母(Saccharomyces cerevisiae),虽然也具有β-葡萄糖苷酶活性,但其活性却很低,远不及前两种酵母菌。LÓPEZ M C等[3]对114株非酿酒酵母菌进行了研究,并从中筛选出4株高β-葡萄糖苷酶和木糖苷酶活性的酵母,分别是膜醭毕赤酵母(Pichia membranifaciens)、葡萄酒有孢汉逊酵母(Hanseniaspora vineae)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、海洋嗜杀酵母(Wicker hamomyces anomalus)。SWANGKEAW J等[15]从有孢汉逊酵母属(Hanseniaspora sp.)和异常毕赤酵母(Pichia anomala)中筛选出了产β-葡萄糖苷酶的菌株,能够提高麝香类葡萄酒中的花香和果香的香气。BONCIANI T等[16]对45株酿酒酵母(Saccharomyces cerevisiae)和30株葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)进行了研究,其中只有1株酿酒酵母(Saccharomyces cerevisiae)AL41具有β-D-葡萄糖苷酶活性,其余都是葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株GRAS14表现出最高的β-D-葡萄糖苷酶活性。而早在2017年,VERSPOHL A等[17]就将GRAS14菌株用于葡萄酒酿造试验中进行了测试,结果显示该菌株的发酵性能可与酿酒酵母相媲美。
由此看来,假丝酵母属(Candida)、毕赤酵母属(Pichia)和汉逊酵母属(Hansenula)的酵母菌具有高产β-葡萄糖苷酶的的性能,且酶活性较高,可作为筛选β-葡萄糖苷酶的出发菌株,以便更快、更精准的获得在酿酒微环境中具有高β-葡萄糖苷酶活性的酵母菌株。
2 酵母菌产酶部位
不同种类的酵母菌所产β-葡萄糖苷酶在酵母菌体中的分布不同。王凤梅等[11]利用初筛的66株产β-葡萄糖苷酶的菌株进行产酶部位研究,发现只有1株葡萄汁有孢汉逊酵母检测到胞外β-葡萄糖苷酶活性,这与李爱华等[18]利用超声波破碎技术对葡萄汁有孢汉逊酵母所产的β-葡萄糖苷酶进行定位的结果一致。且在所有具有酶活性的菌株中,胞内酶的活性都要比其胞壁结合酶的活性大,其中酶活最高的是2株异常毕赤酵母菌。张方方等[19]通过对8株酿酒酵母菌的上清液、壁膜间隙和细胞内的β-葡萄糖苷酶活性进行研究,发现酿酒酵母产生β-葡萄糖苷酶的部位主要位于壁膜间隙和细胞内。WANG Y X等[20]对源自酿酒环境中的4类酵母菌产β-葡萄糖苷酶进行了定位分析,其中发酵毕赤酵母(Pichia fermentans)、酿酒酵母(Saccharomyces cerevisiae)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)不同部位的β-葡萄糖苷酶的酶活顺序依次是:胞内>胞壁间隙>胞外,而阿氏丝孢酵母(Trichosporon asahii)却略有不同,酶活顺序为胞外>胞内>胞壁间隙。BONCIANI T等[16]对45株酿酒酵母(Saccharomyces cerevisiae)和30株葡萄汁酵母(Saccharomyces uvarum)进行了研究,从中筛选出12株具有β-葡萄糖苷酶活性的酵母菌,这些菌株都具有胞壁结合酶活性,且都无胞外酶活性,只有参考菌株海洋嗜杀酵母(W.anomalus)BS81和葡萄汁酵母(S.uvarum)CRY14具有胞内酶活性。
综上所述,酵母菌分泌的β-葡萄糖苷酶大多为胞内酶或胞壁结合酶,如何使细胞内的代谢产物更有效的转运到发酵基质中发挥作用,将是解决葡萄酒发酵过程增香的关键问题,也是近年来研究的热点。曾钰等[21]利用CRISPR/Cas9基因组编辑技术,通过破坏重组酿酒酵母Y294-BGL1中参与细胞壁合成的未知功能基因UTH1,使细胞壁完整性下降,获得了胞外β-葡萄糖苷酶活性明显升高的突变体,相较于出发菌株胞外酶活提高了112.9%。MIYAZAKI T等[22]利用模型蛋白筛选能促进异源蛋白质分泌的信号肽,通过连接质粒转化,获得的重组菌株Streptomyces lividans/pTxcspUxcs,其酶活提高了17倍,说明信号肽在蛋白质的分泌过程当中起着极其重要的作用,它能够引导蛋白质分泌至胞外,提高蛋白质的表达量。
3 产酶工程菌的构建
β-葡萄糖苷酶在葡萄酒增香中起关键作用,但酿酒原料葡萄果实中含量很少,且在酿酒环境几乎无活性,成为结合态香气转化为可感知的游离态香气的瓶颈。因此,利用基因重组技术来构建工程菌,使其表达分泌出高活性的β-葡萄糖苷酶,对葡萄酒香气品质的提升具有重要意义。近期的研究显示,在酵母菌中已经成功地克隆和表达了细菌和真菌的β-葡萄糖苷酶基因,现在应用较多的酵母表达系统主要是酿酒酵母(Saccharomyces cerevisiae)和巴斯德毕赤酵母(Pichia pastoris)。但其表达水平却存在显著差异,在经改造的酿酒酵母菌中的表达水平远低于毕赤酵母表达系统。导致这一结果的原因可能是由于酿酒酵母缺乏对表达的蛋白进行翻译后加工与修饰的能力,也可能是由于蛋白分泌效率差、菌株不稳定或是质粒丢失等原因造成的。而毕赤酵母表达系统成功的避免了这些缺陷,因此表达水平通常高于酿酒酵母表达系统,有时表达的酶活甚至高出原始菌株好几倍[23]。
代军飞等[24]采用聚合酶链式反应(polymerase chain re action,PCR)方法克隆出粘性丝孢酵母β-葡萄糖苷酶基因的部分CDs区片段,并通过实时荧光定量聚合酶链式反应(real-time fluorescent quantitative-polymerase chain reaction,RT-FQ-PCR)方法分析了该基因在不同pH、C/N、温度以及培养时间下的表达量,为进一步挖掘该基因的功能,奠定了良好的基础。邵金辉等[25]应用大肠杆菌和巴斯德毕赤酵母作为受体菌,以pPIC9 K为载体,不仅成功克隆了扣囊复膜孢酵母的β-葡萄糖苷酶基因(BGL1),而且获得了高效表达BGL1基因的毕赤酵母重组工程菌株,该酶在最适温度和pH下,活性最高可达47 U/mL。高院妮[26]把黑曲霉β-葡萄糖苷酶基因在大肠杆菌及毕赤酵母中进行了异源表达,结果显示,在原核生物中β-葡萄糖苷酶基因表达量更高,但其表达产物缺乏β-萄萄糖苷酶水解活性,只有pPICZaA重组载体转化毕赤酵母GS115,才被检测到很低的β-葡萄糖苷酶活性。KAWAI R等[27]采用毕赤酵母表达系统,对从Phanerochaete chrysosporium中克隆得到β-葡萄糖苷酶基因进行表达,结果显示,重组表达的酶活高达原始菌株的几十倍。
4 产酶酵母选育方法
为快速、准确的筛选出高活性高β-葡萄糖苷酶酵母菌株,通常采用平板固态选择培养基对酵母菌进行培养,筛选得到产酶单菌落,再经过液体发酵实验收集不同部位的酶液,对菌株酶活进行定量分析。在实验过程中,按培养基的不同,可以概括为下述几种方法[8,28]。
4.1 对硝基苯基-β-D-吡喃半乳糖苷显色法
在初筛培养基中添加对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,p-NPG),β-葡萄糖苷酶能把p-NPG水解为对硝基苯酚(p-nitrophenol,p-NPh),p-NPh在碳酸钠的作用下可形成黄色的透明圈,黄色光圈的大小即代表产酶活性高低。该检测方法灵敏度高,但操作复杂,透明圈与培养基的颜色相似,不利于肉眼分辨。
刘文龙等[29]采用添加p-NPG的初筛培养基,从大量诱变菌株中快速筛选出高产β-葡萄糖苷酶的正向突变菌株。侯晓瑞等[30]采用对硝基苯基-β-D-吡喃葡萄糖苷为底物的平板作为初筛培养基,对甘肃产区葡萄自然发酵过程中的酵母菌产β-葡萄糖苷酶的性质进行了研究,从中筛选出44株酶活较高的酵母菌株。张敏等[31]利用p-NPG显色法,从18株出发菌株中初步筛选出高产β-葡萄糖苷酶的酵母6株,并根据透明圈的直径大小以及颜色深浅进行比较分析,推测透明圈最大且颜色最深的Y8菌株具有最高的β-葡萄糖苷酶活性,这与后期定量分析结果一致,从而验证了该方法的可靠性。
4.2 京尼平苷显色法
β-葡萄糖苷酶能把京尼平苷水解成京尼平,再与谷氨酸钠反应生成栀子蓝,而栀子蓝呈蓝色,可以通过单菌落的颜色深浅及大小来判断酶活性的高低。该检测方法具有操作简单、显色稳定等优点,但耗时较长。
朱啟会等[32]利用添加栀子苷的培养基,根据菌圈蓝色深浅及大小,从银杏树土壤样品中快速筛选出20株具有β-葡萄糖苷酶活性的菌株。王斌斌等[33]利用栀子苷培养基做初筛培养基,获得一株高产β-葡萄糖苷酶菌株,酶活力达到14.82 U/mL。梁金凤等[34]利用栀子苷培养基,从10株出发菌株中筛选到一株高β-葡萄糖苷酶活性的菌株R57,酶活可达206.11 U/mg。
4.3 七叶苷显色法
采用同时添加七叶苷和三价铁的培养基,七叶苷在β-葡萄糖苷酶作用下生成七叶苷元,七叶苷元可以与Fe3+离子作用呈棕黑色,菌落周围呈棕黑色的圈,黑色透明圈的大小即代表酶活力大小。该检测方法简便、灵敏、直观,常用于大规模出发菌株的筛选。
PÉREZ G等[35]利用七叶灵苷,从154株野生酵母中筛选出30株具有β-糖苷酶活性的酵母菌。周俊等[36]利用七叶苷显色平板法,获得4株产β-D-葡萄糖苷酶的菌株。王佳等[37]以分离自宁夏贺兰山东麓的941株野生酵母菌为出发菌株,采用七叶灵显色法筛选出4株优良产糖苷酶菌株,大大减轻了后续工作量。
4.4 纤维素-刚果红显色法
在培养基中同时加入纤维素和刚果红,培养基中的纤维素能和刚果红结合形成红色物质,纤维素经糖苷酶作用可降解为纤维二糖,不能与刚果红形成红色物质,因此可形成无色透明圈,通过菌落周围透明圈大小来评价产酶活性大小。该检测方法直观、准确,但操作复杂。
吴小刚等[38]采用纤维素-刚果红显色法,从23株原始菌株中筛选出5株产β-葡萄糖苷酶活性较高的菌。姚瑶等[39]利用羧甲基纤维素钠-刚果红显色法,获得2株高β-葡萄糖苷酶的菌株,初始酶活分别为0.026 U/mL和0.023 U/mL。童爱均等[40]利用该方法获得4株能够产生水解圈的单菌落,经测定β-葡萄糖苷酶活力最高为6.589 U/mL。
4.5 4-甲基伞形酮-β-D-葡萄糖苷荧光显色法
在培养基中加入4-甲基伞形酮-β-D-葡萄糖苷(4-methylumbelliferyl-β-D-glucoside,4-MUG),该物质能被β-葡萄糖苷酶水解,生成4-甲基伞形酮,该物质在紫外下有荧光,可通过观察菌落周围荧光圈的大小来判别。该检测方法灵敏度高,快速,但成本昂贵。
万振堂等[41]以4-MUG荧光显色法,选出了一株酶活较高的植物乳杆菌。DAENEN L等[9]以添加4-甲基伞形酮-β-D-葡萄糖苷的培养基为初筛培养基,筛选出了产β-葡萄糖苷酶酵母菌株。该方法水解产物的蓝色荧光容易与生物样品的背景重叠,且培养基的pH值对4-甲基伞形酮的荧光有很大影响。王龙文等[42]设计了一种通过酶触发点击化学反应来检测β-葡萄糖苷酶的方法,使体系荧光强度显著增强,能准确反映β-葡萄糖苷酶的活性。程鑫等[43]利用刃天青被还原后荧光增强的性质,开发了一种简单灵敏的荧光方法用于β-葡萄糖苷酶活性的检测。
4.6 熊果苷显色法
熊果苷能在β-葡萄糖苷酶的作用下分解,使菌落周围呈棕黑色的圈,透明圈的大小即代表酶活力大小。该检测方法操作简便,快速、直观,但需与其他方法配合使用。
VERVOORT Y等[44]以熊果苷作为碳源,利用产酶菌落在平板上显色筛选产β-葡萄糖苷酶的菌株,发现供试的428株菌株中45%的酿酒酵母和47%的非酿酒酵母均有产β-葡萄糖苷酶活性。BONCIANI T等[16]以熊果苷和七叶灵为基质,从同一批菌株中筛选产β-葡萄糖苷酶的酵母菌,结果显示,以熊果苷为基质的实验组显示,75%的菌株都具有糖苷酶活性;而以七叶灵为基质的实验组显示只有接近39%的菌株具有糖苷酶活性。HERNÁNDEZ L F等[45]研究了酵母菌在不同培养基和不同培养条件下的酶活性,结果显示培养基的种类、pH值、培养温度对酵母菌的酶活性都有显著的影响。
因此,在实验过程中,为获得稳定一致的结果,避免出现假阳性现象,至少选择两种以上基质进行平行试验,选择双阳性的菌株进行后续试验。
5 酶解产香机制
β-葡萄糖苷酶(β-glucosidase)EC 3.2.1.21,属于水解酶类,又称β-D-葡萄糖苷水解酶,别名龙胆二糖酶、纤维二糖酶和苦杏仁苷酶,对结合于末端的非还原性β-葡萄糖苷键具有催化和水解作用,最终释放出配基与葡萄糖体[46]。葡萄与葡萄酒中的葡萄糖体常分为双糖苷和单糖苷,极少见三糖苷,其结构如图1所示[47]。
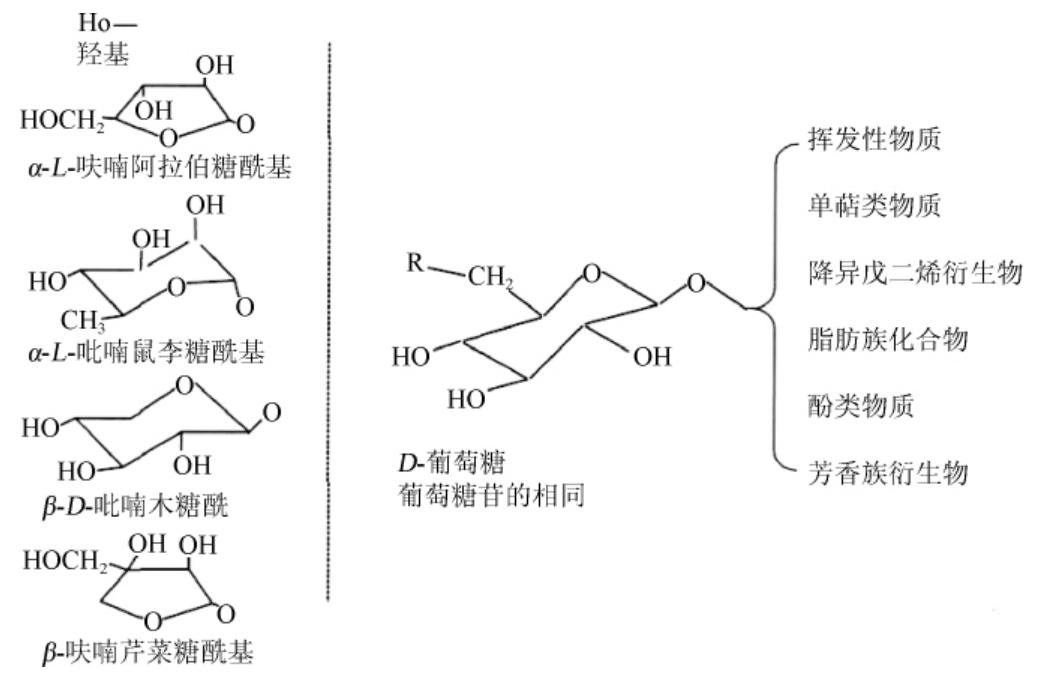
图1 葡萄中风味前体物中的单糖苷或双糖苷
Fig.1 Mono-or diglycoside of flavor precursors in grapes
双糖苷的酶解原理可分为一步酶解和两步酶解,如图2所示[5]。SARRY J E等[48]研究了两步法酶解双糖苷中糖配基的机制:第一步是利用外切酶(例如:α-阿拉伯(呋喃)糖苷酶等)切断双糖苷内部糖与糖之间的糖苷键,得到含有配基的单糖苷;第二步是在β-葡萄糖苷酶的作用下,切断配基与糖之间的糖苷键释放出香气物质。OGAWA K等[49]利用二糖苷酶只通过一步就将双糖苷水解为二糖和配基。
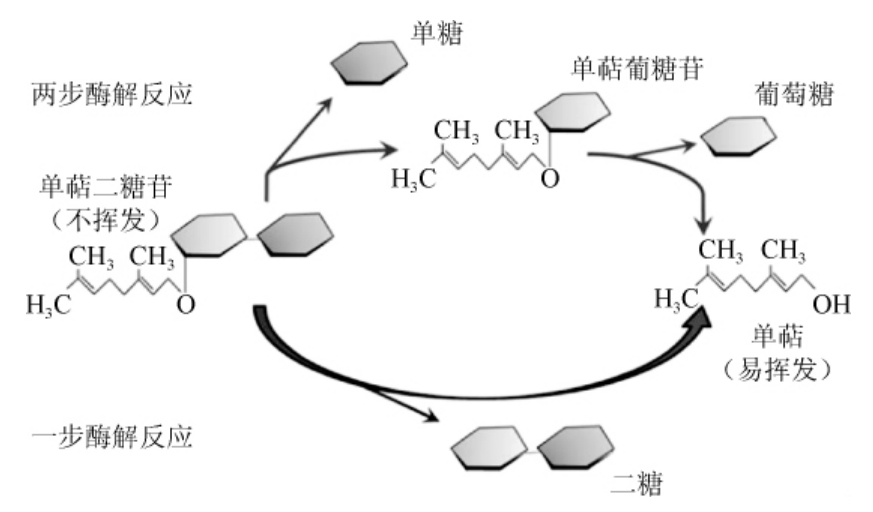
图2 单萜二糖苷酶解示意图
Fig.2 Schematic diagram of monoterpene diglycosides enzymolysis
周立华等[50]在葡萄酒酿造过程中,利用自选高产β-D-葡萄糖苷酶的酿酒酵母KDLYS9-16,能够促进单萜烯类物质的释放,从而增强葡萄酒的香气。王凤梅等[51]采用混菌发酵,利用非酿酒酵母菌自身代谢产生的β-葡萄糖苷酶酶解发酵液中糖苷类芳香前体物质,结果表明,添加萄萄汁有孢汉逊酵母和异常毕赤酵母的组合能显著降低发酵液中糖苷类物质的浓度。MATEO J J等[52]研究表明,降异戊二烯是赤霞珠葡萄酒香气的主要来源,而降异戊二烯类化合物在葡萄浆果中主要以糖苷键合态的形式存在,且糖苷全部都是单糖苷。GÜNATA Z等[53]针对单糖苷前体做了研究,仅仅只需要β-D-葡萄糖苷酶的水解就可以释放香气化合物。HAMPEL D等[54]研究了不同条件对霞多丽和赤霞珠浆果及葡萄酒中糖苷类香气前体释放的影响,结果发现,经β-葡萄糖苷酶水解后的浆果和葡萄酒不仅挥发性香气成分的含量增加了,部分成分(例如:芳樟醇)甚至增加了10倍多,而且香气成分的种类比对照组多检测出41种。
由此可见,葡萄与葡萄酒中存在大量结合态香气前体物质,且大部分香气前体均结合单糖苷,仅使用β-葡萄糖苷酶便可使其释放,达到提升葡萄酒香气品质的目的。
6 展望
葡萄酒的风味是衡量葡萄酒品质的一个重要指标,葡萄中的单萜烯类化合物是葡萄酒香气的重要组成成分,大多数单萜烯类化合物以糖苷结合态的形式存在,只有经过发酵过程的酶解作用才能释放到葡萄酒中。利用风味酶的作用,增强和改善葡萄酒的风味已成为一种趋势。近年来,葡萄酒行业使用的β-葡萄糖苷酶制剂主要源于黑曲霉,虽然能提高葡萄酒的香气,但同时也增加了外来蛋白质对葡萄酒稳定性的潜在威胁。因此,筛选高活性β-葡萄糖苷酶的酿酒酵母,使其在发酵的同时水解葡萄中的萜烯类物质释放香气物质,避免引入外来蛋白,且发酵条件温和,具有广阔的市场应用前景。
[1]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,26(2):107-114.
[2]LIU J B,ZHU X L,NIAMAT U,et al.Aroma glycosides in grapes and wine[J].J Food Sci,2017,82(2):248-259.
[3]LÓPEZ M C,MATEO J J,MAICA S.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].J Food Sci,2015,80(8):C1696-C1704.
[4]王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[5]HELMUT K,GOTTFRIED U,JÜRGEN F.Biology of Microorganisms on Grapes,in Must and in Wine(Second Edition)[M].Berlin:Springer Berlin Heidelberg,2017.
[6]TAMBORRA P,MARTION N,ESTI M.Laboratory tests on glycosidase preparations in wine[J].Anal Chim Acta,2004,513(1):299-303.
[7]GONZÁLEZ-POMBO P,PÉREZ G,CARRAU F,et al.One-step purification and characterization of an intracellular β-glucosidase from Metschnikowia pulcherrima[J].Biotechnol Lett,2008,30(8):1469-1475.
[8]王凤梅,马利兵.非酿酒酵母在发酵过程中的代谢产物对葡萄酒质量的影响[J].中国酿造,2016,35(12):12-17.
[9]DAENEN L,SAISON D,STERCKX F,et al.Screening and evaluation of the glucoside hydrolase activity in Saccharomyces and Brettanomyces brewing yeasts[J].J Appl Microbiol,2008,104(2):478-488.
[10]RODRÍGUEZ M E,LOPES C A,VAN BROOCK M,et al.Screening and typing of Patagonian wine yeasts for glycosidase activities[J].J Appl Microbiol,2004,96(1):84-95.
[11]王凤梅,张邦建,岳泰新.葡萄酒相关酵母β-葡萄糖苷酶活性及影响因素研究[J].中国酿造,2018,37(7):83-87.
[12]马得草,游灵,李爱华,等.高产β-葡萄糖苷酶野生酵母的快速筛选及其糖苷酶酿造适应性研究[J].西北农林科技大学学报(自然科学版),2018,46(1):129-135.
[13]FERNÍNDEZ M,![]() BEDA J F,BRIONES A I.Typing of non-Saccharomyces yeasts with enzymatic activities of interest in wine-making[J].Int J Food Microbiol,2000,59(1-2):29-36.
BEDA J F,BRIONES A I.Typing of non-Saccharomyces yeasts with enzymatic activities of interest in wine-making[J].Int J Food Microbiol,2000,59(1-2):29-36.
[14]FERNÁNDEZ-GONZÁLEZ M,DI STEFANO R,BRIONES A.Hydrolysis and transformation of terpene glycosides from muscat must by different yeast species[J].Food Microbiol,2003,20(1):35-41.
[15]SWANGKEAW J,VICHITPHAN S,BUTZKE C E,et al.Characterization of β-glucosidases from Hanseniaspora sp.and Pichia anomala with potentially aroma-enhancing capabilities in juice and wine[J].World J Microbiol Biotechnol,2011,27(2):423-430.
[16]BONCIANI T,DE VERO L,GIANNUZZI E,et al.Qualitative and quantitative screening of the β-glucosidase activity in Saccharomyces cerevisiae and Saccharomyces uvarum strains isolated from refrigerated must[J].Appl Microbiol,2018,67(1):72-78.
[17]VERSPOHL A,SOLIERI L,GIUDICI P.Exploration of genetic and phenotypic diversity within Saccharomyces uvarum for driving strain improvement in winemaking[J].Appl Microbiol Biotechnol,2017,101(6):2507-2521.
[18]李爱华,孙玮璇,李萍,等.葡萄汁有孢汉逊酵母β-葡萄糖苷酶的提取与纯化[J].中国食品学报,2019,19(6):150-156.
[19]张方方,刘延琳.酿酒酵母的β-葡萄糖苷酶活性及氧气对酵母产酶的影响[J].中国酿造,2013,32(6):32-34.
[20]WANG Y X,ZHANG C,XU Y,et al.Evaluating potential applications of indigenous yeasts and their β-glucosidases[J].J Inst Brew,2015,121(4):642-648.
[21]曾钰,熊亮,李洁,等.UTH1 基因破坏提高重组酿酒酵母分泌β-葡萄糖苷酶[J].菌物学报,2018,37(11):1479-1488.
[22]MIYAZAKI T,NODA S,TANAKA T,et al.Hyper secretion of Thermobifida fusca β-glucosidase via a Tat-dependent signal peptide using Streptomyces lividans[J].Microb Cell Factor,2013,12(1):88.
[23]韩笑,陈介南,王义强,等.β-葡萄糖苷酶基因的克隆与表达研究进展[J].生物技术通报,2008,24(3):8-12.
[24]代军飞,牛锋,钟琦,等.粘性丝孢酵母β-葡萄糖苷酶基因部分CDs区克隆与表达分析[J].西北民族大学学报(自然科学版),2016,37(1):33-37.
[25]邵金辉,赵云,毛爱军,等.扣囊复膜孢酵母β-葡萄糖苷酶基因在毕赤酵母中的克隆与表达[J].微生物学报,2005,45(5):792-794.
[26]高院妮.β-葡葡糖苷酶基因的克隆及表达研究[D].昆明:云南大学,2016.
[27]KAWAI R,YOSHIDA M,TANI T,et al.Production and characterization of recombinant Phanerochaete chrysosporium beta-glucosidase in the methylotrophic yeast Pichia pastoris[J]. Biosci Biotech Bioch,2003,67(1):1-7.
[28]周立华,牟德华,李艳.酵母菌β-D-葡萄糖苷酶酶学性质及对葡萄酒香气的影响研究进展[J].酿酒科技,2016(9):99-104.
[29]刘文龙,王兴吉,盛花开,等.β-葡萄糖苷酶生产菌筛选及酶学特性[J].中国酿造,2017,36(9):120-122.
[30]侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[31]张敏,李佳益,倪永清,等.产β-葡萄糖苷酶非酿酒酵母的筛选及酶学特性研究[J].中国酿造,2016,35(5):97-101.
[32]朱啟会,高泽鑫,何腊平,等.产水解银杏黄酮苷的β-葡萄糖苷酶菌株的筛选及鉴定[J].中国酿造,2017,36(9):102-106.
[33]王斌斌,刘逸寒,李玉,等.β-葡萄糖苷酶高产菌株的筛选及其基因的克隆与表达[J].化学与生物工程,2012,29(6):66-70.
[34]梁金凤,汪涯,肖依文,等.内生真菌Eupenicillium javanicum R57 水解京尼平苷β-葡萄糖苷酶的分离纯化及其酶学性质[J].菌物学报,2017,36(11):1543-1555.
[35]PÉREZ G,FARIÑA L,BARQUET M,et al.A quick screening method to identify β-glucosidase activity in native wine yeast strains:application of Esculin Glycerol Agar(EGA)medium[J].World J Microbiol Biotechn,2011,27(1):47-55.
[36]周俊,夏秀东,李亚辉,等.产β-D-葡萄糖苷酶乳酸菌的筛选、鉴定及系统发育分析[J].食品工业科技,2018,39(12):119-123,131.
[37]王佳,胡兰兰,张军翔,等.高产β-葡萄糖苷酶野生酵母的筛选及产酶能力差异性分析[J].中国酿造,2018,37(2):50-53.
[38]吴小刚,曾莹,周丽明,等.β-葡萄糖苷酶高产菌的筛选[J].中国酿造,2005,150(9):14-16.
[39]姚瑶,霍元鹏,周伟,等.高产β-葡萄糖苷酶菌株的筛选及产酶条件优化[J].江西农业学报,2018,30(3):97-101.
[40]童爱均,赵超,曾峰,等.产β-葡萄糖苷酶菌株的筛选与鉴定[J].福建农业科技,2018,7(7):6-10.
[41]万振堂,杨丽杰.产胞外β-葡萄糖苷酶乳酸菌的筛选及其酶学性质的初步研究[J].食品与发酵工业,2009,35(4):28-32,37.
[42]王龙文,马济美,程鑫,等.基于酶触发的点击化学反应测定β-葡萄糖苷酶活性[J].有机化学,2018,38(10):2775-2786.
[43]程鑫,张珩,马济美.一种基于刃天青还原的荧光方法对β-葡萄糖苷酶活性的检测[J].分析测试学报,2019,38(3):360-363.
[44]VERVOORT Y,HERRERA-MALAVER B,MERTENS S,et al.Characterization of the recombinant Brettanomyces anomalus β-glucosidase and its potential for bioflavouring[J]. J Appl Microbiol,2016,121(3):721-733.
[45]HERNÁNDEZ L F,ESPINOSA J C,FERNÁNDEZ-GONZÁLEZ M,et al.β-Glucosidase activity in a Saccharomyces cerevisiae wine strain[J].Int J Food Microbiol,2003,80(2):171-176.
[46]范培军.嗜热糖苷酶的表达以及在冰葡萄酒增香中的初步研究[D].吉林:吉林大学,2018.
[47]康文怀,徐岩,赵光鳌.葡萄酒风味修饰研究进展[J].食品与生物技术学报,2009,28(4):438-443.
[48]SARRY J E,GÜNATA Z.Plant and microbial glycoside hydrolases:Volatile release from glycosidic aroma precursors[J].Food Chem,2004,87(4):509-521.
[49]OGAWA K,YASUYUKI I,GUO W,et al.Purification of a β-primeverosidase concerned with alcoholic aroma formation in tea leaves(cv.Shuixian)to be processed to oolong tea[J].J Agr Food Chem,1997,45(3):877-882.
[50]周立华,李艳.自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16 的酿酒性能[J].食品科学,2017,38(6):123-129.
[51]王凤梅,张邦建,岳泰新.混菌发酵葡萄汁对葡萄糖苷类芳香前体物水解作用的影响[J].中国酿造,2018,37(8):118-122.
[52]MATEO J J,PERIS L,IBAÑEZ C,et al.Characterization of glycolytic activities from non-Saccharomyces yeasts isolated from Bobal musts[J].J Ind Microbiol Biotechnol,2011,38(2):347-354.
[53]GÜNATA Z,BITTEUR S,BRILLOUET J,et al.Sequential enzymic hydrolysis of potentially aromatic glycosides from grape[J].Carbohyd Res,1988,184:139-149.
[54]HAMPEL D,ROBINSON A L,JOHNSON A J,et al.Directhydrolysis and analysis of glycosidically bound aroma compounds in grapes and wines:comparison of hydrolysis conditions and sample preparation methods[J].Aust J Grape Wine Res,2014,20(3):361-377.