β-受体激动剂是一类具有肾上腺素功能的苯乙醇胺类人工合成物质[1],能有效提高养殖动物饲料转化率和瘦肉率,常被非法用于动物养殖过程,人们食用残留有一定剂量的β-受体激动剂肉制品后会出现不同程度的中毒反应,如面色潮红、四肢麻木等,严重的可能危及到生命[2-3]。因此,国家和主管农业部门加大了对β-受体激动剂的监管力度,2002年2月,原农业部、卫生部、国家药品监督管理局联合发布《禁止在饲料和动物饮用水中使用的药物品种目录》(农业部公告第176号),明确将盐酸克伦特罗、莱克多巴胺等7种β-受体激动剂列入目录[4]。
目前国内外动物源性食品中β-受体激动剂的检测方法[5-6]主要有酶联免疫法(enzyme-linked immunosorbent as say,ELISA)、高效液相色谱法(high performance liquid chromatography,HPLC)、气相色谱-串联质谱联用法(gas chromatography-tandem mass spectrometry,GC-MS/MS)、高效液相色谱-串联质谱联用法(high performance liquid chromatography-mass spectrometry,HPLC-MS/MS)。酶联免疫法(ELISA)[7-9]适用于大批量样品的快速筛查,样品前处理相对简单,所需仪器化程度低,但检验过程易出现假阳性结果,因此用该方法检测到的阳性样品需要用其他仪器方法进行确认。高效液相色谱法(HPLC)[10]分离度好、专属性强,但样品前处理和试剂要求较高,基质干扰较大,也容易出现假阳性结果。气相色谱-质谱联用法(GC-MS)[11-13]能在多种β-受体激动剂同时存在的情况下对某种特定的残留物进行定性、定量分析,与HPLC法相比,检测灵敏度较高,假阳性概率更低,但GC-MS适用于挥发性成分检测,前处理需要衍生化,过程较繁琐,检测耗时长,样品回收率也得不到保证。GC-MS[11-12]要求较高,基质干扰较大,也容易出现假阳性结果。高效液相色谱-串联质谱联用法(HPLC-MS/MS)[14-15]与其他检测方法相比,具有适用范围广、准确,灵敏度高、分析周期短等优点,已被越来越多地应用于动物源性食品中β-受体激动剂的检测和确认。目前GB/T 22286—2008《动物源性食品中多种β-受体激动剂残留量的测定液相色谱串联质谱法》[16]被广泛用于监督检测中,但该标准方法在前处理过程未对肉制品进行去除油脂处理,而是直接提取净化,这样做既会对样品回收率造成影响,同时还易造成液相色谱柱堵塞。此外,已报道的文献[17-21]对目标物提取溶剂和净化方式差异较大,提取回收率高低不同。本实验在GB/T 22286—2008的基础上,选择在猪肉基质中添加克伦特罗、莱克多巴胺、沙丁胺醇3种β-受体激动剂进行研究,先用正己烷对加标样品做去除油脂处理,然后对其提取溶剂和固相萃取净化柱作优化研究,最终建立了超高效液相色谱-串联质谱(ultra-high performance liquid chromatographytriple quadrupole tandem mass spectrometry,UPLC-MS/MS)的检测方法,具有定性和定量准确可靠、高灵敏度、基质干扰小等优点,可为动物源性食品中β-受体激动剂的检测分析提供理论指导。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、乙酸乙酯、正己烷、异丙醇(均为色谱纯):默克股份两合公司;石油醚(分析纯):西陇科学股份有限公司;氯化钠、氢氧化钠、无水醋酸钠、盐酸、氨水、甲酸(均为分析纯):国药集团化学试剂有限公司;β-葡萄糖醛甙酶(分析纯):Helix pomatia公司。猪肉样品:市场抽检。
克伦特罗标准品(纯度>98%):德国E.Q.公司;沙丁胺醇标准品(纯度>98%):中国食品药品检定研究院;莱克多巴胺标准品(纯度>98%):美国Stanford Chemicals公司。
6cc 150 mg SCX、6cc 150 mg WCX、6cc 150 mg PCX、6cc 150mgMCX固相萃取柱:美国Waters公司;C18色谱柱(2.1mm×150 mm,1.8μm):美国Agilent公司;PES滤膜(0.22 μm):天津津腾有限公司。
1.2 仪器与设备
EXION-QTRAP4500超高效液相-串联质谱联用仪:美国AB公司;SK8210HP超声波清洗仪:上海科导超声仪器有限公司;Reacti-Therm氮吹仪:美国Thermo Scientific公司;Allegra X-30R高速离心机:美国贝克曼公司;JJ500电子天平:常熟市双杰测试仪器厂;MF10组织捣碎机:德国IKA公司;S220K pH计:梅特勒-托利多国际贸易(上海)有限公司;HH-6恒温水浴锅:金坛市科析仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
准确量取100 μg/mL的克伦特罗+沙丁胺醇+莱克多巴胺混合标准溶液1 mL,用乙腈稀释定容至100 mL,配制成质量浓度为1 μg/mL的标准储备液,于4 ℃冰箱保存。准确量取1 μg/mL标准储备液,用体积分数30%乙腈依次稀释成5 ng/mL、10 ng/mL、25 ng/mL、50 ng/mL、80 ng/mL、100 ng/mL的系列标准工作溶液,避光4 ℃条件下保存,待用。
1.3.2 样品前处理
(1)提取:准确称取样品约2 g(精确至0.01 g)置于50 mL离心管中,加入10 mL正己烷超声10 min去除油脂处理后,加入8 mL乙酸钠缓冲液,充分混匀,加入50 μL β-葡萄糖醛甙酶于离心管中,混匀后,37 ℃条件下水浴水解12 h。
水解完成后,取出离心管,于水平振荡器上振荡15 min,5 000 r/min离心10 min,取4 mL上清液于另一离心管中,加入0.1 mol/L高氯酸溶液5 mL,混合均匀,用高氯酸调节pH值至1±0.3,5 000 r/min离心10 min,转移全部上清液于50 mL离心管中,用10 mol/L的氢氧化钠溶液调节pH至11,加入10 mL饱和氯化钠溶液和10 mL异丙醇-乙酸乙酯(6∶4,V/V)混合溶液,充分超声提取5 min,5 000 r/min离心10 min,转移有机相至另一50 mL离心管中,重复提取一次,合并有机相,于40 ℃水浴中氮气吹干,加入5 mL乙酸钠缓冲液,超声混匀,残渣充分溶解后备用。
(2)净化:用3 mL甲醇和3 mL水活化MCX阳离子交换柱,将上述待测溶液过柱,依次用2 mL水、2 mL 2%甲酸水溶液和2 mL甲醇洗涤柱子并彻底抽干,再用2 mL 5%的氨水甲醇溶液洗脱柱子上的待测成分,洗脱液在40 ℃水浴条件下氮气吹干,最后用1 mL 0.1%甲酸/水-乙腈(70∶30,V/V)超声溶解,过0.22 μm微孔滤膜,超高效液相色谱-串联质谱仪测定。
1.3.3 超高效液相色谱-串联质谱条件
(1)超高效液相色谱条件为流速0.3 mL/min;柱温40 ℃;进样量10 μL;流动相A为含0.1%甲酸溶液,流动相B为乙腈,洗脱梯度见表1。
表1 梯度洗脱条件
Table 1 Gradient elution conditions

(2)电喷雾离子化串联质谱(electrospray ionization tandem mass spectrometry,ESI-MS/MS)条件:正离子扫描;质谱多反应监测(multiple reaction monitoring,MRM);气帘气,离子源雾化气,离子源辅助加热气,分别设定为38 L/h、55 L/h、55 L/h,喷雾电压5 500 V,加热器温度为550 ℃;优化后的监测离子对(m/z)、去簇电压(declusteringpotential,DP)、碰撞能量(collision energy,CE)、驻留时间等参数见表2。
表2 3种β-受体激动剂保留时间及质谱参数
Table 2 Retention time and mass spectrometry parameters of three β-receptor agonists

注:a为定量离子对。
2 结果与分析
2.1 仪器条件优化
该类化合物分子结构中均含有胺基和羟基基团,在质谱检测离子化过程中,容易形成稳定的[M+H]+离子,故采用电喷雾电离(electrospray ionization,ESI+)正离子扫描模式。优化过程用体积分数50%乙腈水溶液将1 μg/mL混合标准储备溶液稀释成约为200 ng/mL的溶液,针泵恒流注射进样,设置一定的质谱参数,分别扫描3种化合物的母离子Q1和子离子Q3,选取两对离子丰度较强、干扰较小的特征离子对来同时定性,避免假阳性结果的发生,再选取其中离子丰度最强的一对离子对来进行定量,保证定量的准确性。最后对确定的Q1和Q3来优化去簇电压、碰撞能量、驻留时间等参数,建立完整的质谱参数。
正离子扫描模式下,在液相色谱流动相中加入少量的甲酸会增强待测化合物的响应强度,原因是甲酸会电离出更多的H+。因此本实验选用0.1%的甲酸水溶液与乙腈为流动相,由于3种化合物的极性比较相近,故采用较长的C18色谱柱(2.1 mm×150 mm,1.8 μm)进行梯度洗脱,从而保证各个化合物有较好的峰形、分离度和响应强度。建立优化后的超高效液相色谱参数和质谱参数后对混合标准溶液、加标样品溶液和空白样品溶液采集的离子色谱峰图分别如图1所示。

图1 混合标液(A)、加标样品(B)、空白样品(C)的UPLC-MS/MS色谱图
Fig.1 UPLC-MS/MS chromatogram of mixed standard (A),adding standard sample (B) and blank sample (C)
1-沙丁胺醇;2-莱克多巴胺;3-克伦特罗。
2.2 前处理条件的优化
2.2.1 提取溶剂的优化

图2 不同比例异丙醇-乙酸乙酯克伦特罗、沙丁胺醇和莱克多巴胺提取回收率的影响
Fig.2 Effct of different proportions of isopropanol-ethyl acetate on the extraction recovery rate of clenbuterol,salbutamol and ractopamine
克伦特罗、沙丁胺醇、和莱克多巴胺分子结构均由苯环连接着胺基和羟基构成,属于中等极性化合物,本实验考察了异丙醇-乙酸乙酯两种中等极性的溶剂以(10∶0、7∶3、6∶4、5∶5、4∶6、3∶7、0∶10,V/V)等不同比例混合后提取效率的高低,结果如图2所示。从图2可以看出,异丙醇-乙酸乙酯(6∶4,V/V)混合液提取效果最好,3种β-受体激动剂的回收率依次为78.7%、88.9%、83.4%,此结果进一步验证了GB/T 22286—2008《动物源性食品中多种β-受体激动剂残留量的测定液相色谱串联质谱法》所用异丙醇-乙酸乙酯(6∶4,V/V)混合溶液作为提取溶剂的正确性。
2.2.2 净化条件的优化
本实验在前处理过程中,采用4种不同的阳离子交换小柱(WCX、PCX、SCX及MCX)对目标提取液进行净化萃取,比较其对克伦特罗、沙丁胺醇、莱克多巴胺的净化效果,结果如图3所示。从图3可以看出,采用MCX固相萃取柱的净化效果最好,样品中3种β-受体激动剂的回收率均在70%以上,原因可能是MCX填料对3种化合物所形成的[M+H]+离子吸附作用较强,且易于洗脱。因此本实验选择MCX作为固相净化柱。

图3 不同净化柱下克伦特罗、沙丁胺醇和莱克多巴胺的提取回收率
Fig.3 Extraction recovery rate of clenbuterol,salbutamol and ractopamine under different purification columns
2.3 方法学验证
2.3.1 线性关系及检出限
采用外标法定量,以目标物的质量浓度(x)作为横坐标,目标物定量离子对的峰面积(y)作为纵坐标绘制标准曲线。3种化合物的线性方程、相关系数、检出限及定量限见表3。
表3 3种β-受体激动剂的线性方程、相关系数及检出限
Table 3 Linear equations,correlation coefficients and detection limits of three β-receptor agonists
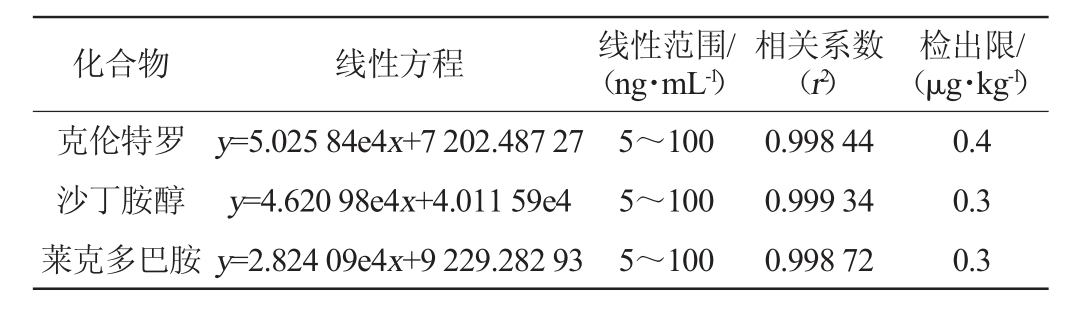
由表3可知,3种β-受体激动剂混合标准液的质量浓度范围在5~100 ng/mL,相关系数R2均>0.99。在空白猪肉样品中加入3种混合标液,经过萃取浓缩和净化后进行仪器检测,以3倍信噪比为方法检出限。目前,国家标准GB/T 22286—2008《动物源性食品中多种β-受体激动剂残留量的测定液相色谱串联质谱法》[16]中对克伦特罗、沙丁胺醇、莱克多巴胺残留量的检出限均为0.5 μg/kg,因此本实验建立的肉制品中β-受体激动剂残留量的检测方法符合国家标准的检测要求。
2.3.2 回收率和精密度
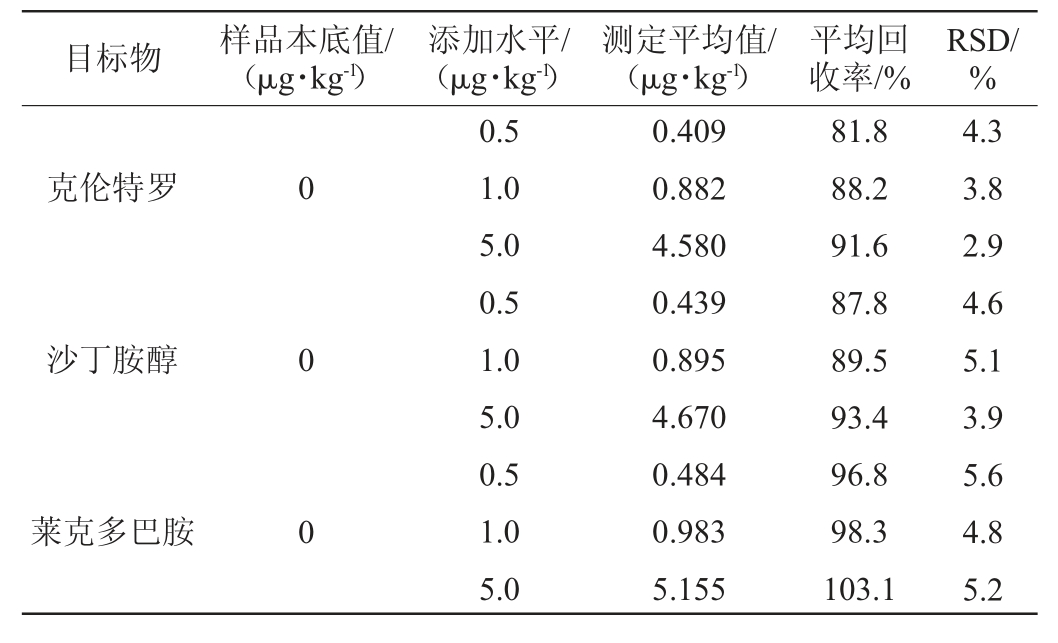
在猪肉中分别添加0.5 μg/kg、1.0 μg/kg、5.0 μg/kg 3个浓度水平的混合标准溶液,每个水平进行6次平行实验,按照优化的实验方法测定,计算其加标回收率及精密度,实验结果见表4。3种β-受体激动剂的平均回收率均为81.8%~103.1%,相对标准偏差(relative standard deviation,RSD)均<10%,其加标回收率和精密度均符合GB/T 27404—2008规定的要求[22]。
表4 加标回收率实验结果(n=6)
Table 4 Results of adding standard recovery rate test (n=6)
3 结论
本实验建立了超高效液相色谱-三重四级杆串联质谱法同时测定猪肉中克伦特罗、沙丁胺醇、莱克多巴胺残留量的分析方法,分别对提取溶剂、固相萃取柱、液相色谱和质谱参数进行了优化。该方法先用正己烷去除样品中油脂,再用异丙醇-乙酸乙酯(6∶4,V/V)混合液萃取浓缩,最后用MCX固相萃取柱进一步净化,有效减弱了基质效应,提高了检测方法的灵敏度和准确度。3种β-受体激动剂的平均回收率在81.8%~103.1%,相对标准偏差均<10%,表明该方法回收率高和重复性好,能够满足国外相关法规的要求,适合大批量猪肉中β-受体激动剂残留量的检测分析。
[1]王培龙.β-受体激动剂及其检测技术研究[J].农产品质量与安全,2014(1):47-49.
[2]彭涛,赖卫华,张富生,等.20 种β2-受体激动剂的性质及检测方法研究进展.食品与机械,2013(3):254-260.
[3]WANG W,ZHANG Y,WANG J,et al.Determination of β-agonists in pig feed,pig urine and pig liver using capillary electrophoresis with electrochemical detection[J].Meat Sci,2010,85(2):302-305.
[4]农业部.禁止在饲料和动物饮用水中使用的药物品种目录[J].湖南畜牧兽医,2011(3):4-5.
[5]万宇平,凌莉,高东微,等.β-激动剂类兽药残留检测技术研究进展[J].饲料工业,2013,34(3):56-59.
[6]白凌.动物组织中β-受体激动剂分析方法研究[D].北京:北京化工大学,2007.
[7]CAO B Y,HE G Z,YANG H.et al.Development of a highly sensitive and specific enzyme-linked immunosor bent assay(ELISA)for the detection of phenylethano lamine A in tissue and feed samples and confirmed by liquid chromatography tandem mass spectrometry(LC-MS/MS)[J].Talanta,2013,11(5):624-630.
[8]杨正涛,张乃生,史利军,等.β-激动剂多组分残留的酶免疫分析方法[J].中国农学通报,2008,24(8):23-27.
[9]周群标,桑亚新,王丽,等.动物性食品中盐酸克伦特罗ELISA 检测方法的建立及应用[J].中国食品学报,2011(6):158-162.
[10]张仁诚,李吉平,郝镯,等.动物组织中3 种β-肾上腺受体激动剂残留的高效液相色谱荧光检测法[J].职业与健康,2015,31(3):322-325.
[11]吴银良,李晓薇,刘素英,等.气相色谱-质谱法测定肝脏组织中盐酸克伦特罗和盐酸莱克多巴胺[J].分析化学,2006,34(8):1083-1086.
[12]黄义彬.猪肉中盐酸克伦特罗和盐酸莱克多巴胺残留量检测气质联用法探讨[J].农技服务,2011(1):67-70.
[13]朱坚,李波,方晓明,等.气相色谱-质谱法测定肝、肾和肉中11 种β-受体激动剂残留量[J].质谱学报,2005,26(3):129-137.
[14]韩婉清,吴楚森,吴玉銮,等.超高效液相色谱-串联质谱测定动物肌肉组织中32 种β-激动剂、β-阻滞剂和糖肽类抗生素药物残留[J].分析化学,2016,44(2):289-296.
[15]张瑞雨,梁孟军,赵丽,等.固相萃取-高效液相色谱-串联质谱法测定食品中的β-受体激动剂[J].中国食品卫生杂志,2017,29(2):167-171.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.动物源性食品中多种β-受体激动剂残留量的测定液相色谱串联质谱法:GB/T 22286—2008[S].北京:中国标准出版社,2008.
[17]沈东强,刘标.超高效液相色谱-串联质谱法测定猪肝中3 种β-受体激动剂残留[J].浙江农业科学,2019,60(2):271-273.
[18]罗辉泰,黄晓兰,吴惠勤,等.分散固相萃取-同位素稀释-高效液相色谱-串联质谱法同时测定猪肉中26 种β-受体激动剂[J].色谱,2016,34(5):481-489.
[19]代立勤,崔银仓.超高效液相色谱-串联质谱法测定猪肉中5 种β-受体激动剂残留[J].现代农业科技,2018,13(1):253-257.
[20]刘敬先,苗翠,刘笑,等.超高效液相串联质谱法分析牛肉中残留的β-受体激动剂[J].药物分析杂志,2014,34(10):1836-1841.
[21]刘敏,刘戎,王立琦,等.猪肝中β-受体激动剂多残留的样品前处理方法比较及同时检测[J].分析测试学报,2012,31(3):290-295.
[22]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.实验室质量控制规范食品理化检验:GB/T 27404—2008[S].北京:中国标准出版社,2008.