辅酶Q10(coenzyme Q10)又名泛醌(ubiquinone),其在动物、植物及微生物体细胞内广泛存在,大量存在于细胞的膜结构中,基本以具有抗氧化活性的还原态存在[1-3]。辅酶Q10由于在体内直接参与代谢,无毒副作用,作为一种良好的生化药物在临床上被广泛应用于心血管疾病方面的治疗[4-9];除此之外,辅酶Q10作为一种天然抗氧化剂、细胞代谢的激活剂,具有促进皮肤新陈代谢、减缓皱纹形成从而延缓衰老的功能,在化妆品和保健品领域越来越多的被应用到[10-13]。
辅酶Q10现有的生产方法主要包括提取分离法、化学合成法和微生物发酵法,其中微生物发酵法相较于提取分离法和化学合成法,生产的产品为全反式辅酶Q10,反式辅酶Q10具有还原性,有非常强的药理活性,人体生物利用度高,且微生物发酵法原料廉价丰富,产物分离过程相对简单,产品纯度高[14-18],受到广泛的关注。但微生物本身生产辅酶Q10产量较低,多使用诱变方法提高辅酶Q10产量,然而56Fe17+重离子束照射类球红细菌(Rhodobacter sphaeroides)诱变选育高产辅酶Q10突菌株技术仍属空白[19]。
本研究采用56Fe17+重离子束照射对辅酶Q10生产野生型类球红细菌(Rhodobacter sphaeroides)进行诱变,通过罗红霉素、卡那霉素、叠氮钠、对羟基苯甲酸和维生素K3五种筛选因子筛选高产辅酶Q10突变菌株,以期为商业化大规模生产辅酶Q10寻求优良菌株,并为相关研究提供可靠的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
类球红细菌(Rhodobacter sphaeroate):中国工业微生物菌种保藏中心(China center of industrial culture collection,CICC),CICC编号为10287。
1.1.2 化学试剂
辅酶Q10标准品:美国Sigma公司;浓硫酸、葡萄糖、玉米浆粉、乙醇、酵母提取物、谷氨酸钠、磷酸二氢钾、罗红霉素、叠氮钠、卡那霉素、对羟基苯甲酸、氯化钠、碳酸钙、盐酸硫铵、硫酸镁、生物素、琼脂粉、烟酸:均为国产分析纯或生化试剂。
1.1.3 培养基
种子培养基(NH1培养基)[20]:葡萄糖3 g/L,氯化钠2 g/L,酵母提取物8 g/L,磷酸二氢钾1.3 g/L,硫酸镁0.125 g/L,盐酸硫胺1 mg/L,生物素15 μg/L,烟酸1 mg/L,用氢氧化钠溶液调节pH值至7.2,固体培养基添加2.0%琼脂粉,115 ℃高压灭菌20 min。
发酵培养基[20]:玉米浆干粉3 g/L,谷氨酸钠3 g/L,氯化钠2.8 g/L,硫酸铵3 g/L,磷酸二氢钾3 g/L,葡萄糖30 g/L,硫酸镁6.3 g/L,碳酸钙2 g/L,盐酸硫胺1 mg/L,生物素15 μg/L,烟酸1 mg/L,用氢氧化钠溶液调节pH值至7.2,115 ℃高压灭菌20 min。
1.2 仪器与设备
56Fe17+重离子束:中国科学院近代物理研究所兰州重离子加速器国家重点实验室;LAN-40-H/L纯水仪:重庆力德高端水处理设备有限公司;AL104电子天平、FE20型pH计:梅特-托利多仪器有限公司;SHIMADZLJ型UV2450紫外可见分光光度计:日本岛津企业管理(中国)有限公司;BSD-YX3600双层恒温摇床、LRH-150F生化培养箱:上海一恒科技有限公司;RE-5220高速冷冻离心机:上海试验仪器厂;DHG9070A(101-1)实验室烘箱:南京同皓干燥设备有限公司;YX-350B双层立式蒸汽压力灭菌锅:上海三申医疗器械有限公司。
1.3 实验方法
1.3.1 类球红细菌的培养
菌株的活化:将保存的类球红细菌接种于种子固体培养基,在30 ℃条件下恒温培养72 h。
种子液的制备:挑取单菌落接种于装液量为30 mL/250 mL的种子培养基,在30 ℃、230 r/min条件下振荡培养30 h。
1.3.2 生长曲线的测定
取5 mL培养至对数期的种子液,接种到装液量为30 mL/250 mL的发酵培养基,在30 ℃、230 r/min条件下恒温振荡培养72 h。每间隔4 h取1 mL菌液,6 000 r/min条件下离心10 min,弃上清液,加入1 mL蒸馏水混匀。采用紫外分光光度计于波长600 nm处测定吸光度值(OD600nm值),绘制其生长曲线。
1.3.3 发酵曲线的测定
取5 mL处于对数生长期的种子培养液于装液量为50 mL/250mL的发酵培养基中,平行设置3组,30℃、230r/min条件下恒温振荡培养,每间隔4 h分别吸取10 mL发酵液,6 000 r/min离心10 min,弃上清液,测定辅酶Q10含量。
1.3.4 56Fe17+重离子束照射诱变
取培养至对数生长期的发酵液10 mL,5 000 r/min离心,弃上清,用无菌生理盐水洗涤两次,重新悬浮于10 mL生理盐水中,即得菌悬液。将2 mL菌悬液装入3 mL无菌离心管中,在56Fe17+重离子束照射剂量分别为2 Gy、4 Gy、6 Gy、8 Gy、16 Gy的条件下进行诱变处理,每个剂量重复试验两次,以未诱变处理的菌悬液为空白对照。56Fe17+重离子照射诱变结束后,将菌悬液梯度稀释,取稀释度为10-5、10-6、10-7的菌悬液各0.2 mL涂布于种子固体培养基,30 ℃条件下恒温培养7 d,进行菌落计数[21],并计算致死率,其计算公式如下:
1.3.5 筛选因子对类球红细菌的最小抑制浓度测定
取0.2 mL处于对数生长期的种子培养液接种于含有筛选因子的种子固体培养基,30 ℃条件下恒温培养7 d,进行菌落计数。筛选因子及其质量浓度分别为叠氮钠:6 mg/L、7 mg/L、8 mg/L、9 mg/L、10 mg/L;维生素K3:5 mg/L、6 mg/L、7 mg/L、8 mg/L、9 mg/L,对羟基苯甲酸:300 mg/L、350 mg/L、400 mg/L、450 mg/L、500 mg/L,罗红霉素:10 mg/L、20 mg/L、30mg/L、40mg/L、50mg/L,卡那霉素:8mg/L、10mg/L、12mg/L、14 mg/L、16 mg/L,重复试验3次。
1.3.6 高产辅酶Q10突变菌株的筛选
空白平板筛选:取最佳56Fe17+重离子束照射剂量诱变后的菌悬液0.2 mL涂布于NH1种子培养基,30 ℃恒温倒置培养7 d,根据长出的菌落颜色、形状、大小等性状的不同,挑取菌落接种于NH1种子液体培养基,30 ℃条件下恒温振荡培养4 d。取种子液5 mL接种于发酵培养基,装液量50 mL/100 mL,30 ℃、230 r/min条件下恒温振荡培养48 h,测定辅酶Q10的产量。
抗性筛选:取最佳56Fe17+重离子束照射剂量诱变后的菌悬液0.2 mL分别涂布于含有筛选因子的5种NH1种子固体培养基中,30 ℃条件下恒温培养7 d。挑取5种筛选培养基上的单菌落各200株,分别接种于NH1种子液体培养基,30 ℃条件下恒温振荡培养4 d。取种子液5 mL接种于发酵培养基,装液量50 mL/100 mL,30 ℃、230 r/min条件下培养48 h,测定辅酶Q10的产量。
1.3.7 高产辅酶Q10突变菌株的遗传稳定性
将筛选到的高产辅酶Q10的突变株接种于NH1种子液体培养基,30 ℃、230 r/min条件下培养4 d。取种子液5 mL接种于发酵培养基,装液量50 mL/100 mL,30 ℃、230 r/min条件下培养48 h,测定辅酶Q10的产量。
1.3.8 辅酶Q10含量的测定
采用皂化法[22]提取类球红细菌中的辅酶Q10,将已破碎的菌体细胞加入7.5 mL pH值为11.0的氢氧化钠溶液中,90 ℃恒温加热30 min,迅速冷却。将已冷却的皂化液转移至500 mL封液漏斗,加入等体积的石油醚,充分振荡萃取两次,静置分层,收集上层萃取液,最后合并两次萃取液,转移至真空旋转蒸发仪中,60 ℃蒸干石油醚,在剩余干粉中加入一定量的无水乙醇,微热溶解,采用紫外分光光度法测定辅酶Q10含量[23]。
2 结果与分析
2.1 类球红细菌的生长曲线
类球红细菌的生长曲线见图1。由图1可知,在0~l0 h,类球红细菌处于较长的延滞期,培养基液体颜色基本无变化;15~30 h内处于对数生长期,菌体数量急速增长,培养基液体颜色逐渐变灰绿色;30~40 h菌体处于稳定期,培养基液体彻底变为浓绿色;40 h后进入衰亡期。

图1 类球红细菌的生长曲线
Fig.1 Growth curve of Rhodobacter sphaeroate
2.2 类球红细菌的发酵曲线
类球红细菌的辅酶Q10产量见图2。由图2可知,随着发酵时间的延长,辅酶Q10产量呈现先升高后缓慢下降的趋势。当发酵48 h时,辅酶Q10产量最高,为74.53 mg/L,因此,确定最佳发酵时间为48 h。
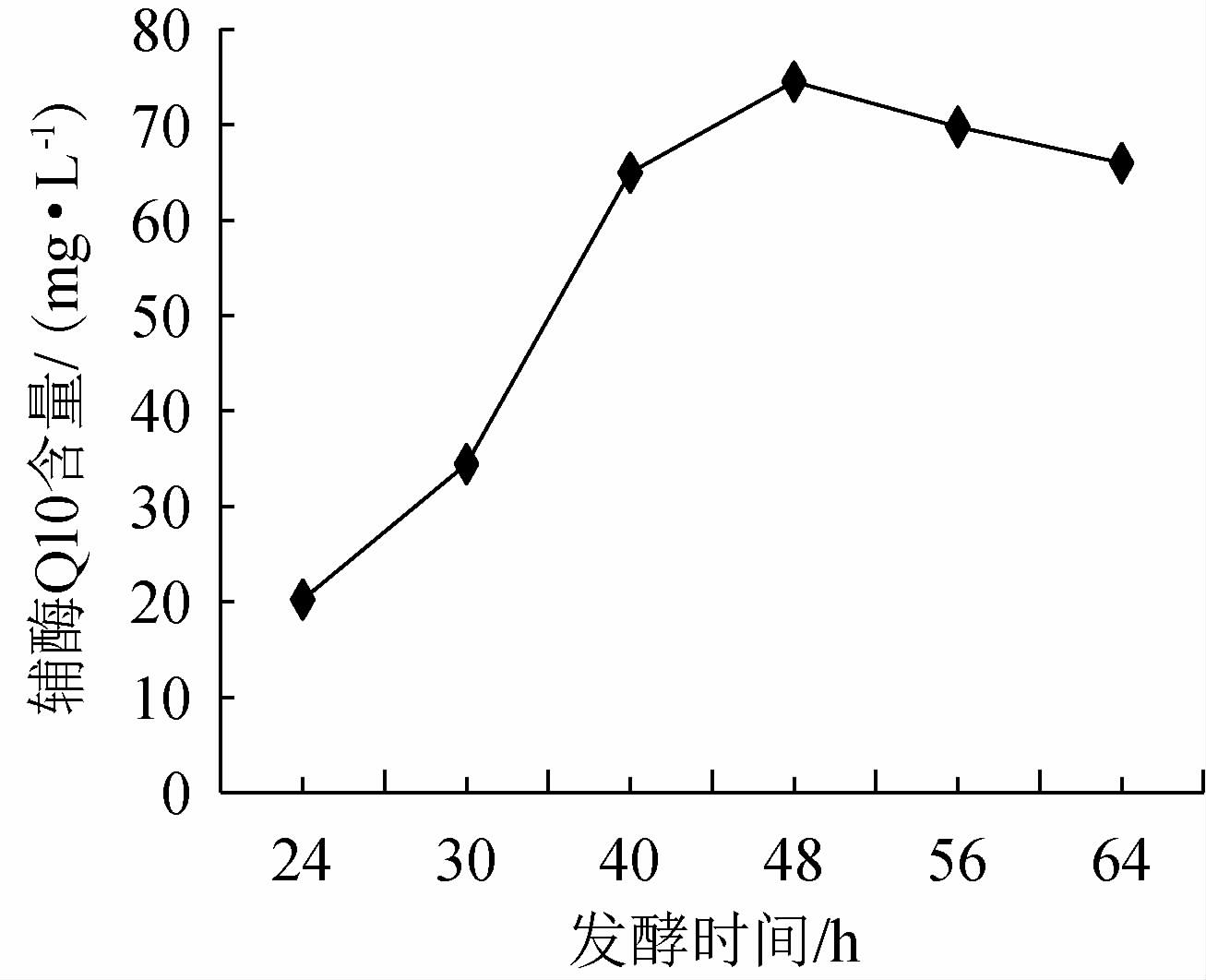
图2 类球红细菌的发酵曲线
Fig.2 Fermentation curve of Rhodobacter sphaeroate
2.3 56Fe17+重离子束照射类球红细菌的致死率
经56Fe17+重离子照射诱变后,类球红细菌的致死率见图3。由图3可知,类球红细菌的致死率随着56Fe17+重离子照射剂量的增加而增大,当照射剂量为16 Gy时,致死率达到99.7%,诱变效果最好。因此,选择最佳照射剂量为16 Gy。
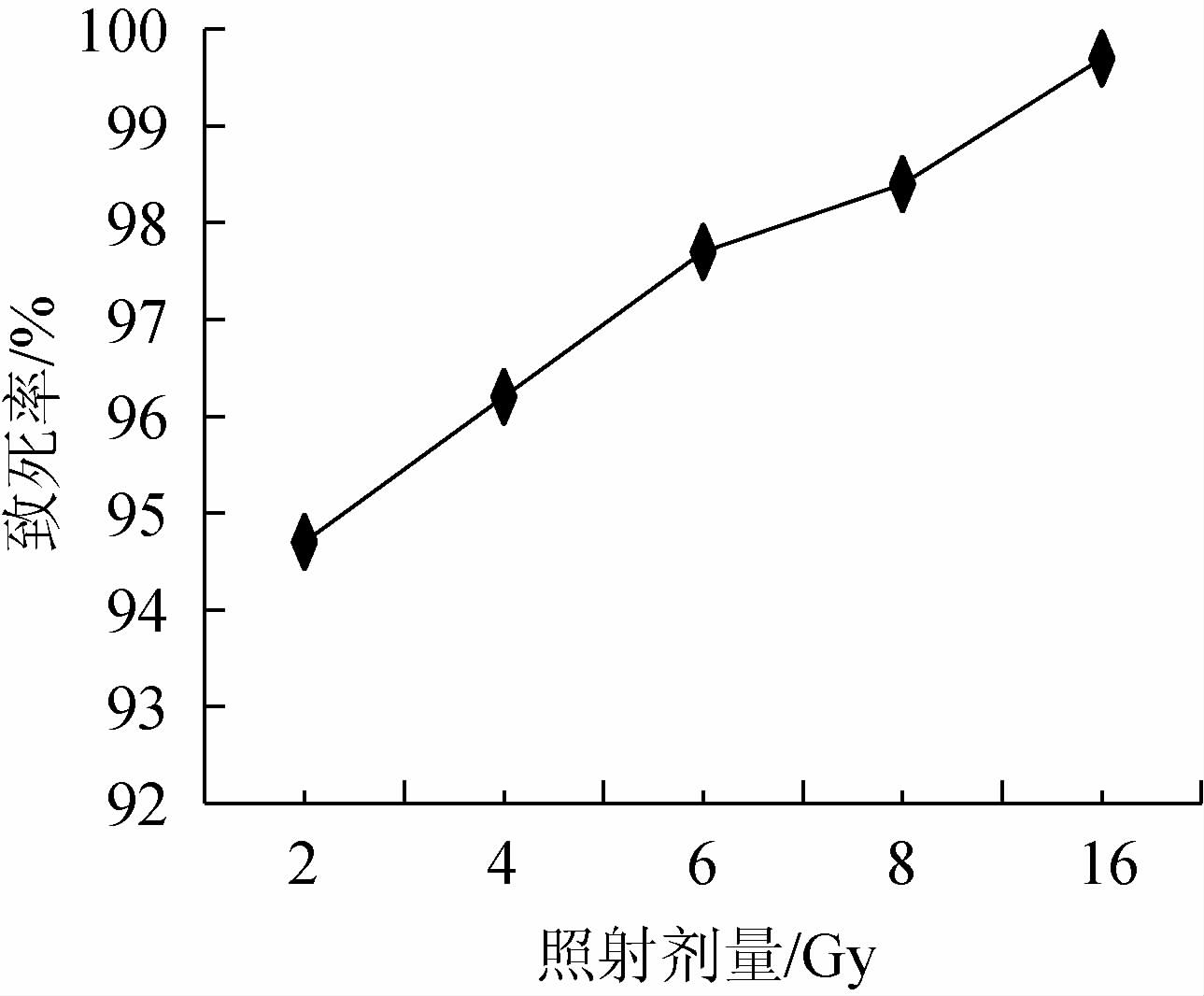
图3 类球红细菌的致死率曲线
Fig.3 Fatality rate of Rhodobacter sphaeroate
2.4 筛选因子最小抑制浓度测定
通过测定筛选因子对类球红细菌的最小抑制浓度发现,叠氮钠对类球红细菌的最小抑制质量浓度为10 mg/L;维生素K3对类球红细菌的最小抑制质量浓度为10 mg/L;对羟基苯甲酸的最小抑制质量浓度为450 mg/L;罗红霉素对类球红细菌的最小抑制质量浓度为50 mg/L;卡那霉素的最小抑制质量浓度为16 mg/L。因此,确定各筛选因子的最小抑制质量浓度为该筛选因子的初始浓度。
2.5 56Fe17+重离子束照射诱变高产辅酶Q10菌株的筛选
2.5.1 空白平板筛选
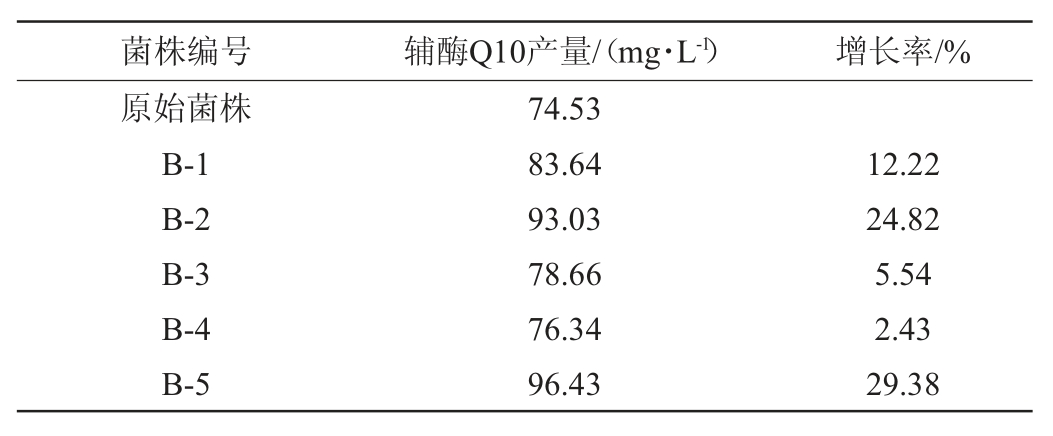
通过空白平板筛选得到5株高产辅酶Q10菌株,编号为B-1、B-2、B-3、B-4、B-5,其辅酶Q10产量见表1。由表1可知,5株菌株的辅酶Q10产量为76.34~96.43 mg/L,其中菌株B-5的辅酶Q10产量最高,达96.43 mg/L,比原始菌株提高了29.38%。
表1 空白平板筛选得到的突变株的辅酶Q10产量
Table 1 Coenzyme Q10 yield of mutant strains screened by blank plates
2.5.2 叠氮钠抗性筛选
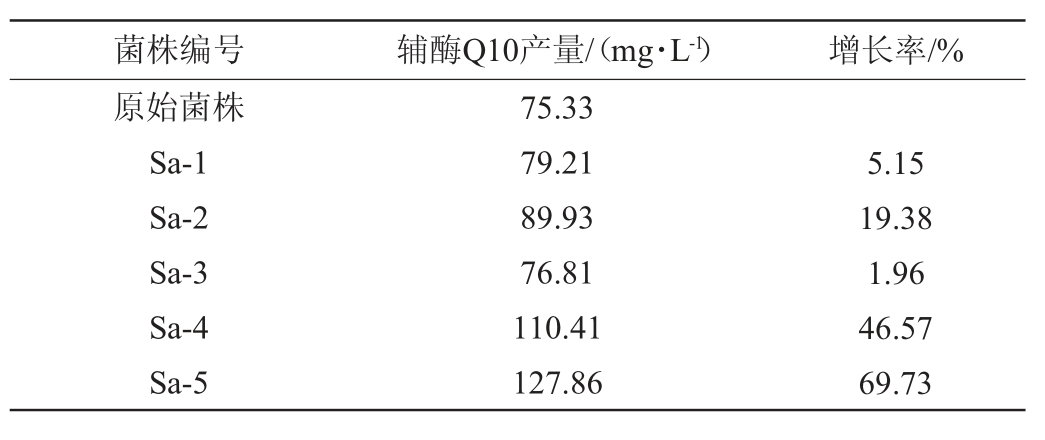
通过叠氮钠(10 mg/L)抗性平板筛选得到5株高产辅酶Q10菌株,编号为Sa-1、Sa-2、Sa-3、Sa-4、Sa-5,其辅酶Q10产量见表2。由表2可知,5株菌株的辅酶Q10产量为76.81~127.86 mg/L,其中菌株Sa-5的辅酶Q10产量最高,达127.86 mg/L,比原始菌株提高了69.73%。
表2 抗叠氮钠突变菌株的辅酶Q10产量
Table 2 Coenzyme Q10 yield of mutant strains with sodium azide resistance
2.5.3 维生素K3抗性筛选
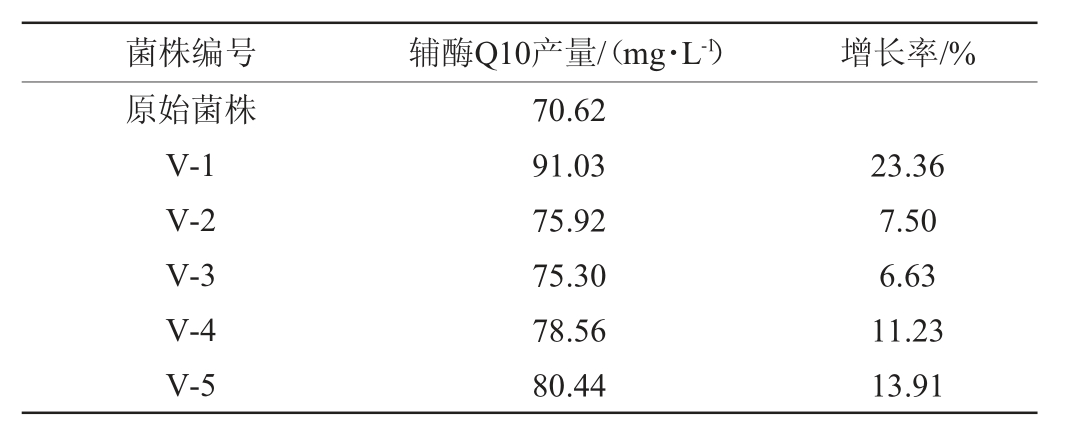
通过维生素K3(9 mg/L)抗性平板筛选得到5株高产辅酶Q10菌株,编号为V-1、V-2、V-3、V-4、V-5,其产量见表3。由表3可知,5株菌株的辅酶Q10产量为75.30~91.03 mg/L,其中,菌株V-1辅酶Q10产量最高,达91.03 mg/L,比原始菌株提高了23.36%。
表3 抗维生素K3突变株的辅酶Q10产量
Table 3 Coenzyme Q10 yield of mutant strains with vitamin K3 resistance
2.5.4 卡那霉素抗性筛选
通过卡那霉素(16 mg/L)抗性平板筛选得到5株高产辅酶Q10菌株,编号为K-1、K-2、K-3、K-4、K-5,其产量见表4。由表4可知,5株菌株的辅酶Q10产量为78.33~97.15 mg/L,其中菌株K-2辅酶Q10产量最高,达97.15 mg/L,比原始菌株提高了24.03%。
表4 抗卡那霉素突变株的辅酶Q10产量
Table 4 Coenzyme Q10 yield of mutant strains with kanamycin resistance

2.5.5 罗红霉素抗性筛选
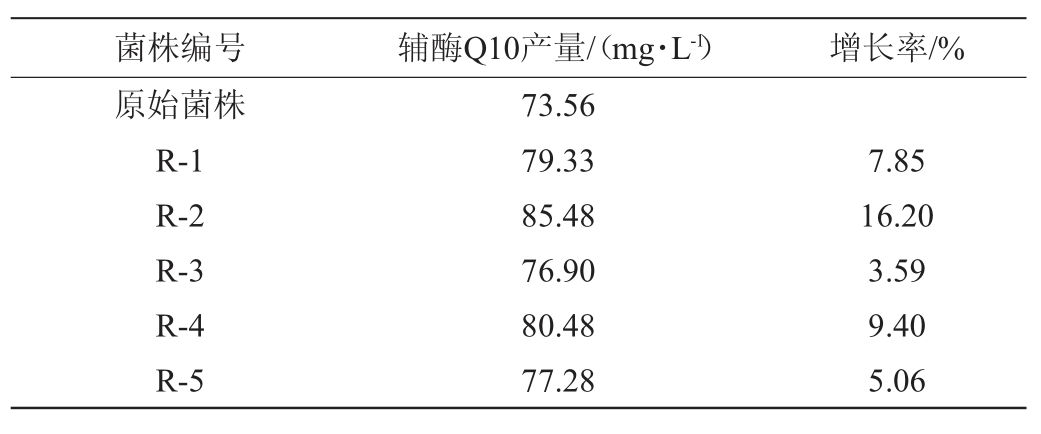
通过罗红霉素(30 mg/L)抗性平板筛选得到5株高产辅酶Q10的菌株,编号为R-1、R-2、R-3、R-4、R-5,其产量见表5。由表5可知,5株菌株的辅酶Q10产量为73.56~85.48 mg/L,其中菌株R-2的辅酶Q10产量最高,达85.48 mg/L,比原始菌株提高了16.20%。
表5 抗罗红霉素突变株的辅酶Q10产量
Table 5 Coenzyme Q10 yield of mutant strains with roxithromycin resistance
综上,通过56Fe17+重离子束照射诱变类球红细菌并结合抗性因子筛选,得到1株高产辅酶Q10的菌株Sa-5,其辅酶Q10产量最高,达127.86 mg/L,比原始菌株提高了69.73%。
2.6 突变菌株Sa-5的遗传稳定性
将突变菌株Sa-5在斜面上连续传5代,每代的辅酶Q10产量见图4。由图4可知,突变菌株Sa-5的辅酶Q10产量随传代次数的增加变化幅度较小,辅酶Q10产量为126~129.1mg/L。说明突变菌株Sa-5是一株高产辅酶Q10且遗传稳定的优良菌株。
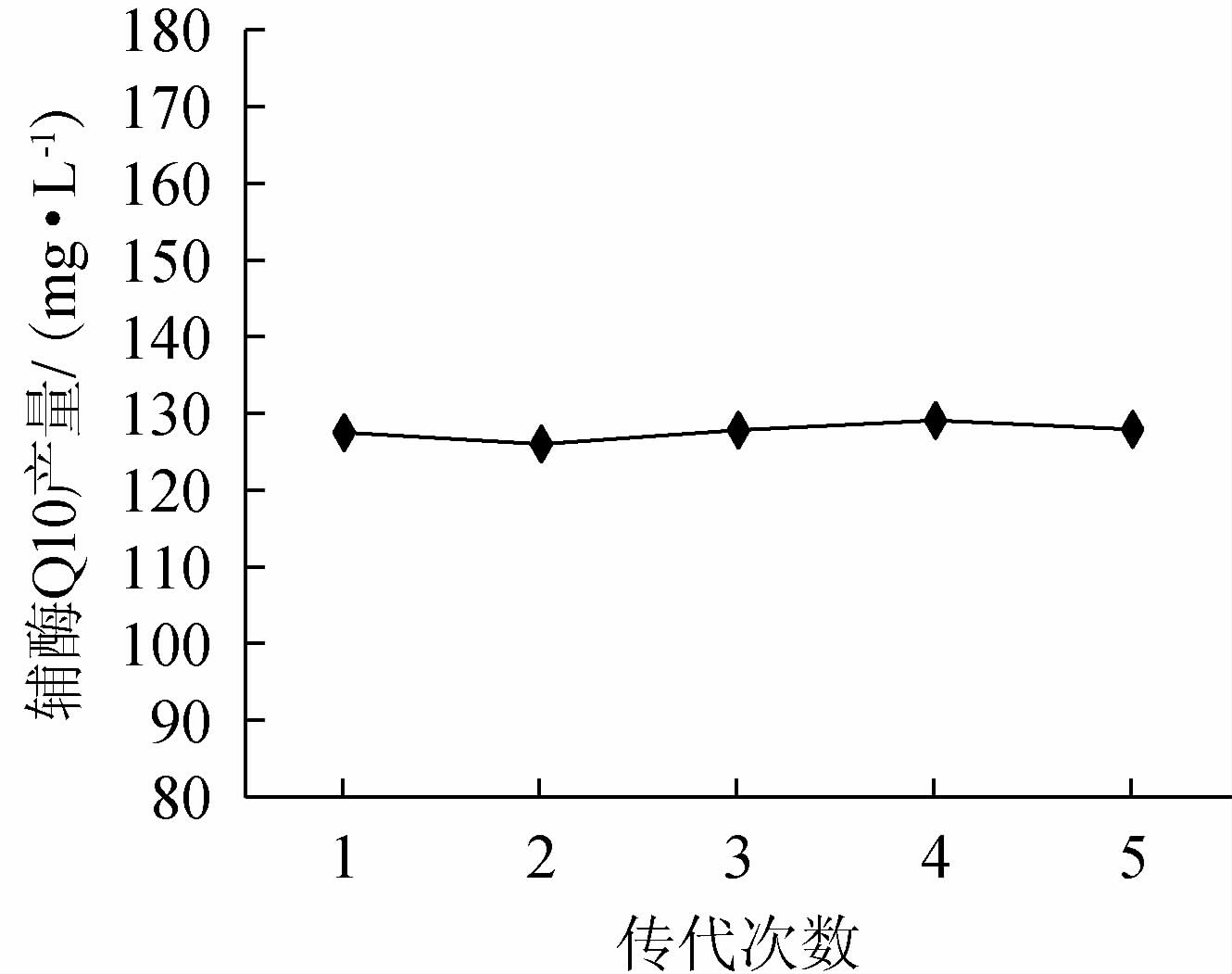
图4 突变菌株Sa-5的遗传稳定性
Fig.4 Genetic stability of mutant strain Sa-5
3 结论
通过照射剂量为16 Gy的56Fe17+重离子束对类球红细菌进行诱变后,采用叠氮钠抗性筛选得到1株高产辅酶Q10的菌株Sa-5,其辅酶Q10产量达127.86 mg/L,比原始菌株提高了69.73%,是一株高产辅酶Q10且遗传稳定的优良菌株。
[1]KECK C M,KOVACˇEVIC′ A,MÜLLER R H.Formulation of solid lipid nanoparticles(SLN):The value of different alkyl polyglucoside surfactants[J].Int J Pharm,2014,474(1-2):33-41.
[2]WOO J,MISRAN M,LEE P F,et al.Development of a controlled release of salicylic acid loaded stearic acid-oleic acid nanoparticles in cream for topical delivery[J].Sci World J,2014:205703.
[3]CORDERO M D,COTAN D,DEL-POZO-MARTIN Y,et al.Oral coenzyme Q10 supplementation improves clinical symptoms and recovers pathologic alterations in blood mononuclear cells in a fibromyalgia patient[J].Nutrition,2012,28(11-12):1200-1203.
[4]LEE D,KIM K Y,SHIM M S,et al.Coenzyme Q10 ameliorates oxidative stress and prevents mitochondrial alteration in ischemic retinal injury[J].Apoptosis,2014,19(4):603-614.
[5]CHEN G,SHI K,SONG D,et al.The pigment characteristics and productivity shifting in high cell density culture of Monascus anka mycelia[J].BMC Biotechnol,2015,15:72.
[6]DHANASEKARAN M,REN J.The emerging role of coenzyme Q-10 in aging,neurodegeneration,cardiovascular disease,cancer and diabetes mellitus[J].Curr Neurovasc Res,2005,2(5):447-459.
[7]李家洲.高产辅酶Q10 工程菌的构建及发酵工艺研究[D].广州:华南理工大学,2013.
[8]李鹏昊.细胞色素及呼吸链对类球红细菌产辅酶Q10 影响的研究[D].天津:天津科技大学,2017.
[9]施磊,扶教龙,吴晨奇,等.产辅酶Q10 根瘤土壤杆菌的紫外诱变选育及其发酵培养基优化[J].江苏农业科学,2017,45(10):224-228
[11]CORDERO M D,COTAN D,DEL-POZO-MARTIN Y,et al.Oral coenzyme Q10 supplementation improves clinical symptoms and recoverspathologic alterations in blood mononuclear cells in a fibromyalgia patient[J].Nutrition,2012,28(11-12):1200-1203.
[12]LAREDJ L N,LICITRA F,PUCCIO H M.The molecular genetics of coenzyme Q biosynthesis in health and disease[J].Biochimie,2014,100:78-87.
[13]赵有玺,龚平,罗忠智,等.原生质体激光诱变选育假白布勒弹孢酵母辅酶Q10 高产菌株[J].食品工业科技,2014,35(14):230-233.
[14]李涵依,李建国,欧小兵,等.沼泽红假单胞菌高产辅酶Q10 菌株的诱变选育研究[J].西南民族大学学报(自然科学版),2013,39(6):869-873.
[15]张琰,宋金玉.辅酶Q10 的应用研究进展[J].山西职工医学院学报,2017,27(3):57-59.
[16]陈有为,陈学瑞,丁点寒,等.辅酶Q10 生物合成方法的研究进展[J].药物生物技术,2017,24(5):431-435.
[17]黄钰清.辅酶Q10 提取分离工艺研究[D].杭州:浙江大学,2017.
[18]吕思敏,丁鸿燕,丁喜生,等.正交试验法优选红曲菌丝体中辅酶Q10的回流提取工艺[J].广东化工,2018,45(5):30-32.
[19]刘建光,王永强,赵贵元,等.重离子辐照诱变育种应用及其生物学效应研究进展[J].作物杂志,2016(3):12-16.
[20]朱永强.代谢工程改造类球红细菌促进辅酶Q10 合成的研究[D].杭州:浙江大学,2017.
[21]李华.平板菌落计数的改进方法[J].生物学通报,2006,41(1):51-52.
[22]扶教龙,钱大伟,吴晨奇,等.高产辅酶Q10 类球红细菌的化学诱变筛选及其发酵培养基优化[J].中国酿造,2016,36(6):90-95.
[23]王根华,钱和,肖刚.发酵菌体中辅酶的提取及其测定方法[J].无锡轻工大学学报,2003,22(2):59-62.